伊立替康联合铂类方案应用于初治及复发小细胞肺癌患者的疗效分析
胡兴胜,王子平,梁向伟,李峻岭,郝学志,林 琳,刘雨桃,石远凯
(1.中国医学科学院肿瘤医院内科,北京 100021;2.北京市朝阳区三环肿瘤医院内科,北京 100122)
伊立替康联合铂类方案应用于初治及复发小细胞肺癌患者的疗效分析
胡兴胜1,王子平1,梁向伟2,李峻岭1,郝学志1,林 琳1,刘雨桃1,石远凯1
(1.中国医学科学院肿瘤医院内科,北京 100021;2.北京市朝阳区三环肿瘤医院内科,北京 100122)
目的 分析伊立替康联合铂类方案应用于初治及复发小细胞肺癌(small cell lung cancer,SCLC)患者的疗效及不良反应。方法 52例初治广泛期SCLC患者中,采用伊立替康联合顺铂方案(IP组)52例,同期复发的SCLC患者50例采用伊立替康联合奈达铂方案(IN组),两组均至少进行2周期的化疗。分析比较两组疗效及不良反应。结果 IP组客观缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)、1年及2年生存率明显优于IN组,腹泻发生率明显高于IN组,差异均有统计学意义(P< 0.05)。结论 伊立替康联合铂类方案在初治及复治SCLC中疗效较好,初治方案好于复治方案,不良反应均可耐受,值得临床进一步推广。
伊立替康;小细胞肺癌;铂类;临床疗效;不良反应
小细胞肺癌(small cell lung cancer,SCLC)的发生率占肺癌的15%~20%,恶性程度高,确诊时多伴有远处转移。目前,《NCCN指南》推荐伊立替康联合顺铂方案(IP)或足叶乙甙联合顺铂方案(EP)作为广泛期SCLC的一线治疗方案。小细胞癌一线化疗后维持时间较短,易出现耐药和病情进展,目前治疗复发SCLC,尚无公认的标准方案。我们采用伊立替康联合奈达铂(IN)方案作为治疗复发的SCLC二线治疗方案,并与伊立替康联合顺铂方案治疗初治及复治SCLC的疗效和不良反应进行分析比较,现将结果报道如下。
1 资料与方法
1.1 一般资料 2008年1月至2013年12月在本院经IP方案初治的ED-SCLC患者52例,男性40例,女性12 例;年龄35~79岁,中位年龄58.4岁。同期资料完整的复发SCLC患者50例,均为一线经依托泊苷联合顺铂(EP)方案或依托泊苷联合卡铂(CE)方案化疗4~6周期,化疗或放疗后出现复发者,采用IN方案治疗。其中男性38例,女性12例;年龄35~73岁,中位年龄52.8岁;一线治疗时局限期19例,广泛期31例,一线采用PE方案26例,CE方案24例;一线治疗疗效CR 2例,PR 33例,SD 6例,PD 9例;一线治疗期间无放射治疗患者27例,进行胸部放射治疗患者18例,经胸部放疗和脑部放疗治疗患者5例。两组患者一般情况比较,差异无统计学意义(P> 0.05),具有可比性,见表1。
1.2 治疗方法 IP组采用伊立替康 65 mg/m2静脉滴注,d1、8,顺铂 25 mg/m2静脉滴注,d2、3、4。IN组采用伊立替康 65 mg/m2静脉滴注,d1、8,奈达铂 80 mg/ m2静脉滴注,d2。 以上方案均以21天为1周期,至少2个周期。最多化疗6个周期。所有患者于化疗结束后每两个月随访一次,末次随访日期至2014年6月。
1.3 观察指标 客观疗效按照RECIST 1.0评价标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。总有效率(ORR)= CR+PR;疾病控制率(DCR)=CR+PR+SD。毒副反应参照NCI-CTC 3.0标准分为0~4级。
1.4 统计学方法 采用SPSS 13.0软件进行处理。计数资料组间比较用卡方检验。利用Kaplan-Meier方法对无进展生存期(PFS)和总生存期(OS)的分布情况进行统计。P< 0.05为差异有统计学意义。
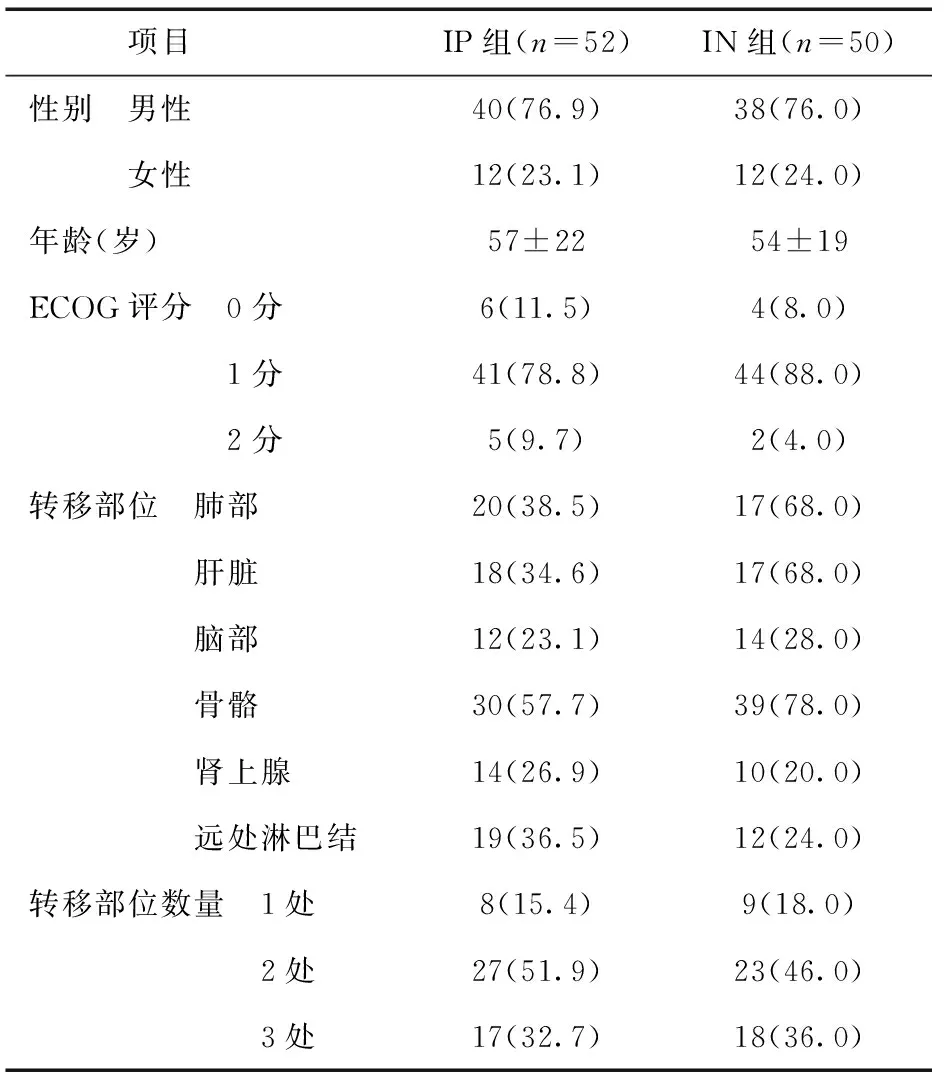
表1 两组患者入组时临床特征比较 [n(%)]
2 结果
2.1 近期疗效 IP组ORR和DCR明显高于IN组,差异有统计学意义(P< 0.05),见表2。
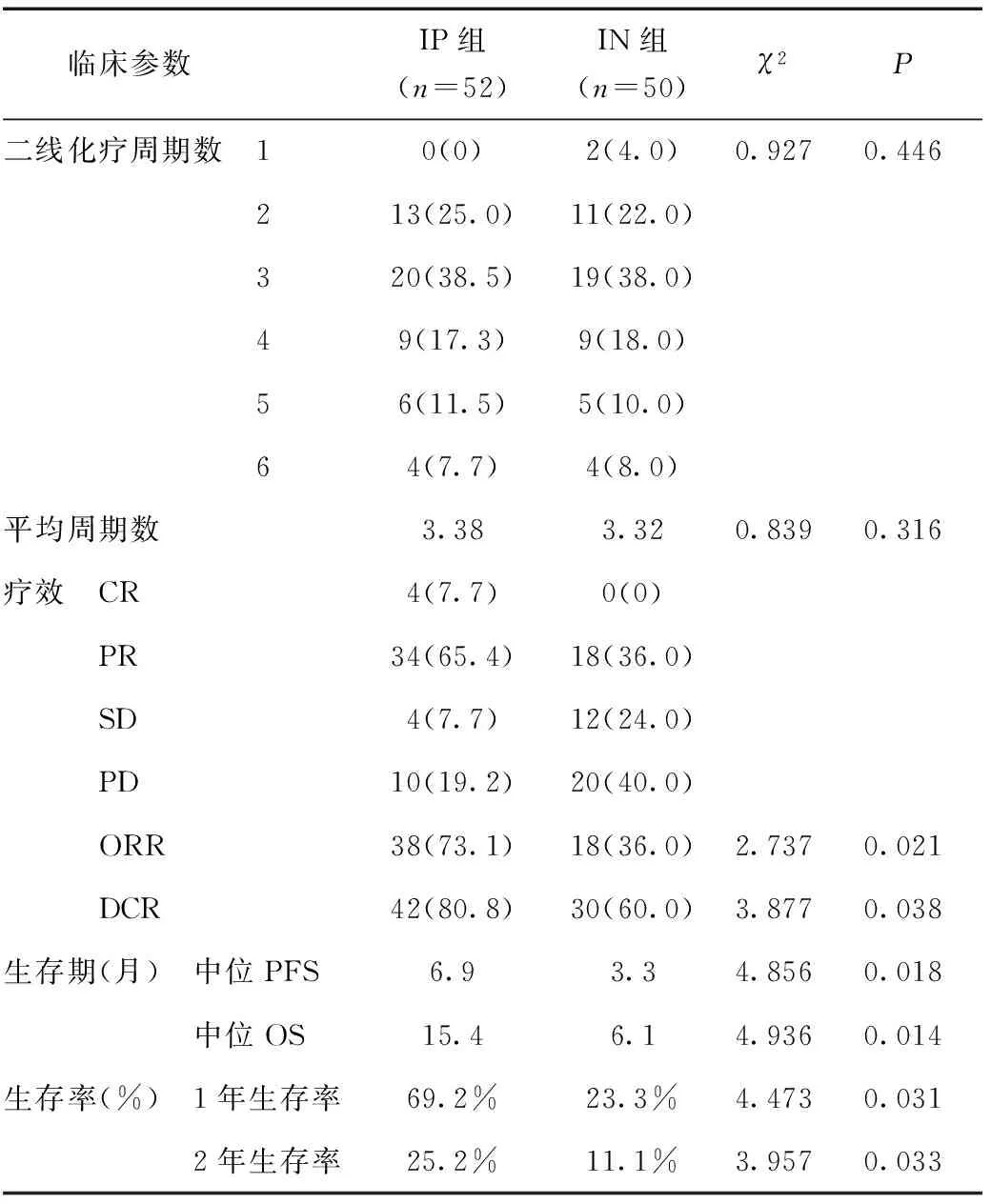
表2 两组化疗周期及疗效比较 [n(%)]
2.2 远期疗效 IP组中位PFS为6.9个月,中位OS为15.4个月,1年生存率69.2%,2年生存率25.2%。IN组中位PFS为3.3个月,中位OS为6.1个月;1年生存率为23.3%,2年生存率为11.1%。两组间差异有统计学意义(P< 0.05),见表2。
2.3 两组不良反应比较 见表3。IP组患者中恶心、呕吐及腹泻发生率高于IN组,血小板降低发生率低于IN组,差异均有统计学意义(P< 0.05)。
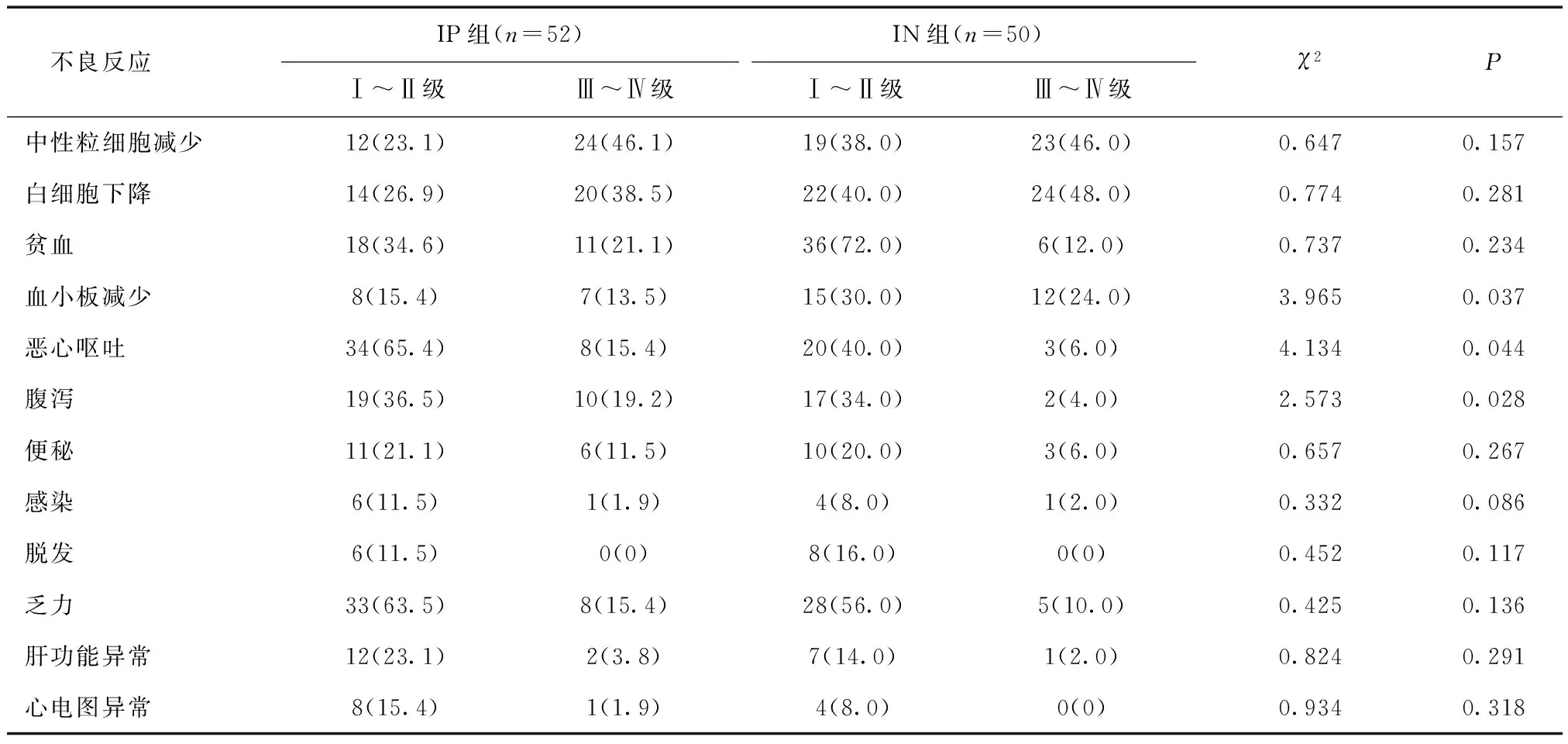
表3 两组患者不良反应比较 [n(%)]
3 讨论
SCLC增殖快,较早发生远处转移,目前化疗是ED-SCLC的标准治疗方法。研究显示,局限期患者中位生存期为14~20个月,广泛期患者中位生存时间为9~11个月,临床上发现超过70%的局限期患者可能出现复发或疾病进展[1]。目前EP方案是ED-SCLC的一线标准化疗。缓解率达60%~80%,但是复发率较高,中位生存期仅为8~13个月[2]。主要原因为大量敏感癌细胞死亡后会促使不敏感癌细胞增生,从而造成耐药。为解决耐药性问题,新型化疗药物不断涌现。伊立替康是喜树碱半人工合成衍生物,在机体内可经羧酸酯酶水解作用转化成有生物活性的7-乙基-10-羟基喜树碱(SN-38),SN-38具有强力抑制拓扑异构酶Ⅰ活性,可作用于细胞分裂间期,抑制DNA单链断裂后的修复,干扰DNA复制和转录,从而发挥抑制和杀死肿瘤细胞活性的作用。日本临床肿瘤协会的JCOG9511研究[3]比较了伊立替康联合顺铂与依托泊苷联合顺铂治疗ED-SCLC的疗效,入组154例患者。结果显示IP组疗效明显优于EP组,血液学毒性低于EP组,腹泻发生率高于EP组。因此,研究认为对于ED-SCLC,伊立替康联合顺铂疗效优于传统的依托泊苷联合顺铂。Hanna等[4]进行的III期临床研究同样比较了IP与EP治疗ED-SCLC的效果,但却未能得出与JCOG9511相似的结论,原因可能为试验方案和治疗时间不同,或者是患者的药物基因学和人群特征差异。本研究显示:IP组疾病控制率为80.8%,中位生存期为15.4个月,1年生存率为69.2%,这与姚南等[5]做的Meta分析结果相似;分析还发现,IP方案发生的并发症如3/4级腹泻较高。
众所周知,SCLC一线化疗有效后复发率高、预后差,尤其是在ED-SCLC中更为常见。一线化疗有效且无治疗间期大于90天为复发敏感者,二线疗效较好;一线治疗有效但无治疗间期小于90天为耐药复发者,二线疗效较差。目前复发SCLC的标准治疗方案处于探索阶段。CAV可用于ED-SCLC的二线化疗。随着新药的不断研发及相关临床研究的实践,疗效更好的药物及方案逐渐应用于二线化疗。2012年Pietanza等[6]报道了替莫唑胺治疗复发或难治的SCLC,有效率为22%,中位生存时间达5.8个月。拓扑替康是目前唯一被美国FDA批准允许用于治疗ED-SCLC化疗后复发的药物,但疗效并不理想。Von Pawel等[7]比较了单药拓扑替康与环磷酰胺、阿霉素联合长春新碱治疗ED-SCLC复发者,结果显示缓解率单药拓扑替康为24%,而环磷酰胺、阿霉素联合长春新碱为18%;中位生存期单药拓扑替康为25周,而环磷酰胺、阿霉素联合长春新碱为24.7周。单药拓扑替康副反应低,患者耐受性好。相比之下,含伊立替康的方案有较强优势,土耳其的试验,入组了46例复发的SCLC患者,接受伊立替康单药治疗,有效率为17.5%[8],毒副反应可耐受。
相关研究表明,伊立替康治疗SCLC效果显著,并且与足叶乙甙、顺铂没有交叉耐药,有研究证实伊立替康与顺铂能协同增效[9,10],其临床应用一直受到重视。奈达铂(NDP)主要与核苷反应,生成核苷-铂结合物,抑制DNA复制,从而达到抗肿瘤作用。且奈达铂的溶出度是顺铂的10倍,故临床常用[11]。Ohe等研究表明[12],伊立替康联合奈达铂二线治疗SCLC RR为75.0%,DCR为100%,中位OS为11.1个月,1年生存率为50%,效果显著。于舒飞等报道[13]IN方案治疗复发SCLC 34例,RR为29%,PFS为5.4个月,OS为14.3个月,6个月生存率为70.6%,1年生存率为26.5%,血小板减少发生率较高,疗效较好。我们选择伊立替康联合奈达铂(IN)方案作为二线方案观察其疗效和不良反应。本研究结果显示治疗复发SCLC,IN方案有效率ORR 36.0%,DCR 60.0%,PFS为3.3个月,中位OS为6.1个月;1年生存率为23.3%,2年生存率为11.1%,研究结果和于舒飞等报道[13]的结果相似。
IP组的消化道反应及腹泻发生率高于IN组,有统计学差异(P= 0.028);IN组的血小板降低较重,但大多数可以经过白介素-11的治疗得以纠正,不影响后续治疗,IP组和IN组其他安全性相似,提示IN方案是治疗复发SCLC安全有效方案。
广泛期SCLC的治疗,一线IP方案及二线IN方案均是安全有效的方案,伊立替康联合铂类一线应用在疗效及生存期方面好于复治患者,主要是因为一线治疗患者耐药比例低。两方案均值得临床进一步研究。
[1] 孙燕.内科肿瘤学[M].北京:人民卫生出版社,2007:388-424.
[2] Demedts K,Vermaelen Y,van Meerbeeck P. Treatment of extensive-stage small cell lung carcinoma: current status and future prospects[J].Eur Respir J,2010,35(1):202-215.
[3] Noda K,Nishiwaki Y,Kawahara M,et al.Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer[J].N Eng Med,2002;346(2):85-91.
[4] Hanna N,Bunn PA,Langer C,et al.Randomized phase III trial comparing irinotecan/cisplatin with etoposide/cisplatin in patients with previously untreated extensive-stage disease small-cell lung cancer[J].J Clin Oncol,2006,24(13):2038-2043.
[5] 姚南,姜雷,杨克虎,等.依立替康联合顺铂与足叶乙甙联合顺铂治疗广泛期小细胞肺癌的系统评价[J].中国肺癌杂志,2009,12(8):884-888.
[6] Pietanza MC,Kadota K,Huberman K,et al.PhaseⅡtrial of temozolomide in patients with relapsed sensitive or refractory small cell lung cancer,with assessment of methylguanine-DNA methyltransferase as a potential biomarker[J].Clin Cancer Res,2012,18(4):1138-1145.
[7] Von Pawel J,Schiller JH,Shepherd FA,et al.Topotecan versus cyclophosphamide,doxorubicin,and vincristine for the treatment of recurrent small-cell lung cancer[J].J Clin Oncol,1999,17(2):658-667.
[8] Sevinc A,Kalender ME,Altinbas M,et al.Irinotecan as a second-line monotherapy small cell lung cancer[J].Asian Pac J Cancer Prev,2011,12(4):1055-1059.
[9] Jagasia MH,Langer DH.Weekly irinotecon and cisplatin in advanced small cell lung cancer: A multicenter phase Ⅱstudy[J].Clin Cancer Res,2001,7(1):68-73.
[10]Hirose T,Horichi N,Ohmori T,et al.Phase Ⅱstudy of irinotecan and carboplatin in patients with refractory small cell lung cancer[J].Lung Cancer,2003,40(3):333-338.
[11]Destioz B,Madoulet C.Particular aspects of platinum compounds used at present in cancer treatment.Crit Rev Oncol Hematol,2001,42:317-325.
[12] Ohe M,Oshita F,Kenmotsu Y,et al.Nedaplatin and irinotecan for patients with recurrent small cell lung cancer.[J].Journal of Experimental Therapeutics and Oncology.2012.Vol.10: 65-69 .
[13]于舒飞,王燕,胡兴胜,等.伊立替康联合奈达铂对比联合顺铂二线治疗复发或难治性小细胞肺癌的疗效及毒副作用回顾分析[J].中国肺癌杂志,2013,16(9):470-475.
The curative effect and experience of irinotecan combined with platinum in the initial and recurrent treatment of patients with small cell lung cancer
HU Xing-sheng1,WANG Zi-ping1,LIANG Xiang-wei2,LI Jun-ling1,HAO Xue-zhi1,LIN Lin1,LIU Yutao1,SHI Yuan-kai1
(1.Department of Medical Oncology,Cancer Hospital &Institute,Chinese Academy of Medical Sciences,Beijing 100021,China;2.Department of Medical Oncology,Sanhuan Cancer Hospital,Chaoyang District,Beijing 100122,China)
Objective To observe the efficacy and safety of irinotecan combined with platinum in the initial and recurrent treatment of small cell lung cancer (SCLC).Methods Fifty-two patients with previously-untreated extensive-stage SCLC were treated with a regimen of irinotecan and cisplatin (IP) for at least two cycles.Fifty recurrencent SCLC patients were treated with a regiment of irinotecan and nedaplatin (IN). The efficacy and toxicity were evaluated after the treatment.Results For the initial treatment of patients,the overall response rate (ORR),disease control rates (DCR),the median PFS,median OS,one-year and two-year survival rate was significant higher than that in the IN group,meanwhile,the diarrhea incidence was obviously higher than that in the IN group (P< 0.05).Conclusion Regimen of irinotecan plus platinum is effective and tolerable in the initial and recurrent treatment of SCLC.The IP regimen is better than the IN regimen.
Irinotecan;SCLC;Platinum;Clinical efficacy;Toxicity
中国医学科学院肿瘤医院科研课题(编号:LC2010B36)
R734.2
A
1672-6170(2015)04-0075-04
2014-03-12;
2015-05-15)
——再论奈达对翻译本质属性的认知

