乳腺癌的危险因素及其预防研究进展
陈 杰 综述,周蕾蕾 审校
(1.遵义医学院,贵州 遵义 563003;2.四川省医学科学院·四川省人民医院乳腺科,四川 成都 610072)
△通讯作者
乳腺癌的危险因素及其预防研究进展
陈 杰1综述,周蕾蕾△审校
(1.遵义医学院,贵州 遵义 563003;2.四川省医学科学院·四川省人民医院乳腺科,四川 成都 610072)
乳腺癌的危险因素很多,主要分为可改变危险因素和不可改变危险因素。良好的生活方式,能降低个体患乳腺癌的风险。他莫昔芬可用于绝经前和绝经后高危妇女乳腺癌的预防;雷洛昔芬和依西美坦只能用于绝经后高危妇女乳腺癌的预防;预防性手术能明显降低乳腺癌突变基因携带者患乳腺癌的风险,但同时存在副作用。因此高危妇女术前应进行多学科的咨询,了解手术的替代治疗方案及手术的风险和获益,最终决定是否进行预防性手术治疗。如果选择预防性双侧乳房切除术,有多种乳房重建方式可供选择。
乳腺癌;危险性因素;预防
乳腺癌已是女性最常见的恶性肿瘤,仅在美国,乳腺癌就占新诊断的女性所有恶性肿瘤的29%,并且,乳腺癌还是仅次于肺癌的第二大死因[1]。近年来,随着乳腺癌诊疗手段的进步,乳腺癌的死亡率逐年下降,但发病率仍在增加,特别是我国存在乳腺癌年轻化的趋势。本文将从乳腺癌的危险因素、个体发生乳腺癌风险预测模型以及预防措施等方面,探讨如何预防乳腺癌。
1 危险因素
病因学研究发现,乳腺癌是机体内外多种危险因素共同作用的结果。已发现的危险因素有:家族或基因相关因素(肿瘤家族史和突变基因携带者);人口统计学相关因素(年龄增加、种族或民族、体重指数大等);生育史(初潮年龄早、未育或少育、初产年龄晚、绝经晚等);环境因素(雌孕激素替代治疗史、饮酒等);乳腺疾病史(小叶原位癌、增生性疾病等);其他(乳腺X射线摄片腺体密度高、30岁前接受胸部放射治疗史)等。各种危险因素的相对危险性详见表1[2]。
这些危险因素按能否被改变分为三大类:不可改变危险因素(家族或基因相关因素、年龄、种族或民族、身高、初潮年龄、乳腺疾病史等);可改变因素(饮酒、体重指数、雌孕激素使用等);潜在可改变因素(第一胎生产年龄、绝经年龄、产次等)。乳腺癌预防的重点是一级预防,一级预防应着重改变可变危险因素,同时评估不可变因素的危险程度,对高危妇女进行必要的预防性药物治疗或手术治疗。
2 预防措施
2.1 生活方式 目前有明确的证据表明,某些不良生活习惯,如激素治疗、饮酒、肥胖等与乳腺癌密切相关。改变不良的生活习惯,保持健康的生活方式,加强锻炼能减低乳腺癌的发病风险。
2.1.1 激素治疗(HT) 美国的WHI(The Women’s Health Initiative)临床试验,1993~1998年登记了161809名50~79岁的绝经后妇女。进行了两个关于HT的随机对照试验,一个试验入组16608名子宫完好的妇女,随机使用HT(雌激素+孕激素)或安慰剂[4]。另一个试验入组10739名子宫切除的妇女,随机使用HT(雌激素)或安慰剂[5]。第一个试验结果显示,与安慰剂组对比,HT(雌激素+孕激素)组增加26%的乳腺癌发病率(HR=1.26,95%CI:1.00~1.59)。但第二个试验结果显示,HT(雌激素)组乳腺癌的发病率低于安慰剂组。然而,另外一些研究结果却都支持第一个试验的结果。如黑人妇女健康研究,随访10年以上,结果显示,与安慰剂组对比,HT(雌激素)组浸润性乳腺癌的发病风险增加(RR=1.41,95%CI:0.95~2.10)[6];护士健康研究结果同样显示,长期(大于20年)HT(雌激素)组,乳腺癌的发病风险明显增加(RR=1.42,95%CI:1.13~1.77)[7]。总之,目前的证据表明,绝经后妇女,HT增加乳腺癌的风险,联合使用激素(雌激素+孕激素)高于单独使用雌激素。对于仅使用雌激素治疗的妇女,停止治疗后,以前增加的乳腺癌患病风险会迅速下降。然而,对于联合使用雌激素和孕激素的妇女,其患乳腺癌的风险,能否在停止治疗后迅速下降,需要WHI临床试验更长的随访来得出结论。
2.1.2 饮酒 大量的研究表明,中等量的饮酒(1~2杯/天)增加乳腺癌的发病风险[8~10]。国外两个队列研究表明,每天饮酒大于10 g的妇女,增加10%的乳腺癌发病风险[11,12]。另外一个对于51847名绝经后妇女的研究结果显示,随着妇女饮酒量的增加,患ER(+)乳腺癌的风险也增加[13]。然而,关于减少饮酒能否降低乳腺癌发病风险,以及能降低多少风险的研究,还未得出明确结论。
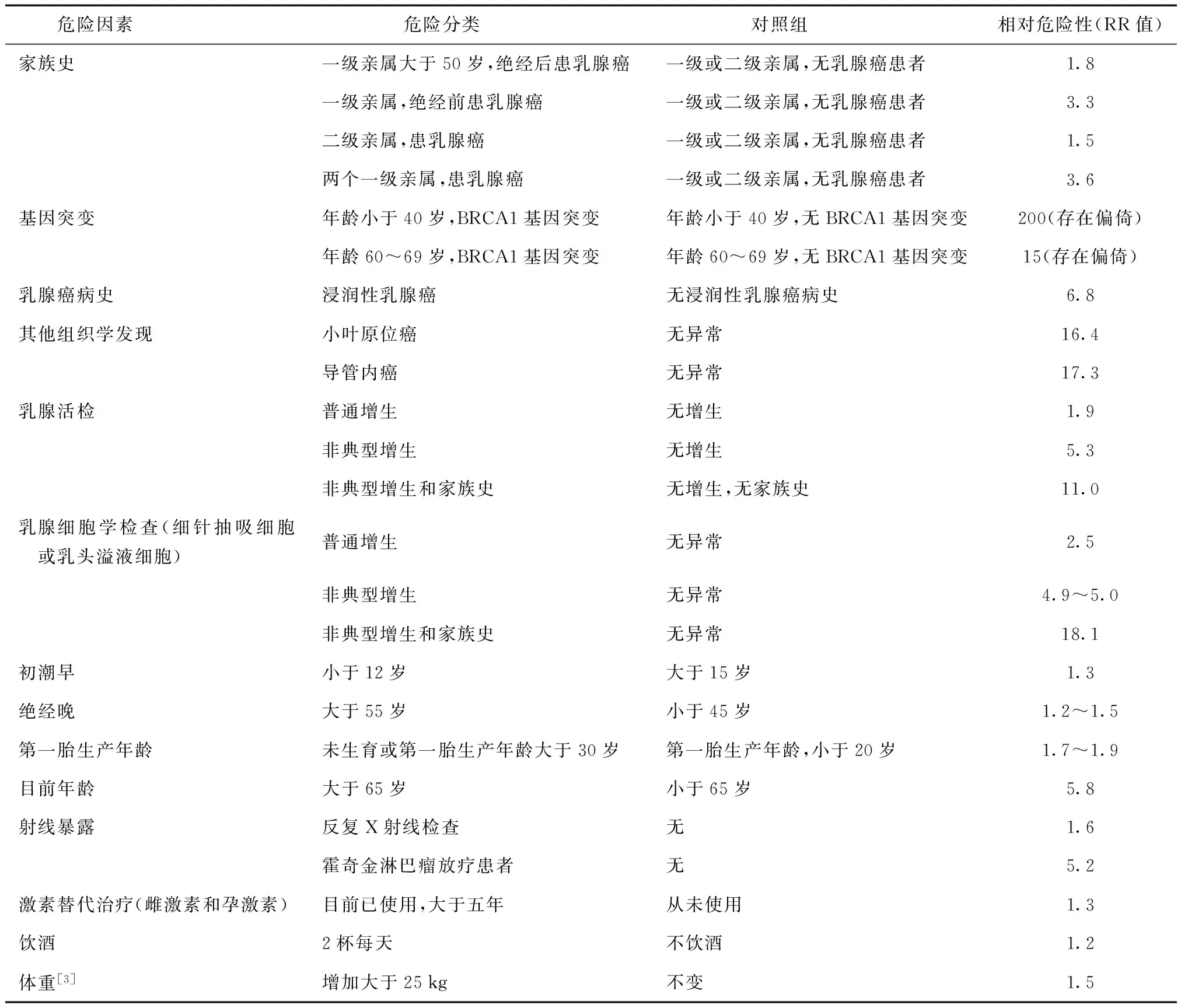
表1 乳腺癌的危险因素
2.1.3 体重 大量的研究结果表明,对于绝经后妇女,超重或肥胖是乳腺癌的高危因素[8,14]。美国护士健康队列研究,以87143名绝经后妇女为研究对象,分析体重改变与浸润性乳腺癌的关系。研究结果表明,从18岁开始,与保持体重不变者相比,体重增加大于25 kg的妇女,乳腺癌的发病风险增加(RR=1.45,95%CI:1.27~1.66)。另外一个结果表明,从绝经期开始,与保持体重不变者相比,减轻体重大于10 kg的妇女,能明显降低乳腺癌的发病率(RR=0.43,95%CI:0.21~0.86)。张雷等[15]以2008 年北京市3460例新发乳腺癌女性病例为研究对象,分析不同体质指数(BMI)乳腺癌病例的一般情况,得出结果:低体重、正常体重、超重和肥胖组绝经后乳腺癌病例所占比例分别为39.7%、40.2%、55.1%和59.6%,差异有统计学意义(P< 0.05),表明超重、肥胖可增加乳腺癌发病危险。但有趣的是,对于绝经前妇女,有一个研究的结果表明,与不超重者比较,超重者乳腺癌的发病风险更低[8]。总之,减肥能降低绝经后妇女乳腺癌的发病风险,但对于绝经前妇女,还需要更多的研究来证明两者之间的关系。
2.2 预防性手术 对于乳腺癌高危妇女,进行乳腺癌减危手术,能有效降低乳腺癌发病风险。
相关文献报道,BRCA1/2基因突变携带者终身患乳腺癌的风险预计是56%~84%;PTEN基因、TP53基因突变携带者终身患乳腺癌的风险分别是26%~50%[16,17]和49%~60%[18]。作为对比,美国妇女终身患乳腺癌的风险平均值约为12%。NCCN乳腺癌减危专家组建议,乳腺癌减危手术适合于乳腺癌高危妇女,仅限于下列情况:①有很强的乳腺癌和/或卵巢癌家族史(一级亲属患双侧乳腺癌、多个一级亲属小于50岁之前患乳腺癌或者卵巢癌);②乳腺癌相关基因(BRCA1/2、PTEN、TP53、CDH1、STK11等基因)突变携带者;③患有乳腺小叶原位癌,且有乳腺癌家族史;④30岁之前,接受过胸部放射治疗,例如:霍奇金淋巴瘤放疗患者。高危妇女行预防性手术,术前患者应该首先进行多学科(包括乳腺外科、整形外科、身心医学科及遗传学科等)的咨询,了解自身患乳腺癌风险的大小,以及手术的获益与风险的大小。其次,进行必要的乳腺体检和双侧乳房X射线照射和彩超检查,了解是否已患乳腺疾病。最后,如果各项检查结果正常,妇女选择双侧乳腺减危切除术时,应考虑是否立即行乳房重建。
乳腺癌减危手术的手术方式有多种,常见的是双侧乳腺减危切除术(RRM)和双侧卵巢-输卵管减危切除术(RRSO)两大类,其中最常见的是RRM。临床上RRM主要包括皮下乳腺切除术和全乳房切除术。皮下乳腺切除术是经乳房下皱褶作切口将乳腺实质移去,并保留乳头-乳晕复合体。为保证乳头和乳晕的血供,再加上经下方切口完整切除乳腺困难性,使得约有5%~10%的乳腺组织残留。残留部位除乳头-乳晕区外,还有锁骨下区和乳腺尾部。与皮下乳腺切除术不同,全乳房切除术是将带有乳头-乳晕复合体的皮瓣连同整个乳腺一同切除,大大减少了乳腺组织残留的可能性。标准的全乳房切除术的范围是:上至锁骨,下至腹直肌上缘,内侧以胸骨外缘为界,外侧达背阔肌前缘。手术的关键是彻底切除乳腺组织,故术中应切除胸肌筋膜和整个乳腺尾叶,但需注意不要损伤肋间神经。术中可以对可疑的边界进行快速冰冻切片检查,以保证全部乳腺组织被切除。目前对于行RRM手术的妇女主张行标准的全乳房切除,加即刻的乳房重建术,包括胸肌下假体植入术和腹直肌皮瓣移植重建术。
多项研究证实,乳腺癌减危手术能明显降低高危妇女乳腺癌的患病风险,但术后往往会给患者带来潜在的精神后遗症和其他并发症。Hartmann等[19,20]回顾分析中位随访13~14年的临床研究,得出中高危的妇女以及携带BRCA1/2突变基因的妇女,进行双侧乳腺减危切除术使患乳腺癌的风险至少减低90%,另外一些前瞻性研究也证实了这一点[21,22]。Eisen等[23]进行了一项国际性的病例对照研究,结果显示,携带BRCA1和BRCA2突变基因的妇女,进行RRSO后,使患乳腺癌的风险分别降低56%(OR=0.44,95%CI:0.29~0.66)和46%(OR=0.57,95%CI:0.28~1.15)。另外一个前瞻性的队列研究结果表明,RRSO能明显降低携带BRCA1/2突变基因妇女的患病风险,且BRCA1突变基因携带者降低程度大于BRCA2突变基因携带者[24]。乳腺癌减危手术能够降低高危妇女患乳腺癌的风险,但也会给患者带来一些副作用。切除乳房后的妇女会出现紧张、易怒、恐惧、自责、否认、回避等情绪异常,有些患者会出现抑郁焦虑或歇斯底里。至于为降险而进行的双侧卵巢和输卵管切除,目前NCCN指南的推荐是:仅限于已知或高度怀疑BRCA1/2基因有突变者。切除卵巢和输卵管的妇女会出现绝经综合征和骨质疏松。总之,乳腺癌减危手术是高危妇女预防乳腺癌的一种选择,但在术前患者一定要进行多学科的咨询,综合考虑手术获益和风险,做出合适的选择。
2.3 预防性药物治疗
2.3.1 预防药物临床试验 乳腺癌作为一种激素依赖性肿瘤,预示其很可能也是能够被预防的恶性肿瘤。选择性雌激素受体调节剂(selective estrogen receptor modulator,SERM)和芳香化酶抑制剂(aromatase inhibitor,AI)在乳腺癌患者辅助治疗中的广泛应用使其成为乳腺癌预防用药的选择。众多临床试验表明SERM和AIs能很好地预防ER(+)乳腺癌(详见表2)。但对于Her2型乳腺癌、三阴性乳腺癌的药物预防的临床试验还在进行中。目前用于Her2型乳腺癌预防的临床试验药物主要是曲妥珠单抗和拉帕替尼。另外,还有其他的一些药物被证实能在一定程度上阻止乳腺癌的发生。这些药物包括:双膦酸盐、二甲双胍、维生素A 类衍生物芬维A胺、非甾体类抗炎药(阿司匹林和布洛芬)、维生素D 和钙的摄入。对于这些药物在乳腺癌预防中的作用,尚需要更多大规模的临床试验通过长时间的随访来说明其有效性和安全性。作为预防用药,药物的毒副作用及安全性更值得关注。
2.3.2 预防性药物的选择 大量的临床试验证明,SERM和AIs能很好地预防乳腺癌的发生。预防性治疗适用于乳腺癌高危人群:①小叶原位癌史或30岁前胸部放疗史,并且预期寿命≥10年的妇女;②修改后Gail 5年危险预测值≥1.7%和预期寿命≥10年的妇女。目前NCCN乳腺癌减危专家组建议,可用于乳腺癌预防的药物是他莫昔芬、雷洛昔芬、依西美坦和阿那曲唑,其他的药物只能参加临床试验。他莫昔芬及雷洛昔芬是FDA批准用于预防乳腺癌的药物,依西美坦和阿那曲唑因缺乏与他莫昔芬或雷洛昔芬获益/风险的对比研究数据,尚未被FDA批准作为预防药物。他莫昔芬可用于绝经前和绝经后乳腺癌高危妇女的预防,雷洛昔芬和依西美坦仅能用于绝经后高危妇女,对于绝经前妇女,只能参加临床试验。他莫昔芬及雷洛昔芬预防性治疗的禁忌证:深静脉血栓病史,肺栓塞病史,脑栓塞病史,短暂脑缺血发作等。在应用药物对乳腺癌高危妇女进行预防时,应考虑患者的获益与风险,争取以最小的副作用,取得最大的获益。
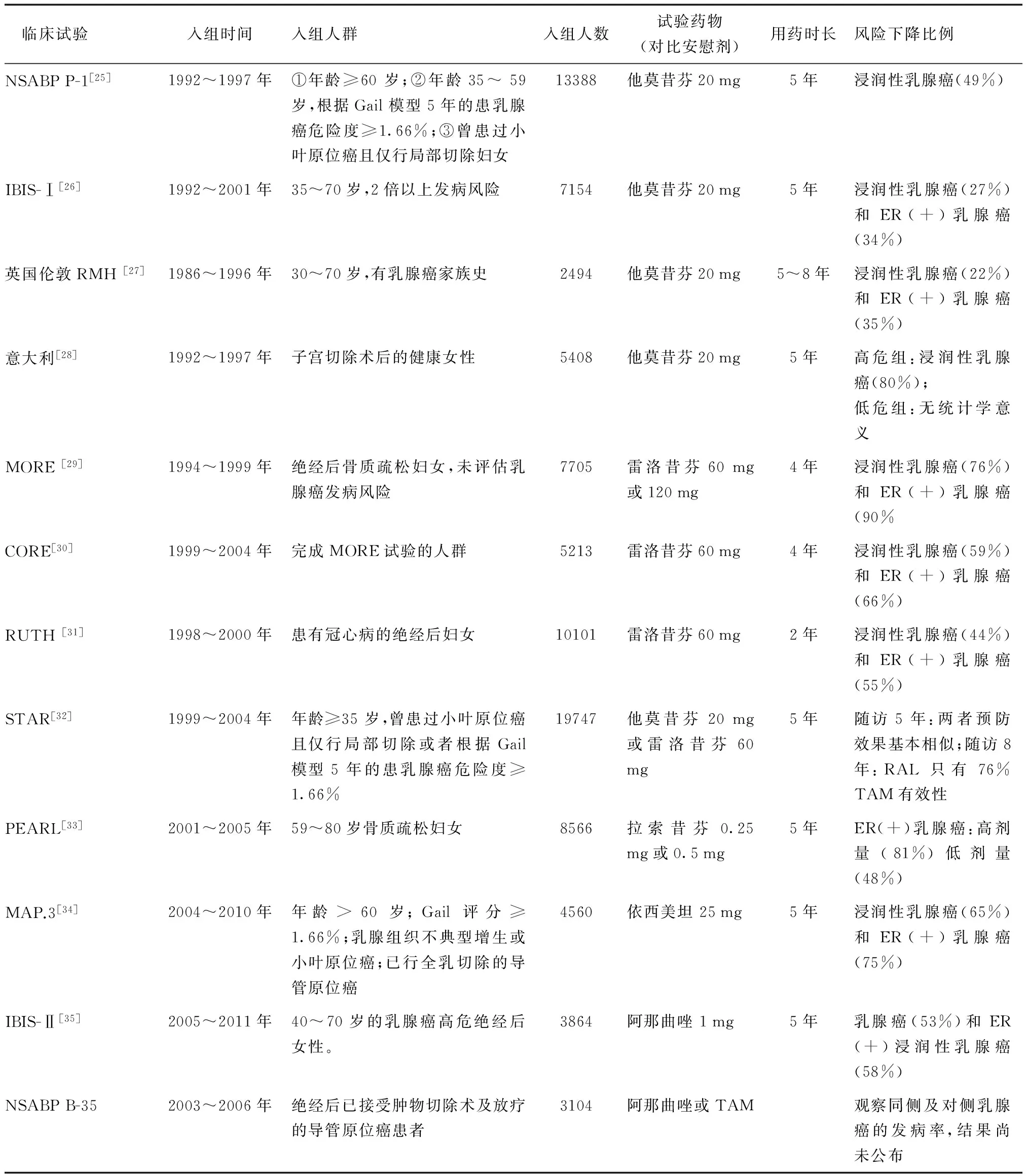
表2 乳腺癌预防药物临床试验
3 结论与展望
乳腺癌的预防重点在于减少危险因素,生活中保持良好的生活方式,避免可改变乳腺癌危险因素;对于不可改变因素,评估其风险的大小,进行必要的干预性治疗。对高危妇女进行预防性乳房切除,需评估患者获益/风险,同时考虑患者失去乳房后的心理创伤。预防性药物需考虑药物的毒副作用,如果预防药物没有良好的有效性或者可能存在严重的毒副作用,健康女性尽管存在乳腺癌高危因素也很难选择长达5年甚至更久的预防性服药。如能找到方便、价廉且副作用非常少的药物,就如同阿司匹林用于预防心血管事件的一级预防一样,乳腺癌的药物预防才会被广泛接受并应用。
[1] Siegel R,Naishadham D,Jemal A,et al.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2] Singletary S.Rating the risk factors for breast cancer[J].Annals Of Surgery,2003,237(4):474-482.
[3] Eliasssen A,Colditz G A,Rosner B,et al.Adult weight change and risk of postmenopausal breast cancer[J].JAMA,2006,296(2):193-201.
[4] Rossouw JE,Anderson GL,Prentice RL,et al.Risk and benefits of estrogen plus progestin in health postmenopausal women:principal results from the Women’s Health Initiative randomized controlled trial[J].JAMA,2002,288(3):321-333.
[5] Anderson GL,Limacher M,Assaf AR,et al.Effects of conjugated equine estrogen in postmenopausal women with hysterectomy:the Women’s Health Initiative randomized controlled trial[J].JAMA,2004,291(14):1701-1712.
[6] Rosenberg L,Palmer JR,Wise LA,et al.A prospective study of female hormone use and breast cancer among black women[J].Arch INTER Med,2006,166(7):760-765.
[7] Chen WY,Manson JE,Hankinson SE,et al. Unopposed estrogen therapy and the risk of invasive breast cancer[J].Arch INTER Med,2006,166(8):1027-1032.
[8] Mahoney MC,Bevers T,Linos E,et al.Opportunities and strategies for breast cancer prevention through risk reduction[J].CA Cancer J Clin,2008,58(6):347-371.
[9] Zhang SM,Lee IM,Manson JE,et al.Alcohol consumption and breast cancer risk in the Women’s Health Study[J].Am J Epidemiol,2007,165(6):667-676.
[10] Terry MB,Zhang FF,Kabat G,et al.Lifetime alcohol intake and breast cancer risk[J].Ann Epidemiol,2006,16(3):230-240.
[11]Smith-Warner SA,Spiegelman D,Yaun SS,et al.Alcohol and breast cancer in women:a pooled analysis of cohort studies[J].JAMA,1998,279(7):535-540.
[12]Hamajima N,Hirose K,Tajima K,et al.Alcohol,tobacco and breast cancer-collaborative reanalysis of individual data from 53 epidemiological studies,including 58515 women with breast cancer and 95067 women without the disease[J].Br J Cancer,2002,87(11):1234-1245.
[13]Suzuki R,Ye W,Rylander-Rudqvist T,et al.Alcohol and postmenopausal breast cancer risk defined by estrogen and progesterone receptor status:a prospective cohort study[J].J Natl Cancer Inst,2005,97(21):1601-1608.
[14]Van den Brandt PA,Spiegelman D,Yaun SS,et al.Pooled analysis of prospective cohort studies on height,weight,and breast cancer risk[J].Am J Epidemiol,2000,152(6):514-527.
[15]张雷,元宵梅,王宁,等.2008年北京市新发乳腺癌病例超重和肥胖与乳腺癌[J].中国慢性病预防与控制,2013,21(2):147-149.
[16]Bennett KL,Mester J,Eng C.Germline epigenetic regulation of KILLIN in Cowden and Cowden-like syndrome[J].JAMA,2010,304(24):2724-2731.
[17]Hobert JA,Eng C.PTEN hamartoma tumor syndrome:an overview[J].Genet Med,2009,11(10):687-694.
[18]Masciari S,Dillon D A,Rath M,et al.Breast cancer phenotype in women with TP53 germline mutations:a Li-Fraumeni syndrome consortium effort[J].Breast Cancer Res Treat,2012,133(3):1125-1130.
[19]Hartmann LC,Schaid DJ,Woods JE,et al.Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer[J].N Engl J Med,1999,340(2):77-84.
[20]Hartmann LC,Sellers TA,Schaid DJ,et al.Efficacy of bilateral prophylactic mastectomy in BRCA1 and BRCA2 gene mutation carriers[J].J Natl Cancer Inst,2001,93(21):1633-1637.
[21]Meijers-Heijboer H,van Geel B,van Putten WL,et al.Breast cancer after prophylactic bilateral mastectomy in women with a BRCA1 or BRCA2 mutation[J].N Eng J Med,2001,345(3):159-164.
[22]Rebbeck R,Friebel T,Lynch HT,et al.Bilateral prophylactic mastectomy reduces breast cancer risk in BRCA1 or BRCA2 mutation carriers:the PROSE Study Group[J].J Clin Oncol,2004,22(6):1055-1062.
[23]Eisen A,Lubinski J,Klijn J,et al.Breast cancer risk following bilateral oophorectomy in BRCA1 and BRCA2 gene mutation carriers:an international case-control study[J].J Clin Oncol,2005,23(30):7491-7496.
[24]Kauff ND,Domchek SM,Friebel TM,et al.Risk-reduction salpingo-oophorectomy for prevention of BRCA1-and BRCA2-asssociated breast and gynecologic cancer:a multicenter,prospective study[J].J Clin Oncol,2008,26(8):1331-1337.
[25]Fisher B,Costantino JP,Wickerham DL,et al.Tamoxifen for prevention of breast cancer:report of the National Surgical Adjuvant Breast and Bowel Project P-1 Study[J].J Natl Cancer Inst,1998,90(18):1371-1388.
[26]Cuzick J,Forbes JF,Sestak I,et al.Long-term results of tamoxifen prophylaxis for breast cancer-96-month follow-up of the randomized IBIS-Ⅰtrial[J].J Natl Cancer Inst,2007,99(4):272-282.
[27]Powles TJ,Ashley S,Tidy A,et al.Twenty-year follow-up of the Royal Marsden randomized,double-blinded tamoxifen breast cancer prevention trial[J].J Natl Cancer Inst,2007,99(4):283-290.
[28]Veronesi U,Maisonneuve P,Rotmensz N,et al.Italian randomized trial among women with hysterectomy:tamoxifen and hormone-dependent breast cancer in high-risk women[J].J Natl Cancer Inst,2003,95(2):160-165.
[29]Cummings SR,Eckert S,Krueger KA,et al.The effect of raloxifene on risk of breast cancer in postmenopausal women:results from the MORE randomized trial[J].JAMA,1999,281(23):2189-2197.
[30]Martino S,Cauley JA,Barrett-Connor E,et al.Continuing outcomes relevant to Evista:breast cancer incidence in postmenopausal osteoporotic women in a randomized trial of raloxifene[J].J Natl Cancer Inst,2004,96(23):1751-1761.
[31]Grady D,Cauley JA,Geiger MJ,et al.Reduced incidence of invasive breast cancer with raloxifene among women at increased coronary risk[J].J Natl Cancer Inst,2008,100(12):854-861.
[32]Vogel VG,Costantino JP,Wickerham DL,et al.Update of the National Surgical Adjuvant Breast and Bowel Project Study of Tamoxifen and Raloxifene(STAR)P-2 Trial:Preventing breast cancer[J].Cancer Prev Res(Phila),2010,3(6):696-706.
[33]Cummings SR,Ensrud K,Delmas PD,et al.Lasofoxifene in postmenopausal women with osteoporosis[J].N Eng J Med,2010,362(8):686-696.
[34]Goss PE,Ingle JN,Ales-Martinez JE,et al.Exemestane for breast-cancer prevention in postmenopausal women[J].N Eng J Med,2011,364(25):2381-2391.
[35]Cuzick J,Sestak I,Forbes JF,et al.Anastrozole for prevention of breast cancer in high-risk postmenopausal women(IBIS-Ⅱ):an international,double-blind,randomised placebo-controlled trial[J].Lancet,2014,383(9922):1041-1048.
The disk factor and prevention of breast cancer
CHEN Jie,ZHOU Lei-lei
R655.8
B
1672-6170(2015)04-0159-05
2014-12-01;
2015-02-05)

