长心卡帕藻愈伤组织的诱导与其形态建成的初步研究
李虎,刘建国,庞通
(1.中国科学院 海洋研究所,山东 青岛 266071;2. 中国科学院大学,北京 100049)
长心卡帕藻愈伤组织的诱导与其形态建成的初步研究
李虎1,2,刘建国1*,庞通1
(1.中国科学院 海洋研究所,山东 青岛 266071;2. 中国科学院大学,北京 100049)
以PES液体培养基、固体培养基,采用正交设计,开展了长心卡帕藻(Kappaphycusalvarezii)棕色藻株组织培养和愈伤组织诱导实验,探索了蔗糖、光强、植物生长调节剂对新芽形成和愈伤组织形成的影响,结果表明,固体培养基、IBA、6-BA处理可诱导该藻产生愈伤组织,同时固体培养基更利于诱导形成愈伤组织;显微跟踪观察显示,该藻愈伤组织与高等植物的疏松愈伤组织不同,由细丝状细胞组成,系藻枝段中心髓部细胞脱分化形成的致密型愈伤组织;另外,愈伤枝段比新芽枝段有更高的光合和呼吸速率。
长心卡帕藻;组织培养;愈伤组织;氧电极;光合与呼吸
1 引言
长心卡帕藻(Kappaphycusalvarezii)属红藻门、真红藻纲、杉藻目、红翎菜科、卡帕藻属[1],是生产κ型卡拉胶的重要海藻。卡拉胶是一种安全、无毒、无副作用的食品添加剂,具有凝胶、增稠和保水特性,是布丁、奶酪、火腿、冰淇淋等食品加工行业的重要原料[2—5];另外,卡拉胶在医学上也有较好的应用前景[6—8],具有较高的经济价值。卡帕属藻类由Doty等人20世纪70年代首先在菲律宾地区进行人工栽培,随后印度尼西亚、马来西亚、中国、越南等国家相继进行卡帕藻属海藻的人工栽培。40多年来完全依赖于无性繁殖方式进行扩繁,长期的无性繁殖导致了藻体生长速率下降、产胶质量下降、易感染附生藻、抗病能力低下,进而造成产量大幅减少和市场价格发生剧烈波动[9],影响了相关产业健康发展。例如,2008年在我国海南栽培的长心卡帕藻受到冰样白化病暴发的危害而大规模死亡,养殖面积从上万亩锐减到几十亩,给海藻养殖户造成了严重损失[10]。
理论上,长心卡帕藻存在无性繁殖和有性生殖方式,但该藻四分孢子严重退化,生殖细胞很难发现,因此到目前为止,有性生殖进行该藻种苗培育和繁殖难以进行。组织培养作为一种快速繁殖种苗技术已在优良种苗的大量获得和优良种苗的种质保存中显示出越来越重要的作用[11],目前关于海藻愈伤组织研究已有很多报道[12—14],其中主要经济褐藻海带、裙带菜[15—16]以及红藻中的江蓠[17—21]等都有较成熟的愈伤组织诱导技术。长心卡帕藻的组织培养方面,虽然Dawes和Koch等[22]研究并证明植物生长调节剂在该藻组织培养中发挥重要作用,但很遗憾未获得愈伤组织。长心卡帕藻属低等大型海洋红藻,在藻枝段上可直接长出新芽,愈伤组织的产生则需要苛刻条件,并且获得的愈伤组织形态也有所不同,例如Hayashi等[23]获得了两种愈伤组织,即似真菌丝状愈伤组织和块状小细胞组成的致密愈伤组织,Hurtado和Biter[9]在组织培养再生新芽过程中,获得了从枝段切面长出的团状愈伤组织。但到目前为止,对于何种条件能诱导出何种形态的愈伤组织未有定论,对于愈伤组织的发生及来源过程也未见报道。
本文以PES液体与固体培养基(0.8%琼脂),采用正交设计,研究蔗糖、光照、植物生长素(IAA和IBA)和细胞分裂素(6-BA)等对长心卡帕藻枝段组织培养和愈伤组织诱导的影响,并检测了长心卡帕藻愈伤组织诱导过程中的光合及呼吸速率等生理指标的变化,为实现该藻愈伤组织诱导与分化提供基础。
2 材料与方法
2.1 材料处理及消毒
棕色长心卡帕藻(Kappaphycusalvarezii)取自海南省陵水黎族自治县黎安镇黎安湾,选取生长良好枝段(直径3~4 mm,长度5~7 cm),先去除藻体表面可见寄生或附生原生动物及杂藻,然后用刷子在灭菌海水中反复清洗,期间在无菌淡水中仔细刷洗一次,再转移到灭菌海水中刷洗,直至镜检无杂藻等污染物为止。在超净工作台中,按照无菌操作要求,先用0.7%的KI溶液(无菌海水配)浸泡消毒10 min,再用每毫升含1万单位青霉素、10 mg链霉素和250 μg两性霉素B的无菌海水[23]浸泡12 h,之后用无菌海水冲洗至少3次,最后将藻段切成长5~7 mm小段,备用。
2.2 培养基的配制
PES(Provasoli Enriched Seawater)液体培养基[24]:使用500 mL三角瓶,2 mL PES母液加入到100 mL海水中,再加入碳源——蔗糖,然后在121℃下高压蒸汽灭菌20 min,备用。
PES固体培养基:PES液体培养基100 mL中加入0.8 g琼脂(0.8%),灭菌后,冷却到40~50℃,在超净工作台中倒平板,每瓶倒3个平皿(每个约33 mL),备用。
2.3 碳源(蔗糖)浓度实验
PES液体培养基添加蔗糖浓度梯度0、0.5、1.0、1.5 g/L,每个梯度选取20个长心卡帕藻枝段(长度5~7 mm),3个平行,每周更换培养基,培养条件:光强(40±5) μmol/(m2·s),光周期为14∶10(L∶D),温度(26±1)℃,相对湿度75%。5周后统计枝段存活率、枝段发芽率。

(1)

(2)
2.4 枝段培养的正交实验
最优条件的筛选用正交实验的方法进行。
实验A(PES液体培养基、IAA、6-BA实验):用PES液体培养基,选取光照、植物生长素IAA,细胞分裂素6-BA 3个因素,每个因素3个水平,依据文献[23,25]确定这3个水平大致范围,选取光照强度23、41、54 μmol/(m2·s),IAA浓度0、1、2 mg/L,6-BA浓度0、1、2 mg/L。采用正交表L9(34)设计实验,如表1。

表1 长心卡帕藻愈伤组织诱导的正交实验表
实验共9个组,每个实验组选用20个5~7 mm小枝段(9×20),培养条件:温度(26±1)℃,光周期14∶10(L∶D),相对湿度75%,每周更换培养基,观察枝段生长状态,记录枝段存活率和枝段发芽率,并观察愈伤组织形成情况,如有愈伤组织产生,统计枝段愈伤组织发生率,
枝段愈伤组织发生率=
(有愈伤组织枝段数/存活枝段数)×100%.
(3)
实验B(PES液体培养基、IBA、6-BA实验):更换植物生长素,把IAA换成IBA,其他条件与实验A相同。
实验C(PES固体培养基、IBA、6-BA实验):植物生长素是IBA,而液体培养基换成固体培养基,9个实验组,每实验组有3个平皿(3个平行),每个平皿中培养7个小枝段(9×3×7),培养基两周更换一次,其他条件与实验A相同。
2.5 愈伤组织和枝段新芽形成过程的观察及呼吸速率和光合速率的检测
利用步骤2.4中PES固体培养基、IBA、6-BA组合获得愈伤组织的最优条件重新培养枝段,共选用18个平皿,每个平皿中10个小枝段,培养基两周更换一次。愈伤和新芽出现后,分别选取大小尽量相同的愈伤枝段和发芽枝段(愈伤和发芽枝段各取5个,作为5个平行),用Chlorolab-2氧电极(英国Hansatech公司)进行耗/放氧速率检测,然后计算出光合和呼吸速率;另外,在显微镜下观察愈伤组织和新芽形成过程。
Chorolab-2氧电极的检测方法[26—27]:取样品枝段,在无菌海水中涮洗几次,去除粘附的固体培养基,然后用灭菌滤纸吸除表面水分,称量后用无菌白色棉线细绳拴住,悬于反应杯中,反应介质为含0.1 mol/L NaHCO3的灭菌海水,测光合时要打开饱和光源,整个过程由软件“Oxylab”程序控制,每次实验前都要根据实验室温度进行校正,然后设定相应参数。
实验统计采用t-test检测。
3 结果与分析
3.1 蔗糖对长心卡帕藻枝段存活率和发芽率的影响
培养2周,用肉眼可见每个实验组都有枝段发芽,到5周时统计枝段存活数和发芽数,并计算出枝段存活率和枝段发芽率,如图1所示。实验结果表明,不加蔗糖,枝段存活率为(52.5±3.5)%,当蔗糖浓度为0.5 g/L时,存活率相对较高,为(97.5±2.5)%,随蔗糖浓度进一步增加,存活率下降(见图1a);当蔗糖浓度为0或0.5 g/L时,枝段发芽率较高(见图1b),分别为(71.8±11.6)%、(74.2±8.2)%,综合考虑,选取蔗糖浓度0.5 g/L为后续组织培养实验的最适碳源浓度。
3.2 枝段培养的正交实验
PES液体培养基、IAA、6-BA实验(实验A):在实验A(表2)中,通过正交实验的极差分析得出枝段存活最优组合为:光强23 μmol/(m2·s),IAA浓度1 mg/L,6-BA浓度0;枝段发芽最优组合为:光强41 μmol/(m2·s),IAA浓度2 mg/L,6-BA浓度0。但未形成愈伤组织。
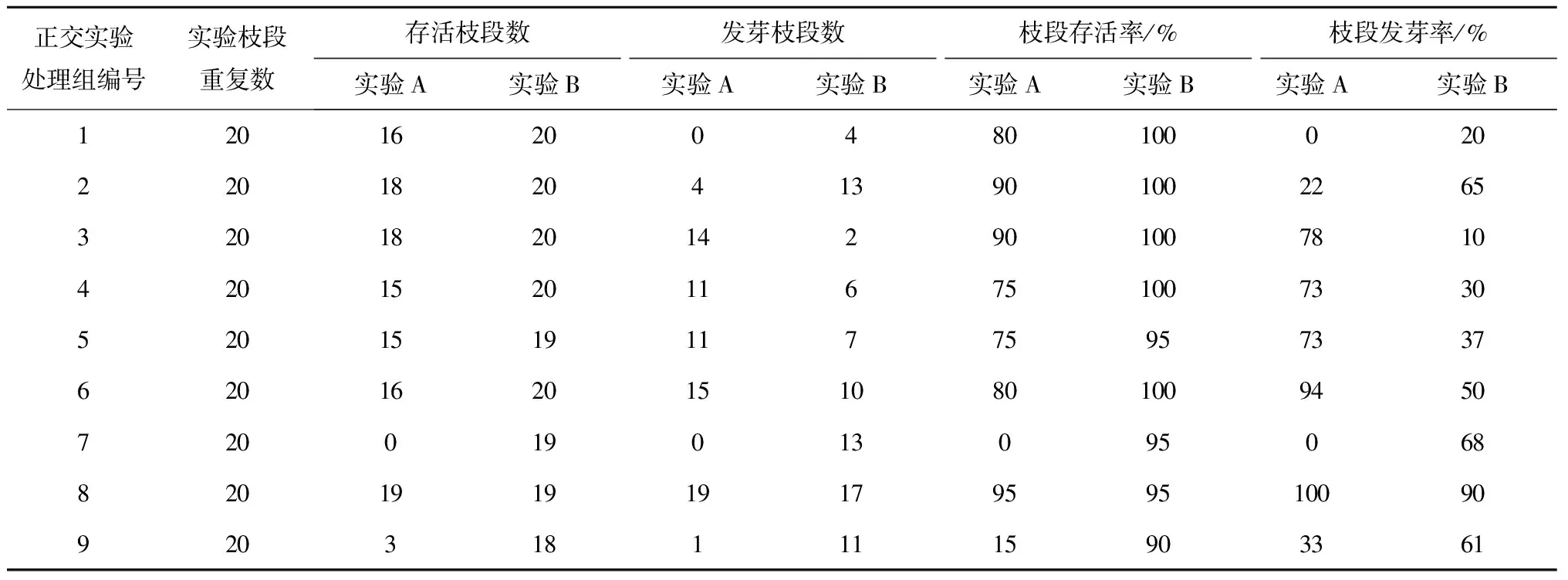
表2 正交实验A(PES液体培养基、IAA、6-BA)和B(PES液体培养基、IBA、6-BA)的枝段培养情况

图1 长心卡帕藻枝段组织培养5周的枝段存活率(a)和枝段发芽率(b)Fig.1 Branch survival rate (a) and germination rate (b) of Kappaphycus alvarezii in 5 weeks
PES液体培养基、IBA、6-BA实验(实验B):在实验B(见表2)中,通过正交实验的极差法分析得出枝段发芽的最优组合为:光强54 μmol/(m2·s),IBA浓度1 mg/L,6-BA浓度0。但同样未形成愈伤组织。
PES固体培养基、IBA、6-BA实验(实验C):形成了愈伤组织(见图2中黑色箭头所示),有的枝段一端发芽,另一端形成愈伤组织(见图2a,2b),有的枝段两端产生愈伤组织(见图2c),但未观察到两端都发芽的枝段(实验A、B中也未观察到),而实验中愈伤组织可以两端都产生,推测发芽可能有极性,而产生愈伤组织没有极性;枝段培养情况统计如表3所示,实验组6有最高的枝段存活率,经极差法分析,发芽率最优组合为:光强54 μmol/(m2·s),IBA浓度1 mg/L,6-BA浓度1 mg/L;愈伤组织产生率最佳组合为:光强54 μmol/(m2·s),IBA浓度0,6-BA浓度2 mg/L。此结果表明:加6-BA同时不加IBA,有促进愈伤组织产生的作用;另外,实验B中用的液体培养基,其余条件与实验C相同,但枝段没有形成愈伤组织,说明固体培养基对愈伤组织的形成起着关键作用。
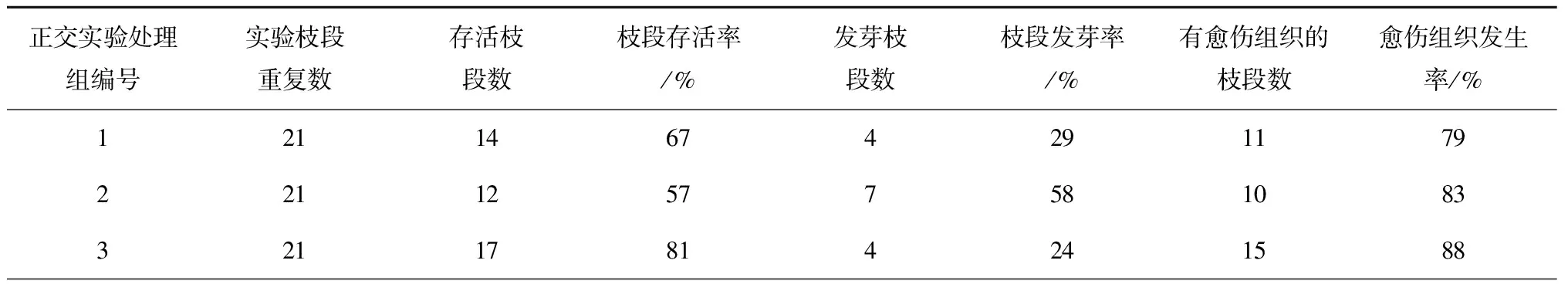
表3 正交实验C(PES固体培养基、IBA、6-BA)的枝段培养情况

续表3

图2 长心卡帕藻枝段培养5周时产生的愈伤组织和新芽Fig.2 Callus formation and new buds germination in Kappaphycus alvarezii induced by PES solid medium with 0.8% agar after 5 weeks

图3 长心卡帕藻愈伤组织图 Fig.3 Kappaphycus alvarezii callus by PES solid medium with 0.8% agar after 5 weeks

图4 长心卡帕藻枝段培养10天所形成的愈伤组织及长出的新芽Fig.4 Callus formation and new bud germination in Kappaphycus alvarezii induced by PES solid culture medium with 0.8% agar after 10 days
3.3 长心卡帕藻愈伤组织显微观察结果
长心卡帕藻愈伤组织为坚硬致密组织(图2,图3a),对愈伤枝段进行竖切并显微观察(见图3a,3b),发现愈伤组织细胞团覆盖于枝段横切面,藻枝段皮层薄壁大细胞与丝状愈伤组织细胞接触部分的过渡细胞为直径约10 μm,形态类似成熟枝段的髓部小细胞,但愈伤组织具体是不是由髓部小细胞发育而来需要进一步跟踪观察验证。显微镜下,愈伤细胞团由细长状细胞组成,细胞长度从几十微米到几百微米不等,宽约10 μm;愈伤组织前端部分(见图3c),每个细长细胞前部连接有一圆形小细胞,推测细长状细胞由圆形小细胞伸长发育而来,进一步对愈伤组织细胞团进行观察,发现有的长细胞上有分支细胞,犹如树枝主干分出来的支干(见图3d),分支细胞开始为圆球形,后来逐渐也成为细长状。
对长心卡帕藻愈伤组织形成过程跟踪显微观察:在第7天时发现肉眼可见新芽,第10天时观察到肉眼可见愈伤;愈伤组织从枝段横切面形成小凸起,呈透明状(见图4a);通过跟踪观察愈伤组织的形成情况,发现愈伤细胞来源于藻枝段中心的髓部小细胞,在成熟长心卡帕藻枝段中,髓部细胞较小,不同于皮层的薄壁大细胞,要形成愈伤组织时,髓部细胞拉长,变成细长状细胞,向外不断增殖,呈发散状向前生长,最终形成愈伤组织(见图4b);而跟踪观察形成新芽的枝段(见图4c),新芽也是由髓部细胞形成,但仅是髓部细胞的增大、增殖过程,并未见细长状细胞,新芽细胞和原组织细胞形态一致,并且表面有含色素的表皮细胞层,使外观来看新芽颜色较深,不同于愈伤组织的无色透明状(见图4d)。因此,推测髓部小细胞的形态变化(即是否进行脱分化)决定着形成愈伤还是新芽。
3.4 长心卡帕藻产生愈伤组织与萌发新芽两个不同过程及发生时的光合和呼吸速率变化
在对长心卡帕藻的培养过程中,藻枝段形成的愈伤组织在第10天肉眼可见,在接下来培养的35天中,愈伤组织的生长表现为致密细胞团的增大,细胞团颜色较浅,表层没有带色素的深色细胞覆盖,细胞仍为细长状;而发芽枝段的新芽生长表现为变粗变长,表面始终有深色表皮细胞覆盖,未见细长状细胞。图5为培养过程中15天、25天、35天时愈伤枝段和发芽枝段的形态。
通过测定愈伤枝段和发芽枝段过程中的光合及呼吸速率,发现愈伤枝段呼吸速率和光合速率都比发芽枝段的高(见图6),在第10天开始出现愈伤组织时,愈伤枝段的光合速率为(111.7±38.2) nmol/(min·g)(以氧计),而发芽枝段的光合速率只有(59.0±13.2) nmol/(min·g)(以氧计);愈伤枝段的呼吸速率为(105.2±41.5)nmol/(min·g)(以氧计),也显著高于发芽枝段的(57.6±26.2)nmol/(min·g)(以氧计),提示我们,藻枝段上愈伤组织的出现比新芽的出现都有着较高的细胞生理活性。但长心卡帕藻是如何控制产生愈伤组织或新芽的机制还需深入研究。

图5 长心卡帕藻的愈伤枝段和新芽枝段在培养过程中的形态变化Fig.5 The morphological changes of Kappaphycus alvarezii callus and new bud in culturing
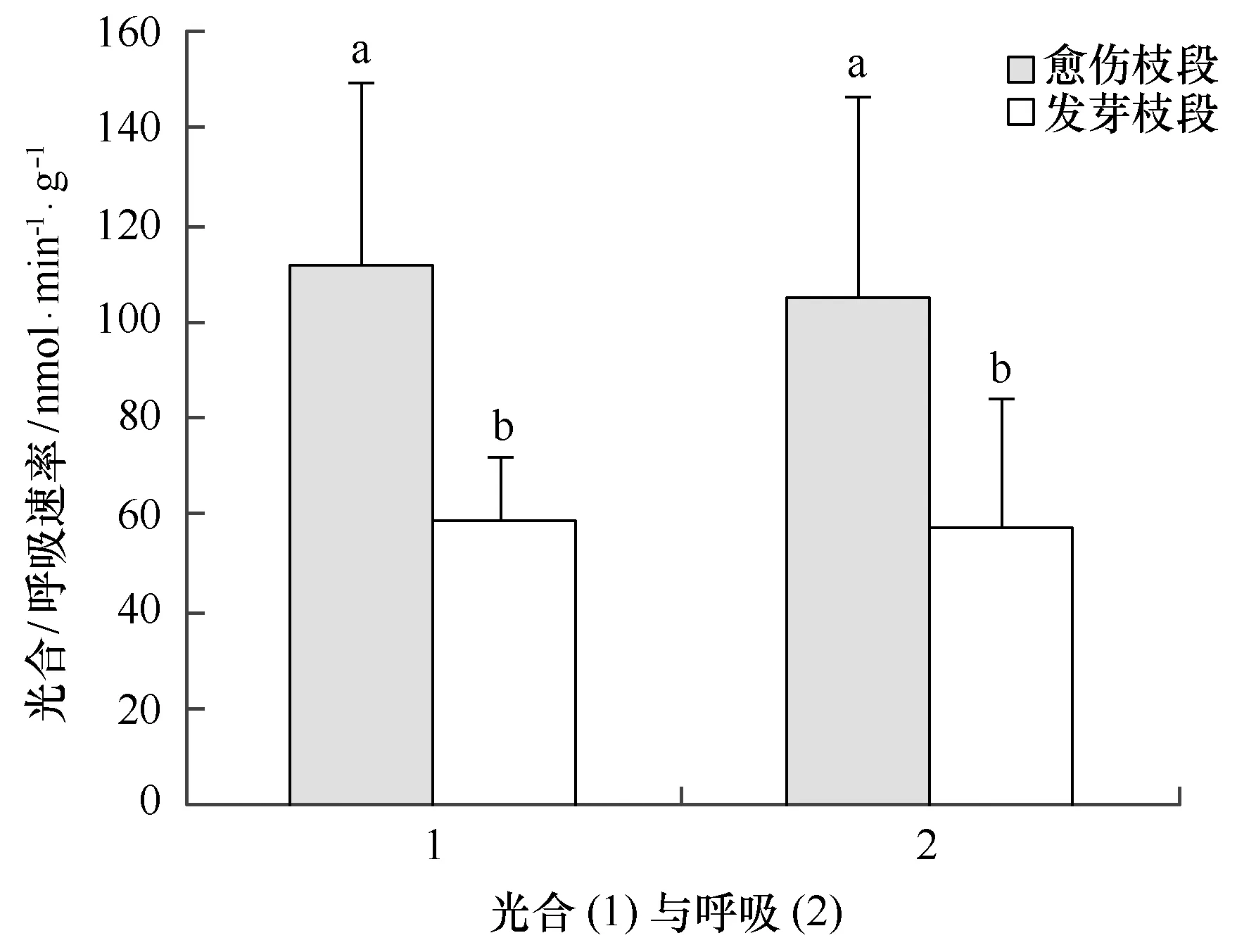
图6 培养10天时长心卡帕藻愈伤枝段和新芽枝段光合速率与呼吸速率(不同小写字母代表显著性差异,p<0.05)Fig.6 Photosynthetic rate and respiratory rate of 10 days cultured Kappaphycus alvarezii branch with callus and new bud,respectively(The different lowercase letters indicate significant differences among treatments,p<0.05)
4 讨论
组织培养技术能够快速繁殖稀有或较大经济价值的植物,对于植物种质资源的保存、挽救濒临灭绝植物都有重要作用。海洋藻类方面,已经报道超过85种海藻的组织培养研究,其不仅在海藻优良种苗培育上有重要作用,而且也促进了海藻医药保健品等高附加值产品的生物加工产业的发展[28—29]。本研究中的长心卡帕藻是一种生产卡拉胶的重要原材料,具有较高经济价值,其组织培养的研究对于其优良种苗选育和种质保存都有重要意义[30]。目前对于长心卡帕藻的组织培养研究表明,能够通过组培技术较易得到长心卡帕藻新芽[22],但得到愈伤组织往往需要苛刻条件。在红藻的愈伤组织研究中,Gusev等[31]发现蔗糖和植物生长调节剂对洋菜植物(Agarophytemarinealgae)愈伤组织的形成有着重要作用,Yokoya等[32—33]发现高浓度的6-BA对红藻Chondracanthuschamissoi和红藻Solieriafiliformis愈伤组织的产生有刺激作用,而Robledo和Garcia-Reina[34]又发现静置的液体培养基不能使红藻Solieriafiliformis产生愈伤组织,在本实验中,我们也印证了蔗糖、固体培养基、6-BA在红藻——长心卡帕藻愈伤组织产生中的重要作用,用0.5 g/L蔗糖、PES固体培养基、2 mg/L 6-BA、未加植物生长素组合能高效诱导出愈伤组织。此外,在诱导得到的长心卡帕藻愈伤组织的形态上,不同人的研究结果有所不同。Hayashi等和Zitta等[23,35]得到的为丝状愈伤组织,形态上看类似真菌菌丝,而本实验中得到的愈伤组织为如瘤状的致密细胞团,由不含色素的细长状细胞组成,这与Reddy等[36]得到的愈伤组织非常类似,他们用固体培养基培养出了细丝状愈伤(filamentous callus),对比分析,我们推测当培养在固体培养基中,长心卡帕藻横切枝段的切面(即受伤面)接触固体培养基的部分,均长成瘤状致密细胞团的愈伤组织,而其未接触固体培养基、暴露在空气中部分可能会长出丝状愈伤组织,但本实验中枝段受伤面是贴于固体培养基中的,故此得到了致密愈伤。在本研究中,我们又对愈伤组织的形成过程进行了跟踪观察,发现愈伤组织来源于髓部小细胞,培养过程中,形成愈伤组织的愈伤枝段与形成新芽的发芽枝段相比,前者的光合速率和呼吸速率都较高,提示我们,产生愈伤组织时枝段组织细胞会有较高的生理活性,但具体什么原因造成的这种现象,还有待进一步的研究。
本研究采用正交实验来降低实验工作量,探索摸索出了一条新的获得长心卡帕藻愈伤组织的方法,并初步探讨了愈伤组织发生来源及发生过程中的生理变化,对于长心卡帕藻在培养过程中如何精密控制产生愈伤组织还是新芽、愈伤组织再分化等问题,需进一步的探索。
[1] 匡梅,曾呈奎,夏邦美.中国麒麟菜族的分类研究[J]. 海洋科学集刊,1999,41:168-236.
Kuang Mei,Zeng Chengkui,Xia Bangmei. Taxonomy of Eucheumatoidae in China[J]. Studia Marina Sinica,1999,41:168-236.
[2] Doty M S,Alvarez V B. Status,problems,advances and economics ofEucheumafarms[J]. Marine Technology Society Journal,1975,9(4): 30-36.
[3] 庞通. 卡帕藻属和麒麟菜属的种苗选育与病害防治研究[D]. 青岛:中国科学院海洋研究所,2011.
Pang Tong. Seed selection and disease control of carrageenan-producing seaweedKappaphycusandEucheuma[D]. Qingdao: Institute of Oceanology,Chinese Academy of Sciences,2011.
[4] 黄园,刘建国,庞通,等. 盐度降低对长心卡帕藻原初光化学反应的影响[J]. 海洋学报,2010,32 (3): 146-152.
Huang Yuan,Liu Jianguo,Pang Tong,et al. The changes of primary photochemical reactions inKappaphycusalvareziiexposed to low salinity[J]. Haiyang Xuebao,2010,32(3): 146-152.
[5] Liu C,Huang X,Liu J. Assessment of introducedKappaphycus(Solieriaceae,Rhodophyta) species relationships in China with molecular markers[J]. Acta Oceanologica Sinica,2013,32(2): 59-65.
[6] Yamada T,Ogamo A,Saito T,et al. Preparation ofO-acylated low-molecular-weight carrageenans with potent anti-HIV activity and low anticoagulant effect[J]. Carbohydrate Polymers,2000,41(2): 115-120.
[7] Yamada T,Ogamo A,Saito T,et al. Preparation and anti-HIV activity of low-molecular-weight carrageenans and their sulfated derivatives[J]. Carbohydrate Polymers,1997,32(1): 51-55.
[8] Haijin M,Xiaolu J,Huashi G. A κ-carrageenan derived oligosaccharide prepared by enzymatic degradation containing anti-tumor activity[J]. Journal of applied phycology,2003,15(4): 297-303.
[9] Hurtado A Q,Biter A B. Plantlet regeneration ofKappaphycusalvareziivar. adik-adik by tissue culture[J]. Journal of Applied Phycology,2007,19(6): 783-786.
[10] Yunque D A T,Tibubos K R,Hurtado A Q,et al. Optimization of culture conditions for tissue culture production of young plantlets of carrageenophyteKappaphycus[J]. Journal of Applied Phycology,2011,23(3): 433-438.
[11] 刘建国,庞通,王莉,等. 导致热带产卡拉胶海藻大规模死亡原因分析与藻株抗病差异性比较[J]. 海洋与湖沼,2009,40(2): 235-241.
Liu Jianguo,Pang Tong,Wang Li,et al. The reasons causing catastrophic death in tropical carrageenan producing seaweeds and their difference in resistance to illness[J]. Oceanologia et Limnologia Sinica,2009,40(2): 235-241.
[12] Aguirre-Lipperheide M,Estrada-Rodríyuez F J,Evans L V. Facts,problems,and needs in seaweed tissue culture: an appraisal[J]. Journal of Phycology,1995,31(5): 677-688.
[13] Polne-Fuller M,Gibor A. Calluses and callus-like growth in seaweeds: induction and culture[C]. Twelfth International Seaweed Symposium. Springer Netherlands,1987: 131-138.
[14] Kumar G R,Reddy C R K,Jha B. Callus induction and thallus regeneration from callus of phycocolloid yielding seaweeds from the Indian coast[J]. Journal of Applied Phycology,2007,19(1): 15-25.
[15] Kawashima Y,Tokuda H. Callus formation inEckloniacavaKjellman (Laminariales,Phaeophyta)[C]. Thirteenth International Seaweed Symposium. Springer Netherlands,1990: 375-380.
[16] Kawashima Y,Tokuda H. Regeneration from callus ofUndariapinnatifida(Harvey) Suringar (Laminariales,Phaeophyta)[C]. Fourteenth International Seaweed Symposium. Springer Netherlands,1993: 385-389.
[17] Bouzon Z L,Schmidt E C,Almeida A C,et al. Cytochemical characterization and ultrastructural organization in calluses of the agarophyteGracilariopsistenuifrons(Gracilariales,Rhodophyta)[J]. Micron,2011,42(1): 80-86.
[18] Collantes G,Melo C,Candia A. Micropropagation by explants ofGracilariachilensisBird,McLachlan and Oliveira[J]. Journal of applied phycology,2004,16(3): 203-213.
[19] Yokoya N S. Apical callus formation and plant regeneration controlled by plant growth regulators on axenic culture of the red algaGracilariopsistenuifrons(Gracilariales,Rhodophyta)[J]. Phycological Research,2000,48(3): 133-142.
[20] Yokoya N S,West J A,Luchi A E. Effects of plant growth regulators on callus formation,growth and regeneration in axenic tissue cultures ofGracilariatenuistipitataandGracilariaperplexa(Gracilariales,Rhodophyta)[J]. Phycological Research,2004,52(3): 244-254.
[21] Kaczyna F,Megnet R. The effects of glycerol and plant growth regulators onGracilariaverrucosa(Gigartinales,Rhodophyceae)[J]. Hydrobiologia,1993,268(1): 57-64.
[22] Dawes C J,Koch E W. Branch,micropropagule and tissue culture of the red algaeEucheumadenticulatumandKappaphycusalvareziifarmed in the Philippines[J]. Journal of applied phycology,1991,3(3): 247-257.
[23] Hayashi L,Yokoya N S,Kikuchi D M,et al. Callus induction and micropropagation improved by colchicine and phytoregulators inKappaphycusalvarezii(Rhodophyta,Solieriaceae)[J]. Journal of Applied Phycology,2008,20(5): 653-659.
[24] Provasoli L. Media and prospects for the cultivation of marine algae[C]. Cultures and Collections of Algae. Proceedings of the US-Japan Conference,Hakone,September 1966. Japanese Society for Plant Physiology,1968: 63-75.
[25] 卓书辉,郭彦岑,尹群健,等. 长心卡帕藻外植体培养及不定芽诱导[J]. 广东农业科学,2012,39(23): 126-128.
Zhuo Shuhui,Guo Yancen,Yin Qunjian,et al. Explant regeneration and shoot induction ofKappaphycusalvarezii[J].Guangdong Agricultural Sciences,2012,39(23): 126-128.
[26] Lee T M,Chang Y C,Lin Y H. Differences in physiological responses between winter and summerGracilariatenuistipitata(Gigartinales,Rhodophyta) to varying temperature[J]. Botanical Bulletin of Academia Sinica,1999,40:93-100.
[27] 张栩,李大鹏,施定基,等. 裙带菜配子体和幼孢子体的光合作用特性[J]. 海洋科学,2004,28(11): 20-27.
Zhang Xu,Li Dapeng,Shi Dingji,et al. Photosynthesis properties of gametophytes and juvenile sporophytes of algae,Undariapinnatifida[J]. Marine Sciences,2004,28(11): 20-27.
[28] Reddy C R K,Jha B,Fujita Y,et al. Seaweed micropropagation techniques and their potentials: an overview[J]. Journal of Applied Phycology,2008,20(5): 609-617.
[29] Yokoya N S,Yoneshigue-Valentin Y. Micropropagation as a tool for sustainable utilization and conservation of populations of Rhodophyta[J]. Revista Brasileira de Farmacognosia,2011,21(2): 334-339.
[30] Bindu M S,Levine I A. The commercial red seaweedKappaphycusalvarezii——an overview on farming and environment[J]. Journal of Applied Phycology,2011,23(4): 789-796.
[31] Gusev M V,Tambiev A H,Kirikova N N,et al. Callus formation in seven species of agarophyte marine algae[J]. Marine Biology,1987,95(4): 593-597.
[32] Yokoya N S,vila M,Piel M I,et al. Effects of plant growth regulators on growth and morphogenesis in tissue culture ofChondracanthuschamissoi(Gigartinales,Rhodophyta)[J]. Journal of Applied Phycology,2014,26(2): 819-823.
[33] Yokoya N S,Handro W. Effects of plant growth regulators and culture medium on morphogenesis ofSolieriafiliformis(Rhodophyta) cultured in vitro[J]. Journal of applied phycology,2002,14(2): 97-102.
[34] Robledo D R,Garcia-Reina G. Apical callus formation inSolieriafiliformis(Gigartinales,Rhodophyta) cultured in tanks[J]. Hydrobiologia,1993,260(1): 401-406.
[35] Zitta C S,Rover T,Hayashi L,et al. Callus ontogeny of theKappaphycusalvarezii(Rhodophyta,Gigartinales) brown tetrasporophyte strain[J]. Journal of Applied Phycology,2013: 1-15.
[36] Reddy C R K,Kumar G,Siddhanta A K,et al.Invitrosomatic embryogenesis and regeneration of somatic embryos from pigmented callus ofkappaphycusalvarezii(doty) doty (rhodophyta,gigartinales) [J]. Journal of phycology,2003,39(3): 610-616.
Callus induction and morphogenesis of callus inKappaphycusalvarezii(Rhodophyta,Solieriaceae)
Li Hu1,2,Liu Jianguo1,Pang Tong1
(1.InstituteofOceanology,ChineseAcademyofSciences,Qingdao266071,China; 2.UniversityofChineseAcademyofSciences,Beijing100049,China)
The brown morphotype of red seaweedKappaphycusalvareziicollected from Li’an Bay in Lingshui County,Hainan Province of China,was used as explants in order to generate new buds and induce callus. Effect of the PES (Provasoli enriched seawater) media (with or without gelling agent),light intensity,and phytoregulators (Indole-3-acetic acid (IAA),Indole-3-butyric acid (IBA),6-benzylaminopurine (6-BA)) were tested on new bud generation and callus formation by orthogonality experiment. The callus forming was observed in microscope,and the changes of the respiration rate and photosynthesis rate in explants among callus forming were detected. The callus ofKappaphycusalvareziiwas achieved successfully by the combination of PES solid medium (0.8% ager),IBA,6-BA,while callus was not observed in the combination of PES liqiud medium,IBA and 6-BA. That indicates the solid medium plays an important role in callus induction.Kappaphycusalvareziicallus which consists of compact filamentous cells was different from the loose callus of superior plants. And callus derived from the medullary cells. It was found that both photosynthetic rate and respiratory rate in the branch inducing callus were higher than ones of the branch germinating new bud by means of oxygen electrode.
Kappaphycusalvarezii; tissue culture; callus; oxygen electrode; photosynthesis and respiration
10.3969/j.issn.0253-4193.2015.04.005
2014-05-21;
2014-12-18。
国家自然科学基金青年科学基金项目(41306154);青岛市海洋经济创新发展区域示范成果转化及产业化项目。
李虎(1988-),男,河南省濮阳市人,博士研究生,主要研究方向为藻类生理。E-mail: li_hu2007@163.com
*通信作者:刘建国,博士,研究员,主要研究方向为藻类和藻类生物技术。E-mail:jgliu@qdio.ac.cn
Q945.52
A
0253-4193(2015)04-0052-10
李虎,刘建国,庞通. 长心卡帕藻愈伤组织的诱导与其形态建成的初步研究[J].海洋学报,2015,37(4):52—61,
Li Hu,Liu Jianguo,Pang Tong. Callus induction and morphogenesis of callus inKappaphycusalvarezii(Rhodophyta,Solieriaceae)[J]. Haiyang Xuebao,2015,37(4):52—61,doi: 10.3969/j.issn.0253-4193.2015.04.005

