牙鲆选育F3代家系的建立及遗传效应分析
田永胜,陈红林,2,齐文山,2,姜静,2,张英平,2,刘万军,3,李宝玉,刘寿堂,孙德强,陈松林*
(1.中国水产科学研究院 黄海水产研究所 农业部海洋渔业可持续发展重点实验室,山东 青岛 266071;2.上海海洋大学 水产与生命学院,上海 201306;3.中国海洋大学 海洋生命学院,山东 青岛 266003; 4.海阳市黄海水产有限公司,山东 海阳 265100)
牙鲆选育F3代家系的建立及遗传效应分析
田永胜1,陈红林1,2,齐文山1,2,姜静1,2,张英平1,2,刘万军1,3,李宝玉4,刘寿堂4,孙德强4,陈松林1*
(1.中国水产科学研究院 黄海水产研究所 农业部海洋渔业可持续发展重点实验室,山东 青岛 266071;2.上海海洋大学 水产与生命学院,上海 201306;3.中国海洋大学 海洋生命学院,山东 青岛 266003; 4.海阳市黄海水产有限公司,山东 海阳 265100)
牙鲆是太平洋西岸海水养殖、捕捞和自然增殖的主要鱼类,但是人工养殖病害多、生长慢,针对这一问题,从2003年开始开展了牙鲆选择育种。本文利用筛选和培育的F1、F2代牙鲆家系核心群体,构建了F3代家系52个,在生长到196 d时,对家系1 560尾鱼苗全长、体宽、体质量、全长日增量和体质量日增量5个生长性状进行测量和计算,获得7 800个数据。采用“加性-显性”线性模型、最小范数二阶无偏估计法(MINQUE)对以上生长性状的边际平均值、加性方差分量、显性方差分量、随机方差分量、狭义遗传力、广义遗传力、亲本加性效应、杂交随机效应等遗传参数进行了评估。结果显示:1202、1206、1226和1211家系以上生长性状的边际平均值同时显著高于其他家系。以上5个生长性状的加性方差分量比率为(0.099±0.01)~(0.24±0.02),显性方差分量比率为(0.30±0.02)~(0.31±0.02),随机方差分量比率为(0.48±0.02)~(0.61±0.01),5个性状狭义遗传力为0.099~0.24,广义遗传力为0.38~0.54,以上遗传参数均达极显著性水平(p<0.01)。综合比较18个亲本5个性状的加性效应预测值,发现F0917、F0908、F0905、F0915、F09125和KS(韩国牙鲆)亲本在5个性状上都具有极显著的正向效应(p<0.01),其他亲本5个性状都不同程度的表现为显著(p<0.05)或极显著(p<0.01)的负向加性效应。对42个杂交组合显性随机效应进行预测,D(2×6)、D(2×18)、D(3×4)、D(7×12)、D(7×14)和D(8×13) 6个杂交组合在5个性状上都表现为极显著(p<0.05)正效应,利用这些杂交组合建立家系将促进牙鲆以上5个性状的生长。本文研究结果,为牙鲆优良家系的建立及新品种的培育初步筛选出了性状优良的亲本、杂交组合和家系,同时为牙鲆进一步选择育种提供了理论和技术依据。
牙鲆;F3代家系;遗传力;加性效应;显性效应
1 引言
牙鲆(Paralichthysolivaceus)是中国、韩国、日本等太平洋西岸国家的主要经济鱼类,2009年世界牙鲆产量达到4.5万吨,牙鲆的养殖产量26 477.5 t,占鲆鲽类产量的30%,在鲆鲽鱼类养殖中处于第2位,仅次于大菱鲆(57 042 t)[1],在渔业生产中具有重要的地位。我国牙鲆的大量养殖始于20世纪60年代,但直到21世纪初在国内从未有过关于牙鲆育种方面的研究报道。牙鲆繁殖和育苗亲鱼主要来源于养殖群体,经过多代的人工繁殖后,牙鲆的规模化养殖出现了种质退化现象,如生长速度慢、抗逆力下降、病害多(白化病、肠道白浊、鳗弧菌病、淋巴囊肿病、纤毛虫感染等)[2],导致牙鲆养殖效益降低,养殖者对牙鲆养殖信心不足,养殖规模相对缩小。同时也导致了牙鲆养殖中使用抗病药物的种类和用量大增,使牙鲆商品鱼品质无法保障;另一方面过多的使用药物使养殖环境受到污染,造成恶性循环,因此培育生长快、抗逆力强的牙鲆养殖新品种已成为产业发展的迫切需求。
从21世纪初开始,国内在牙鲆养殖群体遗传多样性分析[3—4],MHC抗病分子标记筛选及多态性分析[5—6],遗传连锁图谱构建[7],数量遗传参数评估[8—9],雌核发育[10—11],家系建立及选择育种[12—13]等多方面开展了研究,利用家系选择和杂交育种方法,初步培育出一个生长快牙鲆新品种“鲆优1号”[14]。日本通过抗淋巴囊肿相关微卫星标记辅助,筛选出抗淋巴囊肿病养殖新品种[15]。到目前国内已经建立了牙鲆育种核心种群及技术体系,为牙鲆养殖新品种的培育打下了基础。
本文主要利用已经建立的牙鲆F1和F2代家系选育群体为基础,通过回交、杂交和雌核发育等方式建立了牙鲆F3代家系,对其生长性状进行测定,并对其数量遗传参数进行分析,拟继续筛选优良的牙鲆亲本和家系,为培育出下一代生长快、抗病力强的牙鲆新品种提供育种群体和理论依据。
2 材料和方法
2.1 牙鲆优良繁殖群体构建
2007年利用实验室建立的3个基础群体:牙鲆抗鳗弧菌感染群体(RS)、日本群体(JS)和黄海野生群体(YS),通过简单多系交配方式建立牙鲆F1代63个家系,并通过遗传参数估计等一系列方法,选育和筛选出生长快、抗逆性强的优良家系F0719、F0750、F0751、F0768和F0780家系[2,9]。2008年从韩国济州岛引进韩国牙鲆群体(KS)。2009年利用筛选出的F1代家系、韩国牙鲆、日本牙鲆群体,通过回交和杂交、雌核发育方式,构建F2代家系,经过3年的人工培育,生长和抗病力性状测定、多重比较和遗传参数估计,筛选到生长快、成活高的优良家系,如:F0905、F0908、F0915、F0917、F0921和F0927(F0750雌核发育系)、F0939、F0990、F09104、F09119、F09121和F09125等12个家系。2012年春天利用筛选到的F1、F2家系和韩国牙鲆群体亲本,采用杂交、回交及雌核发育方式建立了F3代家系52个。
2.2 亲鱼培育和生殖调控
以上F1(253尾)、F2(443尾)代家系和韩国牙鲆群体(99尾)亲鱼共计795尾,分别饲养在6个30 m2的水泥池中,循环水培育,水流量4~5 m3/h,并利用纯氧增氧系统向池水中加入纯氧,溶氧量为7~8 mg/L。平时投喂人工加工的冷冻颗粒混合饵料(成分为4%小麦粉、1%鱼粉,95%小杂鱼,少量维生素C和E),每天投喂2次,投喂量为亲鱼体质量的2%~3%。在进入繁殖季节后,以投喂野生杂鱼为主(沙丁鱼、玉筋鱼等),每天的投喂量为亲鱼体质量的5%~6%,并同时在饲料中添加500 mg/kg维生素E。
2012年3月初对牙鲆亲鱼进行生殖调控,工厂化培育亲鱼生殖调控必须利用人工控光、控温、水流调控和饵料调控相结合的方式,才能达到成熟和产卵的目的。利用锅炉加热方式将亲鱼池水温逐渐升温到14℃,保持水温至产卵,繁殖期最适宜水温14~17℃。光照采用长日照模式,白天/黑夜时间比为16 h/8 h,光照强度300~500 lx。经过2个月的生殖调控牙鲆亲鱼达到性成熟。
2.3 家系的构建及标准化培育
在牙鲆繁殖季节,以不完全双列杂交方法,利用以上18个牙鲆家系亲本,构建牙鲆F3代全同胞和半同胞家系52个。亲鱼性成熟后,人工采卵,干法受精,受精后将卵置于50 cm×50 cm×100 cm的孵化网箱中,在14~17℃的水中进行孵化24 h左右,收取上浮卵,转移到实验车间,利用容积为3 m3的玻璃缸进行人工孵化,每缸初始放卵量为20 mL(20 000粒卵左右)。孵化后随着鱼苗成长,随时做好苗种的标准化工作,在完成变态后每个家系鱼苗数量保持在5 000尾左右,鱼苗达5 cm时调整到2 000尾,10 cm时调整到1 000尾,尽量保证每个缸的家系鱼数量保持一致。在鱼苗长到15 cm左右时(日龄150 d),利用荧光染料进行标记,每个家系标记150~250尾鱼苗,集中放入容积为30 m3的水池中培育。
2.4 家系生长性状数据测定
所有家系鱼苗生长到196 d左右时,进行家系生长性状进行测量。测量指标主要包括鱼苗全长、体宽、体质量3个指标,每个家系测量30尾鱼。共测定1 560尾鱼苗的生长性状,再分别利用体长/日龄、体质量/日龄计算出全长日增量和体质量日增量。共获得数据7 800个。
2.5 数据分析方法
使用QGAStation软件中的“加性-显性”模型对F3代家系全长、体宽、体质量、全长日增量、体质量日增量5个性状进行边际均值及遗传参数估计,其线性模型如下:
(1)
式中,y为所有观察值构成的向量,常数向量1是系数为常数1的向量;μ是群体平均数;eA是加性效应向量;UA是加性效应向量关联矩阵;eD是显性效应向量;UD是显性效应向量关联矩阵;eε是随机效应向量[16]。
采用最小范数二阶无偏估计法[17]——MINQUE(1)法(Minimum Norm Quadratic Unbiased Estimation by setting 1 for all prior values),估算各性状的方差分量:即表型方差、加性方差、显性方差和机误方差。
3 结果
3.1 家系生长性状的边际均值
对牙鲆家系全长、体宽、体质量和日增量的估计边际均值进行估算(表1),根据全长边际均值选出生长最快的前10个家系为 1202、1226、1211、1209、1206、1221、1219、1225、1218、1208。根据体宽估计边际均值选出生长最好的前10个家系为1202、1226、1209、1211、1206、1223、1221、1225、1219、1207。根据体质量估计边际均值选出生长最好的前10个家系为1202、1226、1211、1209、1206、1221、1219、1208、1203、1223,根据体质量日增量的估计边际均值选出生长最好的前10个家系为1202、1226、1211、1209、1206、1221、1219、1208、1203、1223。综合比较4个性状所选择的家系中,1202、1206、1226和1211等家系在4个性状中均表现优秀。

表1 全长、体宽、体质量和日增体质量的估计边际均值

续表1
注: 模型中出现的协变量在下列值处进行评估: Number of days=195.060 7。
3.2 生长性状的方差分量和遗传力
使用A-D模型对牙鲆F3代家系的全长、体宽、体质量、日增体长和日增体质量5个性状进行遗传分析,结果表明,全长、体宽、体质量、日增体长和日增体质量的加性、显性方差分量、方差分量比率均达到极显著水平(p<0.01)。以上5个性状的加性方差分量比率为(0.099±0.01)~(0.24±0.02),显性方差分量比率为(0.30±0.02)~(0.31±0.02),随机方差分量比率为(0.48±0.02)~(0.61±0.01)。显性方差分量均大于加性方差分量,机误方差分量比率在0.48到0.61之间,达到了极显著水平(p<0.01)。以上性状狭义遗传力在(0.099±0.01)到(0.24±0.02)之间,5个性状都显示低遗传力,广义遗传力在(0.39±0.01)到(0.52±0.02)之间,均达到极显著水平(p<0.01),其中日增体质量的狭义、广义遗传力都是最低(表2)。

表2 利用“A-D”模型对牙鲆F3代家系5个性状方差分量值、方差分量比率以及遗传力估计结果(M±S.E)
注:** 表示差异极显著(p<0.01);*表示差异显著(p<0.05)。
3.3 亲本加性效应
表3列出了参与牙鲆F3代家系建立的18个牙鲆亲本群体5个生长性状的加性效应估计值,全长加性效应在(17.15±1.822)到(-12.86±1.352)之间,其中F0917、F0908、F0905、F0921、F09125、F0915、F0927和KS群体亲本具有显著或极显著正向加效应,其他亲本则为显著的负向效应。体宽的加性效应在(5.37±0.687)到(-5.68±0.553)之间,同样以上8个亲本具有正向效应,其他家系为负向效应。体质量的加性效应在(19.62±2.427)到(-11.41±1.117)之间,F0917、F0908、KS、F0905、F0921和F0915六个亲本具有极显著的正向加性效应,其他亲本具有不同程度的负向效应。全长日增量的加性效应在(0.04±0.006)到(-0.06±0.008)之间,其中F0917、KS、F0905、F0921、F0768、F09125、F09121 七个亲本具有显著或极显著正向加性效应,其他亲本具有不同程度的负向效应。体质量日增量的加性效应在(0.04±0.007)到(-0.06±0.007)之间,正向与负向效应与体长日增量相同。综合以上5个性状的加性效应预测值,可以看出F0917、F0908、F0905、F0915、F09125和KS群体的亲本在5个性状上都具有极显著的正向效应(p<0.01)。其他亲本5个性状都不同程度的表现为显著(p<0.05)或极显著(p<0.01)的负向加性效应(见表3)。
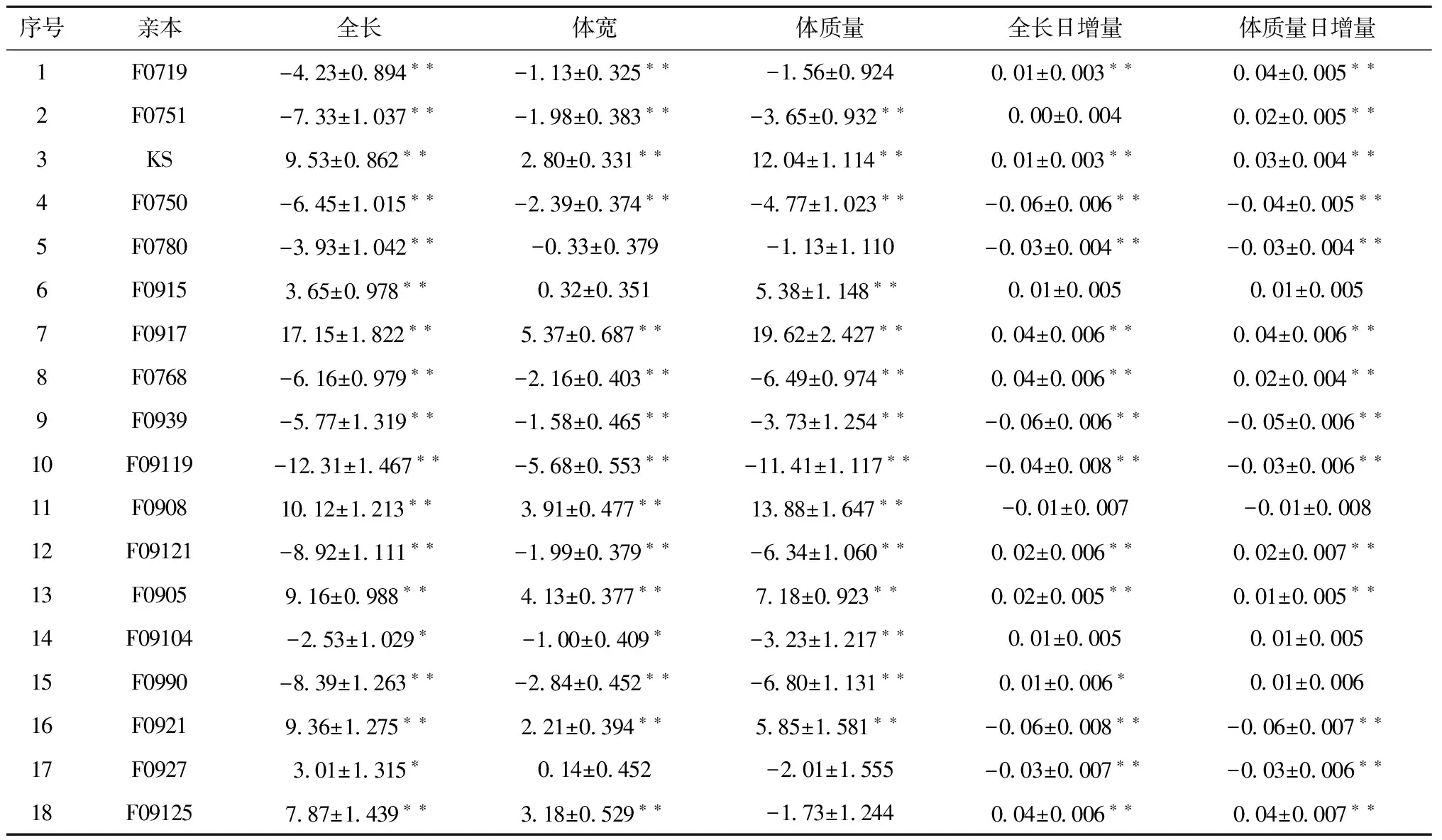
表3 亲本加性效应预测值(M±S.E)
注:** 表示差异极显著(p< 0.01);*表示差异显著(p<0.05)。
3.4 亲本不同杂交组合显性随机效应
对F3代家系建立中42个杂交组合的显性随机效应进行预测,结果显示(表4),全长的显性效应在(45.55±2.585)到(-32.02±3.17)之间,有19个杂交给表现为不同程度的正效应,其中12个杂交组合表现出极显著的正效应(p<0.01)。体宽的显性效应在(17.01±1.031)到(-10.51±1.09)之间,有18个杂交组合表现为不同程度的正效应,其中有11个表现为极显著正效应(p<0.01)。体质量的显性效应在(41.77±3.154)到(-21.74±2.84)之间,有13个杂交组合表现为不同程度的正效应,其中有11个表现为极显著正效应(p<0.01)。在全长、体宽和体质量3个性状上都表现为极显著正效应的杂交组合为D(6×6)、D(1×14)、D(2×6)、D(2×11)、D(3×4)、D(3×16)、D(3×17)、D(4×18)、D(7×12)、D(7×14)、D(8×13) 11个杂交组合。
全长日增量的显性效应在(0.17±0.016)到(-0.10±0.017)之间,有22个杂交组合表现为不同程度的正向效应,其中有14个表现为极显著正效应(p<0.01)。体质量日增量的显性效应在(0.18±0.020)到(-0.12±0.018)之间,有22个杂交组合不同程度的表现为正效应,其中有13个表现为极显著的正效应(p<0.01)。在这两个性状上都表现为极显著正效应的杂交组组合为D(5×5)、D(1×3)、D(1×12)、D(2×6)、D(2×13)、D(2×18)、D(3×4)、D(4×11)、D(6×8)、D(7×12)、D(7×14)、D(8×11)、D(8×15)。对以上结果综合比较,在5个性状上都表现为正效应的杂交组合为D(2×6)、D(2×18)、D(3×4)、D(7×12)、D(7×14)、D (8×13),利用这些杂交组合建立家系将促进牙鲆以上5个性状的生长。
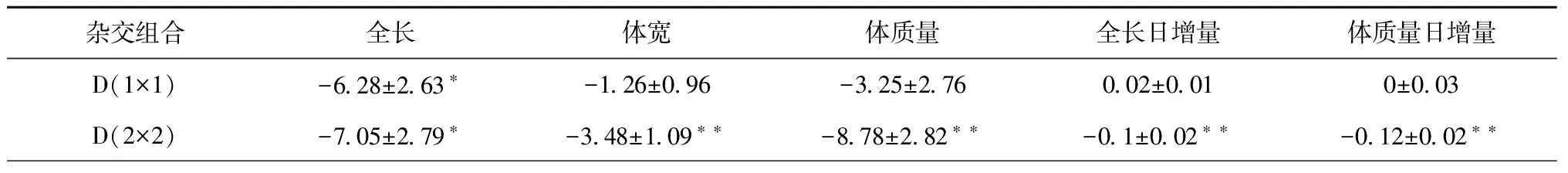
表4 各杂交组合显性随机效应值(M±S.E.)
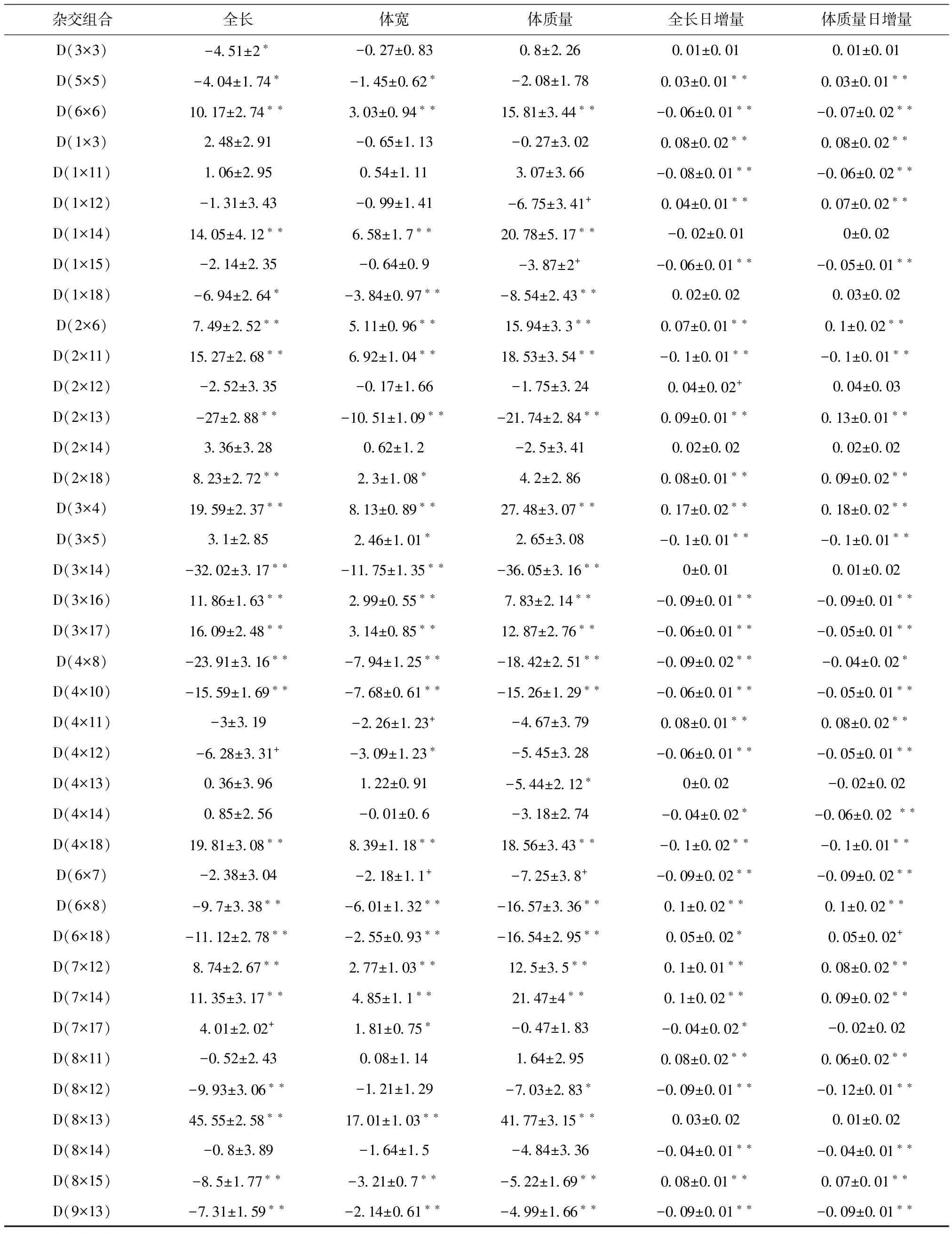
续表4
注:D表示显性效应;1~18为亲本序号,与表3中亲本序号及亲本相同;** 表示差异极显著(p<0.01);*表示差异显著(p<0.05);+表示差异水平为p<0.10。
4 讨论
牙鲆在我国的养殖面积相当广泛,从渤海湾北部到福建南部沿海地区都有牙鲆的养殖[18]。养殖方式有工厂化、池塘和网箱养殖。近年来人们不断总结养殖经验,结合南北方海水温度差异和互补优势,逐渐发展了一种“池塘-网箱南北接力”养殖模式,当年可将牙鲆养殖到400~500 g,极大的提高了商品鱼的养成速度和养殖效益,同时为牙鲆产业化探索了新的途径。随着牙鲆养殖产业化的进一步发展,对生长快、抗病力强、温度适应性广、抗逆力强牙鲆新品种的需求日益迫切。在牙鲆选择育种方面,目前虽然已经培育出1个具有生长优势杂交新品种,但需要对繁殖群体进行不断的保持和延续,对优良性状进行不断的提纯和复壮。另外在国内牙鲆养殖新品种的覆盖率还相当低,为了解决养殖生产中出现的各种问题,还需要针对抗病、耐高温、抗逆力等方面培育出更多的养殖新品种,来不断满足生产发展的需求。
选择育种是目前牙鲆育种中最主要的育种手段,通过群体选育初步建立了牙鲆黄海野生群体、日本群体、韩国群体和抗鳗弧菌群体4个基础育种群体[12—13],从2007-2009年利用这些基础群体,通过家系建立和选育方式建立了牙鲆F1、F2代家系,并从中筛选出生长快、成活率高的家系[13]。2012年利用F1、F2代优良家系和韩国牙鲆群体构建了F3代家系。本研究拟通过F3代家系的选育,为牙鲆新品种的培育准备具有丰富遗传性状的育种材料。
数量性状选择是选择育种的方法之一,数量性状通常受许多微效基因控制,同时受到环境因素的影响[17]。Fisher最早提出了数量性状遗传的“加性—显性”遗传模型,为数量遗传模型的建立奠定了基础[19]。1953年Henderson提出了3种适用于非均衡资料的Henderson方法,1971年Patterson和Thompson正式提出约束极大似然法(Restricted Maximum Likelihood,REML)用于遗传方差组分估计,国内外的大量研究证明,REML方法是目前动物育种中遗传参数估计比较理想的方法[20]。利用动物遗传模型已经对银大麻哈鱼(Oncorhynchuskisutch)[21]、虹鳟(Oncorhynchusmykiss)[22]、尼罗罗非鱼(Oreochromisnilogicus)[23]等鱼类的体长和体质量遗传参数进行了估计。
估计边际均值是指剔除其他变量影响时算出的均值,能够更加客观地评估各家系的生长情况[24],本文利用生长日龄为协变量对家系生长体长、体宽、体质量和日增质量几个性状的边际平均值进行估计,结果直观的反映了家系的生长情况。利用前3个性状进行生长快家系的筛选,具有一定的趋同性,说明全长、体宽、体质量3个性状的相关性比较好。而根据体质量日增量筛选出的优良家系与其他3个性状的优良家系具有一定差别,主要是由于不同家系建立日期不同造成。综合比较以上性状的筛选结果,1202、1206、1226和1211等家系具有生长快特点。
牙鲆家系的表型性状不仅受到遗传因素的影响,同时受到环境因素的影响,其遗传因素主要由基因的加性效应和显性效应来决定,在“加性-显性”线性模型中以加性方差和显性方差来表现。本文中全长、体宽、体质量、全长日增量和体质量日增量5个生长性状的显性方差分量均大于加性分量,说明牙鲆家系在195日龄时以上5个性状的遗传效应主要取决于基因的显性效应。但是利用230日龄F1代牙鲆家系生长数据估计全长和体质量的加性效应高于显性效应[9],是否可以推测在195日龄时有利于显性效应的选择,而在230日龄时有利于加性效应的选择。另外这一时期环境影响造成的随机效应值相对较高,说明环境因素对以上性状有明显影响。主要是由于牙鲆家系早期培育要受到家系建立时间、环境温度、摄食饵料强度、不同培育水缸和操作人员的技术差异等因素的影响,随着家系生长及标准化培育,这种影响会逐渐降低。
在鱼类选择良种中,育种值的估计是选种和配种方案制定的重要指标,育种值可以利用选择指数、最佳线性无偏预测BLUP法和标记辅助BLUP等方法进行估计[25],育种值是指亲本的种用价值,在数量遗传学中把决定数量性状的基因加性效应值定义为育种值。利用育种值选择和表型选择方法分别对大菱鲆家系进行了选育评估,发现育种值的选择效率高于表型值选择的效率[26]。利用单性状重复观测值及动物模型对虹鳟体质量、体长、肥满度的个体育种值和综合育种值进行了估计[27]。本文利用“加性-显性”模型估计了牙鲆全长等5个性状的综合育种值在0.099~0.24。而230日龄F1代牙鲆家系体长和体重育种值分别为0.20和0.26[9],两次评估所得到的体长和体质量的育种值相近。
遗传力是衡量遗传进展的主要标志,狭义遗传力为加性效应方差占表型方差的比率,广义遗传力为加性方差和显性方差之和在表型方差中所占比率[17]。一般认为具有0.2以上遗传力的性状就有选择效果。鲤鱼(Cyprinuscarpio)早期个体体长和体质量的遗传力在0.11~0.16范围内[28];大黄鱼(Larimichthyscrocea)40日龄时的体长和体质量遗传力分别为0.31和0.29[29];罗非鱼(Oreochromisniloticus)在不同环境和不同世代的遗传力估计结果具有较大差异(0.00~0.52)[30],在同一养殖条件下同一世代鱼类的收获体重遗传力为0.06~0.68[31]。田永胜等以3个牙鲆育种群体为研究对象,估计了体长和体质量的狭义遗传率分别为0. 199 和0. 256,广义遗传率分别为0. 312 和0. 336[9];Tian等通过完全双列杂交方式估计了生长早期牙鲆生长性状的遗传力,体长遗传力0.22~0.40、体质量遗传力0.29~0.48[8];Liu等估计牙鲆不同时期生长性状的遗传力结果为0.13~0.39[32]。本文中牙鲆5个生长性状的狭义和广义遗传力分别在0.099~0.24和0.39~0.52,其中,只有全长的遗传力达到了中等遗传力水平(0.24±0.02)(h2>0.2),其它性状的遗传力较低。环境效应造成的随机效应方差达到了0.48~0.61,平均0.53,同时广义遗传力明显大于狭义遗传力,这一现象说明利用当前的牙鲆核心群体进行杂交育种,有望获得较好的效果。另外反映出养殖环境对全长、体宽、体质量、全长日增量和体重日增量的影响较大。这主要由于家系的建立延时较长,繁殖前期和后期建立的家系在生长、环境适应、饵料应用等方面都有较大差异。此外1龄以内的鱼苗在遗传上受母体效应影响较大,从而体现为环境效应大于基因加性、显性效应,给遗传选择方面造成一定的困难。因此对鱼类家系性状的选择应当达到1~2龄较为适宜。
本次研究结果与已报道的关于牙鲆生长性状遗传力的估计结果相比,各性状的遗传力相对较小,主要原因可能是研究群体存在差异,目前家系已经为F3代家系,在F1、F2代家系的建立与筛选过程中,不同群体之间的遗传基因不断的杂合、家系所包含的遗传多样性越来越丰富,这方面的原因也会导致遗传力变小。
生物性状的加性效应通过遗传选择可以遗传给后代。Pante等利用加性、加性-显性、加性-显性-上位动物模型对虹鳟3个核心群体体质量近交效应进行了分析[33]。之后又利用A、A+F、A+CE、A+CE+F、A+D+F、A+D+CE+F线型模型对3个虹鳟群体近交后代的体质量加性效应、显性效应和环境效应等进行了分析,加性效应随着近交效应、环境效应的增加有所降低。显性方差比率在0%~22%,环境方差比率在0%~6%,有较大的变化[34]。王成辉等利用加性-显性-上位性遗传模型,对兴国红鲤(Cyprinuscarpiovar.singuonensis) 、荷包红鲤(C.carpiovar.wuyuanensis) 和瓯江彩鲤(C.carpiovar.color) 双列杂交子二代的体质量10个形态性状的加性和上位性遗传效应进行了分析,结果显示瓯江彩鲤的加性和上位性效应能显著增加后代的体质量、全长和体长,而兴国红鲤和荷包红鲤的加性和上位性效应能显著降低后代的体质量、全长和体长[35]。本文利用加性-显性模型对19个亲本群体的全长、体宽、体质量、体长日增量和体质量日增量5个性状的加性效应进行了分析,结果显示F0917、F0908、F0905、F0915、F09125和KS六个亲本群体在5个性状上都具有极显著的正向效应,说明以上亲本在育种中能够促进牙鲆以上性状的生长。
利用加性-显性模型对41个杂交组合的显性随机效应进行预测,结果显示,D(2×6)、D(2×18)、D(3×4)、D(7×12)、D(7×14)、D(8×13) 6个杂交组合的显性效应在5个性状中均表现为极显著正效应,说明利用以上杂交组合进行家系的建立和优良品系的选育可以促进牙鲆体长、体质量的生长。杂交组合中2号亲本为F0751、3为KS、4为F0750、6为F0915、7为F0917、8为F0768、12为F09121、13为F0905、14为F09104、18为F09125,其中5个亲本具有显著的正向加性效应。F0750和F0751为F1代家系中筛选出的具有生长快、成活率高的优良家系。F0768为具有抗鳗弧菌病能力的F1代家系。F0905、F0915、F0917、F09121、F09125五个亲本为F2代家系中筛选出的具有生长快抗病力强的优良家系。KS为从韩国引进的优良牙鲆群体。可见以上筛选出的杂交组合具有优良的亲本来源,因此,在以后的育种中可以充分利用这6个杂交组合来进行杂交育种和新品种选育。
综上所述,利用牙鲆选育F3代家系生长数据和“加性-显性”线型模型对牙鲆选择育种结果进行分析和预测,可为牙鲆选择育种操作提供可信的育种依据,通过以上遗传效应分析,筛选出了F1202、F1206、F1226和F1211生长快的家系,F0917、F0908、F0905、F0915、F09125和KS优良亲本,以及D(2×6)、D(2×18)、D(3×4)、D(7×12)、D(7×14)、D(8×13) 6个杂交组合,为牙鲆新品种的选育提供明确的技术路线。
[1] 杨正勇,王春晓. 全球视野下中国鲆鲽类养殖业的发展[J]. 中国渔业经济,2009,6(27):115-122.
Yang Zhengyong,Wang Chunxiao. On the development of flatfish aquaculture industry of China:a global perspective[J]. Chinese Fisheries Economics,2009,6(27):115-122.
[2] 田永胜,陈松林,徐田军,等. 牙鲆不同家系生长性能比较及优良亲本选择[J]. 水产学报,2009,33(6):901-912.
Tian Yongsheng,Chen Songlin,Xu Tianjun,et al. The comparison of growth performances of Japanese flounder (Paralichthysolivaceus) families and selection of parents with good trait[J].Journal of Fisheries of China,2009,33(6):901-912.
[3] Liu Y G,Chen S L,Li B F. Genetic differentiation among common and selected hatchery populations of flounder: Evidence from RAPD markers[J]. Biochemical Systematics and Ecology,2007,35: 689-695.
[4] 刘海金,朱晓琛,孙效文,等. 牙鲆5个养殖群体的遗传多样性分析[J]. 中国水产科学,2008,15(1):30-37.
Liu Haijin,Zhu Xiaoshen,Sun Xiaowen,et al. Analysis of genetic structure among 5 cultured stocks of Japanese flounderParalichthysolivaceus[J]. Journal of Fishery Sciences of China,2008,15(1):30-37.
[5] Zhang Y X,Chen S L,Liu Y G,et al. Major Histocompatibility Complex Class IIB Allele Polymorphism and Its Association with Resistance/Susceptibility to Vibrio anguillarum in Japanese Flounder (Paralichthysolivaceus) [J]. Marine Biotechnology,2006,8:600-610.
[6] Xu T J,Chen S L. Genomic structure of DAA gene and polymorphism within MHC-DAA alleles in Japanese flounder (Paralichthysolivaceus) [J]. Yi Chuan,2009,31: 1020-1028.
[7] Song W,Pang R,Niu Y,et al. Construction of high-hensity genetic linkage maps and mapping of growth-related quantitative trail loci in the Japanese flounder (Paralichthysolivaceus) [J]. PLoS One,2012,7(11): e50404.
[8] Tian Y S,Xu T J,Liang Y,et al. Estimates of genetic and phenotypic parameters for weight and length inParalichthysolivaceus(Temminck et Schlegel) [J]. Acta Oceanology Sinica,2011,30(6):58-64.
[9] 田永胜,徐田军,陈松林,等.三个牙鲆育种群体亲本效应及遗传参数估计[J].海洋学报,2009,31(6):119-128.
Tian Yongshen,Xu Tianjun,Chen Songlin,et al.Parent effects and estimation of genetic parameters for three Japanese flounder breeding populations[J]. Haiyang Xuebao,2009,31(6):119-128.
[10] Zhu X P,You F,Zhang P J,et al. Effects of cold shock on microtubule organization and cell cycle in gynogenetically activated eggs of olive flounder (Paralichthysolivaceus) [J]. Mar Biotechnol (NY),2006,8: 312-318.
[11] 刘海金,陆桂,王晓梅,等. 有丝分裂雌核发育牙鲆的微卫星鉴定[J].中国水产科学,2010,17(5):889-894.
Liu Haijin,Lu Gui,Wang Xiaomei,et al. Identification of mitogynogenetic Japanese flounder (Paralichthysolivaceus) using microsatellite marker[J]. Journal of Fishery Sciences of China,2010,17(5):889-894.
[12] 陈松林,田永胜,徐田军,等.牙鲆抗病群体和家系的建立及其生长和抗病性能初步测定[J]. 水产学报,2008,32(5):665-674.
Chen Songlin,Tian Yongsheng,Xu Tianjun,et al. Development and characterization for growth rate and disease resistance of disease-resistance population and family in Japanese flounder (Paralichthysolivaceus) [J].Journal of Fisheries of China,2008,32(5): 665-674.
[13] 田永胜,陈松林,徐田军,等. 牙鲆不同家系生长性能比较及优良亲本选择[J]. 水产学报,2009,33(6):901-912.
Tian Yongshen,Chen Songlin,Xu Tianjun,et al. The comparison of growth performances of Japanese flounder (Paralichthysolivacus) families and selecion of parents with good trait[J]. Journal of Fisheries of China,2009,33(6):901-912.
[14] 全国水产技术推广总站. 2010水产新品种推广指南[M]. 北京:中国农业出版社,2011:242-268.
National Fisheries Extension Center. 2010 Promotion of new varieties of aquatic guide[M]. Beijing: Agriculture Press of China,2011:242-268.
[15] Sakamoto T,Okamoto N. Marker-assisted breeding of a lymphocystis disease-resistant Japanese flounder (Paralichthysolivaceus) [J]. Aquaculture ,2007,272:291-295.
[16] 朱军.遗传模型分析方法[M].北京:中国农业出版社,1997:58-87.
Zhu Jun. Analysis method of genetic model[M].Beijing:Agriculture Press of China,1997:58-87.
[17] 盛志廉. 数量遗传学[M]. 北京: 科学出版社,1999.
Sheng Zhilian. Quantitative genetics[M]. Beijing: Science Press,1999.
[18] 田永胜,陈松林,严安生,等.牙鲆的胚胎发育[J].水产学报,2004,28(6):609-616.
Tian Yongsheng,Chen Songlin,Yan Ansheng,et al. Study on the embryonic development ofParalichthysolivaceus[J]. Journal of Fisheries of China,2004,28(6):609-616.
[19] 翟虎渠,王建康.应用数量遗传[M].北京:中国农业科学技术出版社,2007:1-250.
Zhai Huqu,Wang Jiankang. Application of quantitative genetics[M]. Beijing: Agricultural Science and Technology Press of China,2007:1-250.
[20] 杨泽明,熊远著,喻传洲.影响猪遗传评估效果的主要因素研究[J].华中农业大学学报,2001,20(6):598-602.
Yang Zeming,Xiong Yuanzhu,Yu Chuanzhou. The development of pig genetic evaluation[J]. Journal of Huazhong Agricultural University,2001,20(6):598-602.
[21] Neira R,Diaz N F,Gall G A E,et al. Genetic improvement in coho salmon (Oncorhynchuskisutch): Ⅰ. Selection response and inbreeding depression on harvest weight[J]. Aquaculture,2006,257: 9-17.
[22] Su G S,Liljedahl L E,Gall G A E. Genetic correlations between body weight at different ages and with reproductive traits in rainbow trout[J]. Aquaculture,2002,213: 85-94.
[23] Eknath A E,Bentsen H B,Ponzoni R W,et al. Genetic improvement of farmed tilapias: Composition and genetic parameters of a synthetic base population ofOreochromisniloticusfor selective breeding[J]. Aquaculture,2007,273: 1-14.
[24] 蔡一林,岳永生.水产生物统计[M]. 北京:中国农业出版社,2004.
Cai Yilin,Yue Yongshen. Aquatic biostatistics[M]. Beijing: Agriculture Press of China ,2004.
[25] 栾生,孔杰,王清印.水产动物育种值估计方法及其应用的研究进展[J].海洋水产研究. 2008,29(3):101-108.
Luan Sheng,Kongjie,Wang Qingyin. Methods and application of aquatic animal breeding value estimation: A review[J]. Marine Fisheries Research,2008,29(3):101-108.
[26] 马爱军,王新安,雷霁霖.大菱鲆(Scophthalmusmaximus)不同生长阶段体重的遗传参数和育种值估计[J]. 海洋与湖泊,2009,40(2):187-194.
Ma Aijun,Wang Xin’an,Lei Jilin.Genetic parameterization for turbotScophthalmusmaximus: implication to breeding strategy[J].Oceanologia et Limnologia Sinica,2009,40(2):187-194.
[27] 王炳谦,刘宗岳,高会江,等.应用重复力模型估计虹鳟生长性状的遗传力和育种值[J]. 水产学报,2009,33(2):182-188.
Wang Bingqian,Liu Zongyue,Gao Huijiang,et al. Estimation of genetic parameters for growth traits in rainbow trout (Oncorhynchusmykiss) with differentmodels[J]. Journal of Fisheries China,2009,33(2):182-188.
[28] Nielsen H M,Odegard J,Olesen I,et al. Genetic analysis of common carp (Cyprinuscarpio) strains:Ⅰ. Genetic parameters and heterosis for growth traits and survival[J]. Aquaculture,2010,304:14-21.
[29] 王晓清,王志勇,何湘蓉. 大黄鱼40 日龄体长和体重遗传力估计[J]. 集美大学学报,2010,15(1):7-10.
Wang Xiaoqing,Wang Zhiyong,He Xiangrong. Heritability estimate of 40-day-old body length and weight ofPseudosciaenacrocea[J].Journal of Jimei University(Natural Science),2010,15(1):7-10.
[30] Thodesen J,Rye M,Wang Y X,et al. Genetic improvement of tilapias in China: Genetic parameters and selection responses in growth of Nile tilapia (Oreochromisniloticus) after six generations of multi-trait selection for growth and fillet yield[J]. Aquaculture,2011,(322/323):51-64.
[31] Bentsen H B,Gjerde B,Nguyen N H,et al. Genetic improvement of farmed tilapias: Genetic parameters for body weight at harvest in Nile tilapia (Oreochromisniloticus) during five generations of testing in multiple environments[J]. Aquaculture,2012,(338/341): 56-65.
[32] Liu Y X,Wang G X,Wang Y F,et al. Estimation of genetic parameters for growth traits of Japanese flounderParalichthysolivaceususing an animal model[J]. Fisheries Science, 2011,77: 87-93.
[33] Pante M J R,Gjerde B,McMillan I. Effect of inbreeding on body weight at harvest in rainbow trout,Oncorhynchusmykiss[J]. Aquaculture,2001,192:201-211.
[34] Pante M J R,Gjerde B,McMillan I. Ignacy Misztal.Estimation of additive and dominance genetic variances for body weight at harvest in rainbow trout,Oncorhynchusmykiss[J]. Aquaculture,2002,204:383-392.
[35] 王成辉,李思发,刘志国,等.红鲤生长性状的上位性遗传效应分析[J].中国水产科学,2006,13(4):573-579.
Wang Chenghui,Li Sifa,Liu Zhiguo,et al.Genetic analysis of epistatic of growth traits in red common carp[J]. Journal of Fishery Sciences of China,2006,13(4):573-579.
Establishment and estimated genetic effects ofParalichthysolivaceusF3 families
Tian Yongsheng1,Chen Honglin1,2,Qi Wenshan1,2,Jiang Jing1,2,Zhang Yingping1,2,Liu Wanjun1,3,Li Baoyu4,Liu Shoutang4,Sun Deqiang4,Chen Songlin1
(1.KeyLaboratoryforSustainableUtilizationofMarineFisheryResources,MinistryofAgriculture,YellowSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Qingdao266071,China; 2.CollegeofFisheriesandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China3.OceanUniversityofChina,Qingdao266003,China; 4.HuanghaiAquacultureLtd.,Haiyang265100,China)
Paralichthysolivaceusis the major species for marine aquaculture and fisheries on the western Pacific coast. Due to the high disease incidence and slow growth rate observed in artificial-breeding programs,the selective breeding of Japanese flounder has been pursued since the beginning of this century. Here,we established 52 F3 families based on the screened F1 and F2 core families that we bred previously. Approximately 196 days after hatching,we measured five growth traits of 1 560 fry from the 52 families,for a total of 7 800 data points. An “A-D” model and MINQUE were used to estimate the marginal mean,additive-variance component,dominance-variance component,random-variance component,narrow-sense heritability,broad-sense heritability,parental additive effect and random hybridization effect of each trait. The additive-variance component ratios of the five traits were between (0.099±0.01) and (0.24±0.02); the dominance-variance component ratios were between (0.30±0.02) and (0.31±0.02); the random-variance component ratios were between (0.48±0.02) and (0.61±0.01); the narrow-sense heritabilities were between 0.099 and 0.24; and the broad-sense heritabilities were between 0.38 and 0.54. Each of these genetic parameters showed highly significant differences (p<0.01). The random dominance effects of 42 crosses were predicted,and D(2×6),D(2×18),D(3×4),D(7×12),D(7×14) and D(8×13) all showed highly significant positive effects (p<0.01) on the five traits. The results of this study provide a preliminary set of optimal parental lines,crosses and families to establish improved Japanese flounder strains. These results also provide a theoretical and technical foundation for further selective breeding.
japanese flounder;Paralichthysolivaceus; F3 family; heritability; additive effect; dominance effect
10.3969/j.issn.0253-4193.2015.04.004
2014-07-15;
2014-12-17。
“863”高技术研究发展计划(2012AA10A408);国家自然科学基金(31372510);上海海洋大学研究生科研基金(A1-0209-14-0900-37);山东省泰山学者建设工程专项资助。
田永胜(1964—),男,甘肃省会宁县人,研究员,博士,主要从事鱼类低温生物学及遗传育种研究。 E-mail:tianys@ysfri.ac.cn
*通信作者:陈松林,研究员。E-mail:chensl@ysfri.ac.cn
S917.4
A
0253-4193(2015)04-0040-12
田永胜,陈红林,齐文山,等. 牙鲆选育F3代家系的建立及遗传效应分析[J].海洋学报,2015,37(4):40—51,
Tian Yongsheng,Chen Honglin,Qi Wenshan,et al. Establishment and estimated genetic effects ofParalichthysolivaceusF3 families[J]. Haiyang Xuebao,2015,37(4):40—51,doi:10.3969/j.issn.0253-4193.2015.04.004

