春季水华对南黄海总溶解态无机砷生物地球化学行为的影响
孙友旭,任景玲*,刘素美,刘诚刚
(1. 中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100; 2. 国家海洋局 第二海洋研究所,浙江 杭州 310012)
春季水华对南黄海总溶解态无机砷生物地球化学行为的影响
孙友旭1,任景玲1*,刘素美1,刘诚刚2
(1. 中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100; 2. 国家海洋局 第二海洋研究所,浙江 杭州 310012)
利用氢化物发生-原子荧光光谱法(HG-AFS)对2007年3月30日至4月23日南黄海海域总溶解态无机砷(TDIAs,[TDIAs]=[As5+]+[As3+])的含量进行了测定,其中针对水华中心区域(BM1站)进行了25 h的连续观测,以探讨春季水华对有毒类金属元素砷的生物地球化学行为的影响。结果表明,TDIAs的浓度范围为7.9 ~ 22.3 nmol/L,平均值为(17.8±1.9) nmol/L。TDIAs在南黄海的分布主要表现为由近岸向外海逐渐升高的趋势,最大值出现在南部海域底层海水中。近岸海域表、底层TDIAs的含量相当,而中、南部海域由于存在明显的密度跃层,表、底层TDIAs的浓度具有显著性差异。2007年3月31日至4月1日研究区域西南部受到沙尘天气和降雨的影响,表层海水中TDIAs的含量显著升高。研究区域中、南部海域在观测期间暴发了典型的黄海春季水华,通过大面观测和对重点区域的连续观测可以发现,水华期间TDIAs的分布和磷酸盐类似,与Chla呈现出较好的负相关关系(r=0.51,p<0.05,n=39)。经初步计算,浮游植物水华对10 m以上表层水体中TDIAs的清除量约为2.4 nmol/L,占表层保有量的15%左右。通过箱式模型计算得出黄海TDIAs的停留时间约为(15.6±7.3) a,远远低于大洋。通过对该海域砷、磷摩尔比值的计算可以发现,南黄海砷、磷摩尔比值为大洋中的20倍左右,这可能会引起浮游生物对砷酸盐的大量吸收和转化,从而带来潜在的生态危机,需要引起足够的重视。
总溶解态无机砷;分布;春季水华;南黄海
1 引言
砷是自然界中普遍存在的有毒类金属元素,广泛分布于岩石、土壤、空气、水环境以及生物体中[1]。天然水体中总溶解态无机砷(TDIAs,[TDIAs]=[As5+]+[As3+])通常以+5和+3两种价态存在[2—3]。由于热力学稳定性的差异,+5价的砷在水体中占有绝对优势。但是水体pH值、氧化还原电位以及生物活动等因素都会影响到总溶解态无机砷的赋存形态[4—5]。例如在生物活动较为密集的表层水体,由于砷酸盐与磷酸盐具有相似的化学结构,当磷酸盐匮乏时(c<0.05 μmol/L),浮游生物会吸收砷酸盐释放亚砷酸盐或者有机砷,从而降低砷酸盐在总溶解态无机砷中的比例[6—8]。不同形态的砷其毒性也不尽相同,一般认为,亚砷酸盐的毒性较大,砷酸盐的毒性次之,有机砷的毒性较小[9-10]。由于高浓度的砷具有致癌作用,它能够沿食物链传递,最终危害人类的健康[11],因而近些年来受到了国内外学者的广泛关注。
近岸海水中的砷主要受到河流、地下水的输入,大气的干、湿沉降,悬浮颗粒物的吸附解吸,海底沉积物的释放以及生物活动等因素的影响[12—15],其中沙尘的干、湿沉降对于表层水体中TDIAs的贡献不容忽视[16]。在东大西洋的研究[17]中曾发现,靠近撒哈拉沙漠近岸海域表层水体中TDIAs的含量明显高于其他海域,个别站位的垂直分布甚至与砷在大洋中的垂直分布规律(营养盐型)有明显不同,这表明TDIAs在表层水体富集的现象与大气沙尘输入密切相关。砷在不同海域其保守性差别也较大。例如在污染较轻的Kakr河口和万泉河河口,砷的行为通常是保守的[18—19];而在一些受工业污染较严重的河口(如斯凯尔特河口),砷则表现出明显的非保守性[20]。砷在大洋中不易被清除,因而具有较长的停留时间,约为105年[21]。
黄海是太平洋西部的一个边缘海,位于中国大陆和朝鲜半岛之间,面积约3.8×105km2,平均水深约为44 m。习惯上以胶东半岛成山角到朝鲜的长山串之间的连线将黄海分为北黄海和南黄海两部分,其中南黄海面积约占80%[22]。中国大陆和朝鲜半岛有多条河流(长江、汉河、大同江等)注入南黄海,其携带的陆源物质是南黄海陆架重要的物质来源[23]。此外,冬、春季节频繁的沙尘天气也会向黄海表层水体输送大量的陆源物质[24]。南黄海的水文特征受复杂的环流系统的影响,主要包括黄海暖流、黄海沿岸流以及朝鲜沿岸流等,且有明显的季节变化,秋、冬季的影响略高于春、夏季。受强北风和海面冷却作用的影响,南黄海在冬季表、底层水体混合比较均匀,而夏季则有明显的层化现象[25]。南黄海拥有丰富的生物资源和矿产资源,是我国传统的渔场及海产品基地,因此对南黄海总溶解态无机砷的生物地球化学行为的研究具有重要的现实意义。
目前世界上对于总溶解态无机砷在大洋中的生物地球化学行为的研究已经比较成熟,对于砷在大洋中的分布、来源、形态转化规律都有比较系统的认识[26—28]。我国在该领域的研究起步较晚,研究区域主要集中在我国的主要河流、河口、海湾以及陆架边缘海地区,认识上与国外相比还有较大的差距[29—33]。黄海作为我国重要的陆架边缘海,近十年来已有不少专家和学者对黄海的水文特征、生源要素以及痕量元素等进行了系统的研究和初步的探讨[15,34—36]。本文拟在前人研究的基础上,着重探讨春季水华(本文将水体中叶绿素a的浓度高于4 μg/L作为判别春季水华发生与否的依据[33,37—38])对南黄海总溶解态无机砷分布的影响,并以箱式模型初步计算总溶解态无机砷在黄海的收支状况及停留时间,以期为认识砷在南黄海的生物地球化学循环提供丰富的数据基础和科学依据。
2 样品采集与分析
2.1 样品的采集
于2007年3月30日至4月23日乘坐“北斗”号科学考察船对南黄海中部海域(34°~ 37°N,121°~ 124.5°E)进行了调查研究,采样站位图如图1所示。除了大面观测站以外,根据南黄海海域春季水华的暴发和消亡状况,增设了1个25 h的连续观测站(BM1),用于探讨浮游植物水华过程对TDIAs的生物地球化学行为的影响。根据遥感卫星图像显示①http://earthobservatory.nasa.gov/NaturalHazards/view.php?id=18217.,3月31日至4月1日该海域还受到了一场强烈的沙尘暴天气(伴随着农业焚烧产生的烟雾)的影响,在此期间沙尘的沉降通量为(879.8±167.8) mg/(m2·d)[39]。

图1 采样站位Fig.1 Sampling locations in the South Yellow Sea (SYS)
所有样品均用Niskin采水器采集,采水器内壁事先用酒精擦拭并用Milli-Q水清洗。采样所用的采样瓶和样品瓶使用前均用1∶5的盐酸浸泡1周,然后用蒸馏水和Milli-Q水洗净,装入双层塑料袋中备用。本航次中表层样品均采集海面以下1 m水层;为避免发生触底等突发情况,根据现场水文环境将底层样品设定为采集距海底4 m左右的水层。样品采集后立即在一个100等级的洁净工作台上用已处理过的洁净的Nalgene滤器和0.45 μm的醋酸纤维膜(经pH=2的HCl浸泡24 h,再用Milli-Q水洗至中性,烘干称重以后使用)过滤,过滤以后的样品装入洁净的Nalgene样品瓶中,用HCl酸化至pH=2左右保存。现场用Milli-Q水过滤做空白水样。温盐数据通过Sea-Brid 911plusCTD现场测定获得,叶绿素a(Chla)的数据则利用Turner Ⅱ型荧光光度计测定获得。
2.2 分析方法
在实验室中利用氢化物发生-原子荧光光谱法(HG-AFS)对样品中TDIAs的含量进行了测定,即在1 mol/L的HCl介质中,海水样品中的TDIAs先经硫脲-抗坏血酸预还原后,再被NaBH4还原为AsH3进入原子荧光光谱仪进行测定。该方法的检出限为0.10 nmol/L,对20 nmol/L的样品测定的相对标准偏差小于3%,对砷的国家标准溶液(2 μg/L)(国家钢铁材料测试中心)的测定准确度为(2.02±0.06)μg/L,符合近岸海水中TDIAs的测定要求。溶解态无机磷(DIP)采用磷钼蓝法由营养盐自动分析仪测定,方法精密度小于3%[40]。
3 结果与讨论
3.1 南黄海总溶解态无机砷的含量及平面分布
表1给出了南黄海表、底层海水中温度、盐度、悬浮颗粒物(SPM)、叶绿素a(Chla)以及TDIAs的浓度范围和平均含量。由表可知,南黄海春季底层海水中盐度和SPM的含量均高于表层海水,而表底层温度没有明显差异(t检验,p<0.05,n=59)。TDIAs的浓度也是底层略高于表层,除中部海域存在明显层化现象的站位外,南黄海表、底层海水中TDIAs的含量没有显著性差异(t检验,p<0.05,n=46)。2007年春季南黄海海域水体中TDIAs的平均浓度为(17.8±1.9) nmol/L,该结果略低于任景玲等在2001年5月对南黄海海域的观测结果[(18.8±1.4) nmol/L][41]。

表1 2007年4月南黄海海域表、底层温度(℃)、盐度、SPM(mg/L)、Chl a(μg/L)及TDIAs(nmol/L)的浓度范围
注: 括号内为平均值。

图2 南黄海表、底层海水中温度、盐度和TDIAs的分布Fig.2 Horizontal distributions of temperature,salinity and TDIAs in the surface and bottom layer of the SYS

图3 南黄海A断面温度、盐度、SPM及TDIAs的垂直分布Fig.3 Vertical profiles of temperature,salinity,SPM and TDIAs at Section A in the SYS

图4 南黄海G断面温度、盐度、Chl a及TDIAs的垂直分布Fig.4 Vertical profiles of temperature,salinity,Chl a and TDIAs at Section G in the SYS
南黄海表、底层海水中温度、盐度和TDIAs的平面分布如图2所示。南黄海温度和盐度基本上都呈现出从近岸向外海逐渐升高的趋势,其中底层的变化幅度较表层更为显著,最高值均出现在研究区域的西南部。根据上述水文特征可以看出,研究区域南部的底层海水主要受高温、高盐的黄海暖流入侵的影响,而在北部近岸海域及东部海域则主要受到低温、低盐的黄海沿岸流和朝鲜沿岸流的影响。由于南黄海近岸海域水深较浅,垂直混合比较均匀,在航次中未观测到明显的层化现象;而中部海域则与之相反,存在较为明显的密度跃层,在近底层水体存在温度和盐度的高值。
南黄海表、底层海水中TDIAs的分布均呈现出从近岸向外海逐渐升高的趋势。A断面(样品采集于沙尘暴影响期间)表层水体中TDIAs的含量较高,这可能与大气沙尘的输入有关。研究区域东南部表层水体暴发了春季水华[42],与之对应,表层TDIAs的浓度恰好在该海域出现了较为明显的低值,这从侧面反应了浮游植物水华对TDIAs分布的影响。然而该海域底层海水中TDIAs的含量显著高于表层,结合温、盐的分布可以看出这可能与黄海暖流的入侵有关。黑潮水中有较高的砷的背景值[15],黄海暖流作为它的一个分支,其对底层海水中TDIAs的贡献不容忽视。
3.2 南黄海总溶解态无机砷的断面分布
本文分别选取了A断面(A1-A4站)和G断面(G1-C6,不包含E5站,E5站为航次后期采样,未发生水华现象)来探讨沙尘沉降和春季水华过程对南黄海TDIAs的生物地球化学行为的影响,其中A断面样品采集于沙尘暴影响期间,G断面样品采集于春季水华暴发区域。
图3给出了A断面温度、盐度、SPM和TDIAs的垂直分布状况。从图中可以看出,A断面温度和盐度基本呈现出从近岸向外海逐渐升高的趋势。近岸海域受黄海沿岸流的影响,温度和盐度较低且在垂直方向上混合均匀,没有明显的层化现象,表、底层温盐的差别不大。而南黄海中部海域A4站则出现了明显的密度跃层,底层海水受黄海暖流入侵的影响,温度和盐度迅速升高,远远高于表层。受黄海沿岸流的影响,SPM的分布主要表现为离岸方向上的递减趋势,在近岸海域垂直方向上混合均匀,表、底层没有显著的变化。由于受沉积物再悬浮作用的影响,A3和A4站的底层水体也可以观测到SPM的明显高值。TDIAs的分布与温、盐基本类似,也呈现出从近岸向外海逐渐升高的趋势,表层低于底层。但在A3和A4站表层水体中也可以观测到TDIAs的高值出现,这与砷在大洋中的垂直分布特征(营养盐型分布)并不吻合,大气沙尘的输入可能是导致这一异常现象出现的主要原因。同一航次中该断面溶解态铝的垂直分布也呈现出这一特点[24]。近岸表层水体之所以没有观测到同样的高值,可能与水体垂直混合过程以及砷的颗粒活性有关。底层海水由于受沉积物再悬浮作用和黄海暖流入侵的影响,TDIAs的含量显著升高。
G断面位于研究区域东部边缘,图4给出了该断面温度、盐度、Chla以及TDIAs的垂直分布图。由图可知,G断面水体在垂直方向上混合比较均匀,表、底层温度和盐度没有明显的差别。G2和G3站表层水体的盐度较低,这可能与朝鲜沿岸流的影响有关。C6站底层水体可以观测到明显的温、盐高值,黄海暖流的入侵可能是导致出现这一现象的主要因素。近岸海水中Chla的含量较低,普遍低于2 μg/L,但从位于南部海域的F4站开始,表层水体中Chla的含量迅速升高,中心区域的含量甚至高于10 μg/L,属于典型的黄海春季水华。C6站Chla的浓度有所降低,但上层水体的浓度依旧高于4 μg/L。TDIAs的垂直分布与Chla的呈现出较好的负相关性,即随着Chla浓度的升高,水体中TDIAs的含量则不断降低。近岸海域中表层TDIAs浓度大于底层,差值约为1 ~ 2 nmol/L左右;而F4站和C6站则底层大于表层,差值约为2 ~ 3 nmol/L左右,除了垂直方向上的物理混合过程的差异,表层浮游植物水华的清除作用和黄海暖流向南部海域底层水体的输送可能是造成这一现象的主要原因。
3.3 南黄海总溶解态无机砷的周日变化
根据春季水华暴发的情况,选择BM1水华站位进行了25 h的定点连续观测,观测结果如图5所示(第一个采样点时CTD出现故障,因此缺少该点的温盐数据)。由图可知,BM1站位属于规则半日潮,潮差为1.7 m左右。在观测期间,BM1站位出现了明显的层化现象,密度跃层大约位于30 m,其下的底层海水的温度和盐度均显著高于表层,且相对比较稳定,随时间的变化很小。表层水体中Chla的含量在观测初期即达到最大值,最高浓度约为10 μg/L,然后随时间的推移不断降低,至第二天早上9点前后,表层水体中浮游植物水华基本消失。底层水体中Chla的含量则在观测开始后6 h左右达到最大值,此时底层浓度为表层的2倍左右,然后随时间的变化而逐渐降低。这种特殊的周日变化表明该处的春季水华在观测开始后处于衰退期,水体中的浮游植物随时间的推移由表层向底层不断沉降,最后在底层消亡。水体中TDIAs的周日变化较小,底层浓度高于表层,最小值出现在观测开始阶段的表层水体。此外,与Chla高值相对应,21点前后底层海水中TDIAs的含量也出现了较为明显的低值,之后随着时间的推移,底层海水中TDIAs的含量显著升高。这一现象的发生可能与底层浮游植物的降解释放有关。

图5 BM1连续站的潮汐变化(a、b)及温度(℃)(c)、Chl a(μg/L)(d)、盐度(e)和TDIAs(nmol/L)(f)的周日变化Fig.5 Diel variations of temperature(℃)(c),Chl a(μg/L)(d),salinity(e) and TDIAs(nmol/L)(f) at Station BM1,in which changes in tidal elevation
3.4 影响南黄海总溶解态无机砷分布的主要因素
3.4.1 浮游植物水华对总溶解态无机砷分布的影响
图6给出了南黄海海域表层水体中TDIAs与Chla的相关关系图。从图中可以看出,TDIAs与Chla呈现出较好的负相关关系(r=0.51,P<0.05,n=39),说明春季水华对南黄海海域表层水体中TDIAs的影响不容忽视(图中圆圈内站位处于水华衰退时期,此时表层水体中Chla的浓度有所降低,而TDIAs尚未得到有效补充,因此Chla和TDIAs的浓度都处于较低状态)。由于缺乏亚砷酸盐或者有机砷的相关数据,本文无法讨论春季水华对南黄海砷形态转化的影响。
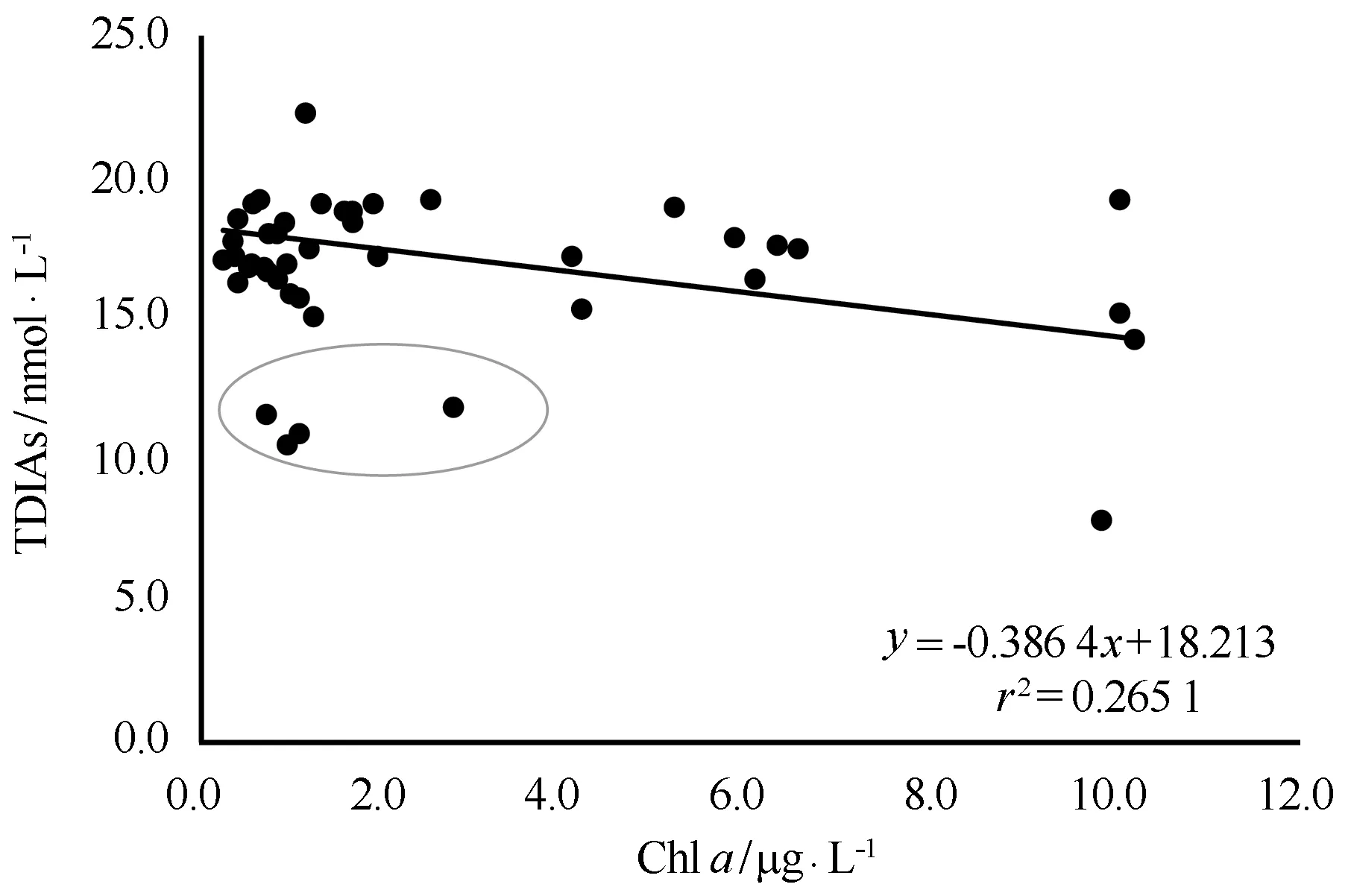
图6 南黄海海域表层水体中TDIAs(nmol/L)与Chl a(μg/L)的相关关系Fig.6 Relationships between TDIAs(nmol/L) and Chl a(μg/L) in surface waters in the SYS
为了进一步探讨春季水华过程对水体中TDIAs分布所产生的影响,我们选取了位于南黄海中部海域的3个站位[未发生水华站位(E4),水华暴发站位(B6)和水华衰退站位(BM1)],对其温度、盐度、Chla、溶解态无机磷(DIP)和TDIAs的垂直分布状况进行了讨论,结果如图7所示。从温、盐的垂直分布可以看出,3个站位的水体在观测期间均出现了明显的层化现象,表层的温、盐低于底层(E4站温度除外),密度跃层大概出现在30 m左右。在E4站,水体中Chla的含量普遍较低,浓度基本上都低于1 μg/L,最大值出现在底层附近;而B6站,表层水体Chla的含量迅速升高,最大值甚至高达10 μg/L,随深度的增加而逐渐降低;在BM1站,表层水体中Chla的浓度有所降低,同时可以观测到底层海水中存在Chla的高值,这种叶绿素高值深度下移的现象表明水华衰退过程中浮游植物群落表现为大量沉降的特征,航次中对底层进行分层拖网采集到的最高浮游植物生物量样品也可以从侧面证明这一点。E4站表层水体中DIP和TDIAs的含量较高,随深度的增加有所降低,DIP在底层海水中的含量很低,而TDIAs的浓度则有所回升,黄海暖流(低DIP,高TDIAs)的入侵可能是导致底层海水出现这一分布特征的主要原因。B6站DIP和TDIAs的垂直分布与Chla具有较好的负相关关系,即表层水体中DIP和TDIAs的含量随叶绿素的升高而迅速降低,然后随深度的增加而逐渐升高,表现为显著的营养盐型垂直分布特征。而在BM1站表层水体中DIP和TDIAs的含量依旧维持在较低的水平,底层水体中二者的浓度有所升高,这可能与表层水体中DIP和TDIAs尚未得到有效补充而沉降到底层的浮游生物发生降解从而释放DIP和TDIAs有关。以BM1水华站的连续观测结果作为水华发生过程中TDIAs的实测浓度,以相隔半月之后的后续观测结果作为背景值进行初步计算,可以得到春季水华对10 m以上表层海水中TDIAs的清除量约为2.4 nmol/L,约占表层海水中TDIAs浓度的15%左右。
3.4.2 黄海总溶解态无机砷的停留时间
大气的干、湿沉降是表层海水中TDIAs的主要来源之一。通常情况下大气中砷的干沉降通量可以通过下式进行估算:
(1)
式中,Jatm,TDIAs代表大气中砷的干沉降通量[mmol/(m2·d)],D代表大气气溶胶的沉降通量[mg/(m2·d)],AAs代表地壳中砷的丰度,SAs代表气溶胶颗粒物中砷的溶出率,MAs是砷的相对原子质量(g/mol)。沙尘暴影响期间沙尘的沉降通量为(879.8±167.8) mg/(m2·d)[39],地壳中砷的丰度约为0.000 5%[43],砷的溶出率则采用位于黄海近岸的胶州湾的实验结果(3.7%)[44]。假设全年黄海海域有10 d左右的沙尘天气,则可以计算出大气干沉降对黄海TDIAs的年贡献量约为(1.8±1.2)× 104mol/a。大气湿沉降通量通常利用雨水中元素的浓度和降雨量的乘积求得[45]。黄海的年降雨量为1 030~1 670 mm,平均值为1 150 mm[22]。由于缺乏湿沉降数据,所以采用2004年4月濒临黄海的青岛市雨水中TDIAs的含量(18.5 nmol/L)[44]与桑沟湾雨水中TDIAs含量(10.9 nmol/L,实验室未发表数据)的平均值进行估算,从而可以计算出大气湿沉降对黄海TDIAs的年贡献量约为(6.4±2.6)× 106mol/a。
输入黄海的河流有30条左右,其中主要包括长江、淮河、汉河、鸭绿江等[24,35],其入海径流量及TDIAs的含量如表2所示。此外,表中还列出了黄海与渤海和东海的交换情况。由于缺乏淮河、汉河中TDIAs的观测结果,本文假设这些河流中TDIAs 的浓度与DIP浓度的比值与长江类似,从而通过DIP的浓度换算求得TDIAs的浓度。河流以及渤海和东海的输入通量可以通过下式进行估算:
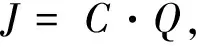
(2)
式中,J代表各个端元输入TDIAs的通量(mol/a),C代表TDIAs在各个端元的浓度(nmol/L),Q代表各个端元输入的水量(m3/a)。通过计算可以得出各个端元向黄海中的输入通量,结果列于表2。因此,根据以上数据和大气干、湿沉降的结果并忽略沉积物-水界面的影响可以初步估算出黄海TDIAs的停留时间约为(15.6±7.3) a。该结果远远低于砷在大洋中的停留时间[21]。较强的生物活动影响可能是导致黄海海域TDIAs的停留时间远低于大洋的主要原因。

表2 河流及相邻海域向黄海输入TDIAs的通量
注:a) 长江每年约有14.1%的水量进入黄海[35];
b) 假设该河流TDIAs与DIP的比值与长江类似,通过DIP的浓度换算求得;
c) 东海向黄海的输入仅仅发生在每年的6月至10月间。
3.5 南黄海总溶解态无机砷的污染状况及与世界其他海域的对比
世界上其他主要海域TDIAs的含量如表3所示。通过对比可以看出,南黄海海域TDIAs的含量明显低于受人为活动影响较为显著的海湾和河口,例如切萨皮克湾、渤海湾、斯凯尔特河口等,与东海和澳大利亚沿岸的浓度相当,略高于大洋中的浓度。通过对2007年4月南黄海海域砷、磷摩尔比进行计算可以发现,该海域As/P的值约为(0.05±0.01),这一结果为大洋中As/P的20倍左右[27]。由于该海域砷酸盐的含量基本处于正常水平,受浮游植物水华的影响,水体中磷酸盐相对匮乏(N∶P也大于Redfield比值)可能是导致As/P升高的主要原因。而As/P的值过高可能会导致生物体在生长过程中吸收大量的砷酸盐,从而带来潜在的生态危机,需要加以重视。

表3 与世界上其他主要海域TDIAs含量的对比
4 主要结论
(1)2007年4月南黄海海域TDIAs的平均浓度为(17.8±1.9) nmol/L,基本呈现出由近岸向外海逐渐升高的趋势。
(2)受沙尘天气和降雨的影响,研究区域西南部(A断面)表层水体中TDIAs的含量显著升高。东南部海域(G断面F4站附近)暴发了典型的黄海春季水华,受浮游生物清除作用的影响,表层水体中TDIAs的含量显著降低。
(3)黄海TDIAs的停留时间约为(15.6±7.3) a,远远低于大洋。较强的生物活动影响可能是导致该现象的主要原因。
(4)南黄海海域TDIAs的浓度低于受人为活动影响较为显著的海湾和河口,与东海等陆架边缘海的含量相当,略高于大洋中的含量。
致谢:感谢天津大学魏皓教授提供的水文数据。在野外和实验室工作当中得到了中国海洋大学海洋生物地球化学实验室的老师和同学们以及“北斗”号科学考察船全体工作人员的帮助和支持,在此表示感谢!
[1] 胡立刚,蔡勇. 砷的生物地球化学[J]. 化学进展,2009,21(2): 458-466.
Hu Ligang,Cai Yong. Biogeochemistry of Arsenic[J]. Progress in Chemistry,2009,21(2): 458-466.
[2] Millward G E,Ebdon L,Walton A P. Seasonality in estuarine sources of methylated arsenic[J]. Applied Organometallic Chemistry,1993,7(7): 499-511.
[3] Ellwood M J,Maher W A. Arsenic and antimony species in surface transects and depth profiles across a frontal zone: the Chatham Rise,New Zealand[J]. Deep-Sea Research Part Ⅰ: Oceanographic Research Papers,2002,49(11): 1971-1981.
[4] Cutter G A. Dissolved arsenic and antimony in the Black Sea[J]. Deep-Sea Research Part A. Oceanographic Research Papers,1991,38: S825-S843.
[5] Cutter G A,Cutter L S. Biogeochemistry of arsenic and antimony in the North Pacific Ocean[J]. Geochemistry,Geophysics,Geosystems,2006,7(5),doi:10.1029/2005GC001159.
[6] Cullen W R,Reimer K J. Arsenic speciation in the environment[J]. Chemical Reviews,1989,89(4): 713-764.
[7] Sanders J G,Riedel G F,Osman R W. Arsenic cycling and its impact in estuarine and coastal marine ecosystems[J]. Arsenic in the Environment,Part Ⅰ: Cycling and Characterization,1994: 289-308.
[8] Hellweger F L,Farley K J,Lall U. Arsenic transformation by algae: the role of phosphorus luxury uptake[J]. American Chemical Society,2003,226: 581-582.
[9] 刘演兵,韩恒斌. 砷形态分析方法研究进展[J]. 环境科学进展,1994,2(4): 1-14.
Liu Yanbing,Han Hengbin. Development of methods for arsenic speciation[J]. Advances in Environmental Science,1994,2(4): 1-14.
[10] Francesconi K A,Edmonds J S. Arsenic and marine organisms[J]. Advances in Inorganic Chemistry,1997,44: 147-189.
[11] Mandal B K,Suzuki K T. Arsenic round the world: a review[J]. Talanta,2002,58: 201-235.
[12] Featherstone A M,Butler E C V,O’Grady B V. Meridional distribution of arsenic species in the subantarctic zone of the Southern Ocean,south of Australia[J]. Journal of Geophysical Research,2001,106(C12): 31657-31667.
[13] Smedley P L,Kinniburgh D G. A review of the source,behavior and distribution of arsenic in natural waters[J]. Applied Geochemistry,2002,17(5): 517-568.
[14] Anninou P,Cave R R. How conservative is arsenic in coastal marine environments? A study in Irish coastal waters[J]. Estuarine,Coastal and Shelf Science,2009,82: 515-524.
[15] Ren J L,Zhang J,Li D D,et al. Behavior of dissolved inorganic arsenic in the Yellow Sea and East China Sea[J]. Deep-Sea Research Part Ⅱ,2010,57(11): 1035-1046.
[16] Dousova B,Erbanova L,Novak M. Arsenic in atmospheric deposition at the Czech-Polish border: Two sampling campaigns 20 years apart[J]. Science of the Total Environment,2007,387: 185-193.
[17] Cutter G A,Cutter L S. Behavior of dissolved antimony,arsenic,and selenium in the Atlantic Ocean[J]. Marine Chemistry,1995,49(4): 295-306.
[18] Seyler P,Martin J M. Arsenic and selenium in a pristine river-estuarine system: the Krka,Yugoslavia[J]. Marine Chemistry,1991,34: 137-151.
[19] 曹秀红,任景玲,张桂玲,等. 海南东部河口和近岸海域总溶解态无机砷的分布及季节变化[J]. 环境科学,2012,33(3): 720-726.
Cao Xiuhong,Ren Jingling,Zhang Guiling,et al. Distributions and seasonal variations of total dissolved inorganic arsenic in the estuaries and coastal area of eastern Hainan[J]. Environmental Science,2012,33(3): 720-726.
[20] Gieter M D,Elskens M,Baeyens W. Fluxes and major transport routes of Arsenic in the Scheldt estuary[J]. Marine Chemistry,2005,95(1): 15-30.
[21] 张正斌,刘莲生. 海洋化学(下)[M].济南:山东教育出版社,2004:247-251.
Zhang Zhengbin,Liu Liansheng. Marine Chemistry (the second volume)[M]. Jinan:Shandong Education Press,2004:247-251.
[22] 孙湘平. 中国近海区域海洋[M]. 北京:海洋出版社,2006:24-27.
Sun Xiangping. Oceanic Properties of the Coastal Seas of China[M]. Beijing: China Ocean Press,2006:24-27.
[23] 苏纪兰. 中国近海水文[M]. 北京:中国科学出版社,2005:55-61.
Su Jilan. Hydrographic properties of the coastal seas of China[M]. Beijing: Science Press,2005:55-61.
[24] Ren J L,Zhang G L,Zhang J,et al. Distribution of dissolved aluminum in the Southern Yellow Sea: Influences of a dust storm and the spring bloom[J]. Marine Chemistry,2011,125: 69-81.
[25] 冯士筰,李凤岐,李少菁. 海洋科学导论[M]. 北京:高等教育出版社,1999:115-118.
Feng Shizuo,Li Fengqi,Li Shaojing. An Introduction to Marine Science[M]. Beijing: Higher Education Press,1999:115-118.
[26] Cutter G A,Cutter L S. Metalloids in the high latitude North Atlantic Ocean: Sources and internal cycling[J]. Marine Chemistry,1998,61(1): 25-36.
[27] Cutter G A,Cutter L S,Featherstone A M,et al. Antimony and arsenic biogeochemistry in the western Atlantic Ocean[J]. Deep-Sea Research Part Ⅱ,2001,48(13): 2895-2915.
[28] Chaillou G L,Schfer J,Anschutz P,et al. The behavior of arsenic in muddy sediments of The Bay of Biscay (France)[J]. Geochimica et Cosmochimica Acta,2003,67(16):2993-3003.
[29] Huang W W,Martin J M,Seyler P,et al. Distribution and behavior of arsenic in the Huang He (Yellow River) Estuary and Bohai Sea[J]. Marine Chemistry,1988,25: 75-91.
[30] Zhang Y Y,Zheng Q H,He Y Q,et al. An experimental study on the self-purification of COD Mn oil and As in the mixing area of salt water and freshwater in the Zhujiang River Estuary[J]. Tropical Oceanology,1995,14: 67-74.
[31] 马建新,靳洋,刘晓波,等. 2002年莱州湾海域渔业生态环境监测报告[J]. 齐鲁渔业,2003,20(5):38-39.
Ma Jianxin,Jin Yang,Liu Xiaobo,et al. The fishery ecological environment monitoring report about Laizhou bay in 2002[J]. Shandong Fisheries,2003,20(5): 38-39.
[32] 闫哲,任景玲,刘素美,等. 桑沟湾总溶解态无机砷的分布与季节变化[J]. 海洋环境科学,2008,27(5): 432-436.
Yan Zhe,Ren Jingling,Liu Sumei,et al. Distribution and seasonal variation of total dissolved inorganic arsenic in Sanggou Bay[J]. Marine Environmental Science,2008,27(5): 432-436.
[33] Li L,Ren J L,Yan Z,et al. Behavior of arsenic in the coastal area of the Changjiang (Yangtze River) Estuary: Influences of water mass mixing,the spring bloom and hypoxia[J]. Continental Shelf Research,2014,80: 67-78.
[34] Hsu M K,Liu A K,Liu C. A study of internal waves in the China Seas and Yellow Sea using SAR[J]. Continental Shelf Research,2000,20(4/5): 389-410.
[35] Liu S M,Zhang J,Chen S Z,et al. Inventory of nutrient compounds in the Yellow Sea[J]. Continental Shelf Research,2003,23: 1161-1174.
[36] Li F M,Ren J L,Liu S M,et al. The biogeochemical behavior of dissolved aluminum in the southern Yellow Sea: Influence of the spring phytoplankton bloom[J]. Chinese Science Bulletin,2013,58(2): 238-248.
[37] Calvo-Díaz A,Morn X A G,Nogueira E,et al. Picoplankton community structure along the northern Iberian continental margin in late winter-early spring[J]. Journal of Plankton Research,2004,26(9): 1069-1081.
[38] Xuan J L,Zhou F,Huang D J,et al. Physical processes and their role on the spatial and temporal variability of the spring phytoplankton bloom in the central Yellow Sea[J]. Acta Ecologica Sinica,2011,31: 61-70.
[39] Shi J H,Zhang J,Gao H W,et al. Concentration,solubility and deposition flux of atmospheric particulate nutrients over the Yellow Sea[J]. Deep-Sea Research Part Ⅱ: Topical Studies in Oceanography,2013,97: 43-50.
[40] Liu S M,Zhang J,Chen H T,et al. Factors influencing nutrient dynamics in the eutrophic Jiaozhou Bay,North China[J]. Progress in Oceanography,2005,66: 66-85.
[41] 任景玲,李丹丹,张经,等. 黄、东海溶解态无机砷的形态及其分布[J]. 海洋环境科学,2007,26(3): 212-216.
Ren Jingling,Li Dandan,Zhang Jing,et al. Species and distribution of dissolved inorganic arsenic in the Yellow Sea and East China Sea[J]. Marine Environmental Science,2007,26(3): 212-216.
[42] Fu M Z,Wang Z L,Li Y,et al. Phytoplankton biomass size structure and its regulation in the Southern Yellow Sea (China): seasonal variability[J]. Continental Shelf Research,2009,doi:10.1016/j.csr.2009.08.010.
[43] 曹锡章,宋天佑,王杏乔. 无机化学[R]. 北京:高等教育出版社,1994:824.
Cao Xizhang,Song Tianyou,Wang Xingqiao. Inorganic Chemistry[Z]. Beijing: Higher Education Press,1994:824.
[44] Ren J L,Zhang J,Li D D,et al. Speciation and seasonal variations of dissolved inorganic arsenic in Jiaozhou Bay,North China[J]. Water Air Soil Pollut: Focus,2007,7: 655-671.
[45] Danihelka P. Coal combustion and heavy metals pollution[J]. Fuel and Energy Abstract,1997,38: 439.
[46] Zhu Z Y,Zhang J,Wu Y,et al. Hypoxia off the Changjiang (Yangtze River) Estuary: Oxygen depletion and organic matter decomposition[J]. Marine Chemistry,2011,125(1): 108-116.
[47] 朱道清. 中国水系图典[M]. 青岛:青岛出版社,2010:642.
Zhu Daoqing. The Lexicon of Chinese Water System[M]. Qingdao: Qingdao Press,2010:642.
[48] Hong G H,Kim S H,Chung C S,et al. The role of the anthropogenic nutrient input in the carbon xation of the coastal ocean Yellow Sea: a preliminary study[M]// Handa N,Ohsumi T. Direct Ocean Disposal of Carbon Dioxide. Tokyo: Terra Scientic Publishing Company (TERRAPUB),1995: 13-22.
[49] Ryu J S,Lee K S,Chang H W. Chemical weathering of carbonates and silicates in the Han River basin,South Korea[J]. Chemical Geology,2008,247: 66-80.
[50] Zhang J,Liu S M,Ren J L,et al. Nutrient gradients from the eutrophic Changjiang (Yangtze River) Estuary to the oligotrophic Kuroshio waters and re-evaluation of budgets for the East China Sea Shelf[J]. Progress in Oceanography,2007,74: 449-478.
[51] Munksgaard N C,Parry D L. Trace metals,arsenic and lead isotopes in dissolved and particulate phases of North Australian coastal and estuarine seawater[J]. Marine Chemistry,2001,75(3): 165-184.
[52] Riedel G F,Valette-Silver N. Differences in the bioaccumulation of arsenic by oysters from Southeast coastal US and Chesapeake Bay: environmental versus genetic control[J]. Chemosphere,2002,49(1): 27-37.
[53] 李全生,沈万仁,马锡年. 渤海湾砷的研究[J]. 山东海洋学院学报,1984,14(2): 27-39.
Li Quansheng,Shen Wanren,Ma Xinian. A study on arsenic in Bohai Bay[J]. Jourmal of Shandong College of Oceanology,1984,14(2): 27-39.
[54] 辛福言,马绍赛,崔毅,等. 乳山湾海水、底质及贝类体内砷的研究[J]. 海洋水产研究,1997,(2): 55-60.
Xin Fuyan,Ma Shaosai,Cui Yi,et al. Study on the contents of arsenic in seawater ,sediment and shellfish in Rushan bay[J]. Marine Fisheries Research,1997,(2): 55-60.
The impact of spring bloom on the biogeochemical behavior of total dissolved inorganic arsenic in the South Yellow Sea
Sun Youxu1,Ren Jingling1,Liu Sumei1,Liu Chenggang2
(1.KeyLaboratoryofMarineChemistryTheoryandTechnology,MinistryofEducation,OceanUniversityofChina,Qingdao266100,China; 2.SecondInstituteofOceanography,StateOceanAdministration,Hangzhou310012,China)
In order to understand the impact of spring bloom on the biogeochemical behavior of arsenic (a toxic metalloid element) in the South Yellow Sea (SYS),the field investigation was carried out during March 30th to April 23rd 2007 to study the concentrations and distributions of total dissolved inorganic arsenic (TDIAs,[TDIAs]=[As5+]+[As3+]) in the SYS. In addition,a 25 h anchor station (BM1) was also carried out at the central of SYS,where Chlaconcentrations were higher than 4 μg/L. The concentrations of TDIAs were measured by Hydride Generation-Atomic Fluorescence Spectrometry (HG-AFS) and showed the range of 7.9-22.3 nmol/L,with the average of (17.8±1.9) nmol/L. The concentrations of TDIAs increased gradually from the coastal area to offshore,with the maximum values appearing at the near bottom layer of the southern region. The concentrations of TDIAs showed well mixed vertical profile in the coastal area,while was stratified in the middle and southern region. Due to the impact of strong dust storm and followed rainfall in the SYS during the investigation of March 31st to April 1st 2007,the concentrations of TDIAs in the surface waters were significant increased. A large-scale spring bloom occurred in the middle and southern region of study area for 4-5 days after the dust storm. Through the observations it can be found that the vertical profiles of TDIAs was similar to that of phosphate,and showed relatively negative relationships with chlorophylla(r=0.51,p<0.05,n=39). After primary estimation,the scavenging of TDIAs by phytoplankton above 10 meters layer can reach up to 2.4 nmol/L,which account for 15% of that in the surface waters. The residence time of TDIAs in the YS was (15.6±7.3) a,which is much lower than the open oceans. The molar ratio of arsenic to phosphorus in the study area was about 20 times higher than the open ocean,which might lead to significant absorption and transformation of arsenate and cause the potential ecological crisis.
total dissolved inorganic arsenic; distribution; spring bloom; the South Yellow Sea
10.3969/j.issn.0253-4193.2015.04.002
2014-07-15;
2014-12-10。
国家基础研究发展规划项目(2011CB409801);国家自然科学基金(41176096)。
孙友旭(1990—),男,山东省滕州市人,主要从事痕量元素的海洋生物地球化学循环研究。E-mail:syx08hx@yeah.net
*通信作者:任景玲,教授,主要从事痕量元素的海洋生物地球化学循环研究。E-mail:renjingl@ouc.edu.cn
P736.4
A
0253-4193(2015)04-0016-12
孙友旭,任景玲,刘素美,等. 春季水华对南黄海总溶解态无机砷生物地球化学行为的影响[J].海洋学报,2015,37(4):16—27,
Sun Youxu,Ren Jingling,Liu Sumei,et al. The impact of spring bloom on the biogeochemical behavior of total dissolved inorganic arsenic in the South Yellow Sea[J]. Haiyang Xuebao,2015,37(4):16—27,doi:10.3969/j.issn.0253-4193.2015.04.002

