海水酸化对中华哲水蚤全蛋白表达的影响
张达娟,郭东晖,王桂忠,李少菁*
(1. 天津农学院 水产学院 天津市水产生态及养殖重点实验室,天津 300384;2. 厦门大学 海洋与地球学院,福建 厦门 361005)
海水酸化对中华哲水蚤全蛋白表达的影响
张达娟1,郭东晖2,王桂忠2,李少菁2*
(1. 天津农学院 水产学院 天津市水产生态及养殖重点实验室,天津 300384;2. 厦门大学 海洋与地球学院,福建 厦门 361005)
运用蛋白质组学相关技术对暴露于酸化海水中的中华哲水蚤全蛋白进行分析,结果表明,对照组、CCO20.08%和CCO20.20%处理组中华哲水蚤的双向电泳图谱上可以分别分辨出1 191、1 117和946个蛋白点,选取其中43个差异蛋白进行MALDI-TOF/TOF质谱鉴定,成功鉴定出23个差异蛋白,这些蛋白主要与蛋白合成和分解、能量代谢、DNA分子修复以及解毒过程有关。
二氧化碳;酸化;中华哲水蚤;蛋白质组学
1 引言
由于人类活动,尤其是矿物燃料燃烧、植被破坏导致大量温室气体排放,二氧化碳(CO2)作为其重要组成部分,在大气中的浓度已达到0.038%[1],至本世纪末,将升至0.075%。海洋作为重要的碳汇,每年可以吸收CO2排放量的1/3,大量CO2溶于海水,导致其碳酸盐系统及其他化学性质的改变,海水pH已由工业化前的8.20下降至2007年的8.10,至本世纪末将继续降低0.3~0.5个单位[2—3],这种海水二氧化碳分压升高、pH降低,碳酸盐系统发生改变的现象即为海水酸化(ocean acidification)。
近年来,很多学者已开展海水酸化对生物(主要为个体较大的生物或钙化生物)影响的研究工作,酸化不仅影响生物的种群组成、群落结构,还影响其生长、繁殖等一系列生理、生化过程,并具有一定的种类特异性[4—7]。桡足类作为海洋浮游动物的重要组成部分,在海洋物质循环和能量流动过程中起承上启下的作用,而关于海水酸化对桡足类影响的报道十分稀少。Kurihara等[8—9]以及Zhang等[10—12]对酸化条件下几种桡足类的存活率、产卵率、孵化率以及抗氧化能力进行过研究,而桡足类对海水酸化响应的分子作用机制却未见报道。本研究运用蛋白质组学的相关技术,选取我国近岸桡足类的典型代表种类——中华哲水蚤(Calanussinicus)作为受试对象,研究其在酸化条件下机体全蛋白表达情况,寻找并鉴定特异性蛋白及其功能,对揭示桡足类对海水酸化响应的分子机制具有重要意义。
2 材料与方法
2.1 样品采集
中华哲水蚤采自厦门港附近。样品用大型 (网孔直径 505 μm)浮游生物网于夜间水平拖网采得。将采集好的样品在2 h内带回实验室,立即进行挑选、分离,挑选成熟雌性个体 (挑选标准:活泼、雌性生殖节饱满),经解剖镜 (SMZ-140,Motic)镜检确定后,暂养于结晶皿中。实验海水取自厦门大学海洋与地球学院海洋生物科学与技术系活体培养室,经砂滤后,用0.45 μm微孔滤膜过滤,其盐度为29~30,pH为8.10~8.24。
2.2 酸化海水制备
将经过0.45 μm微孔滤膜过滤的海水充分曝气后分装到5个500 mL大小的细口瓶中,其中1瓶作为对照,不进行通气处理,实验开始前利用酸碱滴定法测定海水总碱度、用pH测定计测定pH,其平均pH为(8.17±0.02)。另外2组海水分别通入混合气体 (厦门空分特气实业有限公司提供),其中一组CO2、氮气和氧气含量分别为0.08%、78.92%和21.0%;另一组分别为0.20%、78.80%和21.0%。气体流量用流量计 (ZBWJ-90,正博)控制在300 mL/min左右,运用pH控制器 (pH/ORP-101,HOTEC)控制海水pH,当其达到稳定后通气自动停止。
2.3 实验设计
本实验共设置CCO20.08%和0.20%两个处理组和一个对照组 (CCO20.038%)。实验在500 mL的细口玻璃瓶中进行。添加扁藻 (Platymonassp.)和中肋骨条藻 (Skeletonemacostatum)的混合藻液作为中华哲水蚤的饵料,饵料密度分别为0.5 × 104cell/mL和4 × 104cell/mL。每瓶分别投放50只中华哲水蚤成熟雌体,在自然光照控温 (16℃)条件下连续培养4 d,第3 d用相应CCO2的海水换水,不添加饵料,并挑出死亡个体。实验结束时,将收集到的中华哲水蚤用MilliQ水清净后分装于2 mL离心管中 (每管约50只),-80℃储存,待提取总蛋白。
2.4 蛋白的提取与定量
2.4.1 蛋白的提取
(1)向收集到的中华哲水蚤中加入1 mLTrizol裂解液,冰浴超声波破碎;
(2) 加入三氯甲烷,每使用1 mLTrizol加入200 μL三氯甲烷,震荡15s后,室温放置5 min;
(3) 4℃,12 000 g离心15 min,去掉无色上清液以及乳白色中层沉淀;
(4) 加入300 μL100%乙醇震荡混匀,4℃,2 000 g离心5 min,取上清液;
(5) 将上清液转移到新的离心管中,按样品∶异丙醇=1∶3的量加入异丙醇,震荡混匀后,-20℃过夜;
(6) 4℃,14 000 g离心10 min取沉淀;
(7) 向上述沉淀中加入1 mL95%乙醇,震荡重悬浮后4℃,14 000 g离心10 min,取沉淀,本步骤重复操作两遍;
(8) 上述操作结束后获得的沉淀即为蛋白,干燥后将其重溶于相应量的[7 mol/L尿素,2 mol/L硫脲,4% CHAPS (质量体积比)]重溶液中,溶解时间约为1 h;
(9) 蛋白完全溶解后于16℃,20 000 g离心5 min,取上清液,分装保存。
2.4.2 蛋白的定量
采用Amersham公司的PlusOneTM2-D Quant Kit进行蛋白定量。
2.5 蛋白双向电泳
2.5.1 等电聚焦电泳
第一向等电聚焦电泳使用18 cm,pH4-7的IPG胶条。按蛋白量为80 μg计算所需样品体积,将蛋白样品与0.003 4 g二硫苏糖醇(0.01 μg/μL)、1.8 μL IPG缓冲液以及重溶液混合至340 μL 。利用IPGphor3 聚焦仪(GE公司,美国)完成等电聚焦过程。等电聚焦参数设置:50 V,13 h;100 V,2 h;200 V,2 h;500 V,1 h;1 000 V,2 h;4 000 V,2 h;8 000 V,50 000 Vhrs。
2.5.2 胶条平衡和SDS-PAGE垂直电泳
等电聚焦完成后,将胶条转移到装有平衡缓冲液Ⅰ (5 mL平衡液中含有二硫苏糖醇 0.05 g)中,15 min后,移入至平衡缓冲液Ⅱ(5 mL平衡液中含有0.125 g 碘乙酰胺)中,15 min后,用TGS (25 mmol/L Tris,192 mmol/L Glycine和0.1% SDS,pH 8.6)润洗胶条后转移至12.5%SDS聚丙烯酰胺凝胶上端,0.5%琼脂糖封顶液封顶,进行第二向SDS-PAGE电泳。电泳参数为:25 mA,30 min;50 mA至电泳结束 (2张胶)。
2.6 凝胶染色、图像扫描与数据分析
采用硝酸银染色法对凝胶进行染色[13]。凝胶用ImageScanner扫描仪(GE公司,美国)采集图像。扫描后的图像用ImageMaster凝胶图像分析软件(GE公司,美国)分析蛋白点。
2.7 酶解
(1)将挖取所得的差异单白点用MilliQ水冲洗2次后加入200 μL脱色液 (0.16 g硫代硫酸钠和0.1 g 铁氰化钾溶于10 mLMilliQ水中),于室温条件下脱色,脱色时间一般不超过10 min;
(2)脱色后用MilliQ水冲洗3次,每次10 min;
(3)冲洗后向离心管中加入乙腈200 μL,室温条件下脱水约10 min,直至胶粒变成白色颗粒;
(4)干燥:将上述乙腈吸出后,于超净工作台中干燥20 min;
(5) 酶解:加入适量的浓度为10 ng/μL的酶液 (溶于10 mmol/L碳酸氢铵的胰蛋白酶),让胶粒溶胀,置于4℃冰箱中反应30 min;
(6)孵化过夜:向每个离心管中加入5~10 μL 10 mmol/L碳酸氢铵溶液,于37℃条件下过夜,用于质谱分析。
2.8 质谱分析及蛋白鉴定
0.6 μL样品与0.6 μL基质液(100 mmol/L α-氰基-4-羟基肉桂酸溶解于含有50%乙腈和0.1%的三氟乙酸)充分混合后,加至点样板上。利用MALDI-TOF/TOFTM5800质谱串联飞行时间质谱仪(ABI,美国)进行质谱分析。
将所得的质谱数据通过Matrix Science Ltd公司提供的本地NCBInr数据库进行搜索和匹配。
3 结果
3.1 不同酸化条件下中华哲水蚤蛋白的表达
利用双向电泳技术获得了酸化条件下中华哲水蚤总蛋白的双向电泳图谱,蛋白点呈圆形或椭圆形,大部分点与点之间界限清晰,略有横向拖尾现象,说明双向电泳谱图质量较高(见图1)。对照组、CCO20.08%处理组和CCO20.20%处理组蛋白点数分别为1 191、1 117和946个,对照组与CCO20.08%和CCO20.20%的差异蛋白点数分别为74和245个,从中选取表达差异显著的43个点进行质谱分析。
不同酸化条件细胞蛋白质组的表达存在差异:一些蛋白的表达量在不同酸化条件下发生明显变化,甚至消失。各差异蛋白点的变化如图2所示。在CCO20.08%条件下,中华哲水蚤体内1号蛋白的表达量有所上升,不过在CCO20.20%时,表达量明显下降。2、3、6、11、12、13、14、16、18、21、22、23、25、30号蛋白在对照组和CCO20.08%中表达量基本一致,不过在CCO20.20%中表达量显著下降。4、34和43号蛋白在对照组中基本不表达,但随着CCO2的升高,它们的表达量明显升高。42号蛋白在对照组中不表达,在CCO20.08%和CCO20.20%处理组中表达量略有升高。35、36和37号蛋白的表达量在对照组中最高,随着CCO2的升高,它们的表达量下降,甚至不表达。
3.2 差异蛋白的质谱鉴定结果
43个差异蛋白中,8个蛋白不能被质谱仪检测到信号;12个蛋白未能搜索到与其相匹配的蛋白,为未知蛋白;其他23种蛋白则发现了与之同源的蛋白 (其中包括未知功能的假设蛋白质),其表达情况见图2,质谱鉴定结果见表1。根据功能可将检测到的蛋白分为以下几类:与蛋白合成和分解有关的蛋白,如1、4和34号蛋白;与新陈代谢相关的蛋白,如35和36号,主要在机体能量和物质代谢过程中起作用;与机体DNA和分子修复过程、细胞周期以及解毒过程有关的蛋白,如3、9、13、16、21和30号蛋白;与肌肉活动有关的蛋白,如23和37号蛋白等。
4 讨论
CCO20.08%处理组与对照组的差异蛋白点 (74个)比CCO20.20%处理组与对照组的差异蛋白点 (214个)少,这说明CCO20.08%的酸化海水对桡足类的影响相对较小,这与我们其他研究结果相似[10—12]。由于缺乏对应的基因组和蛋白质组库,本研究中中华哲水蚤的差异蛋白有些为未知蛋白或未知功能蛋白,本文重点针对已知的几种蛋白进行讨论。
桡足类的蛋白合成过程是机体正常活动的保障,在这个过程中,翻译起始因子和延长因子起着十分重要的调节作用。在本研究中,34号和1号蛋白分别为真核翻译起始因子4A和翻译延长因子2,前者解旋酶活性被认为是与打开mRNA5′端非编码顺序的次级结构以便募集核糖体有关;后者可以催化初步形成的肽段发生构象变化,而进入下一轮的延长过程[14]。酸化条件下,34号蛋白的表达量明显上调,而1号蛋白表达量显著下降,说明中华哲水蚤的蛋白合成收到影响,这一结果符合Seibel 和Walsh[15—16]的推论。桡足类蛋白合成量的降低可引起其生长和繁殖的变化,尤其需要大量蛋白合成与积累的繁殖过程受到的影响可能更剧烈。这在一定程度上印证了桡足类产卵率随酸化水平的加剧而降低的现象[10—12]。14号蛋白为羧基末端蛋白酶,它是一种蛋白翻译后修饰蛋白。酸化条件下其表达量明显下降,可能会导致蛋白得不到应有的加工和修饰而缺失相应的功能,从而影响机体的正常生命活动。 Fabry[17]指出,机体可以通过抑制一些高耗能过程来完成其对海水酸化的耐受,而其中最为重要的过程之一即为蛋白合成,本文的结果支持这一观点。在酸化条件下,与桡足类蛋白合成有关的蛋白表达量明显下降,这可以作为蛋白合成降低的一个显著标志。

图1 中华哲水蚤全蛋白双向电泳图Fig.1 2D-PAGE analysis of total soluble proteins from C.sinicus
本研究中35号蛋白是以NADP为辅酶的异柠檬酸脱氢酶(NADP-IDHs),参与三羧酸循环过程,是其4个关键氧化-还原步骤之一[18]。朱国萍等[19]指出,NADP-IDHs的最适pH通常略偏碱性,随着pH的降低,IDHs脱羧酶的活性趋于减弱。35号蛋白的表达量在酸化条件下显著下降,可能是因为酸化对机体正常的物质代谢具有抑制作用。36号蛋白是甘油醛-3-磷酸脱氢酶 (GAPDH),是糖酵解过程中的重要催化剂,并可以促进有丝分裂过程中膜融合,并具有修复DNA的作用。本研究中,其表达量在酸化条件下明显下降。如上所述,参与三羧酸循环和糖酵解主要过程的两种蛋白质的表达均在酸化条件下降低,这说明酸化对机体的物质代谢和能量代谢均产生影响,造成机体能量产量的降低。不过Hauton等[20]研究指出,酸化 (pH 7.6)条件下培养至成体的钩虾,体内甘油醛-3-磷酸脱氢酶的表达量显著高于在正常海水中培养的个体。是何原因导致不同物种相同蛋白的表达量在相似条件下呈现不同情况,还需要深入研究。在酸化条件下,17β-羟基类固醇脱氢酶 (6号蛋白)的表达量也明显降低。最初将这种蛋白归为类固醇代谢酶,不过最近发现其在线粒体的脂肪酸合成过程中具有重要作用[21]。其表达量的降低在一定程度上说明桡足类脂肪酸合成可能受到酸化的影响,机体积累能量的能力降低。此外,43号蛋白是脂酰CoA硫酯水解酶,主要参与磷脂的新陈代谢过程并可以催化水解高能硫酯键,使ADP磷酸化成ATP。其表达量在酸化条件下明显升高,说明中华哲水蚤机体在酸化条件下不能维持正常的能量代谢,需要磷脂类的大量参与,进而保证机体的正常活动。

图2 酸化条件下中华哲水蚤特异蛋白点的差异表达Fig.2 Different expression of specific proteins spots of C.sinicus in acidified-seawater
表1 酸化条件下中华哲水蚤差异蛋白的质谱分析
Tab.1 Different expression proteins indentified by MALDI-TOF/TOF inC.sinicusexposed to acidified-seawater
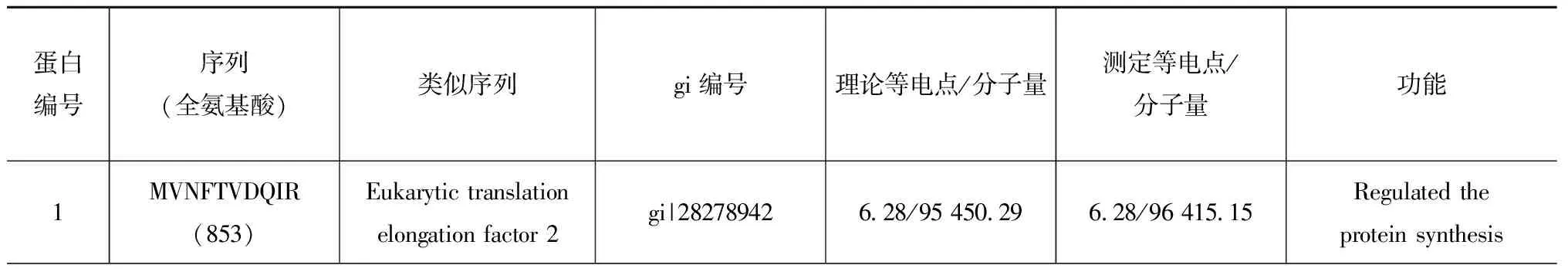
蛋白编号序列(全氨基酸)类似序列gi编号理论等电点/分子量测定等电点/分子量功能1MVNFTVDQIR(853)Eukarytictranslationelongationfactor2gi|282789426 28/95450 296 28/96415 15Regulatedtheproteinsynthesis

续表1

续表1
除上述与机体蛋白合成和基本代谢有关的蛋白受到酸化影响外,其他一些与细胞修复和解毒能力有关的蛋白的表达量也有明显变化。3号蛋白是基于细胞色素C的一氧化氮还原酶,将有毒的一氧化氮 (NO)催化还原为无毒的氧化亚氮 (N2O),从而消除NO对细胞的毒害作用。在酸化条件下,这种蛋白的表达量显著下降,在一定程度上说明,桡足类机体受到酸化的胁迫作用。16号蛋白为谷胱甘肽过氧化物酶,这是一种小分子水溶性蛋白,是机体内重要的Ⅱ相解毒代谢酶,其在酸化条件下的表达量明显下调,解毒能力会下降,这与我们其他研究结果相似[10—11]。Todgham和Hofmann[22]对暴露在酸化海水中96 h后海胆幼体体内GST mRNA表达量进行分析后指出,这种解毒酶的mRNA表达量显著下降,本文的结果与此相似。由此可见,酸化会对桡足类个体产生氧化损伤,从而对其他生命过程产生影响。13号蛋白为DNA连接酶,在DNA复制、重组和修复中起着重要的作用[23]。酸化条件下,这种蛋白的表达量明显下调说明机体分子水平的修复能力可能降低。上述几种蛋白均是桡足类防御系统中不可缺少的重要蛋白,它们的表达量下降直接说明酸化条件会明显降低桡足类对环境胁迫的抵御能力。根据相关研究,酸化对紫贻贝的噬菌能力有显著的抑制作用,贻贝持续的从海水中吸收CO2使其免疫系统逐渐恶化[24];血碳酸浓度升高导致凡纳滨对虾处于缺氧状态,并降低血细胞和组织的抑菌能力,使机体较容易感染细菌[25]。由此可见,酸化对生物的影响不仅体现在其对蛋白合成和新陈代谢的抑制上,而且可以通过对其他抵御系统的破坏来降低其对环境变化的耐受能力。
[1] Scheffer M,Carpenter S,Foley J A,et al. Catastrophic shifts in ecosystems[J]. Nature,2001,413(6856): 591-596.
[2] IPCC. A contribution of Working Groups Ⅰ,Ⅱ and Ⅲ to the third assessment report of the intergovernmental panel on climate change[M]. Cambridge: Cambridge University Press,2001.
[3] Royal Society. Ocean acidification due to increasing atmospheric carbon dioxide[M]. London: The Royal Society,2005: 60.
[4] Clark D,Lamare M,Barker M. Response of sea urchin pluteus larvae (Echinodermata: Echinoidea) to reduced seawater pH: a comparison among a tropical,temperate,and a polar species[J]. Marine Biology,2009,156(6): 1125-1137.
[5] Zippay M L,Hofmann G E. Effect of pH on gene expression and thermal tolerance of early life history stages of red abalone (Haliotisrufescens)[J]. Journal of Shellfish Research,2010,29(2): 429-439.
[6] Bradassi F,Cumani F,Bressan G,et al. Early reproductive stages in the crustose coralline algaphymatolithonlenormandiiare strongly affected by mild ocean acidification[J]. Marine Biology,2013,160(8): 2261-2269.
[7] Wall C B,Fan T Y,Edmunds P J. Ocean acidification has no effect on thermal bleaching in the coralSeriatoporacaliendrum[J]. Coral Reefs,2014,33(1): 119-130.
[8] Kurihara H. Effects of CO2-driven ocean acidification on the early developmental stages of invertebrates[J]. Marine Ecology Progress Series,2008,373: 275-284.
[9] Kurihara H,Ishimatsu A. Effects of high CO2seawater on the copepod (Acartiatsuensis) through all life stages and subsequent generations[J]. Marine Pollution Bulletin,2008,56(6): 1086-1090.
[10] Zhang D J,Li S J,Wang G Z,et al. Impacts of CO2-driven seawater acidification on survival,egg production rate and hatching success of four marine copepods[J]. Acta Oceanologica Sinica,2011,30(6): 86-94.
[11] Zhang D J,Li S J,Wang G Z,et al. Biochemical responses of the copepodCentropagestenuiremisto CO2-driven acidified seawater[J]. Water Science & Technology,2012,65(1): 30-37.
[12] 张达娟,李少菁,王桂忠,等. 二氧化碳酸化对两种桡足类肌肉和卵母细胞超微结构的影响[J]. 海洋学报,2012,34(3): 127-133.
Zhang Dajuan,Li Shaojing,Wang Guizhong,et al. Impacts of CO2-driven acidified seawater on the muscle and oocyte ultrastructure of two marine copepods[J]. Haiyang Xuebao,2012,34(3): 127-133.
[13] Wang D Z,Lin L,Chan L L,et al. Comparative studies of four protein preparation methods for proteomic study of the dinoflagellateAlexandriumsp. using two-dimensional electrophoresis[J]. Harmful Algae,2009,8(5): 685-691.
[14] Redpath N T,Foulstone E J,Proud C G. Regulation of translation elongation factor-2 by insulin via a rapamycin-sensitive signalling pathway[J]. EMBO Journal,1996,15(9): 2291-2297.
[15] Seibel B A,Walsh P J. Potential impacts of CO2injection on deep-sea biota[J]. Science,2001,294(5541): 319-320.
[16] Seibel B A,Walsh P J. Biological impacts of deep-sea carbon dioxide injection inferred from indices of physiological performance[J]. The Journal of Experimental Biology,2003,206(4): 641-650.
[17] Fabry V J. Ocean science: marine calcifiers in a high-CO2ocean[J]. Science,2008,320(5879): 1020-1022.
[18] Hurley J H,Dean A M,Koshland D E,et al. Catalytic mechanism of NADP+-dependent isocitrate dehydrogenase: implications from the structures of magnesium-isocitrate and NADP+complexes[J]. Biochemistry,1991,30(35): 8671-8678.
[19] 朱国萍,黄恩启,赵禙军. NADP-异柠檬酸脱氢酶的结构与功能[J]. 安徽师范大学学报: 自然科学版,2007,30(3): 366-371.
Zhu Guoping,Huang Enqi,Zhao Beijun. Structure and function of NADP-Isocitrate dehydrogenase[J]. Journal of Anhui Normal University: Natural Science,2007,30(3): 366-371.
[20] Hauton C,Tyrrell T,Williams J. The subtle effects of sea water acidification on the amphipodGammaruslocusta[J]. Biogeoscience,2009,6: 1479-1489.
[21] Chen Z J,Kastaniotis A J,Miinalainen I J,et al. 17β-Hydroxysteroid dehydrogenase type 8 and carbonyl reductase type 4 assemble as a ketoacyl reductase of human mitochondrial FAS[J]. The FASEB Journal,2009,23(11): 3682-3691.
[22] Todgham A E,Hofmann G E. Transcriptomic response of sea urchin larvaeStrongylocentrotuspurpuratusto CO2-driven seawater acidification[J]. The Journal of Experimental Biology,2009,212(16): 2579-2594.
[23] Tomkinson A E,Vijayakumar S,Pascal J M,et al. DNA ligases: structure,reaction mechanism,and function[J]. Chemical Reviews,2006,106(2): 687-699.
[24] Bibby R,Widdicombe S,Parry H,et al. Effects of ocean acidification on the immune response of the blue musselMytilusedulis[J]. Aquatic Biology,2008,2(1): 67-74.
[25] Burgents J E,Burnett K G,Burnett L E. Effects of Hypoxia and hypercapnic hypoxia on the localization and the elimination ofVibriocampbelliiinLitopenaeusvannamei,the pacific white shrimp[J]. Biological Bulletin,2005,208(3): 159-168.
Proteomic study of the effects of acidified seawater onCalanussinicus
Zhang Dajuan1,Guo Donghui2,Wang Guizhong2,Li Shaojing2
(1.CollegeofFisheries,TianjinAgriculturalCollege,TianjinKeyLaboratoryofAqua-ecologyandAquaculture,Tianjin300384,China; 2.CollegeofOcean&EarthScience,XiamenUniversity,Xiamen361005,China)
This study compared proteim profiles ofCalanussinicuscultured underCCO20.08% andCCO20.20% CO2-acidified seawater for 4 days using a proteomic approach,and identified the differentially expressed proteins. The results are shown that,1 191,1 117 and 946 protein spots ofC.sinicusin control,CCO20.08% andCCO20.20% groups were detected in the two-dimensional electrophoresis gels,respectively. The 43 protein spots were selected based on their differential expression between control andCCO20.08% group,CCO20.20% group,and 23 proteins of which were identified by MALDI-TOF/TOF mass spectrometry. The data demonstrated that these differentially expressed proteins were associated with protein synthesize and proteolysis,energy metabolism,DNA repaired and detoxified of organisms.
carbon dioxide; ocean acidification;Calanussinicus; proteome
10.3969/j.issn.0253-4193.2015.06.010
2014-09-23;
2015-03-27。
国家自然科学基金“不同生态类型的海洋桡足类对硅藻的利用与适应的生态遗传学研究”面上项目(41276132)。
张达娟(1981—),女,天津市人,博士,实验师,主要从事浮游生物生理生态学研究。E-mail:dajuanzhang@163.com
*通信作者:李少菁(1931—),男,福建省安溪市人,教授,博士生导师,主要从事海洋浮游生物学研究。E-mail:zoopecol@xmu.edu.cn
Q178.53
A
0253-4193(2015)06-0097-09
张达娟,郭东晖,王桂忠,等. 海水酸化对中华哲水蚤全蛋白表达的影响[J].海洋学报,2015,37(6):97—105,
Zhang Dajuan,Guo Donghui,Wang Guizhong,et al. Proteomic study of the effects of acidified seawater onCalanussinicus[J]. Haiyang Xuebao,2015,37(6):97—105,doi:10.3969/j.issn.0253-4193.2015.06.010
——以“不同咖啡因饮料对水蚤心率的影响”为例

