施用氮肥对橡胶林下套种的谢君蘑芋光合系统重要特征及相关生化指标的影响
刘石山, 梁艳丽, 张广辉, 吴诗斌, 谢世清, 陈军文,①
(1. 云南农业大学: a. 云南省优势中药材规范化种植工程研究中心, b. 农学与生物技术学院, 云南 昆明 650201; 2. 西双版纳州种子管理站, 云南 景洪 666100)
施用氮肥对橡胶林下套种的谢君蘑芋光合系统重要特征及相关生化指标的影响
刘石山1a,1b, 梁艳丽1a,1b, 张广辉1a, 吴诗斌2, 谢世清1a, 陈军文1a,1b,①
(1. 云南农业大学: a. 云南省优势中药材规范化种植工程研究中心, b. 农学与生物技术学院, 云南 昆明 650201; 2. 西双版纳州种子管理站, 云南 景洪 666100)
以橡胶林下套种的谢君蘑芋(AmorphophallusxieiH. Li et Z. L. Dao)为研究对象,对施用150 kg·hm-2氮肥后其叶绿素荧光参数、光响应和CO2响应曲线及相关光合参数、光合诱导曲线及相关参数、PSⅡ能量分配的变化进行了研究,并对叶片的全氮含量、抗氧化系统相关指标、叶绿素和叶黄素含量及相关指标进行了比较分析。结果表明:与对照组(不施氮肥)相比,处理组(施氮肥)谢君蘑芋的最小叶绿素荧光值(F0)极显著降低、最大叶绿素荧光值(Fm)极显著升高,最大光化学效率(Fv/Fm)也有一定程度的提高;处理组和对照组间的光响应曲线、CO2响应曲线及光合参数均差异明显,其中,处理组的净光合速率(Pn)高于对照组,其最大净光合速率(Pmax)、光饱和点(LSP)和羧化效率(CE)均极显著高于对照组,而暗呼吸速率(Rd)、表观量子产量(AQY)和光补偿点(LCP)与对照组无显著差异;完成50%和80%光合诱导所需的时间均低于对照组,但差异不显著。与对照组相比,在光响应过程中处理组PSⅡ中用于光合碳同化的能量(ΦPSⅡ)明显增大、用于非光化学淬灭的能量(ΦNPQ)明显减小、用于荧光耗散的能量(Φf.d)变化不明显,而在光合诱导过程中则表现为ΦPSⅡ略减小、ΦNPQ减小、Φf.d增大。与对照组相比,处理组叶片的全氮含量以及超氧化物歧化酶和过氧化物酶活性均极显著升高,氧自由基含量极显著降低,谷胱甘肽含量显著升高,而丙二醛和抗坏血酸含量以及过氧化氢酶、抗坏血酸过氧化物酶、单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶活性变化不显著;叶片中的叶绿素和β-胡萝卜素含量均显著高于对照组,新黄质、叶黄质、紫黄质和花药黄质含量以及紫黄质、花药黄质和玉米黄质的总含量均极显著高于对照组,而玉米黄质含量和叶黄素转化率则极显著低于对照组。综合分析结果显示:施用氮肥能够增强橡胶林下套种的谢君蘑芋的光合作用能力、减少过剩光能、降低活性氧伤害,并减轻光胁迫的危害程度。
谢君蘑芋; 套种; 光合系统; 抗氧化系统; 叶黄素循环; 氮肥
氮素(N)是植物生长发育不可或缺的大量元素之一,与植物的生长和生命活动息息相关;氮肥缺乏可导致植株生长受阻、发育缓慢、叶片失绿和产量降低[1-2]等一系列危害,而氮肥施用过量则造成资源浪费且不利于植物的生长,可导致植物徒长、发生严重病虫害以及果实品质下降[3]等问题。光是自然界中最重要的生态因子,是植物进行光合作用的主导因素和直接能量来源,但是,不适宜的光照会对植物产生不利影响,在抑制植物光合作用的同时还可能会对植株造成过氧化伤害[4-5];CO2是植物进行光合作用的物质基础,对植物的光合作用过程至关重要[6],因此,光和CO2是探究植物光合作用的重要媒介。植物在由暗处或弱光环境转入强光环境的过程中需要经历光合诱导过程,通常光合诱导是指植物的光合作用强度由弱逐渐变强、叶片气孔逐步开放、光合作用的相关酶类逐渐活化、光合速率最终稳定在一定水平(数值一般较大)的过程[7]。氮素营养水平与植物的光合作用紧密相关,缺氮可导致植物光合同化能力降低[2]、对光环境的适应能力下降[3]、抵御强光的能力减弱[8]。
蘑芋(Amorphophallusspp.)又称魔芋,俗称茹芋、药头、蛇头草、花杆莲等,为天南星科(Araceae)蘑芋属(AmorphophallusBlume)多年生草本植物,起源于中南半岛的林下,是一种典型的喜阴植物[9],食用历史悠久,并且在食品加工、医药和化工等领域具有较为广泛的开发和利用价值。蘑芋在国内多个省份均有分布,云南是国内的蘑芋种植大省,同时也是国内蘑芋种质资源非常丰富的地区之一。谢君蘑芋(AmorphophallusxieiH. Li et Z. L. Dao)是近年来在云南省西南部地区发现的蘑芋新种[10],极具生产和应用潜力。
云南省多山并拥有得天独厚的气候资源,非常适合发展蘑芋种植产业;该省西南部地区雨水充沛、热量充足,是中国重要的橡胶(Heveaspp.)产地,同时也是谢君蘑芋的优质产区。橡胶为高大乔木,经济利用周期较长,且其单一种植模式对生态环境破坏严重,因此,发展橡胶林下经济已成为人们的共识,目前西双版纳地区正在逐步推广橡胶林下套种蘑芋的种植模式。
然而,迄今为止关于谢君蘑芋的生理生态适应性和需肥性还不甚清楚。为此,作者以4年生三叶橡胶〔Heveabrasiliensis(Willd. ex A. Juss.) Müll. Arg.〕林下种植的谢君蘑芋为实验对象,研究施用150 kg·hm-2氮肥对林下种植的谢君蘑芋光合系统重要特征以及相关生化指标的影响,以期了解谢君蘑芋的需肥习性和光合生理特征,并为谢君蘑芋种植过程中合理施用氮肥提供参考依据。
1 研究地自然概况和研究方法
1.1 研究地自然概况
研究地位于云南省西双版纳州景洪市嘎洒镇南联门村,距离景洪市区25 km;属北热带季雨林气候,年平均降水量1 557 mm,年平均气温约21 ℃;分雨季和旱季,雨季为每年的5月份至10月份,旱季为当年11月份至翌年4月份。
选择地势平坦的4 年生三叶橡胶林为试验地,林内橡胶树的树高3.5~4.0 m、茎粗10~15 cm、冠幅1.0~1.5 m,橡胶树植株间行距3 m、株距1.0 m。行间整地、开沟、做厢,共10个小区,每个小区长8.5 m、宽3.5 m。土壤酸碱度为pH (5.45±0.02),有机质含量(35.92±1.67) g·kg-1、 全氮含量(1.89±0.15) g·kg-1、全磷含量(0.41±0.03) g·kg-1、全钾含量(15.21±1.26) g·kg-1。
1.2 处理方法
在播种时1次性施入120 kg·hm-2磷肥(P2O5)和100 kg·hm-2钾肥(K2O)作为基肥。出苗后随机选择其中5个小区,按照150 kg·hm-2氮肥总量施入氮肥,其中,苗期的氮肥施用量为氮肥总量的30%,7月初的氮肥施用量为氮肥总量的70%,将此处理组作为施氮肥处理组;不施氮肥的5个小区作为对照组。
选择健康完整且大小一致〔(150±10) g〕的谢君蘑芋作为种芋,用农用链霉素以质量比1∶10的比例兑水后浸种30 min,晒种后于2013年4月25日播种,行距0.8 m、株距0.5 m;同年8月中旬,在每个小区选取3株典型植株,选择羽状复叶的顶端小叶进行气体交换参数和叶绿素荧光参数的测定,每个处理组各测定15株;测定完成后,取叶片用于相关生化指标的测定。每个小区视为1次重复。
1.3 指标测定方法
1.3.1 叶绿素荧光参数及相关指标的测定 采用LI-6400XT便携式光合仪(美国LI-COR公司)测量待测顶端小叶的气体交换参数和叶绿素荧光参数。叶室采用6400-40荧光叶室,并在测定前对所选植株的待测叶片进行挂牌。
1.3.1.1 初始叶绿素荧光参数测定 将待测叶片用暗适应夹子暗适应1 h,然后测定并记录叶片初始最大叶绿素荧光值(Fm)、最小叶绿素荧光值(F0)和最大光化学效率(Fv/Fm),其中,Fv=Fm-F0。
1.3.1.2 光响应过程中净光合速率和叶绿素荧光参数测定 在无风晴天的8:30至11:30测定光响应曲线。测定时,叶室温度设为25 ℃,用CO2注入系统控制参比室的相对CO2浓度为400 μmol·mol-1;预热20 min后夹住叶片,并在光照强度600 μmol·m-2·s-1下诱导3~5 min;待稳定后启动光响应曲线自动测量程序。利用内置的红蓝光源设定光照强度梯度(即光合有效辐射,PAR)为1 500、1 200、800、600、400、200、150、100、80、60、40、20和0 μmol·m-2·s-1,在每个光照强度下均平衡5 min,同时记录各光照强度下叶片的净光合速率和叶绿素荧光参数(Fs和Fm′)。其中,Fs为光下稳定叶绿素荧光值,Fm′为光下最大叶绿素荧光值。
1.3.1.3 CO2响应过程中净光合速率和胞间CO2浓度测定 在无风晴天的8:30至11:30测定CO2响应曲线。测定时,叶室温度设为25 ℃,光照强度设为800 μmol·m-2·s-1;运用CO2注入系统控制参比室的相对CO2浓度分别为1 500、1 200、800、600、400、350、300、250、200、150、100和50 μmol·mol-1,采用CO2响应曲线自动测量程序进行测定;在每个相对CO2浓度下均平衡5 min,并在稳定后同时记录叶片净光合速率和胞间CO2浓度。
1.3.1.4 光合诱导过程中净光合速率和叶绿素荧光参数测定 在无风晴天的8:30至11:30测定光合诱导曲线。测定前一天傍晚用暗适应夹子使叶片处于暗适应状态。测定时,叶室温度设为25 ℃,初始内置光照强度设为20 μmol·m-2·s-1,运用CO2注入系统控制参比室的相对CO2浓度为400 μmol·mol-1;在稳定后调用Time-Lamp程序,设定弱光环境的光照强度为20 μmol·m-2·s-1,记录间隔时间为30 s,记录总时长为2.5 min;设定强光环境的光照强度为1 500 μmol·m-2·s-1,记录间隔时间为30 s,记录总时长为5.5 min,同时记录叶片净光合速率和叶绿素荧光参数(Fs和Fm′)。
1.3.2 叶片全氮含量的测定 采用口径1 cm的取样器打取叶圆片,置于108 ℃条件下杀青30 min,然后置于80 ℃条件下烘干至恒质量;粉碎后交由云南省农业科学院环境资源研究所采用凯氏定氮法完成叶片全氮含量测定。按单株分别进行采样和测定,每处理共15株。
1.3.3 抗氧化系统相关指标的测定 分别采用口径2 cm的取样器打取叶圆片,立即用纱布袋装好并置于液氮中保存,用于抗氧化系统相关指标的测定。其中,参照Knörzer等[11]的方法测定过氧化氢酶(CAT)活性;采用愈创木酚法[12]测定过氧化物酶(POD)活性;采用氮蓝四唑(NBT)比色法[13]测定超氧化物歧化酶(SOD)活性;参照Nakano等[14]的方法测定抗坏血酸过氧化物酶(APX)活性;参照Hossain等[15]的方法测定单脱氢抗坏血酸还原酶(MDHAR)活性;参照Hossain等[16]的方法测定脱氢抗坏血酸还原酶(DHAR)活性;参照Mastubara等[17]的方法测定氧自由基(ROS)含量;参照Madhava Rao等[18]的方法测定丙二醛(MDA)含量;参照Hossain等[16]的方法测定抗坏血酸(VC)含量;参照Guri[19]的方法测定谷胱甘肽(GSH)含量。按单株分别进行采样和测定,每处理共15株。
1.3.4 叶绿素及叶黄素含量的测定 参照赵世杰等[20]的方法测定叶片的叶绿素及叶黄素含量,并略加调整。称取新鲜叶片0.5 g,在黑暗中用丙酮研磨至匀浆,装入预先用锡箔纸包好的容量瓶中,避光条件下用丙酮定容至10 mL, 摇匀后静置10 min; 于4 ℃、15 000g离心3 min,将上清液置于4 ℃且避光条件下保存、待用。按单株分别进行采样和测定,每处理共15株。
采用Agilent 1260型高效液相色谱仪(美国Agilent公司)进行分析。色谱柱为岛津Inertsil ODS-3(4.6 mm×250 mm, 5 μm),使用Agilent 1260双波长检测器(美国Agilent公司)进行检测;检测波长445 nm,洗脱温度25 ℃,流速1.0 mL·min-1;流动相A为V(乙腈)∶V(甲醇)∶V(0.05 mol·L-1Tris-HCl缓冲液)=70∶10∶3, 流动相B为V(甲醇)∶V(正己烷)= 5∶1。采用梯度洗脱法,0~10 min,洗脱液为100%流动相A;10~45 min,洗脱液为100%流动相B。样品溶液上机前用孔径0.1 μm滤膜过滤,进样量5 μL。各色素的标准品均购自美国Sigma公司,按照前述条件分别重复测定5次,以每个色素标准品测定值的平均值制作各自的标准曲线。根据各色素的标准曲线计算叶绿素、新黄质、叶黄质、β-胡萝卜素、紫黄质、花药黄质和玉米黄质的含量,并计算紫黄质、花药黄质和玉米黄质的总含量;按照公式“叶黄素转化率=〔(花药黄质含量+玉米黄质含量)/(紫黄质含量+花药黄质含量+玉米黄质含量)〕×100%”计算叶黄素转化率。
1.4 数据统计和分析
根据方程y=a-c·e-bx拟合光响应曲线和CO2响应曲线并计算相关参数[21],根据光响应曲线的拟合结果计算出最大净光合速率(Pmax,为参数a)、光补偿点〔LCP,为ln(a/c)·(-1/b)〕、光饱和点〔LSP,为ln(0.1a/c)·(-1/b)〕、暗呼吸速率(Rd,为a-c)以及表观量子产量〔AQY,为b·c·eb·(-CP)〕,并根据CO2响应曲线的拟合结果计算出羧化效率〔CE,为b·c·eb·(-CP)〕。
通过方程y=Ashade+(Amax-Ashade)(1-e-x/t1)拟合光合诱导曲线并计算诱导过程中的相关参数[21]。其中,Ashade为低光(20 μmol·m-2·s-1)下的净光合速率;Amax为强光(1 500 μmol·m-2·s-1)诱导稳定后的最大净光合速率;t1为特征时间常数。通过此方程计算完成50%和80%光合诱导所需的时间(t0.5 Pmax和t0.8 Pmax)。
植物PSⅡ的光合能量耗散主要有3条途径,分别为用于光合碳同化的能量(ΦPSⅡ)、用于荧光耗散的能量(Φf.d)和用于非光化学淬灭的能量(ΦNPQ),且ΦPSⅡ+Φf.d+ΦNPQ=1。参照Hendrickson等[22]的方法计算光响应和光合诱导过程中PSⅡ的能量分配情况,计算公式分别为:ΦPSⅡ=1-Fs/Fm′;Φf.d=Fs/Fm;ΦNPQ=Fs/Fm′-Fs/Fm。
采用SPSS 14.0统计分析软件对相关实验数据进行统计和分析,并采用Sigmaplot 10.0软件作图。采用独立样本t检验法对相关数据进行显著性分析(P≤0.05)。
2 结果和分析
2.1 施用氮肥对橡胶林下套种的谢君蘑芋叶片光合系统的影响
2.1.1 对叶片初始叶绿素荧光参数的影响 施用氮肥对橡胶林下套种的谢君蘑芋叶片的最小叶绿素荧光值(F0)、最大叶绿素荧光值(Fm)和最大光化学效率(Fv/Fm)的影响见表1。
结果显示:与不施氮肥组(对照组)相比,施用氮肥后谢君蘑芋叶片的F0值降低,Fm和Fv/Fm值升高,并且其F0和Fm值与对照组间的差异达极显著水平(P<0.01)。
2.1.2 对叶片光合作用的影响 施用氮肥后橡胶林下套种的谢君蘑芋叶片的光响应曲线和CO2响应曲线见图1,根据光响应曲线和CO2响应曲线拟合方程计算获得的相关光合参数见表2。
由图1可见:处理组(施氮肥)和对照组(不施氮肥)的叶片净光合速率均随着光合有效辐射(PAR)和胞间CO2浓度(Ci)升高表现为在低水平时急剧升高、高水平时趋于平缓,并且处理组的叶片净光合速率均高于对照组。


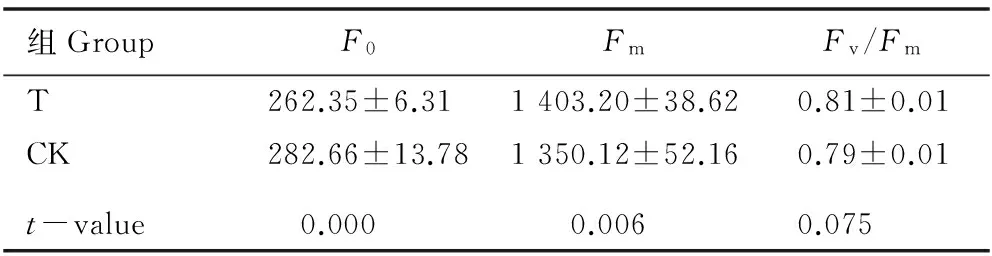
组GroupF0FmFv/FmT262.35±6.311403.20±38.620.81±0.01CK282.66±13.781350.12±52.160.79±0.01t-value0.0000.0060.075
1)T: 处理组(施氮肥) Treatment group (applying nitrogen fertilizer); CK: 对照组(不施氮肥) The control group (not applying nitrogen fertilizer);F0: 最小叶绿素荧光值 The minimum chlorophyll fluorescence;Fm: 最大叶绿素荧光值 The maximum chlorophyll fluorescence;Fv/Fm: 最大光化学效率 The maximum photochemical efficiency.

—●—: 处理组(施氮肥) Treatment group (applying nitrogen fertilizer); —〇—: 对照组(不施氮肥) The control group (not applying nitrogen fertilizer).
图1 施用氮肥后橡胶林下套种的谢君蘑芋叶片的光响应曲线(A)和CO2响应曲线(B)(n=5)
Fig. 1 Light response curve (A) and CO2response curve (B) of leaf ofAmorphophallusxieiH. Li et Z. L. Dao interplanted under rubber plantation after applying nitrogen fertilizer (n=5)



组GroupPmax/μmol·m-2·s-1Rd/μmol·m-2·s-1AQYLCP/μmol·m-2·s-1LSP/μmol·m-2·s-1CE/mol·mol-1T16.79±1.890.56±0.290.06±0.008.49±4.45608.11±68.690.09±0.01CK9.02±2.370.51±0.080.07±0.007.26±1.38310.27±77.820.05±0.02t-value0.0010.7560.1190.6150.0000.002
1)T: 处理组(施氮肥) Treatment group (applying nitrogen fertilizer); CK: 对照组(不施氮肥) The control group (not applying nitrogen fertilizer); Pmax: 最大净光合速率 The maximum net photosynthetic rate; Rd: 暗呼吸速率 Dark respiration rate; AQY: 表观量子产量 Apparent quantum yield; LCP: 光补偿点 Light compensation point; LSP: 光饱和点 Light saturation point; CE: 羧化效率 Carboxylation efficiency.
由表2可见:处理组叶片的最大净光合速率(Pmax)、光饱和点(LSP)和羧化效率(CE)均高于对照组,且差异极显著(P<0.01),而其暗呼吸速率(Rd)、表观量子产量(AQY)和光补偿点(LCP)则较对照组无显著变化。
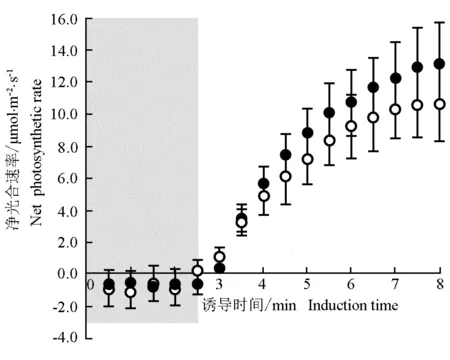
2.1.3 对叶片光合诱导的影响 施用氮肥后橡胶林下套种的谢君蘑芋叶片的光合诱导曲线见图2;根据光合诱导曲线拟合方程计算获得的光合诱导参数见表3。
—●—: 处理组(施氮肥) Treatment group (applying nitrogen fertilizer);
—〇—: 对照组(不施氮肥) The control group (not applying nitrogen fertilizer).
灰色和白色部分分别表示在光照强度20和1 500 μmol·m-2·s-1条件下的光合诱导曲线 The gray and white parts represent photosynthetic induction curves under light intensity of 20 and 1 500 μmol·m-2·s-1, respectively.
图2 施用氮肥后橡胶林下套种的谢君蘑芋叶片的光合诱导曲线(n=5)
Fig. 2 Photosynthetic induction curve of leaf ofAmorphophallusxieiH. Li et Z. L. Dao interplanted under rubber plantation after applying nitrogen fertilizer (n=5)



组Groupt0.5Pmax/st0.8Pmax/sT96.80±17.18193.20±14.17CK102.70±10.88200.20±12.84t-value0.3490.271
1)T: 处理组(施氮肥) Treatment group (applying nitrogen fertilizer); CK: 对照组(不施氮肥) The control group (not applying nitrogen fertilizer);t0.5 Pmax: 完成50%光合诱导所需的时间 Required time for completing 50% light induction;t0.8 Pmax: 完成80%光合诱导所需的时间 Required time for completing 80% light induction.
由图2可见:在弱光条件下处理组和对照组谢君蘑芋叶片的净光合速率均较小,且两个组间差异不明显;而在强光条件下处理组和对照组谢君蘑芋叶片的净光合速率均随诱导时间延长而逐渐升高,并且处理组几乎均高于对照组,二者间差异随诱导时间延长而逐渐增大。
由表3可见:处理组谢君蘑芋的叶片完成50%和80%光合诱导所需的时间(t0.5 Pmax和t0.8 Pmax)分别为96.80和193.20 s,且二者均短于对照组,但在统计意义上差异不显著。
2.1.4 对叶片PSⅡ能量分配的影响 施用氮肥对橡胶林下套种的谢君蘑芋叶片PSⅡ中能量分配的影响见图3。
由图3可以看出:与对照组相比,在光响应过程中,处理组谢君蘑芋叶片PSⅡ中用于光合碳同化的能量(ΦPSⅡ)明显升高,用于非光化学淬灭的能量(ΦNPQ)明显降低,而用于荧光耗散的能量(Φf.d)则变化不明显;在光合诱导过程中,处理组谢君蘑芋叶片PSⅡ中的ΦPSⅡ略有降低,ΦNPQ也在一定程度上下降,而Φf.d则升高。
2.2 施用氮肥对橡胶林下套种的谢君蘑芋叶片相关生化指标的影响
2.2.1 对叶片中全氮含量的影响 施用氮肥后橡胶林下套种的谢君蘑芋叶片全氮含量的测定结果显示:处理组叶片的全氮含量〔(4.20±0.28)%〕高于对照组〔(3.24±0.15)%〕,且差异极显著(t=0.000,P<0.01)。
2.2.2 对叶片中抗氧化系统相关指标的影响 施用氮肥对橡胶林下套种的谢君蘑芋叶片抗氧化系统相关指标的影响见表4。
结果显示:处理组谢君蘑芋叶片抗氧化系统的10项指标均与对照组有一定差异。其中,处理组叶片的氧自由基(ROS)含量较对照组降低且差异极显著(P<0.01);处理组叶片的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性较对照组升高且差异极显著;处理组叶片的谷胱甘肽(GSH)含量较对照组升高且差异显著(P<0.05);处理组叶片的过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和单脱氢抗坏血酸还原酶(MDHAR)活性以及抗坏血酸(VC)含量较对照组略升高但差异不显著;处理组叶片的丙二醛(MDA)含量和脱氢抗坏血酸还原酶(DHAR)活性较对照组略降低但差异不显著。
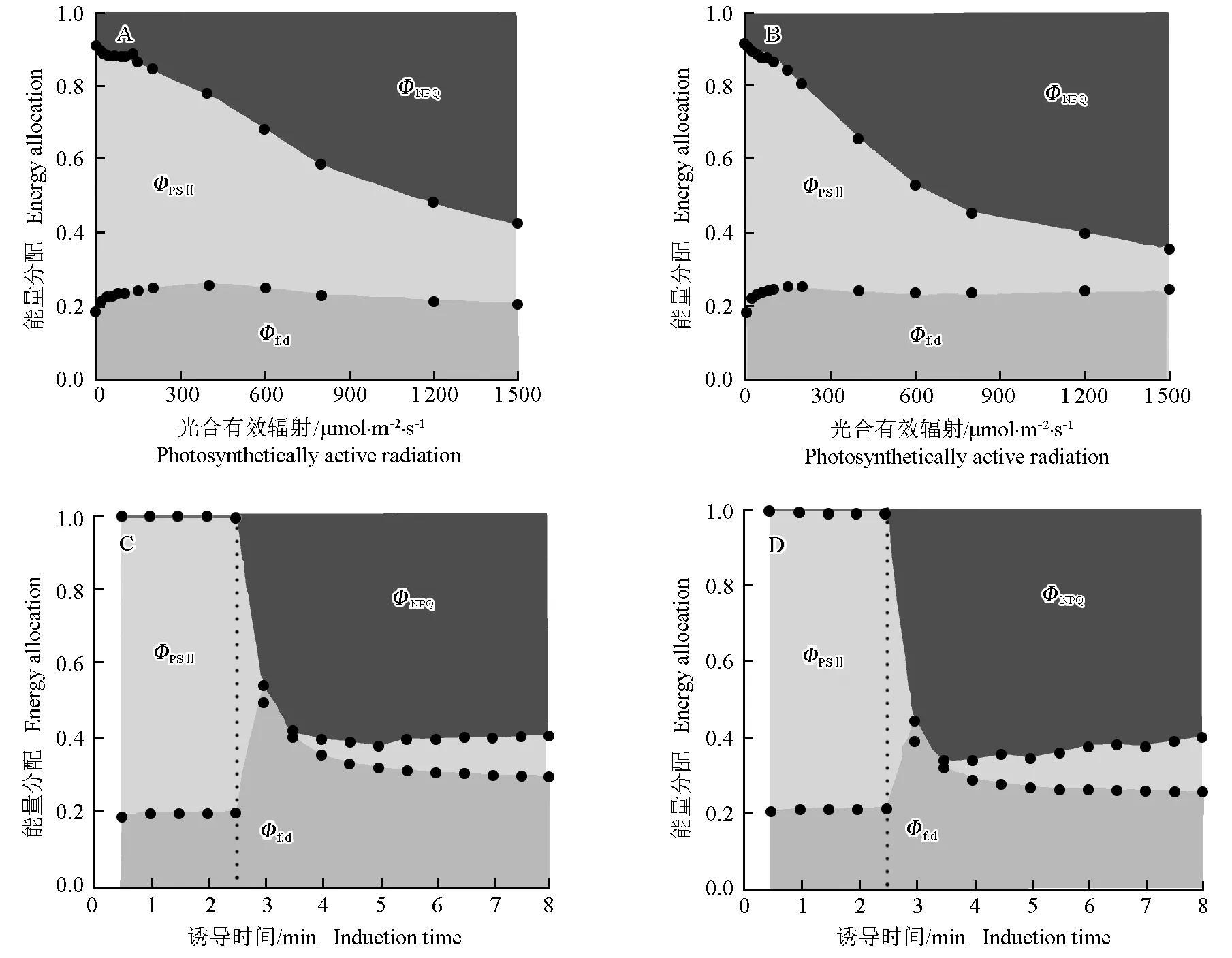
ΦPSⅡ: 用于光合碳同化的能量Energy used for photosynthetic carbon assimilation;ΦNPQ: 用于非光化学淬灭的能量Energy used for non photochemical quenching;Φf.d: 用于荧光耗散的能量Energy used for fluorescence dissipation.
A,C: 处理组(施氮肥) Treatment group (applying nitrogen fertilizer); B,D: 对照组(不施氮肥) The control group (not applying nitrogen fertilizer).
图3 施用氮肥对橡胶林下套种的谢君蘑芋叶片在光响应(A和B)和光合诱导(C和D)过程中PSⅡ能量分配的影响
Fig. 3 Effect of applying nitrogen fertilizer on energy allocation of PSⅡ ofAmorphophallusxieiH. Li et Z. L. Dao interplanted under rubber plantation during light response (A and B) and photosynthetic induction (C and D) processes



组GroupROS/μmol·g-1MDA/μmol·g-1VC/mg·g-1CAT/μmol·min-1·g-1APX/μmol·min-1·g-1T62.16±9.388.13±1.020.19±0.11310.40±87.871.70±0.26CK101.43±15.059.03±1.180.11±0.05291.60±57.101.53±0.43t-value0.0000.0850.0520.5760.308

组Group SOD/U·g-1GSH/μmol·g-1POD/μmol·min-1·g-1 DHAR/μmol·min-1·g-1MDHAR/μmol·min-1·g-1T 4.60±1.7436.30±11.74288.60±39.41 1.39±0.330.31±0.26CK1.72±1.0225.30±9.58156.90±94.301.77±0.540.22±0.10t-value0.0000.0330.0010.0740.325
1)T: 处理组(施氮肥) Treatment group (applying nitrogen fertilizer); CK: 对照组(不施氮肥) The control group (not applying nitrogen fertilizer); ROS:氧自由基含量 Content of oxygen free radical; MDA: 丙二醛含量 Content of malondialdehyde; VC: 抗坏血酸含量 Content of ascorbic acid; CAT: 过氧化氢酶活性 Activity of catalase; APX: 抗坏血酸过氧化物酶活性 Activity of ascorbate peroxidase; SOD: 超氧化物歧化酶活性 Activity of superoxide dismutase; GSH: 谷胱甘肽含量 Content of glutathione; POD: 过氧化物酶活性 Activity of peroxidase; DHAR: 脱氢抗坏血酸还原酶活性 Activity of dehydrogenation ascorbate reductase; MDHAR: 单脱氢抗坏血酸还原酶活性 Activity of monodehydrogenation ascorbate reductase.
2.2.3 对叶片中叶绿素和叶黄素含量及相关指标的影响 施用氮肥对橡胶林下套种的谢君蘑芋叶片中叶绿素和叶黄素含量以及相关指标的影响见表5。
结果表明:处理组谢君蘑芋叶片中的叶绿素和β-胡萝卜素含量均较对照组升高且差异显著(P<0.05);处理组叶片中的新黄质、叶黄质、紫黄质和花药黄质含量极显著高于对照组(P<0.01),并且紫黄质、花药黄质和玉米黄质的总含量也极显著高于对照组;而处理组叶片中的玉米黄质含量和叶黄素转化率则极显著低于对照组。


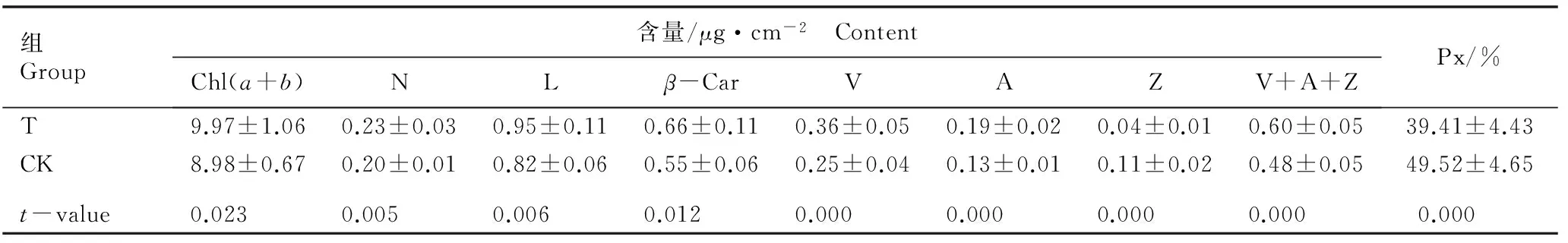
组Group含量/μg·cm-2 ContentChl(a+b)NLβ-CarVAZV+A+ZPx/%T9.97±1.060.23±0.030.95±0.110.66±0.110.36±0.050.19±0.020.04±0.010.60±0.0539.41±4.43CK8.98±0.670.20±0.010.82±0.060.55±0.060.25±0.040.13±0.010.11±0.020.48±0.0549.52±4.65t-value0.0230.0050.0060.0120.0000.0000.0000.0000.000
1)T: 处理组(施氮肥) Treatment group (applying nitrogen fertilizer); CK: 对照组(不施氮肥) The control group (not applying nitrogen fertilizer); Chl(a+b): 叶绿素含量 Content of chlorophyll; N: 新黄质含量 Content of neoxanthin; L: 叶黄质含量 Content of lutein;β-Car:β-胡萝卜素含量 Content ofβ-carotene; V: 紫黄质含量 Content of violaxanthin; A: 花药黄质含量 Content of antheraxanthin; Z: 玉米黄质含量 Content of zeaxanthin; Px: 叶黄素转化率Xanthophyll conversion percentage.
3 讨论和结论
上述研究结果显示:施用氮肥后橡胶林下套种的谢君蘑芋叶片的F0低于对照组(不施氮肥),而其Fm和Fv/Fm较对照组升高。依据叶绿素荧光参数意义(F0与环境胁迫程度正相关,Fm与叶绿素浓度正相关,Fv/Fm与光合作用潜能正相关)可以推断:施用氮肥后谢君蘑芋植株受环境胁迫的可能性低于对照组,而其叶绿素浓度和光合作用潜能均高于对照组。
在光响应和CO2响应过程中,施用氮肥后橡胶林下套种的谢君蘑芋的净光合速率和最大净光合速率均明显高于对照组,说明施用氮肥能够促使谢君蘑芋的光合作用能力显著提高,这与Huber等[23]的研究结果一致。植物从土壤中吸收的氮素绝大部分被运送到叶片中,参与光合色素、光合酶以及光合电子传递链的合成和构建等光合作用过程,因此,对大部分植物来说,缺氮将导致其光合作用能力减弱、光合作用水平降低[24-26]。蘑芋是需肥量较大的作物,虽然套种在橡胶林下能够为其营造适宜的生长环境,但是同时也不可避免为其带来种间竞争压力,缺肥可导致橡胶林下套种的谢君蘑芋光合作用水平降低[27],因此,合理、精准施肥尤为重要。关于橡胶林下套种谢君蘑芋的合理施肥措施尚待进一步的深入研究。
光合诱导时间决定了植物利用太阳光的能力,尤其是其利用波动形式光的能力[7]。本研究中,施用氮肥后谢君蘑芋完成50%和80%光合诱导所需的时间均较对照组缩短,但差异不显著,这与前人[28-29]对不同环境和植物种类的相关研究结果一致,说明植物的光合诱导能力与生长环境没有明显相关性,据此认为这可能是植物在进化过程中形成的固有特征。
抗氧化酶是植物体内重要的抵御氧化伤害的屏障,SOD通过歧化反应将超氧自由基还原为毒性较低的H2O2和O2,CAT和POD可进一步将H2O2还原为H2O和O2[30],抗坏血酸―谷胱甘肽循环也能将H2O2还原,而APX、MDHAR和DHAR则在该循环中起关键的催化作用。比较而言,施用氮肥后谢君蘑芋的SOD和POD极显著高于不施氮肥的对照组,说明施用氮肥后谢君蘑芋叶片内这2种酶对活性氧的清除作用明显增强。
叶黄素循环光保护机制被认为是植物抵御强光伤害的重要防线[31]。强光条件下,植物体内的紫黄质在去环氧化酶的作用下通过中间产物花药黄质形成玉米黄质,以消耗过剩的光能,实现植物的自我保护。相关的研究结果[32-33]表明:紫黄质、花药黄质和玉米黄质的总含量以及叶黄素转化率分别代表潜在非光化学淬灭能力和非光化学淬灭发生水平。与对照组相比,施用氮肥后谢君蘑芋叶片中紫黄质、花药黄质和玉米黄质的总含量较高,但其叶黄素转化率却较低,说明在本研究的施氮水平下,在橡胶林下套种的谢君蘑芋具备较好的非光化学淬灭的物质基础、非光化学淬灭潜力较大、抵御强光伤害的能力较高,实际遭受光胁迫的程度低;而未施氮肥的谢君蘑芋则通过提高叶黄素转化率来降低强光伤害,这一现象也存在于其他植物中[34-36]。
光能过剩是自然界普遍存在的一种现象[4],植物体内的过剩光能若不及时耗散,将对机体产生不同程度的光合抑制作用甚至光氧化伤害[37]。Hendrickson等[22]认为:用于光合碳同化的能量(ΦPSⅡ)与植物的光合作用水平呈正相关、用于非光化学淬灭的能量(ΦNPQ)与叶黄素转化率呈正相关、用于荧光耗散的能量(Φf.d)与光胁迫程度呈负相关,本研究结果也印证了这一观点。施用氮肥后橡胶林下套种的谢君蘑芋的光合作用水平较高,相应的ΦPSⅡ也较高;其叶黄素转化率低,相应的ΦNPQ也较低;而在光合诱导过程中,未施氮肥的谢君蘑芋叶片的Φf.d较低,说明在橡胶林下未施氮肥的植株受到的光胁迫程度更高。
总体来看,施用氮肥能够提高橡胶林下套种的谢君蘑芋的光合作用水平,增强其抵御光氧化伤害的能力,但对其光合诱导能力的影响并不显著。
[1] SUGIHARTO B, MIYATA K, NAKAMOTO H, et al. Regulation of expression of carbon-assimilating enzymes by nitrogen in maize leaf[J]. Plant Physiology, 1990, 92: 963-969.
[2] HIKOSAKAK,TERASHIMAI.Amodel of the acclimation of photosynthesis in the leaves of C3plants to sun and shade with respect to nitrogen use[J]. Plant, Cell and Environment, 1995, 18: 605-618.
[3] TERASHIMA I, EVANS J R. Effects of light and nitrogen nutrition on the organization of the photosynthetic apparatus in spinach[J]. Plant and Cell Physiology, 1988, 29: 143-155.
[4] 王 强, 温晓刚, 张其德. 光合作用光抑制的研究进展[J]. 植物学通报, 2003, 20(5): 539-548.
[5] 朱俊杰. 元江干热河谷植物光保护和抗氧化保护生理生态机制[D]. 勐腊: 中国科学院西双版纳热带植物园, 2007.
[6] LI Y, GAO Y X, XU X M, et al. Light-saturated photosynthetic rate in high-nitrogen rice (OryzasativaL.) leaves is related to chlloroplastic CO2concentration[J]. Journal of Experimental Botany, 2009, 60: 2351-2360.
[7] HAN Q, YAMAGUCHI E, ODAKA N, et al. Photosynthetic induc-tion responses to variable light under field condition in three species grown in the gap and understorey of aFaguscrenataforest[J]. Tree physiology, 1999, 19: 625-634.
[8] MCKINNON L M, MITCHELL A K. Photoprotection, not increased growth characterizes the response of Engelmann spruce (Piceaengelmannii) seedlings to high light, even when resources are plentiful[J]. New Phytologist, 2003, 160: 69-79.
[9] 刘佩瑛. 魔芋学[M]. 北京: 中国农业出版社, 2004.
[10] LI H, DAO Z L. A new species ofAmorphophallus(Araceae) from Yunnan, China[J]. Novon, 2006, 16: 240-243.
[11] KNÖRZER O C, BURNER J, BOGER P. Alterations in the anti-oxidative system of suspension-cultured soybean cells (Glycinemax)induced by oxidative stress[J]. Physiologia Plantarum, 1996, 97: 388-396.
[12] CHANCE B, MAEHLY A C. Assay of catalases and peroxidases[J]. Methods in Enzymology, 1955, 2: 764-775.
[13] BEAUCHAMP C, FRIDOVICH I. Superoxide dismutase: improved assays and applicable to acrylamide gels[J]. Analytical Biochemistry, 1971, 44: 276-287.
[14] NAKANO Y,ASADA K.Hydrogenperoxidesis scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology, 1981, 22: 867-880.
[15] HOSSAIN M A, NAKANO Y, ASADA K. Monodehydroascorbate reductase in spinach chloroplasts and its participation in regeneration of ascorbate for scavenging hydrogen peroxide[J]. Plant and Cell Physiology, 1984, 25: 385-395.
[16] HOSSAINMA,ASADAK.Purificationofdehydroascorbate reductase from spinach and its characterization as a thiol enzyme[J]. Plant and Cell Physiology, 1984, 25: 85-92.
[17] MASTUBARAC,NISHIKAWA Y,YOSHIDAY.Aspectro-photometric method for the determination of free fatty acid in serum using acyl-coenzyme A synthetase and acyl-coenzyme A oxidase[J]. Analytical Biochemistry, 1983, 130: 128-133.
[18] MADHAVA RAO K V, SRESTY T V. Antioxidative parameters in the seedlings of pigeonpea (Cajanuscajan(L.) Millspaugh) in responsetoZnandNistresses[J]. PlantScience, 2000, 157: 113-128.
[19] GURI A. Variation in glutathione and ascorbic acid content among selected cultivars ofPhaseolusvulgarisprior to and after exposure to ozone[J]. Canadian Journal of Plant Science, 1983, 63: 733-737.
[20] 赵世杰, 孟庆伟, 韩长成. 植物组织中叶黄素循环组分的高效液相色谱分析法[J]. 植物生理学通讯, 1995, 31(6): 438-442.
[21] WEBB W L, NEWTON M, STARR D. Carbon dioxide exchange ofAlnusrubra: amathematicalmodel[J]. Oecologia, 1974, 17: 281-291.
[22] HENDRICKSONL,FURBANK RT,CHOW W S.A simple alternative approach to assessing the fate of absorbed light energy using chlorophyll fluorescence[J]. Photosynthesis Research, 2004, 82: 73-81.
[23] HUBER SC,SUGIYAMA T,ALBERTE RS.Photosynthetic determinants of growth in maize plants: effects of nitrogen nutrition on growth, carbon fixation and photochemical features[J]. Plant and Cell Physiology, 1989, 30: 1063-1072.
[24] EVANS J R. Photosynthesis and nitrogen relationships in leaves of C3plants[J]. Oecologia, 1989, 78: 9-19.
[25] CHENG L L, FUCHIGAMI L H, BREEN P J. Light absorption and partitioning in relation to nitrogen content in ‘Fuji’ apple leaves[J]. Journal of the American Society for Horticultural Science, 2000, 125: 581-587.
[26] HUANG Z A, JIANG D A, YANG Y, et al. Effects of nitrogen deficiency on gas exchange, chlorophyll fluorescence, and antioxidant enzyme in leaves of rice plants[J]. Photosynthetica, 2004, 42: 357-364.
[27] 梁艳丽, 李 建, 岩 对, 等. 橡胶树与魔芋间作对魔芋净光合速率及产量的影响[J]. 长江蔬菜: 学术版, 2010(24): 35-38.
[28] CAO K F,BOOTH E B.Leafanatomical structure and photo-synthetic induction for saplings of five dipterocarp species under contrasting light condition in a Bornean heath forest[J]. Journal of Tropical Ecology, 2001, 17: 163-175.
[29] BAI K D, LIAO D B, JIANG D B, et al. Photosynthetic induction in leaves of co-occurringFaguslucidaandCastanopsislamontiisaplings grown in contrasting light environment[J]. Trees, 2008, 22: 449-462.
[30] ASADA K. Radical production and scavenging in the chloroplasts[M]∥BAKER N R. Photosynthesis and the Environment. Dordrecht: Kluwer Academic Publishers, 1996: 123-150.
[31] GOSS R, JAKOB T. Regulation and function of xanthophyll cycle-dependent photoprotection in algae[J]. Photosynthesis Research, 2010, 106: 103-122.
[32] ADAMS W W, Ⅲ, DEMMIG-ADAMS B, VERHOEREN A S, et al. “Photoinhibition” during winter stress: involvement of sustained xanthophyll cycle-dependent energy dissipation[J]. Australian Journal of Plant Physiology, 1994, 22: 261-276.
[33] DEMMIG-ADAMS B, ADAMS W W, Ⅲ. Xanthophyll cycle and light stress in nature: uniform response to excess direct sunlight among higher plant species[J]. Planta, 1996, 198: 460-470.
[34] KHAMIS S, LAMAZE T, LEMOINE Y, et al. Adaptation of the photosynthetic apparatus in maize leaves as a result of nitrogen limitation: relationships between electron transport and carbon assimilation[J]. Plant Physiology, 1990, 94: 1436-1443.
[35] VERHOEVEN A S,DEMMIG-ADAMS B, ADAMS W W,Ⅲ. Enhanced employment of the xanthophyll cycle and thermal energy dissipation in spinach exposed to high light and N stress[J]. Plant Physiology, 1997, 113: 817-824.
[36] CHENG L. Xanthophyll cycle pool size and composition in relation to nitrogen content of apple leaves[J]. Journal of Experimental Botany, 2003, 54: 385-393.
[37] BARBER J, ANDERSSON B. Too much of a good thing: light can be bad for photosynthesis[J]. Trends in Biochemical Sciences, 1992, 17: 61-66.
(责任编辑: 佟金凤)
Effects of applying nitrogen fertilizer on important characteristics of photosynthetic system and related biochemical indexes ofAmorphophallusxieiinterplanted under rubber plantation
LIU Shishan1a,1b, LIANG Yanli1a,1b, ZHANG Guanghui1a, WU Shibin2, XIE Shiqing1a, CHEN Junwen1a,1b,①
(1. Yunnan Agricultural University: a. Yunnan Research Center on Good Agricultural Practice for Dominant Chinese Medicinal Materials, b. College of Agronomy and Biotechnology, Kunming 650201, China; 2. Seed Management Station of Xishuangbanna State, Jinghong 666100, China),
J.PlantResour. &Environ., 2015, 24(4): 18-27
TakingAmorphophallusxieiH. Li et Z. L. Dao interplanted under rubber plantation as research objects, changes of its chlorophyll fluorescence parameters, light response and CO2response curves and related photosynthetic parameters, photosynthetic induction curve and related indexes, energy allocation of PSⅡ were investigated after applying 150 kg·hm-2nitrogen fertilizer, and total nitrogen content, related indexes of antioxidant system, chlorophyll and xanthophyll contents and related indexes in leaf were comparatively analyzed. The results show that compared with the control group (not applying nitrogen fertilizer), the minimum chlorophyll fluorescence (F0) ofA.xieiof treatment group (applying nitrogen fertilizer) decreases extremely significantly, the maximum chlorophyll fluorescence (Fm) increases extremely significantly, the maximum photochemical efficiency (Fv/Fm) also increases at a certain degree. There are obvious differences in light response curve, CO2response curve and photosynthetic parameters between treatment group and the control group, in which, net photosynthetic rate (Pn) of treatment group is higher than that of the control group, its the maximum net photosynthetic rate (Pmax), light saturation point (LSP) and carboxylation efficiency (CE) all are extremely significantly higher than those of the control group, while its dark respiration rate (Rd), apparent quantum yield (AQY) and light compensation point (LCP) have no significant difference from those of the control group. Required times for completing 50% and 80% light induction of treatment group are lower than those of the control group, but the difference is not significant. Compared with the control group, during light response process, energy used for photosynthetic carbon assimilation (ΦPSⅡ) in PSⅡ of treatment group increases obviously, energy used for non photochemical quenching (ΦNPQ) decreases obviously and change of energy used for fluorescence dissipation (Φf.d) is not obvious, while during photosynthetic induction process,ΦPSⅡdecreases slightly,ΦNPQdecreases andΦf.dincreases. Compared with the control group, total nitrogen content and activities of superoxide dismutase and peroxidase in leaf of treatment group all increase extremely significantly, oxygen free radical content decreases extremely significantly, glutathione content increases significantly, while changes in contents of malondialdehyde and ascorbic acid, and activities of catalase, ascorbate peroxidase, monodehydrogenation ascorbate reductaseanddehydrogenationascorbatereductasearenotsignificant. Contentsofchlorophyllandβ-carotene in leaf both are significantly higher than those of the control group, contents of neoxanthin, lutein, violaxanthin and antheraxanthin and total content of violaxanthin, antheraxanthin and zeaxanthin all are extremely significantly higher than those of the control group, while zeaxanthin content and xanthophyll conversion percentage are extremely significantly lower than those of the control group. The comprehensive analysis result indicates that applying nitrogen fertilizer can enhance photosynthetic capacity ofA.xieiinterplanted under rubber plantation, decrease excess light energy, reduce damage of reactive oxygen, and alleviate injury of light stress.
AmorphophallusxieiH. Li et Z. L. Dao; interplanting; photosynthetic system; antioxidant system; xanthophyll cycle; nitrogen fertilizer
2015-02-05
国家自然科学基金资助项目(31160392)
刘石山(1988—),男,湖南邵阳人,硕士研究生,研究方向为薯类生理生态。
①通信作者 E-mail: cjw31412@163.com
Q945.11; S567.23+9.062
A
1674-7895(2015)04-0018-10
10.3969/j.issn.1674-7895.2015.04.03

