不同盐碱胁迫对大麻种子萌发和幼苗生长的影响
胡华冉, 刘 浩, 邓 纲, 杜光辉, 徐 云, 刘飞虎
(云南大学农学院, 云南 昆明 650091)
不同盐碱胁迫对大麻种子萌发和幼苗生长的影响
胡华冉, 刘 浩, 邓 纲, 杜光辉, 徐 云, 刘飞虎①
(云南大学农学院, 云南 昆明 650091)
采用沙培法和盆栽法, 研究了不同浓度NaCl、Na2SO4、Na2CO3和NaHCO3胁迫对大麻品种‘云麻5号’(Cannabissativa‘Yunma 5’)种子萌发和幼苗生长的影响。结果表明:分别用浓度0(CK)、50、100、150、200、250和300 mmol·L-1的4种盐胁迫处理7 d,种子的发芽率、发芽势、萌发指数和活力指数以及胚根和胚轴长总体上随盐分浓度的提高逐渐下降;除浓度50 mmol·L-1NaCl和Na2SO4处理组的胚轴长度显著高于对照外,各处理组种子的各指标均小于对照,其中,在100~300 mmol·L-1盐胁迫条件下种子的各指标均与对照差异显著(P<0.05)。用浓度0(CK)、100、200和300 mmol·L-1的4种盐进行胁迫处理,随胁迫时间延长(0~24 d)幼苗株高逐渐增大,但各处理组幼苗的株高增幅明显小于对照。随各盐分浓度的提高,幼苗干质量、株高和根长均逐渐减小且均低于对照;叶片相对电导率均逐渐增大且均高于对照,其中仅100和200 mmol·L-1Na2SO4处理组的叶片相对电导率与对照无显著差异;各处理组幼苗根冠比也均显著小于对照。不同盐胁迫对幼苗叶片叶绿素含量(SPAD值)有不同的影响效应;其中,各NaCl处理组的SPAD值与对照无显著差异,各Na2SO4处理组的SPAD值均显著高于对照;而随Na2CO3和NaHCO3浓度的提高,SPAD值均逐渐减小并低于对照。另外,在300 mmol·L-1Na2CO3胁迫条件下幼苗死亡。综合分析结果表明:Na2CO3对大麻种子萌发和幼苗生长的胁迫效应明显强于另3种盐分;大麻对盐胁迫的耐性因盐分类型和浓度而异,且不同发育期(萌芽期和苗期)大麻对盐胁迫的敏感性也有一定差异。
大麻; 盐碱胁迫; 种子萌发; 幼苗生长
盐胁迫是危害当今全球农业区域的非生物因素之一,对植物生长和农作物产量有显著影响。目前,全球近20%的陆地面积以及超过50%的农业灌溉土地正受到盐胁迫的危害[1],且有日趋加重的趋势,因此,研究盐碱胁迫对植物的影响以及植物的适应机制具有重要意义。近年来,国内外学者逐渐重视对植物盐碱耐受性的研究,并取得了一定的成果[2-5]。但目前研究者多用NaCl模拟盐胁迫,而有关NaHCO3和Na2CO3等碱性盐胁迫的相关研究报道尚不多见。在碱性盐胁迫环境中,植物受盐离子和土壤高pH值双重胁迫,并且,盐、碱胁迫具有不同的作用机制[6];碱性盐对植物的伤害作用通常比中性盐更复杂,伤害程度和生态破坏力也更大[7]。
大麻(CannabissativaLinn.)为一年生草本植物,因其生长适应性强且抗逆性出色而成为在盐碱地区推广的作物之一。中国现代农业产业技术体系麻类体系“十二五”重点任务之一是实现麻类生产向盐碱地及山坡地转移,但与其他作物相比,目前对大麻耐盐性的相关研究不多,特别缺乏其对不同盐碱胁迫适应性的研究,阻碍了大麻在盐碱地的推广种植。
作者采用萌发期沙培与苗期盆栽相结合的方法,研究了不同浓度中性盐NaCl和Na2SO4以及碱性盐Na2CO3和NaHCO3对大麻种子萌发及幼苗生长的影响,以期为大麻耐盐碱性的研究提供基础研究数据。
1 材料和方法
1.1 材料
供试工业大麻品种‘云麻5号’(‘Yunma 5’)由云南省农业科学院提供;供试中性盐NaCl和Na2SO4、碱性盐Na2CO3和NaHCO3均为分析纯。实验于2014年在云南大学农学院试验基地(带顶棚)进行。
1.2 方法
1.2.1 种子萌发及胁迫处理 选用NaCl、Na2SO4、Na2CO3和NaHCO34种钠盐,分别用蒸馏水配制成浓度0(CK)、50、100、150、200、250和300 mmol·L-1的处理液。在直径90 mm培养皿中装入等体积的经120 ℃高温灭菌40 min的细沙(沙层厚约0.5 cm),分别均匀摆放大小一致的种子30粒,分别加入14 mL上述不同浓度处理液,置于温度25 ℃、光照时间12 h·d-1、光照度4 000 lx的智能人工气候培养箱(宁波莱福科技有限公司生产)中培养,每处理均设3次重复。萌发期间适量补充各处理液以保持湿润环境及维持处理液浓度。种子萌发3 d后统计发芽势(germination energy,GE),萌发7 d后统计萌发率(germination percentage,GP),并计算萌发指数(germination index,GI)和活力指数(vigor index,VI),同时用直尺(精度1 mm)测量胚根和胚轴长度。
1.2.2 幼苗盆栽及胁迫处理 选用NaCl、Na2SO4、Na2CO3和NaHCO34种钠盐,分别用蒸馏水配制成浓度为0(CK)、100、200和300 mmol·L-1的处理液。为防止根系腐烂,将43 g福美双拌入120 kg菜园土中;在高16 cm、直径19 cm的栽培盆中分别装入3 kg上述菜园土,将土表平整后均匀播种并覆土约0.5 cm,一次性浇透水;每天观察并根据土壤湿度进行浇水,且每隔1周移动栽培盆的位置,以保证各盆光照均匀。出苗1周后间苗,3 d后每盆定植长势基本一致的幼苗12株;待幼苗长至高约20 cm时,浇入上述各处理液300 mL进行胁迫处理,每4天添加1次处理液,连续6次。每处理设3次重复。
1.2.3 指标测定方法 胁迫处理期间,每8天用卷尺(精度0.1 cm)测量1次每盆幼苗的株高。胁迫结束时(处理25 d),将各盆幼苗的地上部和地下部分开,用卷尺(精度0.1 cm)测量根长,并用电子天平(上海越平科学仪器有限公司,精度1 mg)分别称量地上部和地下部的鲜质量;然后分别置于105 ℃杀青30 min,65 ℃烘干至恒质量,分别称量各盆幼苗地上部和地下部的干质量,并计算根冠比。株高以及地上部和地下部的鲜质量和干质量均按盆称量,根长按单株测量,结果均以平均值计。
在胁迫结束时(处理25 d),每处理均混合采集大小基本一致的叶片,参照文献[8]中的浸泡法、使用DDS-306型电导率仪(成都方舟开发公司)测定浸提液电导率(R1);然后煮沸30 min,冷却至室温后再次测定电导率(R2),据此计算各处理的相对电导率。
在胁迫结束时(处理25 d),每盆随机取样5株,以幼苗从上至下第3片叶为样叶,分别用TYS-A 叶绿素速测仪(浙江托普仪器有限公司)测定叶片的叶绿素含量(以SPAD值计)。
1.3 数据计算及处理
按下列公式计算种子的发芽势(GE)、萌发率(GP)、萌发指数(GI)和活力指数(VI)以及幼苗根冠比和叶片相对电导率:GE=(第3天发芽种子数/供试种子数)×100%;GP=(发芽种子数/供试种子数)×100%;GI=∑Gt/Dt(式中,Gt为萌发7 d时的发芽种子数;Dt为发芽时间,即7 d);VI=GI×S(式中,S为萌发7 d时发芽种子的胚根与胚轴长度之和);幼苗根冠比=地下部的干质量/地上部的干质量;叶片相对电导率=(R1/R2)×100%。
采用EXCEL 2010软件进行列表、统计和作图,运用SPSS 19.0统计分析软件进行ANOVA方差分析,采用Duncan’s新复极差法进行多重比较。
2 结果和分析
2.1 不同盐碱胁迫对大麻种子萌发的影响
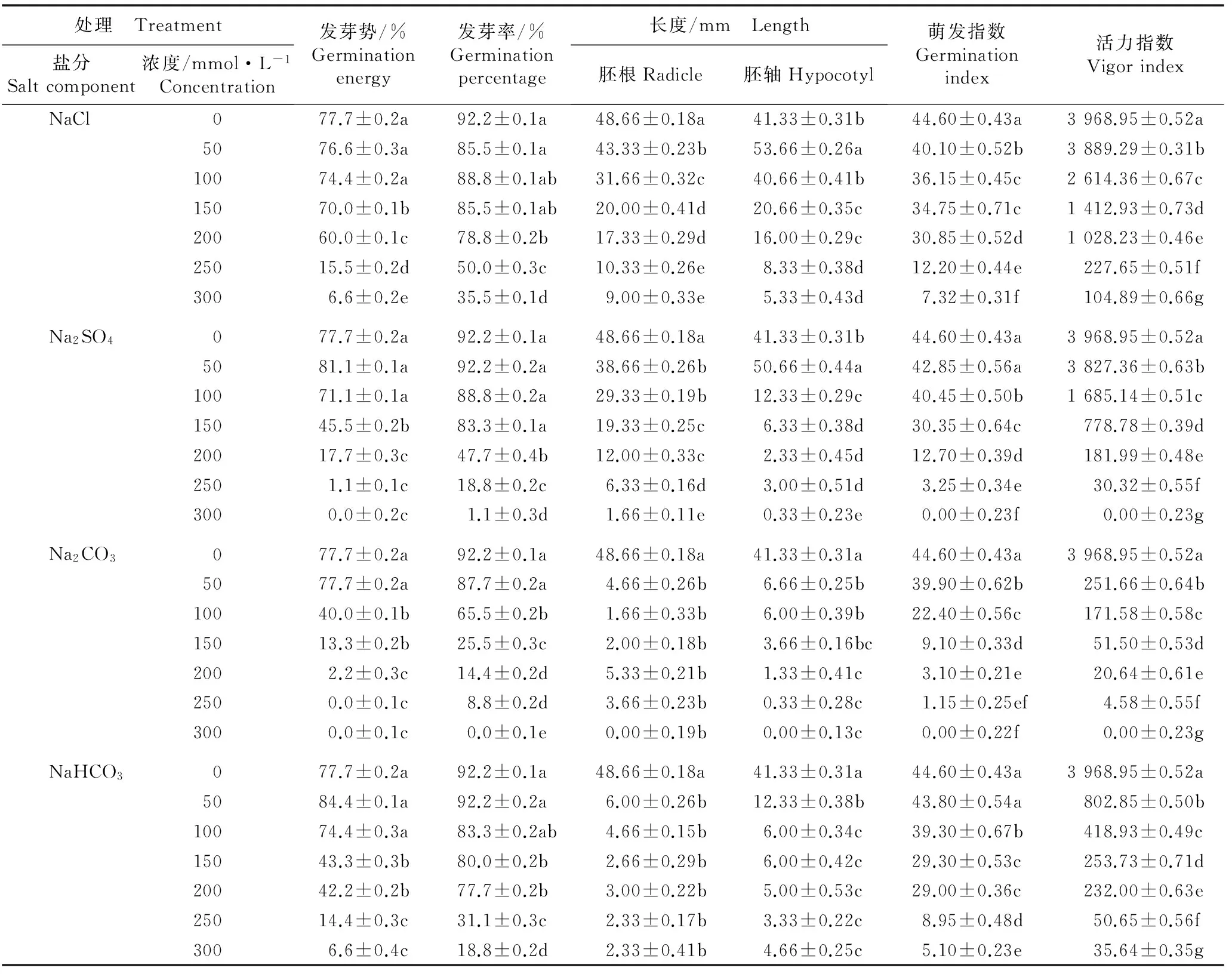
不同浓度NaCl、Na2SO4、Na2CO3和NaHCO3胁迫处理对大麻种子萌发的影响见表1。结果显示:随各盐分浓度的提高,大麻种子的各项萌发指标以及胚根和胚轴长度总体上均呈逐渐下降的趋势。
由表1可见: 仅50 mmol·L-1NaCl、 Na2SO4、 Na2CO3和NaHCO3处理组以及100 mmol·L-1NaCl、Na2SO4和NaHCO3处理组的种子发芽势和发芽率总体上与对照差异不显著(P>0.05);而100 mmol·L-1Na2CO3处理组以及150~300 mmol·L-1NaCl、 Na2SO4、Na2CO3和NaHCO3处理组的种子发芽势和发芽率均显著低于对照(P<0.05)。
对胚根长度的比较结果显示:在不同浓度 NaCl、Na2SO4、Na2CO3和NaHCO3胁迫条件下,种子的胚根长度均小于对照,且差异达显著水平;相比之下,不同浓度Na2CO3和NaHCO3处理对种子胚根生长的抑制作用最大,50 mmol·L-1Na2CO3和NaHCO3处理组的胚根长度分别仅为对照的9.58%和12.33%,并随Na2CO3和NaHCO3浓度提高(100~300 mmol·L-1)呈现一定的波动变化,但各处理组间无显著差异。对胚轴长度的比较结果显示:低浓度(50 mmol·L-1)NaCl和Na2SO4处理对胚轴生长有一定的促进作用,表现为胚轴长度显著大于对照;但50 mmol·L-1Na2CO3和NaHCO3处理则抑制胚轴生长,表现为胚轴长度显著小于对照。在150~300 mmol·L-1NaCl、 Na2SO4、Na2CO3和NaHCO3胁迫条件下,种子的胚轴长度均小于对照且与对照的差异达显著水平。
由表1还可见:仅在50 mmol·L-1Na2SO4和NaHCO3胁迫条件下种子萌发指数与对照无显著差异,其他处理组的种子萌发指数均显著小于对照。随4种盐分浓度的增加,种子的活力指数均逐渐减小,且各处理组与对照组间以及各处理组间均有显著差异。
总体上看,不同盐分对大麻种子萌发具有不同的影响效应,其中,Na2CO3的胁迫效应明显强于NaCl、Na2SO4和NaHCO3。
2.2 不同盐碱胁迫对大麻幼苗生长以及叶片的叶绿素含量和相对电导率的影响
不同浓度NaCl、Na2SO4、Na2CO3和NaHCO3胁迫处理不同时间对大麻幼苗株高的影响见图1;不同浓度NaCl、Na2SO4、Na2CO3和NaHCO3胁迫处理对大麻幼苗生长指标、叶片叶绿素含量和叶片相对电导率的影响见表2。
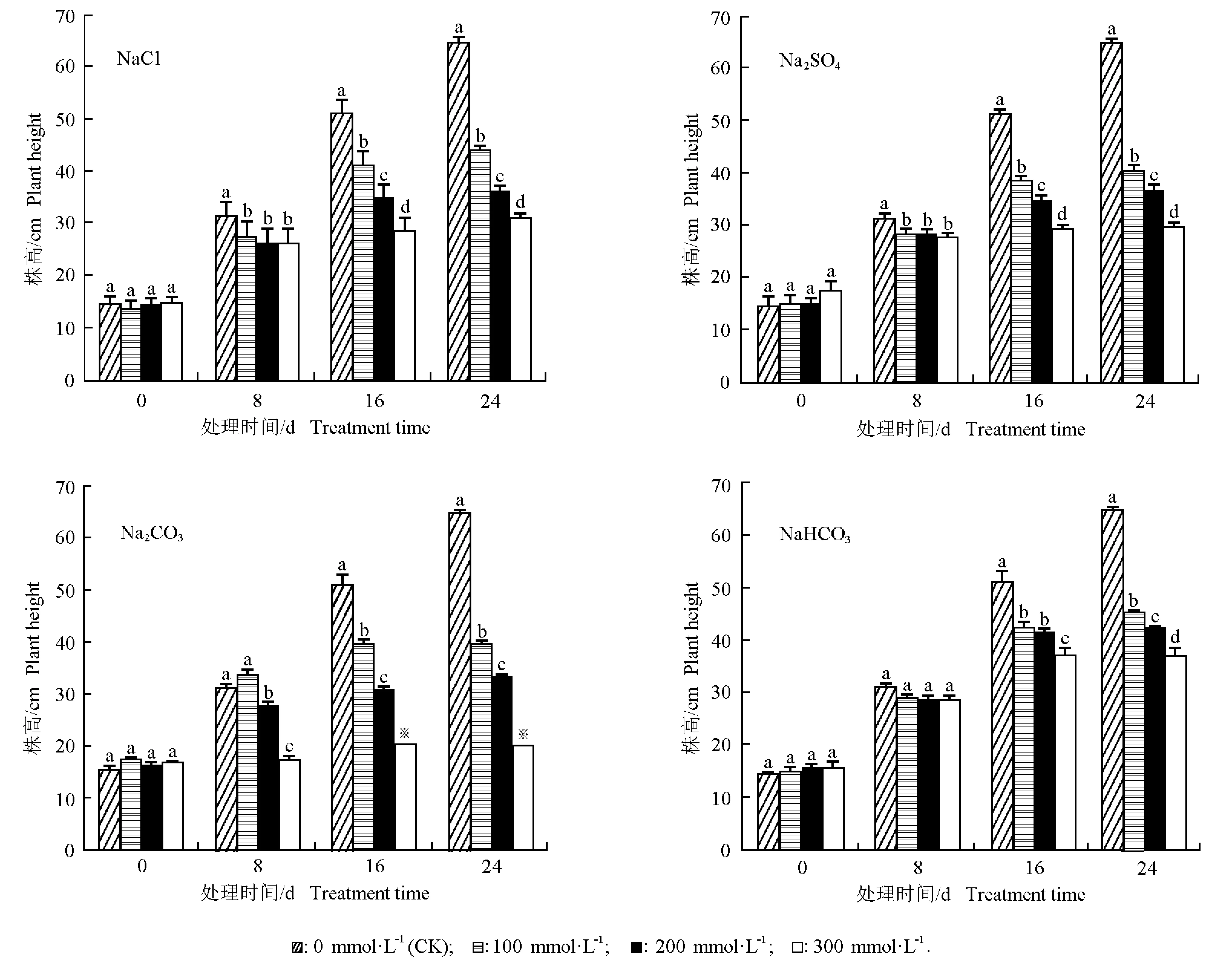
2.2.1 对幼苗株高的影响 由图1可见:随胁迫时间的延长,对照组的幼苗株高呈逐渐增加的趋势,且各时间段株高的增幅均较大;各盐分处理组的幼苗株高总体上也呈逐渐增加的趋势,但增幅明显小于对照。在处理时间相同的条件下,不同盐分处理组的幼苗株高随盐分浓度增加均呈逐渐降低的趋势,其中,在处理的16和24 d各盐分的不同浓度处理组间幼苗株高均有显著差异。


处理 Treatment盐分Saltcomponent浓度/mmol·L-1Concentration发芽势/%Germinationenergy发芽率/%Germinationpercentage长度/mm Length胚根Radicle胚轴Hypocotyl萌发指数Germinationindex活力指数Vigorindex NaCl077.7±0.2a92.2±0.1a48.66±0.18a41.33±0.31b44.60±0.43a3968.95±0.52a5076.6±0.3a85.5±0.1a43.33±0.23b53.66±0.26a40.10±0.52b3889.29±0.31b10074.4±0.2a88.8±0.1ab31.66±0.32c40.66±0.41b36.15±0.45c2614.36±0.67c15070.0±0.1b85.5±0.1ab20.00±0.41d20.66±0.35c34.75±0.71c1412.93±0.73d20060.0±0.1c78.8±0.2b17.33±0.29d16.00±0.29c30.85±0.52d1028.23±0.46e25015.5±0.2d50.0±0.3c10.33±0.26e8.33±0.38d12.20±0.44e227.65±0.51f3006.6±0.2e35.5±0.1d9.00±0.33e5.33±0.43d7.32±0.31f104.89±0.66g Na2SO4077.7±0.2a92.2±0.1a48.66±0.18a41.33±0.31b44.60±0.43a3968.95±0.52a5081.1±0.1a92.2±0.2a38.66±0.26b50.66±0.44a42.85±0.56a3827.36±0.63b10071.1±0.1a88.8±0.2a29.33±0.19b12.33±0.29c40.45±0.50b1685.14±0.51c15045.5±0.2b83.3±0.1a19.33±0.25c6.33±0.38d30.35±0.64c778.78±0.39d20017.7±0.3c47.7±0.4b12.00±0.33c2.33±0.45d12.70±0.39d181.99±0.48e2501.1±0.1c18.8±0.2c6.33±0.16d3.00±0.51d3.25±0.34e30.32±0.55f3000.0±0.2c1.1±0.3d1.66±0.11e0.33±0.23e0.00±0.23f0.00±0.23g Na2CO3077.7±0.2a92.2±0.1a48.66±0.18a41.33±0.31a44.60±0.43a3968.95±0.52a5077.7±0.2a87.7±0.2a4.66±0.26b6.66±0.25b39.90±0.62b251.66±0.64b10040.0±0.1b65.5±0.2b1.66±0.33b6.00±0.39b22.40±0.56c171.58±0.58c15013.3±0.2b25.5±0.3c2.00±0.18b3.66±0.16bc9.10±0.33d51.50±0.53d2002.2±0.3c14.4±0.2d5.33±0.21b1.33±0.41c3.10±0.21e20.64±0.61e2500.0±0.1c8.8±0.2d3.66±0.23b0.33±0.28c1.15±0.25ef4.58±0.55f3000.0±0.1c0.0±0.1e0.00±0.19b0.00±0.13c0.00±0.22f0.00±0.23g NaHCO3077.7±0.2a92.2±0.1a48.66±0.18a41.33±0.31a44.60±0.43a3968.95±0.52a5084.4±0.1a92.2±0.2a6.00±0.26b12.33±0.38b43.80±0.54a802.85±0.50b10074.4±0.3a83.3±0.2ab4.66±0.15b6.00±0.34c39.30±0.67b418.93±0.49c15043.3±0.3b80.0±0.2b2.66±0.29b6.00±0.42c29.30±0.53c253.73±0.71d20042.2±0.2b77.7±0.2b3.00±0.22b5.00±0.53c29.00±0.36c232.00±0.63e25014.4±0.3c31.1±0.3c2.33±0.17b3.33±0.22c8.95±0.48d50.65±0.56f3006.6±0.4c18.8±0.2d2.33±0.41b4.66±0.25c5.10±0.23e35.64±0.35g
1)同列中不同的小写字母表示同一盐分不同浓度处理间差异显著(P=0.05) Different small letters in the same column indicate the significant difference among different concentration treatments of the same salt component (P=0.05).
由图1还可以看出:在不同浓度NaCl和Na2SO4胁迫条件下,在处理8、16和24 d时各处理组的幼苗株高均小于对照,且差异显著。在不同浓度Na2CO3胁迫条件下,仅100 mmol·L-1Na2CO3处理8 d时幼苗株高大于对照但差异不显著,其余处理组在不同时间段的幼苗株高均显著低于对照。在不同浓度NaHCO3胁迫条件下,各处理组的幼苗株高在处理8 d时与对照无显著差异,而在处理16和24 d时均显著低于对照。
综合比较结果显示:在处理前期(8 d),不同浓度NaCl和Na2SO4胁迫对大麻幼苗高生长有显著抑制作用,不同浓度NaHCO3胁迫则对大麻幼苗高生长无显著抑制作用,而较低浓度(100 mmol·L-1)Na2CO3处理对幼苗高生长有一定促进作用,中、高浓度(200和300 mmol·L-1)Na2CO3胁迫则可显著抑制幼苗高生长;在处理的中、后期(16和24 d),不同浓度的4种盐分胁迫处理对幼苗的高生长均有显著的抑制作用,其中,300 mmol·L-1Na2CO3处理对幼苗的伤害最大,导致在处理16 d时供试幼苗死亡。总体上看,中、高浓度Na2CO3胁迫处理对大麻幼苗高生长的抑制效应最大。
不同小写字母表示差异显著(P=0.05) Different small letters indicate the significant difference (P=0.05). ※: 植株死亡The plant died.
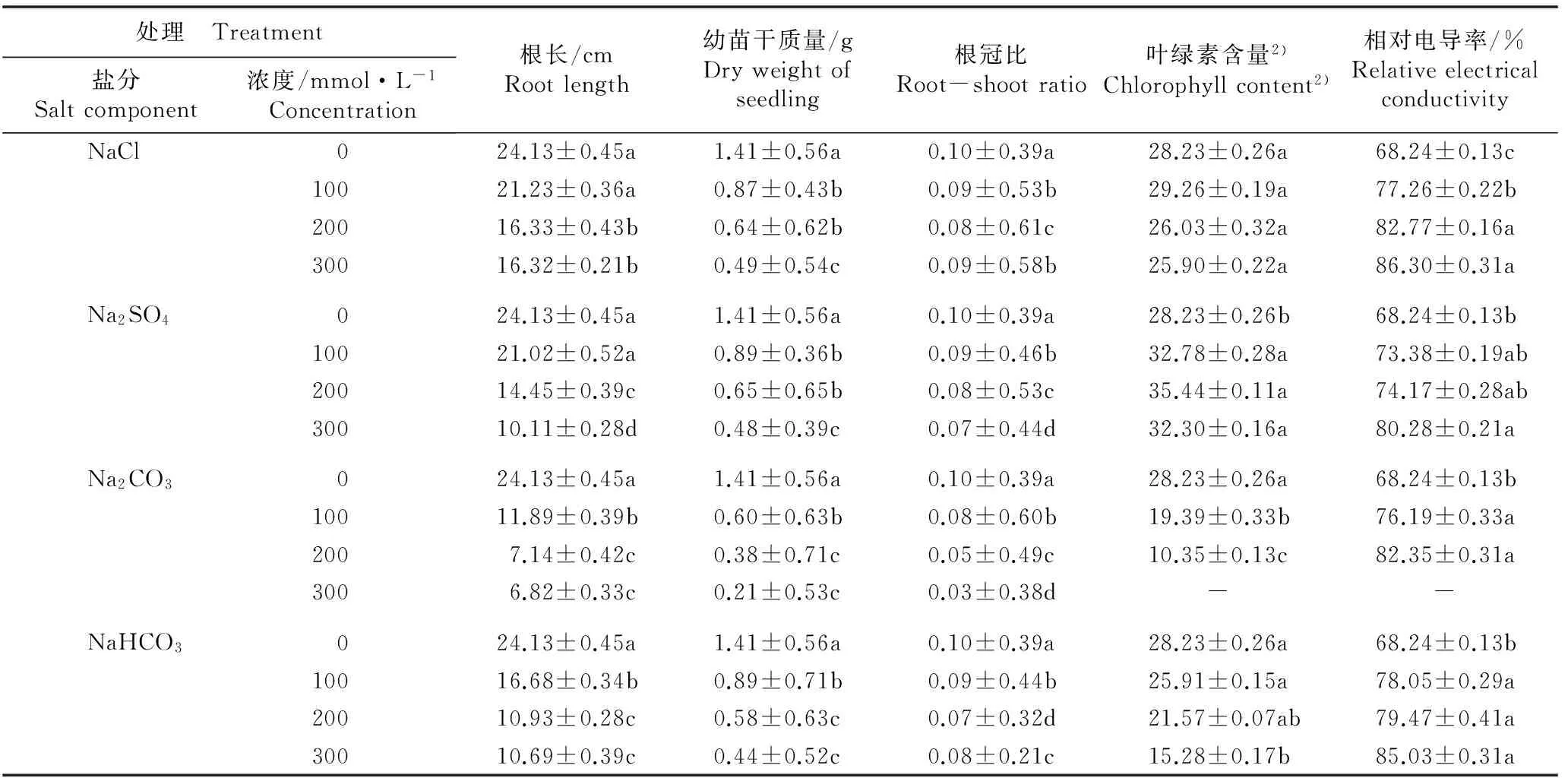
2.2.2 对幼苗根长的影响 实验结果(表2)表明:随NaCl、Na2SO4、Na2CO3和NaHCO3浓度的升高,大麻幼苗的根长均呈逐渐减小的趋势且均小于对照,其中,仅100 mmol·L-1NaCl和Na2SO4处理组幼苗根长与对照差异不显著,其他处理组的幼苗根长均与对照差异显著。此外,相比较而言,不同浓度Na2CO3处理组幼苗根长的降幅最大。
2.2.3 对幼苗干质量及根冠比的影响 实验结果(表2)表明:随NaCl、Na2SO4、Na2CO3和NaHCO3浓度的升高,大麻幼苗的干质量均呈逐渐减小的趋势,且均显著小于对照。不同浓度Na2SO4和Na2CO3处理组幼苗的根冠比随浓度升高呈逐渐减小的趋势,而不同浓度NaCl和NaHCO3处理组幼苗的根冠比随浓度升高则呈逐渐减小最后略增大的趋势,但各盐分的不同浓度处理组的幼苗根冠比均显著小于对照。通过比较可见,不同浓度Na2CO3处理组的幼苗干质量及根冠比降幅最大。
2.2.4 对叶片叶绿素含量的影响 实验结果(表2)表明:不同浓度的4种盐分胁迫处理对大麻幼苗叶片的叶绿素含量具有不同的影响效应。不同浓度NaCl处理组的叶片叶绿素含量(SPAD值)略高于或低于对照,但均与对照无显著差异。不同浓度Na2SO4处理组的SPAD值均高于对照,且与对照差异显著;其中200 mmol·L-1Na2SO4处理组的SPAD值最高,较对照增加了25.54%。随Na2CO3和NaHCO3浓度的升高,叶片SPAD值均呈逐渐减小的趋势,但二者的影响效应有一定差异;100和200 mmol·L-1Na2CO3处理组的叶片SPAD值均显著低于对照且这2个处理组间也有显著差异(300 mmol·L-1Na2CO3处理组植株死亡,无SPAD测定数据);在不同浓度NaHCO3处理组中,仅300 mmol·L-1NaHCO3处理组的叶片SPAD值显著低于对照,而100和200 mmol·L-1NaHCO3处理组的叶片SPAD值则与对照无显著差异。通过比较可见,Na2CO3胁迫对大麻叶片叶绿素含量的影响最明显。


处理 Treatment盐分Saltcomponent浓度/mmol·L-1Concentration根长/cmRootlength幼苗干质量/gDryweightofseedling根冠比Root-shootratio叶绿素含量2)Chlorophyllcontent2)相对电导率/%Relativeelectricalconductivity NaCl024.13±0.45a1.41±0.56a0.10±0.39a28.23±0.26a68.24±0.13c10021.23±0.36a0.87±0.43b0.09±0.53b29.26±0.19a77.26±0.22b20016.33±0.43b0.64±0.62b0.08±0.61c26.03±0.32a82.77±0.16a30016.32±0.21b0.49±0.54c0.09±0.58b25.90±0.22a86.30±0.31a Na2SO4024.13±0.45a1.41±0.56a0.10±0.39a28.23±0.26b68.24±0.13b10021.02±0.52a0.89±0.36b0.09±0.46b32.78±0.28a73.38±0.19ab20014.45±0.39c0.65±0.65b0.08±0.53c35.44±0.11a74.17±0.28ab30010.11±0.28d0.48±0.39c0.07±0.44d32.30±0.16a80.28±0.21a Na2CO3024.13±0.45a1.41±0.56a0.10±0.39a28.23±0.26a68.24±0.13b10011.89±0.39b0.60±0.63b0.08±0.60b19.39±0.33b76.19±0.33a2007.14±0.42c0.38±0.71c0.05±0.49c10.35±0.13c82.35±0.31a3006.82±0.33c0.21±0.53c0.03±0.38d-- NaHCO3024.13±0.45a1.41±0.56a0.10±0.39a28.23±0.26a68.24±0.13b10016.68±0.34b0.89±0.71b0.09±0.44b25.91±0.15a78.05±0.29a20010.93±0.28c0.58±0.63c0.07±0.32d21.57±0.07ab79.47±0.41a30010.69±0.39c0.44±0.52c0.08±0.21c15.28±0.17b85.03±0.31a
1)同列中不同的小写字母表示同一盐分不同浓度处理间差异显著(P=0.05) Different small letters in the same column indicate the significant difference among different concentration treatments of the same salt component (P=0.05). “-”: 植株死亡The plant died.
2)叶绿素含量用SPAD值表示 The chlorophyll content is measured by SPAD value.
2.2.5 对叶片相对电导率的影响 实验结果(表2)表明:随NaCl、Na2SO4、Na2CO3和NaHCO3浓度的升高,大麻幼苗叶片的相对电导率均呈逐渐增加的趋势。除300 mmol·L-1Na2CO3处理组植株死亡导致无测定数据外,不同浓度NaCl、Na2CO3和NaHCO3处理组叶片的相对电导率均显著高于对照;而100和200 mmol·L-1Na2SO4处理组的叶片相对电导率虽高于对照但与对照无显著差异,仅300 mmol·L-1Na2SO4处理组的叶片相对电导率显著高于对照。表明Na2SO4胁迫处理对大麻叶片质膜透性的影响最小。
3 讨论和结论
盐胁迫对植物种子萌发具有明显的抑制作用,而且随浓度提高,其抑制程度逐渐增大[9-10];但也有研究结果显示,低浓度盐处理可促进部分植物种子的萌发[11-15]。本研究中,在50 mmol·L-1NaCl和Na2SO4胁迫条件下大麻种子的胚轴长度显著高于对照,反映出大麻种子萌发对低浓度中性盐胁迫有一定的适应性。不同类型的盐分对大麻种子萌发具有不同的影响效应,其中,碱性盐胁迫对大麻种子萌发的影响效应大于中性盐,这可能与碱性盐胁迫具有盐离子及高pH 值的双重影响[16]有关;不同浓度Na2CO3处理对大麻种子的萌发指数与活力指数有显著影响,也部分验证了这一结果,且与颜宏等[17]和陈冠宜等[18]对碱地肤〔Kochiascopariavar.sieversiana(Pall.) Ulbr. ex Asch. et Graebn.〕和盐地碱蓬〔Suaedasalsa(Linn.) Pall.〕的相关研究结果一致。另外,作者在实验过程中以一定浓度单盐溶液代替蒸馏水为发芽种子提供水分,可能引发盐分积累而导致各处理的实际盐浓度高于预设浓度,对种子萌发的抑制作用也更大,这也可能是本研究中大麻萌芽期对盐胁迫较敏感的原因之一。
盐胁迫不仅影响大麻的种子萌发,对其幼苗生长也产生一定的影响,但不同类型及不同浓度盐分对大麻幼苗生长的影响效应有差异。研究结果表明:大麻幼苗对较低浓度(100 mmol·L-1)盐胁迫有一定的适应性,幼苗能保持一定的生长量;但在100 mmol·L-1Na2CO3胁迫条件下大麻幼苗的多项生长指标均显著降低,并在处理16 d时基本停止生长;而用高浓度(300 mmol·L-1)Na2CO3处理16 d时则导致幼苗死亡,说明在供试的4种盐分中Na2CO3对大麻幼苗生长的抑制作用最大。在高浓度(300 mmol·L-1)NaCl、Na2SO4和NaHCO3胁迫条件下大麻幼苗的各项生长指标虽然也较对照显著降低,但幼苗仍能存活,说明NaCl、Na2SO4和NaHCO3这3种盐分对大麻幼苗生长的危害作用小于Na2CO3。在实验过程中观察到:在不同盐分胁迫条件下,随浓度增加各处理组均出现幼苗根系越来越细的现象,且在高浓度胁迫条件下还出现根系腐烂的现象,其中在高浓度Na2CO3胁迫条件下根系腐烂程度最为严重;另外,4种盐分处理对大麻幼苗根冠比也均有显著影响,说明盐、碱胁迫对大麻根系的生长也有一定的抑制作用,其中碱性盐Na2CO3的抑制效应更强。在不同浓度中性盐NaCl和Na2SO4胁迫条件下,大麻幼苗叶绿素含量与对照无显著性差异甚至显著高于对照,也表明大麻品种‘云麻5号’幼苗对中性盐胁迫有一定的适应性。
对叶片相对电导率的测定结果表明:中性盐Na2SO4胁迫对细胞膜渗透性的影响最小,而其他盐胁迫条件下叶片相对电导率较对照显著升高,说明细胞膜渗透性增大、细胞受到较大的伤害。这与苗莉云等[19]在对盐地碱蓬相关研究中获得的“Na2SO4伤害作用弱于NaCl”的研究结果相一致。孙小芳等[20]认为,在盐胁迫过程中起决定性盐害作用的是Na+;但在本研究中,高浓度Cl-和SO42-对大麻种子萌发产生中等程度盐害,而CO32-则在低浓度条件下就可产生中等程度盐害,因而,盐胁迫对大麻的伤害作用取决于阴离子的类型和浓度,这与吴旭昌[21]对红麻(HibiscuscannabinusLinn.)的研究结果基本一致。
从上述的研究结果看,在浓度相同时,不同类型的盐分对大麻种子萌发和幼苗生长的危害程度不同,其中碱性盐Na2CO3的危害最大;而同一盐分因浓度不同对大麻种子萌发和幼苗生长的危害程度也有一定差异。在高浓度(300 mmol·L-1)盐胁迫条件下,Na2CO3处理导致大麻种子不萌发和幼苗死亡,但经同浓度的其他3种盐处理后大麻种子仍具有一定的萌发能力且幼苗也有一定的生长量,因而,相同浓度的碱性盐对植物生长的抑制作用比中性盐更明显,这与刘明久等[22]的研究结果相一致。300 mmol·L-1Na2SO4处理导致大麻种子的萌发指数和活力指数为0,但同样胁迫条件下幼苗仍能生长;300 mmol·L-1NaHCO3处理导致大麻种子的发芽率在20%以下,但苗期幼苗的存活率达到90%以上(另文发表),表明大麻萌芽期对盐胁迫的敏感性更强,这也可能与苗期使用的栽培基质有一定的缓冲作用有关。
综合分析结果表明:相同浓度的不同盐分以及同一盐分不同的胁迫水平对大麻种子萌发和幼苗生长的危害程度均有差异,而且,大麻的不同发育阶段对同一盐胁迫条件也具有不同的敏感性,说明大麻对盐胁迫的耐性是一个复杂的生理生化过程,且受多种因素的影响,因而,在对大麻耐盐性进行评价时要综合考虑各种因素的作用。
[1] YAN S P, TANG Z C, SU W A, et al. Proteomic analysis of salt stress-responsiveproteinsinriceroot[J]. Proteomics, 2005, 5: 235-244.
[2] 杨少辉, 季 静, 王 罡, 等. 盐胁迫对植物影响的研究进展[J]. 分子植物育种, 2006, 4(3S): 139-142.
[3] KATSCHNIG D, BROEKMAN R, ROZEMA J. Salt tolerance in the halophyteSalicorniadolichostachyaMoss: growth, morphology and physiology[J]. Environmental and Experimental Botany, 2013, 92: 32-42.
[4] ADOLFVI,JACOBSENS-E,SHABALAS.Salttolerance mechanisms in quinoa (ChenopodiumquinoaWilld.)[J]. Environmental and Experimental Botany, 2013, 92: 43-54.
[5] JANICKA-RUSSAK M, KABAA K, WDOWIKOWSKA A, et al. Modification of plasma membrane proton pumps in cucumber roots as an adaptation mechanism to salt stress[J]. Journal of Plant Physiology, 2013, 170: 915-922.
[6] 马晶晶, 黄苏珍, 原海燕, 等. NaHCO3胁迫对喜盐鸢尾和马蔺生长及解剖结构的影响[J]. 植物资源与环境学报, 2012, 21(4): 55-61.
[7] 石德成, 殷丽娟. 盐(NaCl)与碱(Na2CO3)对星星草胁迫作用的差异[J]. 植物学报, 1993, 35(2): 144-149.
[8] 陈爱葵, 韩瑞宏, 李东洋, 等. 植物叶片相对电导率测定方法比较研究[J]. 广东教育学院学报, 2010, 30(5): 88-91.
[9] 陈丽珍, 张振文, 宋付平. NaCl胁迫对不同玉米品种种子萌发特性的影响[J]. 安徽农业科学, 2009, 37(25): 11917-11919.
[10] 金美芳, 朱晓清. NaCl胁迫对油菜种子萌发和幼苗生长的影响[J]. 种子, 2009, 28(9): 76-79.
[11] 张鹤山, 刘 洋, 田 宏, 等. 黑麦种子在不同盐分胁迫下萌发特性的研究[J]. 种子, 2009, 28(3): 14-17.
[12] 苑泽宁, 石福臣. 盐胁迫对互花米草种子萌发及胚生长的影响[J]. 云南植物研究, 2008, 30(2): 227-231.
[13] 马小卫, 郭春会, 罗 梦. 核壳、盐和水分胁迫对长柄扁桃种子萌发的影响[J]. 西北林学院学报, 2006, 21(4): 69-72.
[14] 孙红叶, 李 利, 刘国军, 等. 刚毛柽柳种子萌发对盐分与干旱胁迫的响应[J]. 干旱区地理, 2007, 30(3): 414-419.
[15] 张秀玲, 李瑞利, 石福臣. 盐胁迫对罗布麻种子萌发的影响[J]. 南开大学学报: 自然科学版, 2007, 40(4): 13-18.
[16] 王 萍, 殷立娟, 李建东. 中性盐和碱性盐对羊草幼苗胁迫的研究[J]. 草业学报, 1994, 3(2): 37-43.
[17] 颜 宏, 矫 爽, 赵 伟, 等. 不同大小碱地肤种子的萌发耐盐性比较[J]. 草业学报, 2008, 17(2): 26-32.
[18] 陈冠宜, 周美利, 孟国花, 等. NaCl和Na2CO3对盐地碱蓬和小花碱茅幼苗生长的比较研究[J]. 现代农业科技, 2010(22): 260-262.
[19] 苗莉云, 张 鹏. NaCl和Na2SO4胁迫对盐地碱蓬幼苗生理特征的影响[J]. 北方园艺, 2013(3): 67-70.
[20] 孙小芳, 郑青松, 刘友良. NaCl胁迫对棉花种子萌发和幼苗生长的伤害[J]. 植物资源与环境学报, 2000, 9(3): 22-25.
[21] 吴旭昌. 不同盐分对红麻种子发芽的影响[J]. 中国麻作, 1982(13): 13-16.
[22] 刘明久, 李丁涛. 盐胁迫对红麻种子萌发及幼苗生长的影响[J]. 河南科技学院学报, 2011, 39(4): 9-11.
(责任编辑: 惠 红)
Effects of different salt-alkaline stresses on seed germination and seedling growth ofCannabissativa
HU Huaran, LIU Hao, DENG Gang, DU Guanghui, XU Yun, LIU Feihu①
(School of Agriculture, Yunnan University, Kunming 650091, China),
J.PlantResour. &Environ., 2015, 24(4): 61-68
By methods of sand culture and pot culture, effects of stresses of NaCl, Na2SO4, Na2CO3and NaHCO3with different concentrations on seed germination and seedling growth ofCannabissativa‘Yunma 5’ were studied. The resultsshowthatwhenstressedbyfoursaltswith concentrations of 0 (CK), 50, 100, 150, 200, 250 and 300 mmol·L-1for 7 d, respectively, germination rate, germination energy, germination index and vigor index, and lengths of radicle and hypocotyl of seeds all are gradually decreasing as rising of salt concentration, and except hypocotyl length in treating groups of NaCl and Na2SO4with concentration of 50 mmol·L-1is significantly higher than that of the control, all indexes of seeds in all treating groups are lower than those of the control, in which, there are significant differences (P<0.05) in all indexes of seeds under 100-300 mmol·L-1salt stresses with the control. Stressed by four salts with concentrations of 0 (CK), 100, 200 and 300 mmol·L-1, respectively, seedling height increases gradually as prolonging of stress time (0-24 d), but its increasing range in all treating groups is obviously smaller than that of the control. As rising of salt concentrations, dry weight, height and root length of seedling decrease gradually and are lower than those of the control;relative electrical conductivity of leaf increases gradually and is higher than that of the control, in which, there is no significant difference in relative electrical conductivity only in treating groups of 100 and 200 mmol·L-1Na2SO4with the control; and root-shoot ratio of seedling in all treating groups is significantly smaller than that of the control. There are various effects of different salt stresses on chlorophyll content (SPAD value) in seedling leaf, in which, there is no significant difference in SPAD value between all NaCl treating groups and the control, and SPAD value in all Na2SO4treating groups is significantly higher than that of the control, while, as rising of concentrations of Na2CO3and NaHCO3, SPAD value reduces gradually and is lower than that of the control. Moreover, seedlings die under stress of 300 mmol·L-1Na2CO3. The result of comprehensive analysis indicates that stress effect of Na2CO3on seed germination and seedling growth ofC.sativais obviously stronger than that of other three salts; resistance ofC.sativato salt stress varies with salt type and salt concentration, and during different development periods (seed germination period and seedling period), there is a certain difference in sensitivity ofC.sativato salt stress.
CannabissativaLinn.; salt-alkaline stress; seed germination; seedling growth
2015-04-07
国家自然科学基金资助项目(31371678); 国家麻类产业技术体系建设专项资金资助项目(CARS-19)
胡华冉(1988—),女,山东济宁人,博士研究生,主要从事大麻耐盐性研究。
①通信作者 E-mail: dmzpynu@126.com
Q945.78; S563.3
A
1674-7895(2015)04-0061-08
10.3969/j.issn.1674-7895.2015.04.08

