经低温锻炼后荷花不同品种对低温胁迫的生理响应差异分析
李 欣, 江 君, 徐 君, 李静会, 姜红卫
(苏州市农业科学院, 江苏 苏州 215155)
经低温锻炼后荷花不同品种对低温胁迫的生理响应差异分析
李 欣, 江 君, 徐 君, 李静会, 姜红卫①
(苏州市农业科学院, 江苏 苏州 215155)
以荷花(NelumbonuciferaGaertn.)品种‘太湖红莲’(‘Taihu Honglian’)和‘荷塘情深’(‘Hetang Qingshen’)为实验材料,以MDA含量、相对电导率、脯氨酸含量、可溶性糖含量、SOD活性和POD活性为指标,对经过5 ℃低温锻炼10 h后2个品种地下茎对0 ℃低温胁迫(0、2、4、6、8和10 h)的生理响应差异进行了分析,并比较了低温锻炼对2个荷花品种抗寒性的影响。结果表明:在低温胁迫条件下,随低温胁迫时间的延长(0~10 h),经低温锻炼的荷花品种‘太湖红莲’和‘荷塘情深’地下茎的MDA含量和相对电导率总体上呈逐渐升高的变化趋势,可溶性糖含量均呈“升—降—升”的变化趋势,SOD活性基本呈“升—降—升—降”的变化趋势,而POD活性则呈先上升后微幅波动的变化趋势;二者的脯氨酸含量变化趋势有一定差异,其中,前者的脯氨酸含量逐渐上升,而后者的脯氨酸含量则先升后降。经低温锻炼后,在低温胁迫条件下2个荷花品种的6项生理指标均与对照组(未进行低温锻炼)有一定差异;其中,品种‘太湖红莲’地下茎的MDA含量和相对电导率在低温胁迫的4~10 h均显著低于对照组,品种‘荷塘情深’地下茎的相对电导率在低温胁迫的2~8 h显著低于对照组,但其MDA含量则与对照组无显著差异;2个品种地下茎的脯氨酸含量和可溶性糖含量总体上显著高于对照组,而二者的SOD活性和POD活性也总体上高于对照组。综合分析结果显示:低温锻炼有助于减轻低温胁迫对荷花地下茎膜系统的伤害、增加细胞内渗透调节物质的含量、提高抗氧化酶活性,在一定程度上提高了荷花的抗寒性;经低温锻炼后品种‘太湖红莲’抗寒性的增幅大于品种‘荷塘情深’。
荷花; 低温锻炼; 抗寒性; 膜系统; 渗透调节物质; 抗氧化酶活性
荷花(NelumbonuciferaGaertn.)又名莲、水芙蓉,为多年生草本水生花卉,其叶片碧绿挺拔、花型花色多变且花香四溢,盛开于炎热的夏季,是中国十大名花中惟一的水生花卉;该种在水生植物群落中处于光照竞争优势地位,可广泛栽植于湿地中。荷花耐高温但不耐低温,生长发育的适宜温度为22 ℃~32 ℃,其地下茎对短时间0 ℃环境有一定耐性,但寒冷气候条件可对荷花造成伤害,在很大程度上限制了其推广种植及抗寒品种的选育[1]。近年来,国内外学者对荷花的研究多集中于重金属胁迫和基因表达[2-4]等方面,对荷花耐寒性的研究报道较少;而研究低温胁迫条件下荷花的生理特性变化,对提高荷花的抗寒性及其耐寒品种的选育和推广种植具有重要的意义。
低温锻炼有助于提高植物的抗寒性,是作物耐寒性改良的有效措施之一[5-7]。作者以苏州地区湿地群落中常见的荷花品种‘太湖红莲’(‘Taihu Honglian’)和‘荷塘情深’(‘Hetang Qingshen’)为实验材料,研究经低温锻炼后2个品种在低温胁迫条件下的生理响应,并探讨低温锻炼对其抗寒性提升的机制,以期为通过低温锻炼提高荷花的抗寒性以及在生产实践中采取相应措施减轻低温对荷花的寒害提供依据。
1 材料和方法
1.1 材料
供试的大株型粉色单瓣荷花品种‘太湖红莲’和大株型粉色重瓣荷花品种‘荷塘情深’均种植于苏州市农业科学院水生植物基地,于2013年10月选取生长健壮一致、无病虫害、顶芽完整的地下茎,种植于直径30 cm、高30 cm的不透水陶土盆中,每盆种植2支地下茎;每盆加入2/3陶土盆容量的培养基质,培养基质为田园土和水(体积比1∶1)。
1.2 方法
1.2.1 低温锻炼和低温胁迫方法 将供试的2个品种的地下茎分为2组:一组置于MLR-351H植物培养箱(日本三洋)中,以2 ℃·h-1的降温速率将处理温度逐渐降至5 ℃并保持10 h,对地下茎进行低温锻炼,为低温锻炼组;另一组置于常温(25 ℃)条件下处理同样的时间,为对照组(CK)。然后将低温锻炼组和对照组的地下茎放置于植物培养箱中,分别于0 ℃低温胁迫处理0、2、4、6、8和10 h。每处理3次重复,每重复5支地下茎。分别于低温胁迫处理的各时间段取各处理组的带顶芽地下茎,迅速用去离子水冲洗干净后吸干表面水分,避开顶芽和芽眼取样,切片混匀,用于生理指标的测定。
1.2.2 生理指标测定方法 采用硫代巴比妥酸法[8]260-261测定MDA含量;采用电导法[8]261-263测定相对电导率;采用磺基水杨酸法[8]258-260测定脯氨酸含量;采用蒽酮乙酸乙酯法[8]195-197测定可溶性糖含量;采用氮蓝四唑显色法[8]167-169测定SOD活性;采用愈创木酚比色法[8]164-165测定POD活性。各指标测定均重复3次。
1.3 数据分析
采用EXCEL 2003软件对实验数据进行预处理,并采用IBM SPSS Statistics 21.0分析软件进行实验数据的分析。
2 结果和分析
2.1 经低温锻炼后在低温胁迫条件下荷花地下茎MDA含量及相对电导率的变化
经过5 ℃低温锻炼10 h后,在低温胁迫条件下荷花品种‘太湖红莲’和‘荷塘情深’地下茎的MDA含量和相对电导率的变化分别见表1和表2。
2.1.1 MDA含量的变化 由表1可见:随低温胁迫时间的延长(0~10 h),低温锻炼组和对照组中2个荷花品种地下茎的MDA含量总体上呈逐渐升高的趋势。经低温锻炼后,在连续低温胁迫条件下同一荷花品种地下茎的MDA含量均无显著差异(P>0.05);而未经低温锻炼(对照组)的2个荷花品种地下茎的MDA含量在低温胁迫初期(2 h)显著(P<0.05)高于低温胁迫前(0 h)。经低温锻炼后,品种‘太湖红莲’地下茎的MDA含量在低温胁迫的4~10 h均显著低于对照组,而品种‘荷塘情深’地下茎的MDA含量与同期对照组无显著差异。在低温胁迫的2~10 h,低温锻炼组和对照组中品种‘太湖红莲’地下茎的MDA含量均低于相应处理组的品种‘荷塘情深’。
2.1.2 相对电导率的变化 由表2可见:随低温胁迫时间的延长(0~10 h),低温锻炼组和对照组中2个品种地下茎的相对电导率总体上均呈逐渐升高的趋势,且在不同处理时间相对电导率差异显著;低温胁迫2~10 h,低温锻炼组2个荷花品种地下茎的相对电导率总体上显著低于其对照组;此外,虽然经过相同的低温锻炼过程,但品种‘太湖红莲’地下茎的相对电导率均显著低于品种‘荷塘情深’。
2.2 经低温锻炼后在低温胁迫条件下荷花地下茎脯氨酸含量和可溶性糖含量的变化
经过5 ℃低温锻炼10 h后,在低温胁迫条件下荷花品种‘太湖红莲’和‘荷塘情深’地下茎中脯氨酸含量和可溶性糖含量的变化分别见表3和表4。



品种和处理2)Cultivarandtreatment2)不同胁迫时间地下茎的MDA含量/nmol·g-1 MDAcontentinrhizomeatdifferentstresstimes0h2h4h6h8h10hTH-CK4.74±0.24cB5.92±0.37bA7.04±0.23abA7.35±0.20aA7.57±0.56aA7.81±0.29aATH-T5.84±0.32bA5.97±0.31bA5.56±0.50bB6.21±0.23abB6.45±0.77abB6.92±0.33aBHQ-CK4.56±0.21dB6.38±0.88cA7.16±0.97bcA7.61±0.26abA8.25±0.28abA8.54±0.64aAHQ-T5.57±0.07dA6.00±0.46cdA6.33±0.28bcdAB6.81±1.11abcAB7.40±0.43abAB7.86±0.47aA
1)表中数值为3次重复的平均值Datums in this table are the average of three replications. 同行中不同的小写字母表示差异显著(P<0.05) Different small letters in the same row indicate the significant difference (P<0.05); 同列中不同的大写字母表示差异显著(P<0.05) Different capitals in the same column indicate the significant difference (P<0.05).
2)TH: 品种‘太湖红莲’ Cultivar ‘Taihu Honglian’; HQ: 品种‘荷塘情深’ Cultivar ‘Hetang Qingshen’; CK: 对照,未进行低温锻炼The control, without cold acclimation; T: 于5 ℃低温锻炼10 h Cold acclimation at 5 ℃ for 10 h.


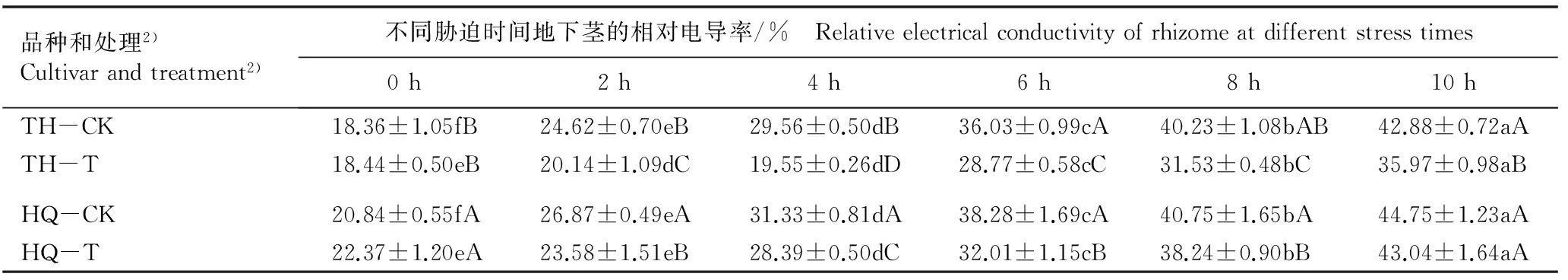
品种和处理2)Cultivarandtreatment2)不同胁迫时间地下茎的相对电导率/% Relativeelectricalconductivityofrhizomeatdifferentstresstimes0h2h4h6h8h10hTH-CK18.36±1.05fB24.62±0.70eB29.56±0.50dB36.03±0.99cA40.23±1.08bAB42.88±0.72aATH-T18.44±0.50eB20.14±1.09dC19.55±0.26dD28.77±0.58cC31.53±0.48bC35.97±0.98aBHQ-CK20.84±0.55fA26.87±0.49eA31.33±0.81dA38.28±1.69cA40.75±1.65bA44.75±1.23aAHQ-T22.37±1.20eA23.58±1.51eB28.39±0.50dC32.01±1.15cB38.24±0.90bB43.04±1.64aA
1)表中数值为3次重复的平均值Datums in this table are the average of three replications. 同行中不同的小写字母表示差异显著(P<0.05) Different small letters in the same row indicate the significant difference (P<0.05); 同列中不同的大写字母表示差异显著(P<0.05) Different capitals in the same column indicate the significant difference (P<0.05).
2)TH: 品种‘太湖红莲’ Cultivar ‘Taihu Honglian’; HQ: 品种‘荷塘情深’ Cultivar ‘Hetang Qingshen’; CK: 对照,未进行低温锻炼The control, without cold acclimation; T: 于5 ℃低温锻炼10 h Cold acclimation at 5 ℃ for 10 h.



品种和处理2)Cultivarandtreatment2)不同胁迫时间地下茎的脯氨酸含量/μg·g-1 Prolinecontentinrhizomeatdifferentstresstimes0h2h4h6h8h10hTH-CK34.60±1.92cC52.11±0.93bC57.76±1.64aC57.11±0.77aC51.64±1.80bC33.39±1.56cDTH-T56.67±3.14eA63.34±1.15dA67.56±1.24cA73.10±0.96bA75.93±0.71aA77.17±0.31aAHQ-CK26.87±1.02eD40.91±1.61cD56.54±2.52aC57.52±1.11aC51.92±0.32bC36.23±0.13dCHQ-T46.73±1.74cB59.10±2.58bB63.21±0.06aB66.38±2.27aB57.64±0.94bB40.96±1.14dB
1)表中数值为3次重复的平均值Datums in this table are the average of three replications. 同行中不同的小写字母表示差异显著(P<0.05) Different small letters in the same row indicate the significant difference (P<0.05); 同列中不同的大写字母表示差异显著(P<0.05) Different capitals in the same column indicate the significant difference (P<0.05).
2)TH: 品种‘太湖红莲’ Cultivar ‘Taihu Honglian’; HQ: 品种‘荷塘情深’ Cultivar ‘Hetang Qingshen’; CK: 对照,未进行低温锻炼The control, without cold acclimation; T: 于5 ℃低温锻炼10 h Cold acclimation at 5 ℃ for 10 h.



品种和处理2)Cultivarandtreatment2)不同胁迫时间地下茎的可溶性糖含量/mg·g-1 Solublesugarcontentinrhizomeatdifferentstresstimes0h2h4h6h8h10hTH-CK9.37±1.04dB11.76±0.24cD15.89±0.20aD14.11±0.96bB13.66±1.17bB13.62±0.36aCTH-T12.77±0.60dA15.85±0.43cA19.22±0.38bA16.83±0.55cA20.19±0.24aA20.77±0.36aAHQ-CK10.10±0.64dB13.06±0.31cC17.06±0.68aC15.88±0.18bA13.70±1.06cB10.88±0.59dDHQ-T11.59±0.43dA14.45±0.14cB18.55±0.18aB16.33±0.39bA18.68±1.20aA18.84±0.26aB
1)表中数值为3次重复的平均值Datums in this table are the average of three replications. 同行中不同的小写字母表示差异显著(P<0.05) Different small letters in the same row indicate the significant difference (P<0.05); 同列中不同的大写字母表示差异显著(P<0.05) Different capitals in the same column indicate the significant difference (P<0.05).
2)TH: 品种‘太湖红莲’ Cultivar ‘Taihu Honglian’; HQ: 品种‘荷塘情深’ Cultivar ‘Hetang Qingshen’; CK: 对照,未进行低温锻炼The control, without cold acclimation; T: 于5 ℃低温锻炼10 h Cold acclimation at 5 ℃ for 10 h.
2.2.1 脯氨酸含量的变化 由表3可见:随低温胁迫时间的延长(0~10 h),经低温锻炼的品种‘太湖红莲’地下茎的脯氨酸含量呈逐渐升高的变化趋势,而对照组的脯氨酸含量则呈先升高后降低的变化趋势,并在胁迫处理4 h时达到最高值;低温锻炼组和对照组中品种‘荷塘情深’地下茎的脯氨酸含量均随低温胁迫时间的延长(0~10 h)呈先升高后降低的变化趋势,且均在胁迫处理6 h达到最高值,但二者的变幅有一定差异。
低温胁迫0~10 h,经低温锻炼的2个品种地下茎的脯氨酸含量均显著高于对照;其中,在低温胁迫10 h时,品种‘太湖红莲’地下茎的脯氨酸含量与对照差异最大(为对照的2.31倍),而品种‘荷塘情深’地下茎的脯氨酸含量仅为对照的1.13倍。在对照组中,低温胁迫0~4 h时品种‘太湖红莲’地下茎的脯氨酸含量高于品种‘荷塘情深’,低温胁迫6~10 h时前者地下茎的脯氨酸含量则低于后者;而经过低温锻炼后,在低温胁迫的各时间段品种‘太湖红莲’地下茎的脯氨酸含量均显著高于品种‘荷塘情深’。
2.2.2 可溶性糖含量的变化 由表4可见:随着低温胁迫时间的延长(0~10 h),经低温锻炼的2个荷花品种地下茎的可溶性糖含量均呈“升—降—升”的变化趋势;而对照组2个品种地下茎的可溶性糖含量则呈先升高后降低的变化趋势,且均在低温胁迫4 h时达到最高值。低温胁迫0~10 h,经低温锻炼后2个荷花品种地下茎的可溶性糖含量在低温胁迫过程中总体上显著高于对照。对照组中,低温胁迫0~8 h时品种‘太湖红莲’地下茎的可溶性糖含量均低于品种‘荷塘情深’,仅在低温胁迫10 h时前者的可溶性糖含量高于后者;而经过低温锻炼后,在低温胁迫的不同时间段品种‘太湖红莲’地下茎的可溶性糖含量均高于品种‘荷塘情深’。
2.3 经低温锻炼后在低温胁迫条件下荷花地下茎SOD活性和POD活性的变化
经过5 ℃低温锻炼10 h后,在低温胁迫条件下荷花品种‘太湖红莲’和‘荷塘情深’地下茎中SOD活性和POD活性的变化分别见表5和表6。
2.3.1 SOD活性的变化 由表5可见:随低温胁迫时间的延长(0~10 h),低温锻炼组和对照组2个荷花品种地下茎的SOD活性变化趋势基本一致,均呈“升—降—升—降”的波动趋势,且均在低温胁迫4 h时SOD活性最高。低温胁迫0~10 h,经低温锻炼的品种‘太湖红莲’和‘荷塘情深’地下茎的SOD活性均高于对照组,但前者与其对照的SOD活性总体上无显著差异,而后者与其对照的SOD活性在低温胁迫中期(2~8 h)均差异显著。此外,在低温锻炼组和对照组中,品种‘太湖红莲’地下茎的SOD活性均高于相应处理组的品种‘荷塘情深’。
2.3.2 对POD活性的变化 由表6可见:随着低温胁迫时间的延长(0~10 h),经低温锻炼后2个荷花品种地下茎的POD活性均呈先上升后微幅波动的变化趋势,而对照组二者的POD活性则呈先上升后下降的变化趋势。低温胁迫0~10 h,经低温锻炼的2个荷花品种地下茎的POD活性总体上高于对照组;此外,在低温锻炼组和对照组中,品种‘太湖红莲’地下茎的POD活性均高于相应处理组的品种‘荷塘情深’,且在低温胁迫的中后期(6~10 h),二者的POD活性均差异显著。



品种和处理2)Cultivarandtreatment2)不同胁迫时间地下茎的SOD活性/U·g-1 SODactivityinrhizomeatdifferentstresstimes0h2h4h6h8h10hTH-CK311.03±9.93cdAB346.09±14.52abAB356.43±17.26aA319.48±8.09cdB332.33±3.94bcAB298.16±8.24dATH-T318.36±13.09cA369.98±20.81abA382.80±14.99aA352.94±2.55bA355.44±18.09bA305.99±14.72cAHQ-CK278.79±20.67bcC294.45±33.97abC316.20±12.75aB251.08±7.30cD302.15±20.77abB291.41±2.55abAHQ-T288.23±7.35bBC342.57±25.35aB362.57±2.47aA293.90±4.62bC346.91±10.83aA305.93±25.56bA
1)表中数值为3次重复的平均值Datums in this table are the average of three replications. 同行中不同的小写字母表示差异显著(P<0.05) Different small letters in the same row indicate the significant difference (P<0.05); 同列中不同的大写字母表示差异显著(P<0.05) Different capitals in the same column indicate the significant difference (P<0.05).
2)TH: 品种‘太湖红莲’ Cultivar ‘Taihu Honglian’; HQ: 品种‘荷塘情深’ Cultivar ‘Hetang Qingshen’; CK: 对照,未进行低温锻炼The control, without cold acclimation; T: 于5 ℃低温锻炼10 h Cold acclimation at 5 ℃ for 10 h.


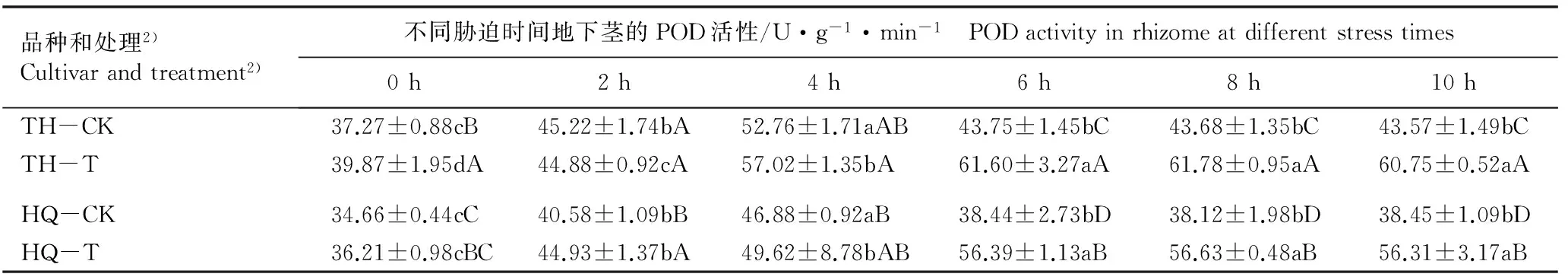
品种和处理2)Cultivarandtreatment2)不同胁迫时间地下茎的POD活性/U·g-1·min-1 PODactivityinrhizomeatdifferentstresstimes0h2h4h6h8h10hTH-CK37.27±0.88cB45.22±1.74bA52.76±1.71aAB43.75±1.45bC43.68±1.35bC43.57±1.49bCTH-T39.87±1.95dA44.88±0.92cA57.02±1.35bA61.60±3.27aA61.78±0.95aA60.75±0.52aAHQ-CK34.66±0.44cC40.58±1.09bB46.88±0.92aB38.44±2.73bD38.12±1.98bD38.45±1.09bDHQ-T36.21±0.98cBC44.93±1.37bA49.62±8.78bAB56.39±1.13aB56.63±0.48aB56.31±3.17aB
1)表中数值为3次重复的平均值Datums in this table are the average of three replications. 同行中不同的小写字母表示差异显著(P<0.05) Different small letters in the same row indicate the significant difference (P<0.05); 同列中不同的大写字母表示差异显著(P<0.05) Different capitals in the same column indicate the significant difference (P<0.05).
2)TH: 品种‘太湖红莲’ Cultivar ‘Taihu Honglian’; HQ: 品种‘荷塘情深’ Cultivar ‘Hetang Qingshen’; CK: 对照,未进行低温锻炼The control, without cold acclimation; T: 于5 ℃低温锻炼10 h Cold acclimation at 5 ℃ for 10 h.
3 讨论和结论
植物的细胞膜系统是植物感受低温的重要部位,膜系统受到的伤害通常采用MDA含量和相对电导率进行评估[9-10]。低温胁迫可使荷花地下茎的膜脂过氧化作用加剧,激发渗透调节物质的积累和抗氧化酶活性的变化,从而使荷花对低温胁迫产生一系列的生理响应。随低温胁迫时间的延长(0~10 h),荷花品种‘太湖红莲’和‘荷塘情深’地下茎的MDA含量和相对电导率总体上呈逐渐升高的趋势,说明低温胁迫对其细胞膜造成伤害,破坏了细胞膜的正常生理功能;而经过低温锻炼后,在低温胁迫2~10 h的条件下,2个荷花品种地下茎的MDA含量和相对电导率总体上低于各自未经低温锻炼(对照)的地下茎,说明低温锻炼能在一定程度上减轻荷花受冷害的程度,削弱了膜脂过氧化作用,有利于荷花抵御低温能力的提高。
脯氨酸和可溶性糖广泛存在于高等植物细胞的细胞质中,是典型的渗透调节物质,在植物遭受低温胁迫时大量积累,并通过调节细胞渗透压平衡,达到提高细胞膜的稳定性、防止细胞脱水及蛋白质变性的目的[11-12],最终抵抗低温对细胞的伤害。在可忍受的低温胁迫条件下,植物细胞内渗透调节物质的含量与其抗寒性呈正相关[13];而脯氨酸含量的增加除了具有维持细胞渗透势平衡的作用,还具有增加蛋白质可溶性的功能[14]。本研究中,经过低温锻炼后荷花品种‘太湖红莲’和‘荷塘情深’地下茎的脯氨酸含量和可溶性糖含量在低温胁迫0~10 h时均高于对照,表明低温锻炼有助于激发荷花地下茎细胞中渗透调节物质的积累,促进其抵御低温能力的增强;这一现象在经过一定程度低温锻炼的水生植物鸢尾(IristectorumMaxim.)和菖蒲(AcoruscalamusLinn.)[14]中也存在。因而,经过低温锻炼后再遭受低温胁迫时细胞内脯氨酸含量和可溶性糖含量升高可能是水生植物中普遍存在的现象。随低温胁迫时间的延长,经过低温锻炼的荷花品种‘太湖红莲’地下茎的脯氨酸含量呈逐渐升高的趋势;而品种‘荷塘情深’地下茎的脯氨酸含量在低温胁迫6 h时达到最高值但之后开始下降,说明低温胁迫初期品种‘荷塘情深’通过提高细胞内的脯氨酸含量增强其渗透调节能力,但在低温胁迫超过其耐受能力后(6 h后),细胞伤害加重、质膜透性被破坏,导致细胞内含物外渗,脯氨酸含量也因此下降。此外,随低温胁迫时间的延长,经过低温锻炼后荷花品种‘太湖红莲’和‘荷塘情深’地下茎的可溶性糖含量均较对照有不同程度的升高,说明低温锻炼有助于荷花地下茎细胞内可溶性糖的积累,并参与调节细胞渗透压,增强其抗寒能力。2个品种相比较,低温锻炼后品种‘太湖红莲’地下茎的可溶性糖含量和脯氨酸含量均高于品种‘荷塘情深’,说明品种‘太湖红莲’细胞内渗透调节物质的含量更高,对低温伤害的缓解作用相对较强。
抗氧化酶活性与植物耐冷性直接相关,SOD和POD是植物体内清除超氧阴离子自由基的重要抗氧化酶,能够有效的清除活性氧、防止细胞膜脂过氧化[15]。随低温胁迫时间的延长,经低温锻炼后荷花品种‘太湖红莲’和‘荷塘情深’地下茎的SOD活性呈“升—降—升—降”的趋势,二者的POD活性在低温胁迫条件下呈现先上升后维持微幅波动的趋势,且总体上高于各自对照;而李云等[6]对经过低温锻炼后冷胁迫条件下菊花〔Dendranthemamorifolium(Ramat.) Tzvel.〕抗氧化酶活性变化的研究也获得了相似的结果,说明低温锻炼可激发细胞内的抗氧化酶活性、加速膜脂过氧化产物的分解,从而减弱低温胁迫对细胞的伤害。此外,2个品种比较,经过低温锻炼后,品种‘太湖红莲’的抗氧化酶活性在低温胁迫过程均高于品种‘荷塘情深’,说明品种‘太湖红莲’缓解低温伤害的能力相对较强。
综上所述,在低温胁迫条件下,随胁迫时间延长,荷花品种‘太湖红莲’和‘荷塘情深’地下茎的细胞膜系统遭到一定程度的破坏,表现为地下茎中相对电导率和MDA含量升高;而经过低温锻炼后,在低温胁迫条件下2个荷花品种地下茎受害程度减轻,表现为地下茎的MDA含量和相对电导率降低、细胞内渗透调节物质含量提高、抗氧化酶活性增强。从本实验结果看,荷花不同品种对低温胁迫的响应能力有一定差异,但本实验对2个供试品种采用了同样的低温锻炼过程,没有考虑荷花不同品种抗寒异质性的差异。因而,在今后的研究中应该针对荷花不同品种的生长、生理和遗传特性,采用不同的低温锻炼方法,以期为荷花耐寒品种的选育提供更为详实的实验数据。
[1] 王其超, 张行言. 中国荷花品种图志[M]. 北京: 中国林业出版社, 2005: 30-31.
[2] KUMAR M, CHIKARA S, CHAND M K, et al. Accumulation of lead, cadmium, zinc, and copper in the edible aquatic plantsTrapabispinosaRoxb. andNelumbonuciferaGaertn.[J]. Bulletin of Environmental Contamination and Toxicology, 2002, 69: 649-654.
[3] 刘艺平, 李 创, 李 娜, 等. 荷花遗传多样性的ISSR标记分析[J]. 西北农林科技大学学报: 自然科学版, 2013, 41(4): 139-146.
[4] 郭会敏, 顾春笋, 陈发棣, 等. 荷花NnNHX1基因耐盐性在转化烟草中的验证[J]. 园艺学报, 2012, 39(2): 323-332.
[5] 陈玉珍, 李凤兰. 低温锻炼对绵头雪莲花组织培养苗抗寒性及抗氧化酶活性的影响[J]. 植物生理与分子生物学学报, 2005, 31(4): 437-440.
[6] 李 云, 杨际双, 张 钢, 等. 低温锻炼对低温胁迫下菊花生理活性的影响[J]. 华北农学报, 2009, 24(4): 179-182.
[7] WANG W B, KIM Y H, LEE H S, et al. Differential antioxidation activities in two alfalfa cultivars under chilling stress[J]. Plant Biotechnology Reports, 2000, 3: 301-307.
[8] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[9] SAIRAM R K,TYAGI A.Physiologyandmolecularbiology of salinity stress tolerance in plants[J]. Current Science, 2004, 86: 407-421.
[10] 张 京, 孙小明, 吴家森, 等. 4种常绿水生鸢尾抗寒性的初步研究[J]. 河北农业大学学报, 2012, 35(2): 30-34.
[11] COUÉE I,SULMON C,GOUESBET G, et al.Involvement of soluble sugars in reactive oxygen species balance and responses to oxidative stress in plants[J]. Journal of Experimental Botany, 2006, 57: 449-459.
[12] UEMURA M,STEPONKUS P L.Coldacclimationinplants: relationship between the lipid composition and the cryostability of the plasma membrane[J]. Journal of Plant Research, 1999, 112: 245-254.
[13] 南丽丽, 师尚礼, 陈建纲, 等. 不同根型苜蓿根系对低温胁迫的响应及其抗寒性评价[J]. 中国生态农业学报, 2011, 19(3): 619-625.
[14] 梁 雪, 贺 锋, 徐 洪, 等. 三种湿地植物抗寒性的初步研究[J]. 农业环境科学学报, 2012, 31(12): 2466-2472.
[15] KRATSCH H A, WISE R R. The ultrastructure of chilling stress[J]. Plant, Cell and Environment, 2000, 23: 337-350.
(责任编辑: 张明霞)
Difference analysis on physiological responses of different cultivars ofNelumbonuciferato low temperature stress after cold acclimation
LI Xin, JIANG Jun, XU Jun, LI Jinghui, JIANG Hongwei①
(Suzhou Academy of Agricultural Sciences, Suzhou 215155, China),
J.PlantResour. &Environ., 2015, 24(4): 76-82
Taking cultivar ‘Taihu Honglian’ and ‘Hetang Qingshen’ ofNelumbonuciferaGaertn. as experimental materials, and taking MDA content, relative electrical conductivity, contents of proline and soluble sugar, and activities of SOD and POD as indexes, after cold acclimation at 5 ℃ for 10 h, difference in physiological response of rhizome of two cultivars to low temperature stress at 0 ℃ for 0, 2, 4, 6, 8 and 10 h was analyzed, and effect of cold acclimation on cold resistance of two cultivars was compared. The results show that under low temperature stress, MDA content and relative electrical conductivity of rhizome of cultivar ‘Taihu Honglian’ and ‘Hetang Qingshen’ after cold acclimation totally appear gradually increasing trend with prolonging of low temperature time (0-10 h), their soluble sugar contents appear the “increasing-decreasing-increasing” trend, SOD activities basically appear the “increasing-decreasing-increasing-decreasing” trend, while POD activities appear the trend of firstly increasing and then slightly fluctuating; there is a certain difference in change trend of proline content of two cultivars, in which, proline content of cultivar ‘Taihu Honglian’ increases gradually, while that of cultivar ‘Hetang Qingshen’ increases firstly and then decreases. After cold acclimation, there is a certain difference in six physiological indexes of twoN.nuciferacultivars under low temperature stress with those of the control group (without cold acclimation), in which, both MDA content and relative electrical conductivity of rhizome of cultivar ‘Taihu Honglian’ under low temperature stress for 4-10 h are significantly lower than those of the control group, relative electrical conductivity of rhizome of cultivar ‘Hetang Qingshen’ under low temperature stress for 2-8 h is significantly lower than that of the control group and its MDA content has no significant difference with that of the control group; contents of proline and soluble sugar in rhizome of two cultivars are totally significantly higher than those of the control group, and their SOD and POD activities are totally higher than those of the control group. The comprehensive result shows that cold acclimation is benefit to relieve damage to membrane system of rhizome ofN.nucifera, increase osmoregulation substance content and enhance antioxidant enzyme activity, therefore, cold resistance ofN.nuciferacan be enhanced at a certain degree. And increasing range of cold resistance of cultivar ‘Taihu Honglian’ is higher than that of cultivar ‘Hetang Qingshen’ after cold acclimation.
NelumbonuciferaGaertn.; cold acclimation; cold resistance; membrane system; osmoregulation substance; antioxidant enzyme activity
2015-01-08
江苏省农业科技自主创新资金项目〔cx(13)3018〕; 苏州市科技计划项目(SYN201325); 江苏省林业三新项目〔LYSX(2015)45〕
李 欣(1982—),女,黑龙江鹤岗人,硕士,助理研究员,主要从事观赏植物种质资源抗逆性评价研究。
①通信作者 E-mail: sacjhw@163.com
Q945.78; S682.32
A
1674-7895(2015)04-0076-07
10.3969/j.issn.1674-7895.2015.04.10

