椎-基底动脉系统短暂性脑缺血发作患者脑白质变性的危险因素研究
牛宝丰 周卫东 刘长春 曾庆玉 尹晓明 张文静
椎-基底动脉系统短暂性脑缺血发作患者脑白质变性的危险因素研究
牛宝丰 周卫东 刘长春 曾庆玉 尹晓明 张文静
目的 探讨椎-基底动脉系统短暂性脑缺血发作(VB-TIA)患者脑白质变性(leukoaraiosis,LA)的危险因素。方法 回顾性连续选取313例住院行头颅MRI检查的VB-TIA患者,以所收集的患者性别、年龄、心电图RV5+SV2电压值(mV)、是否有颈动脉斑块、C-反应蛋白(CRP)、胆固醇(TC)、高密度脂蛋白(HDL)、三酰甘油(TG)、低密度脂蛋白(LDL)、尿酸(UA)、同型半胱氨酸(Hcy)、糖化血红蛋白(HbA1c)、叶酸(FA)、维生素B12水平(VB12)等临床资料为自变量,以是否并发LA为因变量,先对各自变量分别进行单因素Logistic回归分析,再对单因素分析有统计学意义自变量进行多因素Logistic回归分析。结果 并发LA的VB-TIA患者与未并发LA的VB-TIA患者间年龄、心电图RV5+SV2电压值、CRP、HDL、Hcy、FA和颈动脉斑块发生率比较差异有统计学意义(P<0.1);将上述单因素Logistic回归分析有统计学意义的自变量纳入多因素Logistic回归分析进行校正,结果显示年龄增长(P=0.000,OR=1.116,95%CI:1.081~1.153)、颈动脉斑块(P=0.000,OR=4.881,95%CI:2.510~9.493)和低HDL水平(P=0.017,OR=3.676,95%CI:1.267~10.638)为VB-TIA患者并发LA的独立危险因素。结论 年龄增长、颈动脉斑块及低HDL水平可能为VB-TIA患者LA发生的独立危险因素。
脑缺血发作,短暂性;椎基底动脉系统供血不足;脑白质疏松症;危险因素
脑白质变性(LA)是临床常见的脑小血管病,影像上表现为非特异性CT低密度和MRIT2/FLAIR高信号的脑白质疏松状态[1]。短暂性脑缺血发作(TIA)为LA发生的危险因素之一[2],反之LA亦为TIA患者发生脑梗死的独立预测因素[3]。LA的危险因素是近年研究热点之一[4-6],且临床常见中老年TIA患者并发LA,但目前关于TIA患者并发LA的危险因素研究较少。椎-基底动脉系统短暂性脑缺血发作(VB-TIA)是TIA最常见的发病形式,患病率极高,因而探讨VB-TIA患者并发LA的危险因素有助于预防TIA患者发生脑梗死。
1 对象和方法
1.1 临床资料 回顾性分析2011-05-2014-05作者医院收治的且行头颅MRI检查的VB-TIA患者313例,其中男143例、女170例,年龄50~93(68.04±10.36)岁。按照2009年美国心脏协会和美国卒中协会(AHA/ASA)标准[7],病例均符合VB-TIA的诊断。LA的诊断标准[8]为MRI脑室周围或皮质下(半卵圆中心)T2/FLAIR边缘模糊的弥漫性高信号,且DWI无明显高信号,并排除其他引起脑白质病变的疾病。经两名影像科医师基于患者住院MRI资料独立判断每例入组患者有无LA,结论一致者采纳,不一致者由另一名影像科主任医师重新诊断并讨论,直至最终结果一致且无异议。其中并发LA的患者163例,男78例,女85例,年龄50~93(72.91±8.95)岁;未并发LA的患者150例,男65例,女85例,年龄50~90(62.73±9.12)岁。排除单纯性眩晕、单纯性头晕、单纯性复视、偏头痛发作、陈旧性脑梗死、陈旧性脑出血、凝血障碍、血管炎、多发性硬化、代谢及中毒性脑病、全身感染、恶性肿瘤及脏器衰竭者。
1.2 方法 收集患者的性别构成、年龄、心电图RV5+SV2电压值(mV)、血浆胆固醇(TC)、血浆三酰甘油(TG)、血浆高密度脂蛋白(HDL)、血浆低密度脂蛋白(LDL)、血浆尿酸(UA)、血浆同型半胱氨酸(Hcy)、糖化血红蛋白(HbA1c)、C-反应蛋白(CRP)、血浆叶酸(FA)、血浆维生素B12(VB12)、有无颈动脉斑块等临床资料,以及头颅MRI影像资料(判断是否并发LA)。
1.3 统计学处理 以上述各临床资料为自变量,以是否并发LA为因变量,其中对二分类计数资料按如下规定赋值:女性=0,男性=1;颈动脉超声正常=0,颈动脉斑块=1;未并发LA=0,并发LA=1。应用SPSS16统计软件进行统计分析,经非参数单样本K-S正态性检验,符合正态分布的计量资料以均数±标准差表示,不符合正态分布的计量资料以中位数(四分位数间距)表示,先对各自变量分别进行单因素Logistic回归分析,以P<0.1为差异有统计学意义;再对单因素分析有统计学意义自变量进行多因素Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 单因素Logistic回归分析 并发LA的VB-TIA患者与未并发LA的VB-TIA患者相比较,年龄、心电图RV5+SV2电压值、CRP、HDL、Hcy、FA及颈动脉斑块发生率的差异均有统计学意义(均P<0.1),而性别构成、TC、TG、LDL、UA、HbA1c及VB12的差异均无统计学意义(均P>0.1) (表1)。
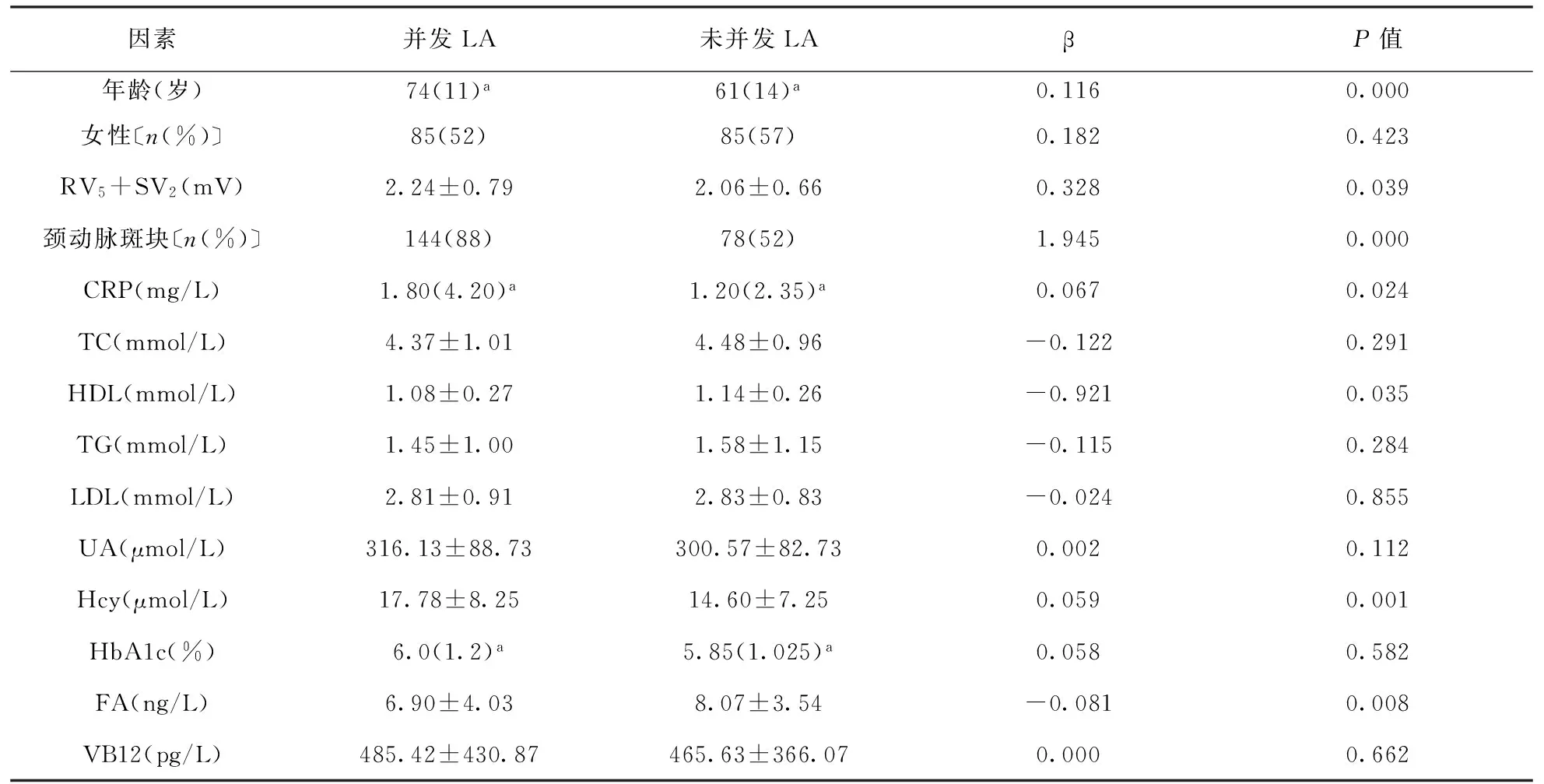
表 1 VB-TIA患者LA相关因素的单因素Logistic回归分析结果
注:a为中位数(四分位数间距)形式;CRP:C-反应蛋白,TC:胆固醇,HDL:高密度脂蛋白,TG:三酰甘油,LDL:低密度脂蛋白,UA:尿酸,Hcy:同型半胱氨酸,HbAlc:糖化血红蛋白,FA:叶酸,VB12,维生素B12,表2同

表 2 VB-TIA患者LA危险因素的多因素Logistic回归分析结果
2.2 多因素非条件二分类Logistic回归分析 对单因素Logistic分析有统计学意义的自变量(年龄、心电图RV5+SV2电压值、CRP、HDL、Hcy、FA、颈动脉斑块)纳入多因素非条件二分类Logistic回归分析(Enter法)校正后结果显示,年龄增长、颈动脉斑块和低HDL水平为VB-TIA患者LA的独立危险因素(P<0.05) (表2)。
3 讨论
本研究结果提示,在50岁以上VB-TIA人群中,高龄、颈动脉斑块形成及低HDL水平可能是其LA发生的独立危险因素。
有研究结果显示高龄为LA的危险因素[4-5],其机制可能为,高龄者脑小血管病危险因素随时间累积增加;并且为脑白质区供血的小穿通动脉多为缺乏侧支循环的终支,一旦发生脑小血管病可造成脑血流自动调节功能受损和慢性低灌注[6];另外年龄相关的脑萎缩、脑白质区域血管周围间隙扩张均可能导致LA的发生。本研究结果显示高龄是50岁以上VB-TIA患者发生LA的独立危险因素之一。
颈动脉斑块脂质比例及颈动脉壁厚度与LA的发生密切相关[9-10]。国内段作伟等[11]对333例LA患者的研究亦发现颈动脉狭窄与侧脑室旁LA存在独立相关性。其机制可能为,颈动脉斑块多累及颈动脉窦,可影响颈动脉窦压力感受性反射,另外与颈动脉斑块密切相关的动脉硬化可导致血管顺应性降低,两者均可降低机体对急骤变化的血压的缓冲能力,在动脉硬化及颈动脉狭窄的基础上,血压波动可导致依靠侧支循环维持功能的脑区反复缺血,为脑白质区域供血的穿通动脉常从上级动脉垂直发出,因而其对血压波动极为敏感,在长期高血压引起的脑白质区域小穿通动脉结构重塑和脑血流量自动调节功能的丧失的基础上,反复发作的血压波动可导致LA的发生[12-13];此外脂质比例高的颈动脉斑块处脱落的微栓子可导致小穿通动脉末端闭塞性改变,降低脑白质区域的血流灌注。本研究经多因素Logistic回归分析显示颈动脉斑块是VB-TIA患者发生LA的独立危险因素。
目前尚未检索到国外关于血浆HDL水平与LA相关性的文献报道。国内殷雁等[14]对181例LA患者和141例无LA者的研究未发现血浆HDL水平与LA的相关性。这与本研究结果显示的低血浆HDL水平为VB-TIA患者LA的独立危险因素相矛盾。其原因可能与病例选择、混杂因素控制不同等有关。从理论上分析,HDL可穿透动脉内膜,将沉积于血管壁的脂质斑块成分转运回肝脏,并修复血管内皮,具有抗动脉硬化作用[15], 可能为LA的保护因素。但要明确低血浆HDL水平是否为VB-TIA患者LA的独立危险因素尚需进一步大样本的前瞻研究。
本研究选择心电图RV5+SV2电压值来反映患者长期血压真实水平[16],旨在弥补患者住院血压测量值对长期血压真实水平代表性差这一状况,结果并未显示其是VB-TIA患者发生LA的独立影响因素,但高血压是LA的危险因素已经被众多研究证实,可能提示用心电图RV5+SV2电压来反映患者长期血压真实水平敏感性较差。HbA1c可反映近8~12周平均血糖水平,但本研并未发现其是LA发生的独立影响因素,其原因可能为:病程较长糖尿病患者才出现各种慢性并发症,HbA1c不能有效反映与脑小血管病变密切相关的高血糖暴露累积时间,另外该研究也无法完全排除入组患者近期应用胰岛素等降糖药物对患者血HbA1c水平的影响。尽管本研究在统计分析时对VB-TIA患者LA的相关因素进行了初筛排除,并对混杂因素进行了校正,但作为回顾性研究,可能存在不可控偏倚,进而可能会影响本研究结论的外推性。因此VB-TIA患者发生LA的确切危险因素仍需在前瞻性的研究中进一步探讨。
[1]牛宝丰,尹晓明,周卫东.脑白质变性与认知障碍[J].中国神经免疫学和神经病学杂志,2014,21(4):282-285.
[2]Henon H,Godefroy O,Lucas C,et al.Risk factors and leukoaraiosis in stroke patients[J].Acta Neurol Scand,1996,94(2):137-144.
[3]Simoni M, Li L, Paul NL, et al.Age- and sex-specific rates of leukoaraiosis in TIA and stroke patients: population-based study[J].Neurology,2012,79(12):1215-1222.
[4]Miki Y, Sakamoto S. Age-related white matter lesions (leukoaraiosis): an update[J].Brain Nerve,2013,65(7):789-799.
[5]高关然,伊红丽,黄勇华,等.腔隙性脑梗死与脑白质疏松的相关性[J].中国动脉硬化杂志,2013,21(11):1009-1011.
[6]Pantoni L.Pathophysiology of age-related cerebral white matter changes[J].Cerebrovasc Dis,2002,13(Suppl2):7-10.
[7]Easton JD,Saver JL,Albers GW,et al. Definition and evaluation of transient ischemic attack[J].Stroke,2009,40(6):2276-2293.
[8]Wahlund LO,Barkhof F,Fazekas F,et al.A new rating scale for age-related white matter changes applicable to MRI and CT[J].Stroke,2001,32(6):1318-1322.
[9]Saba L, Raz E, Grassi R,et al.Association between the volume of carotid artery plaque and its subcomponents and the volume of white matter lesions in patients selected for endarterectomy[J].AJR, 2013,201(5):747-752.
[10]Saba L,Pascalis L Sanfilippo R,et al. Carotid artery wall thickness and leukoaraiosis: preliminary results using multidetector row CT angiography[J].AJNR, 2011,32(5):955-961.
[11]段作伟,李华,孙文,等.老年脑白质疏松与脑血管狭窄的相关性研究[J].中华老年心血管病杂志,2014,16(1):46-49.
[12]Robert B,Daroff GM,Fenichel JJ,et al.Bradley’s neurology in clinical practice[M].Philadelphia:Saunders,2012.1569-1571.
[13]Samuels MA,Feske S.Office practice of neurology[M].Philadelphia:Elsevier Science,2003.312.
[14]殷雁,王齐,张仲慧.脑白质疏松与血脂水平的关系[J].中国康复理论与实践,2012,18(11):1066-1068.
[15]Toth PP. Cardiology patient page. The “good cholesterol”:high-density lipoprotein[J].Circulation,2005,111(5):89-91.
[16]Rodrigues SL, D’Angelo L, Pereira AC,et al.Revision of the Sokolow-Lyon-Rappaport and cornell voltage criteria for left ventricular hypertrophy[J].Arq Bras Cardiol,2008,90(1):46-53.
(本文编辑:时秋宽)
Analysis of risk factors of leukoaraiosis in vertebrobasilar transient ischemic attack patients
NIUBaofeng,ZHOUWeidong*,LIUChangchun,ZENGQingyu,YINXiaoming,ZHANGWenjing.
*Department of Neurology,China Meitan General Hospital,Beijing 100028,China
ZHOUWeidong,Email:weidongzh@yahoo.com
ObjectiveToinvestigatetheriskfactorsofleukoaraiosis(LA)invertebrobasilartransientischemicattack(VB-TIA)patients.MethodsThreehundredandthirteenconsecutiveVB-TIAinpatientswithMRIimageswereincluded.Thefollowingdata:age,gender,ECG(RV5+SV2),carotidarteryplaques,CRP,TC,HDL,TG,Hcy,LDL,UA,HbA1c,FA,VB12(independentvariables),leukoaraiosis(withorwithout)(dependentvariable)werecollected.UnconditionalunivariateandmultivariatelogisticregressionwereanalyzedusingSPSS16software.ResultsSevenfactors,age,ECG(RV5+SV2),carotidarteryplaques,CRP,HDL,Hcy,FAwerescreenedoutwithunivariatelogisticregression(P<0.1).Themultivariatelogisticregressionindicated:olderage(P=0.000, OR=1.116, 95%CI: 1.081-1.153),carotidarteryplaques(P=0.000, OR=4.881, 95%CI: 2.510-9.493),andlowerserumHDLlevel(P=0.017, OR=3.676, 95%CI: 1.267-10.638)wereindependentriskfactorsofLAinVB-TIApatients.ConclusionsOlderage,carotidarteryplaques,andlowserumHDLlevelarelikelytobetheindependentriskfactorsofLAinVB-TIApatients.
ischemicattack,transient;vertebrobasilarinsufficiency;leukoaraiosis;riskfactors
10.3969/j.issn.1006-2963.2015.01.011
首都卫生发展科研专项项目(2011-6011-01)
100028煤炭总医院神经内科(牛宝丰、周卫东、刘长春),影像科(曾庆玉、尹晓明),病案统计室(张文静)
周卫东,Email:weidongzh@yahoo.com
R743.9
A
1006-2963 (2015)01-0046-04
2014-08-02)

