不同纯度和极性的香蕉果皮黄酮抑菌活性的研究
顾采琴,伍尤文,林丽珊,朱冬雪,刘 鹏
(广州大学化学化工学院,广东广州 510006)
不同纯度和极性的香蕉果皮黄酮抑菌活性的研究
顾采琴,伍尤文,林丽珊,朱冬雪,刘 鹏
(广州大学化学化工学院,广东广州 510006)
采用滤纸片法,以大肠杆菌和金黄色葡萄球菌为供试菌,对香蕉果皮黄酮粗提物、纯化物、不同极性的黄酮以及香蕉果皮黄酮-丙酸复配剂的抑菌活性进行了研究.结果表明,香蕉果皮黄酮纯度越高,极性越大,抑菌活性越强,对革兰氏阳性菌金黄色葡萄球菌的抑菌活性明显大于对革兰氏阴性菌大肠杆菌的抑菌活性.香蕉果皮黄酮纯化后对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度(MIC)分别为13.00 mg·mL-1和3.25 mg· mL-1,其与丙酸复配能显著增加对大肠杆菌的抑菌活性,2者具有协同增效作用.
香蕉果皮;黄酮纯度;黄酮极性;抑菌活性
近年来食品安全问题受到广泛关注,天然食品防腐剂更加受到人们的重视,并成为食品添加剂研究和应用的一个热点,但目前已真正开发成功并推广应用于食品防腐保鲜的产品并不多,大多处于实验研究阶段,主要原因在于产品生产成本较高,抑菌活性不强等方面的问题[1].国内外近年来开始利用果实加工过程中的废渣如果皮[2]、种子[3]等为原料,开发天然食品防腐剂可大大降低其生产成本,又可减少环境污染,因而在生产上已有部分进行了推广应用.
香蕉(Musa nana)在东南亚及中国广泛种植,但人们只食其果肉,而占香蕉全果质量35%~41%的香蕉果皮则随意丢弃,既污染环境又浪费资源[4].目前香蕉果皮除了可以用于提取果胶[5]等产品外,未见将香蕉果皮开发成食品防腐剂进行商业应用.黄酮类化合物对大肠杆菌等病原菌具有明显的抑制作用[6].本课题组前期研究表明,香蕉果皮黄酮粗提物[2]、粗提物与丙酸复配剂以及纯化后的黄酮均具有较好的抑菌作用和食品防腐效果[7-8],但由于黄酮纯度不高,其抑菌效果仍不理想.因此,本文在提高了香蕉果皮黄酮纯度以及对不同极性黄酮进行分离的基础上,以大肠杆菌和金黄色葡萄球菌为供试菌,对香蕉果皮黄酮的抑菌活性进行研究,以期为利用香蕉果皮开发新型、高效、安全和低成本的天然食品防腐剂提供科学依据.
1 材料与方法
1.1 材料与试剂
7~8成熟度的香蕉,品种为“香牙蕉”,购于广州市农贸市场.
培养基:营养琼脂.
菌种:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)均由广州大学微生物学实验室提供.
氯化钠、无水乙醇、氢氧化钠、醋酸、丙酸,天津市大茂化学试剂厂;聚酰胺树脂,郑州勤实科技有限公司;以上试剂均为分析纯.
1.2 仪器与设备
ALPHR 1-2 LD真空冷冻干燥器,博励行仪器有限公司;R206D旋转蒸发仪,上海申生科技有限公司;UV-2300紫外分光光度计,上海天美科学仪器有限公司;XH-B漩涡混合器,姜堰市康健医疗器具有限公司;YX-24LD高压蒸汽灭菌锅,江阴滨江医疗设备有限公司;SPX-150BS-Ⅱ生化恒温培养箱,上海新苗医疗器械制造有限公司;DE-180E超声波清洗器,上海之信仪器有限公司.
1.3 方法
1.3.1 香蕉果皮黄酮粗提物的制备及其纯度的计算
精确称取一定量香蕉果皮粉于1 000 mL二口平底烧瓶中,加入浓度70%的乙醇进行微波提取,微波功率300 W,微波提取时间10 min.将提取液减压浓缩至无乙醇,然后冷冻干燥至恒重,得黄酮粗提物.称取一定量干燥后的黄酮粗提物用70%乙醇溶解定容至100 mL,按照文献[7]方法测定黄酮的含量.黄酮纯度的计算方法如下:
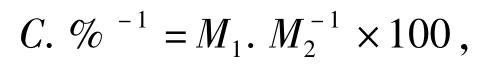
式中,C为黄酮纯度;M1为粗提物中黄酮含量;M2为粗提物质量.
8月14日,由中农集团控股股份有限公司主办的“2018年东北乡村振兴创富大会暨中国农资——社会化服务体系建设论坛”在大连成功举办。来自农业农村部、大连市供销合作社联合社和多家合作企业的专家领导,以及种植农场主、合作社和经销商代表们,共120余人与会。会上,中国农资——社会化服务体系正式上线。
1.3.2 香蕉果皮黄酮纯化物的制备
利用H103大孔树脂按照文献[8]方法对经石油醚处理后的香蕉果皮黄酮粗提物进行纯化,洗脱液经减压浓缩后,冷冻干燥至恒重,得黄酮纯化物,然后按1.3.1方法计算黄酮纯度.
1.3.3 聚酰胺树脂对不同极性香蕉果皮黄酮的分离
将预处理过的聚酰胺树脂混悬于水中,使其充分溶胀,然后装柱,让其自由沉降.采用湿法上样,使溶液以0.8 mL·min-1的流速流过层析柱.分别用蒸馏水、20%、40%和60%的乙醇溶液进行梯度洗脱,每10 min收集1管.收集每个梯度的洗脱液,经减压浓缩后,冷冻干燥至恒重,得到极性大小不同的香蕉果皮黄酮.
1.3.4 香蕉果皮黄酮的抑菌试验
(1)抑菌液的制备
黄酮粗提物、纯化物、不同极性成分均按其纯度配成一定浓度的溶液;丙酸水溶液:丙酸与水按照1∶1的比例配成水溶液;香蕉果皮黄酮-丙酸复配剂:分别取上述纯化后的黄酮溶液和丙酸溶液进行复配得复配剂.按相应的比例加入水分别得到黄酮和丙酸对照.
(2)供试菌菌悬液的制备
分别用接种环在试管斜面上挑取少量菌体,用无菌水洗配制成浓度约为107CFU·mL-1的菌悬液.
1.3.5 抑菌试验
滤纸片扩散法[8].试验重复6次.
1.3.6 最小抑菌浓度实验(MIC)
采用混平板稀释法[9].试验重复6次.
所有试验数据采用SPSS软件进行分析.
2 结果与分析
2.1 不同纯度香蕉果皮黄酮的抑菌活性
大肠杆菌和金黄色葡萄球菌是2种重要的污染食品和致人患病的细菌.由表1可见,黄酮含量为92.3%的样品对大肠杆菌和金黄色葡萄球菌的抑菌圈直径明显大于黄酮含量为10.1%的样品,前者对2种菌的抑菌圈直径分别是后者的2.97倍和152.12%,结合文献[8]可见,当香蕉果皮黄酮纯度提高后,对大肠杆菌抑菌效果的提高程度明显增大,其原因可能是高纯度的黄酮样品降低了杂质对黄酮抑菌作用的干扰,这与陈乃东等[10]的研究结论一致.由表1还可见,香蕉果皮黄酮抑制革兰氏阳性菌金黄色葡萄球菌的活性明显大于抑制革兰氏阴性菌大肠杆菌的活性,这与IKIGAI等[11]的研究结论一致.
2.2 香蕉果皮黄酮不同极性组分的抑菌活性
由表2可见,香蕉果皮黄酮随着极性的降低,其抑菌活性亦逐渐降低.其中水洗脱成分和20%乙醇洗脱成分对大肠杆菌和金黄色葡萄球菌的抑菌圈直径接近,但明显比40%和60%乙醇洗脱成分的高出1倍多,其中60%乙醇洗脱成分对大肠杆菌几乎没有抑菌效果.由此可知,香蕉果皮黄酮中具有抑菌活性的成分主要是极性比较大的水洗脱部位和20%乙醇洗脱部位,其机理有待进一步研究.

表2 香蕉果皮黄酮不同极性组分的抑菌圈直径Table 2 The diameter of antibacterial activity of different polarity components from banana peel flavonoids mm
2.3 纯化后黄酮的最小抑菌浓度
最小抑菌浓度是指能够抑制指示菌生长繁殖最低的抑菌物质浓度,最小抑菌浓度越低,则抑菌效果越明显.由表3可见,纯化后香蕉果皮黄酮对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度分别为13.00 mg·mL-1和3.25 mg·mL-1,而粗提物[8]对这2种菌的最小抑菌浓度是750 mg· mL-1,进一步证明香蕉果皮黄酮纯度提高之后能明显提高抑菌作用,而且对金黄色葡萄球菌的抑菌效果比对大肠杆菌的抑菌效果明显.
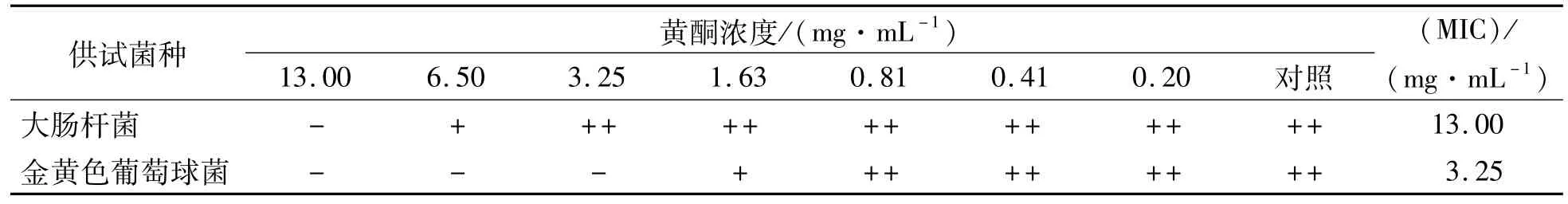
表3 香蕉果皮黄酮的最小抑菌浓度(MIC)Table 3 Theminimum inhibitory concentration of banana peel flavonoids
2.4 香蕉果皮黄酮-丙酸复配剂的抑菌活性
由表4可知,纯化后香蕉果皮黄酮-丙酸复配剂对大肠杆菌的抑菌圈直径大于2者单独使用时的抑菌圈直径之和,说明香蕉果皮黄酮与丙酸复配后具有明显的协同增效抑菌作用.对于金黄色葡萄球菌,复配剂的抑菌圈直径小于2者单独使用的抑菌圈直径之和,说明复配剂对该菌没有增效作用,而香蕉果皮黄酮粗提物-丙酸复配剂对白假丝酵母也有协同增效抑制作用[7].可见,复配抑菌剂的增效作用与作用对象有关.
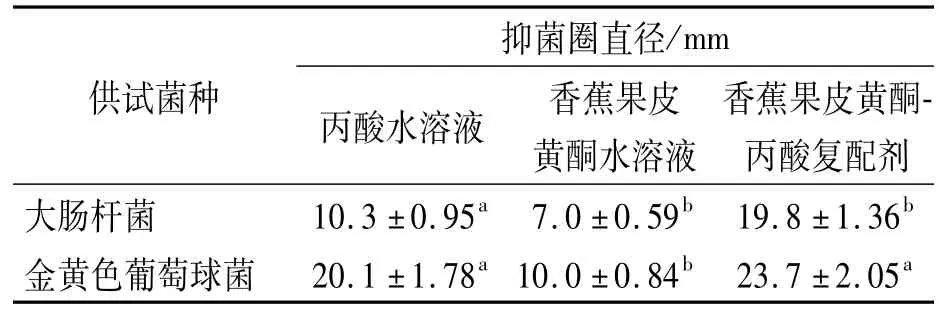
表4 香蕉果皮黄酮-丙酸复配剂的抑菌活性Table 4 The antibacterial activity of banana peel flavonoidspropionic acid blends
3 讨论与结论
植物黄酮类物质具有较强的抑制食品腐败菌和病原菌的作用,但抑菌效果与纯度有关[8,10].本研究结果显示,香蕉果皮黄酮的纯度越高,其抑菌效果越明显(表1),与桂花黄酮抑菌效果研究结论类似[12],表明提高香蕉果皮黄酮纯度可以明显提高其抑菌效果.本研究结果还显示,香蕉果皮黄酮中极性较大的组分,抑菌活性较强(表2),而在费菜黄酮中,抑菌效果最好的是极性较水相弱的乙酸乙酯相黄酮[13],说明不同植物中起抑菌作用的黄酮极性不同.
天然产物与化学防腐剂复配后能明显提高其防腐效果[14].本研究结果表明,纯化后香蕉果皮黄酮与丙酸复配能显著增加对大肠杆菌的抑菌活性,2者具有协同增效作用(表4),前期研究表明香蕉果皮黄酮粗提物与丙酸复配后对食品的防腐效果也很明显[7].由此可见,香蕉果皮黄酮与丙酸复配更能表现出理想的抑菌防腐效果.
总之,通过测定香蕉果皮黄酮不同纯度、不同极性以及与丙酸复配后的抑菌效果,探明了香蕉果皮黄酮经提高纯度、分离极性较大组分或与丙酸复配后能明显增强其抑菌效果,这对利用香蕉果皮开发低成本、安全及高效的食品防腐剂具有重要的实践指导意义.
[1] 向智男,宁正祥.植物性天然防腐剂及其在食品中的应用[J].中国食品添加剂,2004(3):80-83.
XIANG Z Y,NING Z X.Application of natural preservative[J].Chin Food Addit,2004(3):80-83.
[2] 顾采琴,钟逸玲,赖建平,等.香蕉果皮提取物抑菌特性研究[J].广州大学学报:自然科学版,2009,8(4):27-31.
GU CQ,ZHONG Y L,LAIJP.Studies on antibacterial characteristics of banana peel extract[J].JGuangzhou Univ:Nat Sci Edi,2009,8(4):27-31.
[3] MARLA L,JOHN P,JEFFREY M,et al.Inhibitory effect of chardonnay and black raspberry seed extracts on lipid oxida-tion in fish oil and their radical scavenging and antimicrobial properties[J].Food Chem,2007,104(3):1065-1073.
[4] ZHANG P,ROYW,JAMESN B,et al.Banana starch:production,physicochemical properties,and digestibility:A review[J].Carbohydr Polym,2005,59:443-458.
[5] EMAGA H,RONKART SN,ROBERTW B,et al.Characterisation of pectins extracted from banana peels(Musa AAA)under different conditions using an experimental design[J].Food Chem,2008,108(2):463-471.
[6] WU T,ZANG X,HEM,etal.Structure-activity relationship of flavonoids on their anti-escherichia coliactivity and inhibition of DNA Gyrase[J].JAgr Food Chem,2013,61(34):8185-8190.
[7] 赖建平,顾采琴,朱冬雪,等.香蕉果皮黄酮及与丙酸、茶多酚复配剂的抑菌防腐作用[J].食品科学,2012,33(13):53-57.
LAI JP,GU C Q,ZHU D X,et al.Antibacterial activity and preservative effect of flavonoids from banana peels alone and their blendswith propionic acid or tea polyphenols[J].Food Sci,2012,33(13):53-57.
[8] 顾采琴,谢琳琳,张织芬,等.香蕉皮黄酮的分离纯化及抑菌活性研究[J].食品科学,2013,34(16):98-102.
GU CQ,XIE L L,ZHANG Z F,et al.Research on separation and purification and inhibition microorganism of total flavonoid in banana peel[J].Food Sci,2013,34(16):98-102.
[9] 姚晓敏,孙向军,黄时.芦荟及其抑菌作用的研究[J].食品科技,2001,4:23-25.
YAO X M,SUN X J,HHANG S.Study on bacteriostasis effect of aloe[J].Food Sci Tech,2001,4:23-25.
[10]陈乃东,周守标,罗琦,等.不同提取剂对春花胡枝子黄酮含量及抑菌活性影响的研究[J].中国卫生检验杂志,2007,17(2):193-196.
CHEN N D,ZHOU SB,LUO Q,etal.Effects of different reagents on contentand activity against bacteria of Lespedza dunnii flavonoid[J].Chin JHealth Lab Tech,2007,17(2):193-196.
[11]IKIGAIH,NAKAE T,HARA Y,et al.Bactericidal catechins damage the lipid bilayer[J].BBA-Biomembranes,1993,1147(1):132-136.
[12]王丽梅,余龙江,崔永明,等.桂花黄酮的提取纯化及抑菌活性研究[J].天然产物研究与开发,2008,20(4):717-720.
WANG L M,YU L J,CUIY M,et al.Flavonoids from Osmanthus fragrans:Extraction and bacteriostatic activities[J].Nat Prod Res Dev,2008,20(4):717-720.
[13]王鸿飞,刘飞,徐超,等.费菜总黄酮及其不同极性提取物抑菌活性研究[J].中国食品学报,2013,5:124-128.
WANG H F,LIU F,XU C,etal.Study on anti-microbial activity of total flavaniod and its different polar extracts from Sedum aizoon L.[J].JChin Instit Food Sci Tech,2013(5):124-128.
[14]李海娜,朱希强,郭学平.天然防腐剂乳链菌肽复配应用的研究进展[J].食品与药品,2010,12(1):51-53.
LIH N,ZHU X Q,GUO X P.Progress on application of compound nisin[J].Food Drug,2010,12(1):51-53.
Study on antibacterial activity of different purity and polar flavonoids from banana peel
GU Cai-qin,WU You-wen,LIN Li-shan,ZHU Dong-xue,LIU Peng
(School of Chemistry and Chemical Engineering,Guangzhou University,Guangzhou 510006,China)
The activity against bacteria of flavonoids-propionic acid mixtures,different purity and different polar flavonoid from banana peel was studied by filter paper with Escherichia coli and Staphylococcus aureus.The results showed that the higher the purity of flavonoid was and the stronger the polarity was,themore powerful the antibacterial activity of flavonoid was.Antibacterial activity against gram positive bacteria Staphylococcus aureus was significantly greater than that against gram negative bacteria Escherichia coli.The minimal inhibitory concentration(MIC)of purified flavonoids on Staphylococcusaureus and Escherichia coli were 13.00 mg·mL-1and 3.25 mg·mL-1.Flavonoids-propionic acid compound could increase antibacterial activity against Escherichia coli,both had synergistic effect.
banana peel;flavonoids purity;flavonoids polarity;antibacterial activity
O 623.54
A
【责任编辑:周 全】
1671-4229(2015)03-0034-04
2015-01-18;
2015-03-19
广州市科技计划资助项目(2013J4100020).
顾采琴(1964-),女,教授.E-mail:gcq86@163.com

