纳米二氧化钛对Tl(I)离子的吸附性能研究
邓红梅,王耀龙,吴宏海,刘 涛,张紫君,武高远,陈永亨
(1.广州大学a.环境科学与工程学院;b.珠江三角洲水质安全与保护省部共建重点实验室;c.土木工程学院,广东广州 510006;2.华南师范大学化学与环境学院,广东广州 510006;3.北京大学深圳研究生院环境与能源学院,广东深圳 518055)
纳米二氧化钛对Tl(I)离子的吸附性能研究
邓红梅1a,b,王耀龙1a,2,吴宏海2,刘 涛1c,张紫君3,武高远1a,b,陈永亨1a,b
(1.广州大学a.环境科学与工程学院;b.珠江三角洲水质安全与保护省部共建重点实验室;c.土木工程学院,广东广州 510006;2.华南师范大学化学与环境学院,广东广州 510006;3.北京大学深圳研究生院环境与能源学院,广东深圳 518055)
采用批处理吸附实验,研究了纳米二氧化钛(nano-TiO2)对水溶液中Tl(I)离子的去除及其初步机理.结果表明,nano-TiO2对Tl(I)吸附随pH而增大,当pH大于等电点(6.0)时,Tl(I)离子被迅速吸附,pH=10吸附率达99%.nano-TiO2对Tl(I)的吸附在30 min内达到平衡,并满足准一级动力学方程.在温度为288、303、318 K的条件下,Tl(I)初始浓度为10~1 000 mg·L-1时,饱和吸附量分别为15.7、13.8、11.6 mg·g-1,符合Langmuir吸附等温式.吸附过程的ΔG和ΔH均为负值,表明该过程是自发的放热过程.实验证明,TiO2是一种极具潜力的Tl(I)的吸附剂.
铊;纳米二氧化钛;动力学;等温线;热力学
铊(Tl)是一种稀有、分散重金属,它对哺乳动物的毒害作用远远大于Cu、Pb、Zn、Hg、Cd等常规重金属[1-2].Tl在环境中有一价(Tl(I))和三价(Tl(III))2种价态[3],Tl(I)形成的化合物通常具有更高的溶解度,更易于通过水体迁移进入其它环境介质中,因此,存在于环境中的Tl(I)比Tl(III)具有更高的危害性[2].Tl易在骨髓、肾脏等器官内蓄积,一般症状为毛发脱落、胃肠道反应、神经系统损伤等,严重时会对机体造成永久性损伤,如肌肉萎缩、中枢神经系统损伤等[1].Tl以其高毒性、强蓄积性愈来愈受到人们的重视.我国已于2011年正式将元素Tl列为《重金属污染综合防治“十二五”规划》中的重点防治对象之一.美国环保署规定Tl的含量,在饮用水中不得超过2μg· L-1,海水中不得超过4μg·L-1,工业废水中不得超过140μg·L-1[4].近些年,随着矿山开采、重金属冶炼等工业开发规模的加大[5-7],Tl对环境造成的污染也日益加重,污染水体事件时有发生.如2010年10月22日,广东北江水体发生Tl污染事件[8],出水口的Tl浓度高达1 067μg·L-1,沿线所设12个断面中Tl浓度介于0.18~1.03μg· L-1,均超过国家地表水环境质量标准.因此,去除与控制环境中的Tl显得尤为重要.
吸附法因其价格低廉,方法简单而被广泛应用于重金属的去除.目前针对T1的吸附去除的吸附材料包括活性炭[9]、木屑[10]、聚丙烯酰胺[11]、沸石[12]、地质材料[13]和水合二氧化锰[14]等.随着纳米材料的兴起,一些学者探索利用多壁碳纳米管和纳米二氧化钛(nano-TiO2)吸附去除水中Tl(I)和Tl(III)[15-17],吸附速度快,吸附容量较高.而仅有ZHANG等[17]研究了锐钛型TiO2对Tl(III)的吸附性能,并未见Tl(I)的报道.
因此,本文研究了nano-TiO2对Tl(I)的吸附规律,考察溶液的pH、离子强度、投加量、时间、Tl(I)的初始浓度和温度等不同因素对吸附的影响,同时还分析了吸附过程的热力学和动力学,探讨了nano-TiO2的吸附机理,以期为水体和土壤Tl污染治理和修复提供一定的科学依据.
1 实验材料和方法
1.1 材料和试剂
二氧化钛(TiO2),购自于阿拉丁(上海)试剂有限公司,没有做进一步的提纯处理.NaNO3、NaOH和HNO3购自于广州化学试剂厂.实验所用的药品均为分析纯.TI(I)储备液用TlNO3(Acros,Belgium)和二次去离子水配制.
1.2 仪器
pH计(Sartorius pH-10);火焰原子吸收分光光度计(FAAS,SHIMADZU AA-6800,Japan);X射线衍射仪(PANalytical X’pert);比表面积和孔径采用BET法[18];阳离子交换量采用BaCl2-H2SO4方法[19];电荷零点(pHzpc)采用电位滴定法[20].
1.3 吸附实验
nano-TiO2对Tl(I)的吸附实验在室温下进行,以0.01 mol·L-1NaNO3为支持电解质,配制浓度为2.5 g·L-1的TiO2悬浊液,用0.01 mol· L-1NaOH和0.01 mol·L-1HNO3调节悬浊液的pH,使悬浊液的pH在吸附前后变化不超过±0.1.吸取20 mL悬浊液于50 mL聚丙烯管中,加入一定量Tl标准储备液,使得加入后聚丙烯管中溶液Tl(I)浓度为20 mg·L-1.在303 K条件下,振荡24 h,4 500 rpm离心5 min,0.45μm滤膜过滤,滤液采用火焰原子吸收分光光度计测试.测试条件:波长276.8 nm,光谱带宽0.5 nm,灯电流为8 mA.
每组3个平行样品,结果取其平均值.管壁吸附经实验验证可以忽略不计.计算吸附容量和吸附率(adsorption efficiency)如下公式:
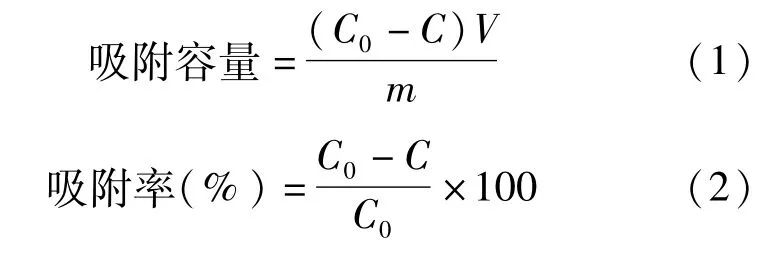
式中:C0和C分别为Tl(I)的初始浓度和剩余浓度,mg·L-1;m为吸附剂使用量,mg;V为溶液体积,L.
1.4 脱附实验
脱附实验采用NaNO3为背景,以验证TiO2吸附过程发生的位置和结合的紧密程度.移除15 mL吸附后的上清液,加入15 mL的0.01 mol·L-1NaNO3溶液,然后,在303 K的温度下,振荡2 h,离心(4 500 rpm)5 min,0.45μm过滤.实验重复5次,滤液上机测试.脱附率(Desorption efficiency)的计算公式如下:

1.5 数据分析方法
(1)动力学分析方法
吸附动力学取决于吸附质-吸附剂之间的相互反应和实验条件.为了更好的解释吸附剂与Tl(I)之间可能的吸附机制,本文使用拉格朗日(Lagergren)准一级动力学模型[21]、准二级动力学模型(Ho)模型[22]拟合了动力学实验数据.
Lagergren准一级动力学方程[21]:
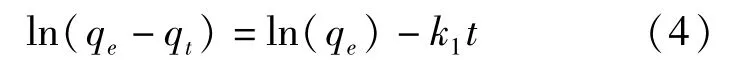
Ho准二级动力学方程[22]:

式中:k1、k2是吸附速率常数,min-1、g·mg-1·min-1;qt是t时间的吸附量,mg·g-1;qe是平衡吸附容量,mg·g-1.
(2)吸附等温线数据分析方法
本文对Tl(I)吸附数据分别使用了2种最常用的吸附等温线,模型分析如下:
①Langmuir模型[23]是基于假设:吸附为单分子层吸附,而且被吸附上的吸附质分子之间没有相互作用,线性方程式如下:
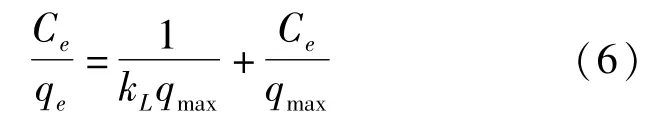
②Freundlich模型[24]一般应用在不均匀表面发生的多分子层吸附和非理想吸附中,吸附剂表面的被吸附分子存在吸附热分布不均匀的相互反应,线性方程式如下:
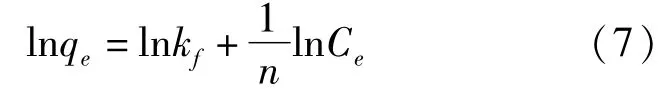
式中:qe为吸附容量,mg·g-1;Ce为平衡浓度,mg· L-1;qmax为最大吸附容量,mg·g-1;Langmuir方程中的kL值是与吸附能有关的吸附平衡常数,L· mg-1;Freundlich方程中的n值也可以作为重金属吸附力强度的指标,n<1代表此条件有利于吸附. kf为平衡常数,mg·g-1.
(3)热力学数据分析方法
热力学数据可以表现出吸附的本质能量变化信息.焓变(ΔH),熵变(ΔS)和吉布斯自由能函数变(ΔG)可以利用不同温度下的吸附数据通过以下公式计算出来:
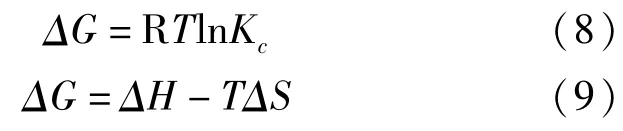
式中:Kc是平衡常数,R为气体常数,T为绝对温度.根据式(9)由不同温度下的吸附平衡常数Kc计算出ΔG的数值,以ΔG-T做线性回归,通过直线的斜率和截距求得焓变ΔH和熵变ΔS.
2 结果与讨论
2.1 nano-TiO2的理化性质
nano-TiO2比表面积和孔径分别为112.7 m2· g-1和10.2 nm;阳离子交换为22.5 meq·100 g-1;电荷零点(pHzpc)为6.0.
nano-TiO2的X射线图谱如图1.在2θ角度值为25.29°、37.98°、48.03°、53.92°、55.06°、62.68°,有6处峰较明显,分别对应101、004、200、105、211、204晶面,与锐钛型TiO2的标准图谱(JCPDS 89-4921)对比吻合,可以证明该材料为锐钛型TiO2,其粒径大小约为6.4~12.1 nm.
2.2 离子强度对nano-TiO2吸附Tl(I)的影响
离子强度是影响吸附的重要因素,图2为不同离子强度下(NaNO3浓度,0~1.0 M),nano-TiO2对Tl(I)吸附容量的变化曲线.Nano-TiO2对Tl(I)吸附容量在实验范围内,随着离子强度的增大先逐渐减小后趋于稳定,但下降幅度不大.
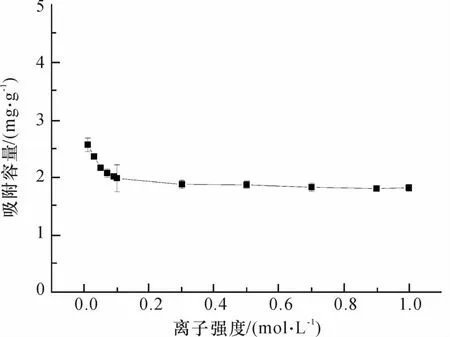
图2 离子强度对nano-TiO2吸附Tl(I)的影响Fig.2 Effect of ionic strength on the adsorption of Tl(I)onto nano-TiO2
研究结果表明,总体上nano-TiO2对Tl(I)的吸附都在一定程度上受到了抑制,吸附率下降,但影响不大.因此可以推测nano-TiO2对Tl(I)的吸附包括离子交换吸附,但离子交换的程度不大.进一步说明nano-TiO2对Tl(I)的吸附主要是通过其表面负电荷与Tl(I)的静电吸引作用.
2.3 pH对nano-TiO2吸附Tl(I)的影响
pH是影响金属离子在金属氧化物上的吸附量的重要因素,因为溶液的pH影响nano-TiO2表面点位的分布规律[17].
图3表示,nano-TiO2的吸附容量随着pH的变化曲线,在pH 2~10时,Tl在水溶液中主要以TI(I)存在.在高pH下,nano-TiO2表面的OH-提供了吸附的点位,而降低pH则导致nano-TiO2表面负电荷减少,使得吸附容量降低.其原因可能如下:①在零点电荷pH=6.0时,nano-TiO2的表面不带电.当pH<6.0,nano-TiO2的表面带正电荷,这增强了nano-TiO2与TI(I)的静电力,并且溶液中的H+与Tl+相互竞争nano-TiO2表面的可结合位点,所以吸附较慢;②当pH高于nano-TiO2的等电点时,nano-TiO2表面带负电荷,Tl(I)离子被迅速吸附;③在pH=8时,吸附效率大于80%,吸附容量为17.88 mg·g-1;而pH=10时,吸附效率已达99%,吸附容量为21.11 mg·g-1,吸附趋于完全.实验表明,nano-TiO2的吸附效果碱性条件比酸性条件好.此外,也可能由于在高pH条件下Tl(I)与OH-结合,形成TlOH或Tl2O沉淀(Ksp分别为-12.92、-27.09),又由于TiO2的比表面积大,从而能够吸附更多的Tl(I).ZHANG等[17]的研究表明,锐钛型TiO2对Tl(III)的吸附率随pH的增大而增大,与本文一致.
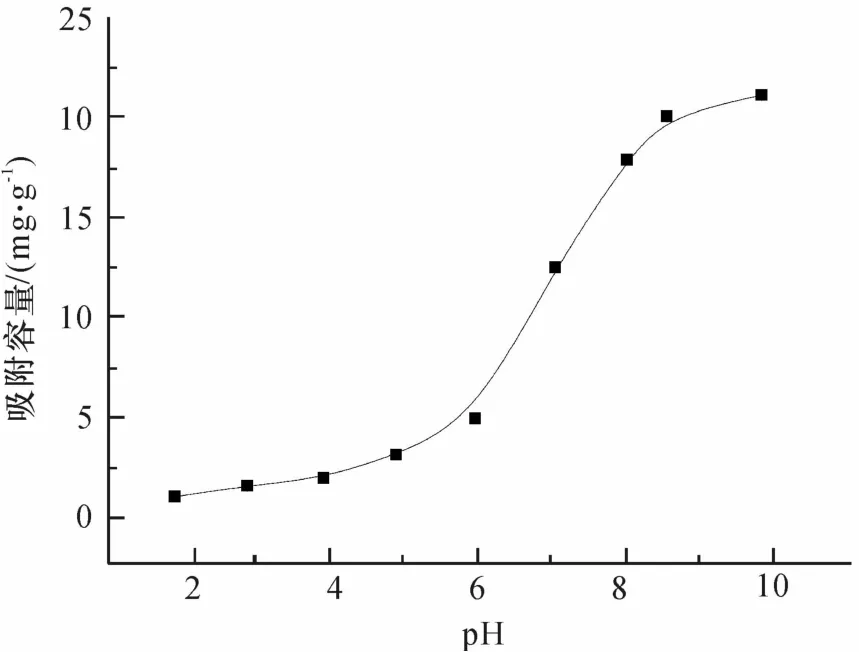
图3 pH对nano-TiO2吸附Tl(I)的影响Fig.3 Effect of pH on the Tl(I)adsorption onto nano-TiO2
2.4 投加量对nano-TiO2吸附Tl(I)的影响
投加量是影响nano-TiO2吸附Tl(I)的因素之一,实验结果见表1.吸附率随投加量增大而增大,吸附容量反之,其中吸附率或者吸附容量均发生由快到慢的变化,并趋于平缓.吸附剂用量为5.0 g·L-1时,吸附效率高达81.5%.
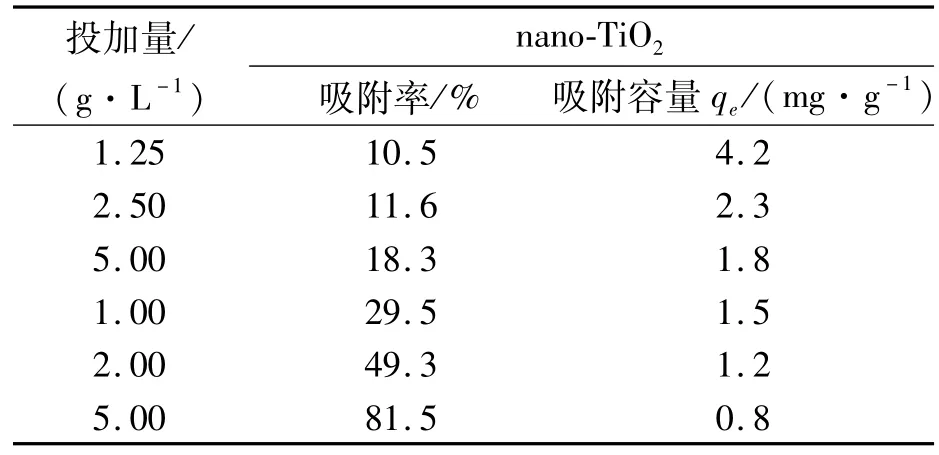
表1 投加量对nano-TiO2吸附Tl(I)吸附率和吸附容量的影响Table 1 Influence of adsorbent dosage on the adsorption efficiency(%)and capacity(qe,mg·g-1)for Tl(I)adsorption onto nano-TiO2
结果表明:①投加量小,重金属能轻易的吸附在吸附剂上.投加量多时,吸附剂过度拥挤,重金属很难到达吸附点位,形成固体浓度效应;②大量的吸附剂可能造成团聚,从而减少整体表面积以及增加重金属到达吸附点位的距离,形成固体团聚效应[25],从而造成了吸附率不断升高,但很难达到吸附完全.
2.5 时间对nano-TiO2吸附Tl(I)的影响
研究不同的接触时间(5 min~24 h)对Tl(I)的影响见图4.在吸附开始的前5 min,吸附量增加较为迅速,在接下来的20 min内,吸附量增加缓慢,然后在30 min之后达到平衡,表明该吸附反应是快速吸附过程.因此对nano-TiO2来说,意味着Tl(I)与TiO2表面的负电荷相互吸引[26],并且吸附过程迅速.
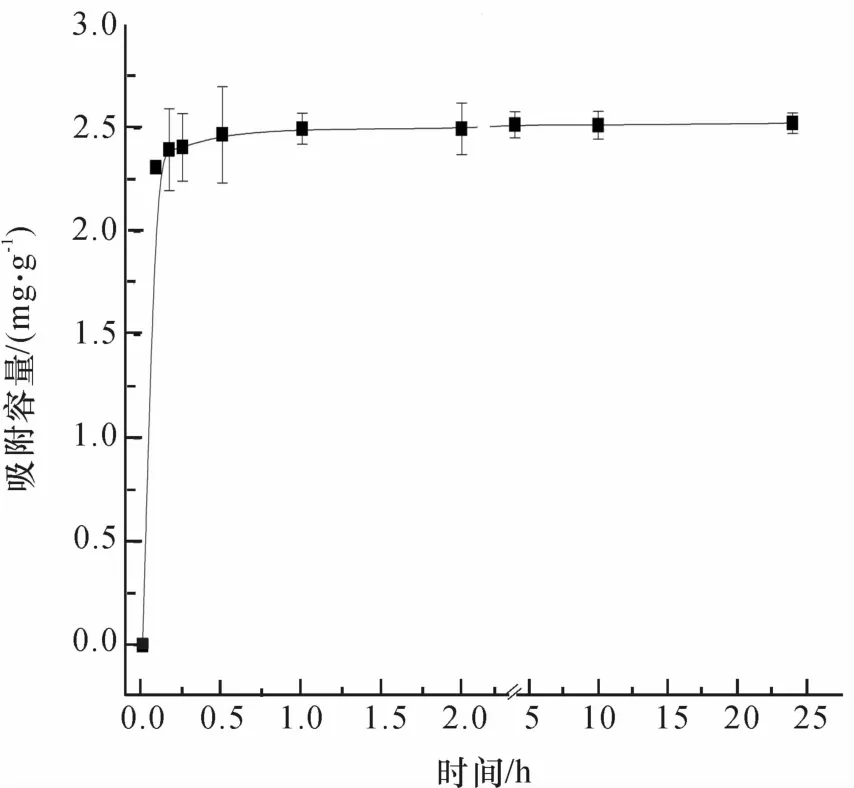
图4 nano-TiO2对Tl(I)的吸附动力学Fig.4 Adsorption kinetics model plots of Tl(I)adsorption onto nano-TiO2
将实验数据根据式(4)、(5)进行线性拟合,所得纳米TiO2的动力学参数和相关系数见表2.
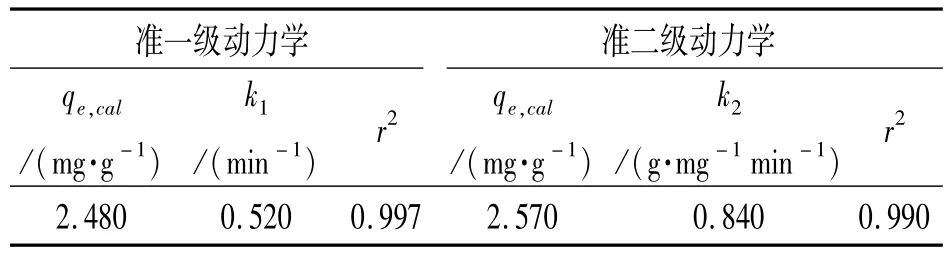
表2 nano-TiO2吸附Tl(I)的动力学参数Table 2 Kinetic parameters for Tl(I)adsorption onto nano-TiO2
由表2可见,准一级动力学模型的相关系数r2比准二级动力学模型的更高.这意味着准一级动力学模型能更好的描述Tl(I)在nano-TiO2上的吸附动力学.准一级动力学模型的计算平衡吸附量与实验值相接近也同样能说明这点.
2.6 等温吸附曲线和热力学
研究不同温度(288,303,318 K)条件下,nano-TiO2对Tl(I)吸附的影响见图5.温度降低能显著增强Tl(I)在nano-TiO2上的吸附量.在288 K时nano-TiO2的吸附量为15.7 mg·g-1,而升高温度到318 K时,nano-TiO2的吸附容量仅为12.7 mg· g-1.说明纳米TiO2对Tl(I)的吸附是放热过程.
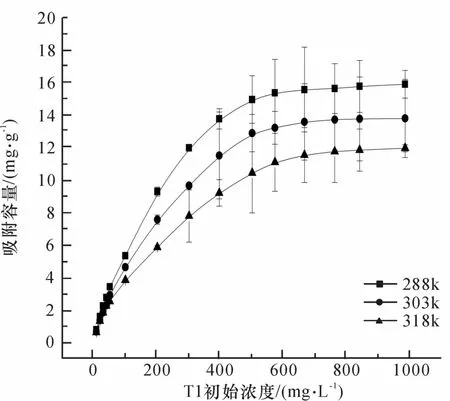
图5 不同温度下Tl(I)在nano-TiO2的等温吸附线Fig.5 Adsorption isotherms of Tl(I)onto nano-TiO2at different temperatures
表3列出了3种不同温度下,Tl(I)在nano-TiO2上的Langmuir,Freundlich吸附等温线模型拟合吸附参数.总体来看,2种吸附模型中Langmuir模型的相关系数r2(>0.99)最大,也就是说TiO2在3种不同温度时的吸附Tl(I)过程较符合Langmuir模型.这意味着吸附主要为单层吸附,而表中nano-TiO2的Freundlich常数n>1说明吸附是容易进行的,并且发生少量的多层吸附[27].
通过Langmuir方程计算出的最大吸附容量出现在288 K,结果为16.1 mg·g-1.ZHANG等[17]在Tl(III)浓度为1~35 mg·L-1时,nano-TiO2的最大饱和吸附量为4.87 mg·g-1.可以表明锐钛型nano-TiO2对Tl的2种价态均有一定吸附作用.

表3 Tl(I)的等温吸附模型参数Table 3 Isotherm parameters of Tl(I)adsorption onto nano-TiO2
另一个值得注意的因素是温度的变化.因此,引入热力学参数评价温度对吸附的影响,结果见表4.由表4可知,nano-TiO2的ΔH<0的,说明其吸附Tl(I)是放热反应,这与吸附等温线的结果是一致的.负的吉布斯函数变ΔG表明nano-TiO2吸附Tl(I)过程均可自发进行.除此之外,nano-TiO2吸附Tl(I)的ΔG随着温度的增加而较大幅度的降低,表明温度较高时吸附效率更高,这也与等温吸附实验结果相符.ΔS>0,说明随着温度的增加熵值增加,即体系的紊乱度增加(物理吸附紊乱度减小).

表4 nano-TiO2吸附Tl(I)的热力学参数Table 4 Thermodynamic parameters for the adsorption of Tl(I)onto nano-TiO2
2.7 脱附实验
脱附实验进行5次,其结果见图6.nano-TiO2第1次脱附率为45%,而在第3次就达到脱附平衡(59%).以上结果表明,被nano-TiO2吸附的Tl(I)可以很容易被解吸下来,这同样能反映出静电吸引是主要的吸附机制.
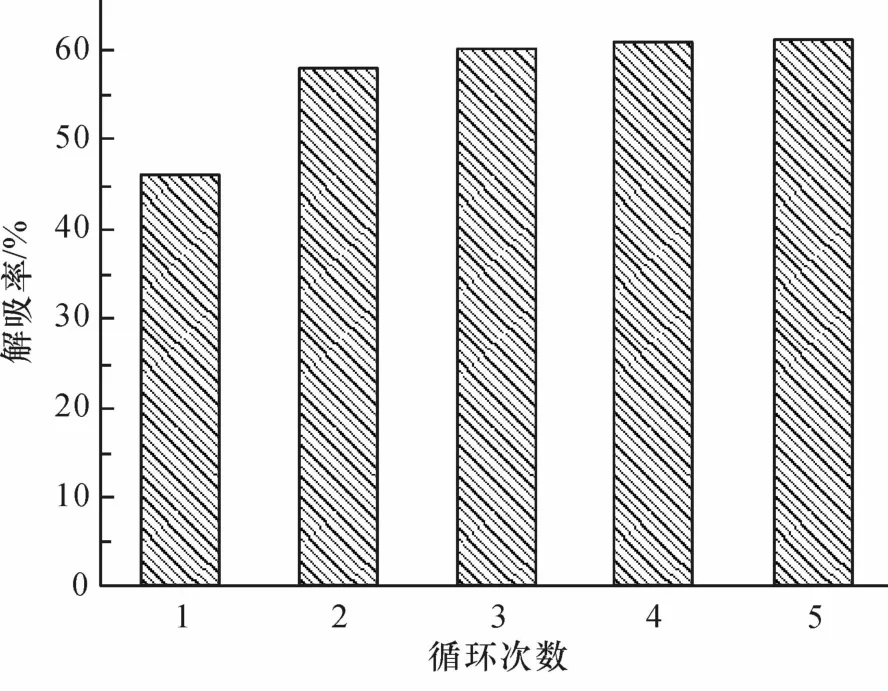
图6 循环次数对nano-TiO2脱附的影响Fig.6 The effectof recycle times on nano-TiO2desorption efficiency
3 结 论
(1)离子强度对吸附基本没有影响,在0.01 mol·L-1时吸附量稍大.
(2)pH增加有利于nano-TiO2的吸附.当pH高于nano-TiO2的等电点(5.96)时,吸附率大幅度提高;pH=10时吸附率达99.5%.
(3)nano-TiO2能较快的吸附Tl(I),在30 min即能基本吸附完全.准一级动力学方程拟合效果好,r2达0.99以上.
(4)在288,303,318 K 3温度下,nano-TiO2对Tl(I)的吸附随着温度的升高而降低,属于放热反应,并且均符合Langmuir吸附等温式.
[1] GALVÁN-ARZATE S,SANTAMARIA A.Thallium toxicity[J].Toxicol Lett,1998,99(1):1-13.
[2] CHEAM V.Thallium contamination of water in Canada[J].Water Qual Res JCan,2001,36(4):851-877.
[3] LAN C H,LIN T S.Acute toxicity of trivalent thallium compounds to Daphniamagna[J].Ecotox Environ Saf,2005,61:432-435.
[4] NTIS(National Technical Information Service)USEPA.Ambient water quality criteria for thallium[Z].EPA 440/5-80-074.U.S.1980.
[5] 邓红梅,陈永亨,刘涛,等.铊在土壤-植物系统中的迁移积累[J].环境化学,2013,32(9):1749-1757.
DENG H M,CHENG Y H,LIU T,etal.Study on the translocation and accumulation of thallium in soil-plant system[J]. Environ Chem,2013,32(9):1749-1757.
[6] XIAO T F,YANG F,LISH,et al.Thallium pollution in China:A geo-environmental perspective[J].Sci Total Environ,2012,421-422:51-58.
[7] YANG C X,CHEN Y H,PENG P A,et al.Distribution of natural and anthropogenic thallium in highly weathered soils[J].Sci Total Environ,2005,341:159-172.
[8] 陈少飞.北江原水铊污染应急处理技术应用实例[J].城镇供水,2011,6:41-44.
CHENG SF.A pilot of emergency treatment technology application inwater thallium pollution in Beijiang River[J].City Town Water Suppl,2011,6:41-44.
[9] EYDE D,JOHNSON T,HANLEY J.Using CABSORB ZS500RW for remediation of thallium in contaminated effluents,In:Adsorption,ion exchange,and solvent extraction:Adsorption II[C]∥127th TMSAnnual Meeting,Warrendale,PA.1998.
[10]SAIMA Q M,NAJMA M,AMBER R S.Sawdust:A green and economical sorbent for thallium removal[J].Chem Eng J,2008,140(1/3):235-240.
[11]ZEYNEPM S,ENOL U U.Thallium adsorption onto polyacryamide-aluminosilicate composites:A Tl isotope tracer study[J].Chem Engin J,2010,162(1):97-105.
[12]ALARIFIA,HANAFIA.Adsorption of cesium,thallium,strontium and cobalt radionuclides using activated carbon[J].J AtMol Sci,2010,1(4):292-300.
[13]LIU J,LIPPOLOD H,WANG J.Sorption of thallium(I)onto geologicalmaterials:Influence of pH and humicmatter[J]. Chemosphere,2011,82(6):866-871.
[14]邓红梅,王耀龙,吴宏海,等.γ-MnO2对Tl(I)的吸附性能[J].环境科学研究,2015,28(1):103-109.
DENG H M,WANGY L,WU H H,etal.Characteristics of Tl(I)adsorption onγ-MnO2[J].Res Environ Sci,2015,28(1):103-109.
[15]PU Y B,YANG X F,ZHENG H,et al.Adsorption and desorption of thallium(I)on multiwalled carbon nanotubes[J]. Chem Engin J,2013,219:403-410.
[16]REHMAN S,ULLAH N,KAMALIA R,etal.Study of thallium(III)adsorption ontomultiwall carbon nanotubes[J].New Carbon Mater,2012,27(6):409-415.
[17]ZHANG L,HUANG T N.Sorption of thallium(III)ions from aqueous solutions using titanium dioxide nanoparticles[J]. Microchim Acta,2009,165:73-78.
[18]张晓明,袁丹.新型比表面积测定仪在检测中的应用[J].计量与测试技术,2011,38(12):21-23.
ZHANG X M,YUAN D.New surface area analyzer in the detection[J].Metrol Measur Tech,2011,38(12):21-23.
[19]王富华.应用BaCl2-MgSO4法测定土壤阳离子代换量的研究[J].华中农业大学学报,1992,11(4):353-357.
WANG F H.Studies on determining cation exchange capacity with BaCl2-MgSO4method[J].JHuazhong AgriUniv,1992,11(4):353-357.
[20]ZHUANG J,YU G R.Effects of surface coatings on electrochemical properties and contaminant sorption of clay minerals[J].Chemosphere,2002,49(6):619-628.
[21]LAGERGREN S.Zur theorie der sogenannten adsorption gel ster stoffe[J].Kungliga Svenska Vetenskapsakad Handl,1898,24:1-39.
[22]HO Y S,MCKAY G.A comparison of chemisorption kinetic models applied to pollutant removal on various sorbents[J]. Trans Ichem E,1998,76:332-340.
[23]LANGMUIR I.The constitution and fundamental properties of solids and liquids.Part I.Solids[J].JAmer Chem Soc,1916,38(11):2221-2295.
[24]FREUNDLICH H.Uber die absorption in losungen[J].Z Phys Chem,1906,57:385-470.
[25]LAW S,TURNER A.Thallium in the hydrosphere of south west England[J].Environ Pollut,2011,159(12):3484-3489.
[26]GHAEDIM,HASSANZADEH A,KOKHDAN SN.Multiwalled carbon nanotubes as adsorbents for the kinetic and equilibrium study of the removal of Alizarin Red Sand Morin[J].JChem Engin Data,2011,56:2511-2520.
[27]YU L J,SHUKLA SS,DORRISK L,et al.Adsorption of chromium from aqueous solutions bymaple sawdust[J].JHazard Mater,2003,100:53-63.
Sorption characteristics of Tl(I)ions from aqueous solutions using nano-TiO2
DENG Hong-mei1ab,WANG Yao-long1a,2,WU Hong-hai2,LIU Tao1c,ZHANG Zi-jun3,WU Gao-yuan1ab,CHEN Yong-heng1ab
(1.a School of Environmental Science and Engineering;b.Guangzhou University Key Laborotary ofWater Safety and Protection in Pearl River Delta,Ministry of Education;c.School of Civil Engineering,Guangzhou University,Guangzhou 510006,China;
2.School of Chemical and Environmental Science,South China Normal University,Guangzhou 510006,China;
3.School of Environment and Energy,Peking University Shenzhen Graduate School,Shenzhen 518055,China)
Nanometer titanium dioxide(nano-TiO2)removal of Tl(I)from aqueous solution and its preliminary mechanism were investigated by using the batch adsorption experiments.The adsorption of Tl(I)onto nano-TiO2decreased with the increase of solution pH.When the pH of solution was higher than the isoelectric point(6.0),the adsorption was fast and adsorption efficiency reached up to 99%at pH10.The adsorption of Tl(I)onto nano-TiO2reached equilibrium within 30 minutes and was fitted well by the pseudo-first-ordermodel.Moreover,when the initial concentrations of Tl(I)in solution was 10~1 000 mg·L-1,the adsorption was fitted well by the Langmuir isotherm and at temperature 288,303,318 K the maximum adsorption of Tl(I)onto nano-TiO2were up to 15.7,13.8,11.6 mg·g-1,respectively.The value ofΔG andΔH were negative during the adsorption,which showed that the adsorption of Tl(I)onto nano-TiO2was essentially an exothermic and spontaneous process.These results indicated that nano-TiO2could be a very promising adsorbent for removal of Tl(I).
Tl(I);nano-TiO2;kinetics;isotherm;thermodynamics
X 71
A
【责任编辑:周 全】
1671-4229(2015)03-0017-07
2014-12-19;
2015-04-07
国家自然科学基金资助项目(41170399)
邓红梅(1978-),女,副教授,博士.E-mail:denghongmei51@126.com

