NLCM纯化的不同分化程度贲门腺癌细胞差异蛋白质组学研究
程 妍,李 阳,刘 冬,宋亚华,张 军,龚 均
(西安交通大学医学部第二附属医院:1.消化内科;2.耳鼻咽喉头颈外科,陕西西安 710004)
NLCM纯化的不同分化程度贲门腺癌细胞差异蛋白质组学研究
程 妍1,李 阳2,刘 冬1,宋亚华1,张 军1,龚 均1
(西安交通大学医学部第二附属医院:1.消化内科;2.耳鼻咽喉头颈外科,陕西西安 710004)
目的 联合导向激光捕获显微切割技术(NLCM)及蛋白质组学技术比较分析高分化贲门腺癌细胞和低分化贲门腺癌细胞的蛋白质表达图谱差异,寻找与贲门腺癌恶性程度和预后有关的分子标志物。方法 应用导向激光捕获显微切割技术分别获取高分化和低分化贲门腺癌细胞,提取蛋白质,应用双向凝胶电泳(2-DE)技术分离蛋白质,选定差异点,胶内酶解后,用基质辅助激光解析电离飞行时间质谱技术(MALDI-TOE MS)鉴定差异蛋白质,并用免疫组化方法验证差异蛋白的表达。结果 ①NLCM分别分离纯化了高分化和低分化贲门腺癌细胞;②建立了高分化和低分化贲门腺癌细胞的蛋白质表达图谱,两组分别检测到(846±52)个和(923±84)个蛋白质点,两组的匹配率为85.4%;③对高分化和低分化的贲门腺癌蛋白质表达谱进行比较分析,鉴定出10种差异蛋白,其中6个蛋白质在低分化贲门腺癌细胞中表达上调,4个蛋白质在低分化贲门腺癌细胞中表达下调;④差异蛋白质涉及细胞间信号转导、细胞代谢、凋亡及迁移等;⑤进一步通过免疫组化方法验证了差异蛋白HSP27的表达与蛋白质组学研究结果一致。结论 高分化和低分化贲门腺癌间存在蛋白质表达的差异,这些差异表达的蛋白质可能与贲门腺癌的恶性程度和预后有关。
贲门腺癌;激光捕获显微切割;蛋白质组学;分子标志物
自20世纪70年代中期以来,世界许多国家和地区食管下段腺癌和贲门腺癌发病率呈逐年上升趋势[1-2]。贲门腺癌早期症状不明显,确诊时多已属晚期。由于其解剖部位特殊,与远端胃癌相比,手术切除难度较大,术后较容易出现复发和转移。患者的总体预后较差。根治术后的5年生存率仅为30%左右,10年生存率低为3%~42%[3]。目前贲门腺癌癌变的机制尚不清楚。贲门腺癌的发生是一个多阶段进行性发展的过程。蛋白质组学(proteomics)是指应用各种手段来研究整个基因组编码的全部蛋白质的组成和活动规律的一门学科。采用蛋白质组学技术分析肿瘤蛋白质种类、表达水平的改变,对揭示肿瘤发病机制以及发现肿瘤标志物具有十分重要的作用[4-5]。
贲门腺癌是由贲门腺癌细胞及各种间质细胞所构成的混合体。组织异质性是蛋白质组学研究面临的一大问题。激光捕获显微切割技术(laser capture microdissection,LCM)可选择性的获取特定目的细胞群,保证了样品的纯度和精确度,有效的解决了组织样品的异质性问题[6]。本研究前期已成功构建了导向激光捕获显微技术(navigated laser capture microdissection,NLCM)在贲门腺癌蛋白质组学研究的技术平台[7]。在前期实验基础上,本研究将采用NLCM技术分离纯化高分化和低分化贲门腺癌细胞,通过2-DE凝胶电泳和MALDI-TOE MS的方法,分离和鉴定出不同分化程度的贲门腺癌细胞表达的差异蛋白质,为寻找与贲门腺癌恶性程度和预后有关的分子标志物奠定基础。
1 材料与方法
1.1 材料9例贲门腺癌患者手术组织标本均来自西安交通大学医学部第二附属医院、唐都医院和陕西省人民医院胸外科,并经病理医师确诊。所有患者在术前均未接受放疗或化疗,患者为50~80岁男性,平均年龄64岁。手术切除的贲门腺癌组织标本,-80℃保存。
1.2 冰冻切片制备用恒冷切片机制备8μm的贲门腺癌组织切片。
1.3 切片处理快速苏木素染色(LCM导向组):700 m L/L乙醇溶液固定冰冻切片,在含蛋白酶抑制剂的超纯水浸泡1 min,苏木素染色10~15 s,然后经700 m L/L乙醇、950 m L/L乙醇、无水乙醇梯度脱水、二甲苯透明后,室温完全干燥。无染色(NLCM组):除去苏木素染色步骤,其余同前。
1.4 导向激光捕获显微切割采用PixCellⅡLCM系统,在显微镜下观察用于LCM导向的染色切片,在感兴趣的部位进行取图作为导向图,然后换上用于NLCM的组织切片,在导向图的指引下进行捕获。切割后的LCM组织切片行苏木素染色,观察捕获结果,保证细胞捕获效率在90%以上[7]。将塑料帽盖到0.5 m L离心管上,-80℃冻存备用。
1.5 蛋白提取在离心管中加入裂解液,将塑料帽扣在离心管上,4℃20 000 r/min离心1 h,提取上清液,Bradford法蛋白定量[7]。
1.6 双向凝胶电泳在提取的蛋白质样本中加入水化液,在IPG phor等电聚焦仪上进行等电聚焦电泳,按如下条件:20℃,60μA/IPG strip,30 V 6 h、60 V 6 h、200 V 2 h、500 V 2 h、1 000 V 1 h、稳定在8 000 V,总共30 000 Vh T;等电聚焦结束后分别在平衡液Ⅰ和平衡液Ⅱ中平衡15 min;平衡后的IPG胶条转移至110 g/L SDS-PAGE胶上端,在垂直电泳槽上进行第二向垂直电泳,电泳结束后进行银染,实验重复3次[]。
1.7 凝胶图像分析用Image Master 2D Platinum Version 5.0凝胶分析软件对图像进行蛋白质斑点检测和匹配分析,比较分析高分化贲门腺癌细胞与低分化贲门腺癌细胞的2-DE图谱差异,选取表达水平相差2倍以上的蛋白质点进行质谱分析。
1.8 胶内酶解将选取的蛋白质点切成1 mm3大小放入离心管中,冲洗、脱色后,加入200μL的20 mmol/L DTT/25 mmol/L NH4HCO3,56℃还原1 h,室温冷却,加入等体积的55 mmol/L碘乙酰胺/ 25 mmol/L NH4HCO3,室温避光震荡45 min,再用乙腈脱水抽干;在冰上加入7~10μL的12.5 ng/μL胰酶溶液静置20 min,加入适量25 mmol/L NH4HCO3静置20 min,37℃过夜;加入50μL萃取液萃取15 min,吸取上清至另一离心管中,在余下的胶块中重复萃取1次,收集萃取液,真空干燥抽干。
1.9 质谱分析抽干的样本用2 m L/L TEA溶液溶解,然后与10 mg/m L的CHCA基质液按1∶2体积混合,充分混匀,吸取1μL,点于点样板上,空气中自然干燥;将样品置于Voyager-DETMMALDI-TOE质谱仪上进行分析,采用线性模式、正离子谱测定,设定离子源加速电压为20 k V,质谱信号单次扫描累加80次,用angiotensinⅡ(912.08 u)和insulin B chain(3 495.95 u)作为内标。
1.10 数据库搜索用Data Explorer软件对肽质量指纹图谱进行分析,将结果输入到http://www.expasy.org/tools/aldente/,用Aldente软件在SWISS-PROT和Tr EMBL数据库中鉴定蛋白质。
1.11 免疫组织化学染色免疫组织化学染色:按S-P免疫组化试剂盒说明进行。组织切片常规脱蜡、水化;于枸橼酸钠缓冲液中微波修复抗原;加入正常山羊血清封闭液;加入一抗HSP27(1∶500)4℃孵育过夜;加入SP免疫组化试剂盒中的生物素标记山羊抗兔IgG,37℃,孵育15 min;加入辣根过氧化物标记的链霉卵白素工作液,37℃,孵育15 min;DAB显色,苏木素复染,中性树胶封固。采用Q550CW型图像采集与分析系统测定灰度值进行结果判定。
1.12 统计学分析采用SPSS 11.5统计软件对实验数据进行统计处理,行t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 通过NLCM技术获得了高分化和低分化的贲门腺癌细胞采用NLCM技术分别从不同分化程度的贲门腺癌组织中成功分离出高分化和低分化贲门腺癌细胞。组织切片先经HE染色确定贲门腺癌的组织分化类型,在快速苏木素染色切片引导下进行显微切割,从而将贲门腺癌细胞准确地捕获至塑料帽的表面,切片上残留非特异性间质组织,细胞捕获效率达90%以上(图1)。

图2 不同分化程度的贲门腺癌细胞2-DE图谱Eig.2 2-DE protein pattern of well differentiated and poorly differentiated GCA

图1 NLCM纯化贲门腺癌细胞的过程Eig.1 Process of navigated laser capture microdissection of GCA tumor tissue
2.2 NLCM纯化的高分化和低分化贲门腺癌细胞的2-DE表达图谱的建立在相同的实验条件和参数设置下,对各组蛋白质样品分别进行3次2-DE以保证实验的重复性,得到高分化(A)和低分化(B)贲门腺癌细胞的2-DE图谱(图2),图中两者的蛋白质表达谱类似,蛋白质点多集中分布于等电点4.5~8.5和分子量85~28 ku之间。经Image Master软件分析,两组平均检测到的蛋白质点数为:高分化组846 ±52、低分化组923±84,两组的匹配率为85.4%。
2.3 差异蛋白质的质谱鉴定情况在上述匹配的基础上,结合肉眼观察进行蛋白质表达差异分析,筛选出差异≥2倍并具有统计学意义且在全部凝胶中存在的蛋白质点10个。差异点标示在图2中。将10个PMEs的质量数据输入到Aldente软件中,查询SWISS-PROT和Tr EMBL数据库,结合双向电泳蛋白质点的表观分子量及等电点数值,共鉴定出了10个差异蛋白质,其中低分化腺癌比高分化腺癌上调6个蛋白质(醛酮还原酶家族1C3、Bcl-2样蛋白11、锌指蛋白、GPR175、ATP合酶亚单位α、α肌动蛋白),下调4个蛋白质(MEMO1、二甲基精氨酸二甲胺水解酶、热休克蛋白27、神经调节蛋白2),具体见表1。
表1 高分化与低分化贲门腺癌比较的差异蛋白Tab.1 Differential proteins between well differentiated and poorly differentiated GCA(±s)

表1 高分化与低分化贲门腺癌比较的差异蛋白Tab.1 Differential proteins between well differentiated and poorly differentiated GCA(±s)
*低分化的贲门腺癌细胞/高分化的贲门腺癌细胞。
编号蛋白质比例(低分化/高分化)*P值表达上调的蛋白质13 Aldo-keto reductase family 1member C3(AKR1C3)4.073 0±1.142 0 0.018 0 23 Bcl-2-likeprotein 11 4.075 6±0.474 3 0.003 0 20 Zinc finger EYVE domain-containing protein 1 3.779 4±0.473 6 0.002 0 21 Integral membrane protein GPR175 3.248 4±0.823 6 0.048 0 70 ATP synthase bunit alpha 2.652 9±0.433 5 0.001 0 22 Alpha-centractin 2.599 7±0.216 1 0.014 0表达下调的蛋白质26 Protein MEMO1 0.334 9±0.043 1 0.007 0 47 NG,NG-dimethylarginine dimethylaminohydrolase 0.368 7±0.084 8 0.023 0 1 Heat-shock protein beta-1(HSP27)0.284 2±0.023 5 0.002 0 37 Neureg0.329 7±0.026 3 0.006 0 ulin-2
2.4 差异蛋白质的亚细胞定位及功能分类通过Swiss-Prot/Tr EMBL数据库对差异蛋白质进行亚细胞定位(图3)和功能分类(图4)。10个差异蛋白质的亚细胞定位:细胞质蛋白3个,线粒体蛋白1个,细胞膜蛋白3个,高尔基体蛋白1个,未知2个。10个差异蛋白质的功能分类涉及细胞代谢、分子伴侣、细胞凋亡、信号转导、细胞转移及其他。
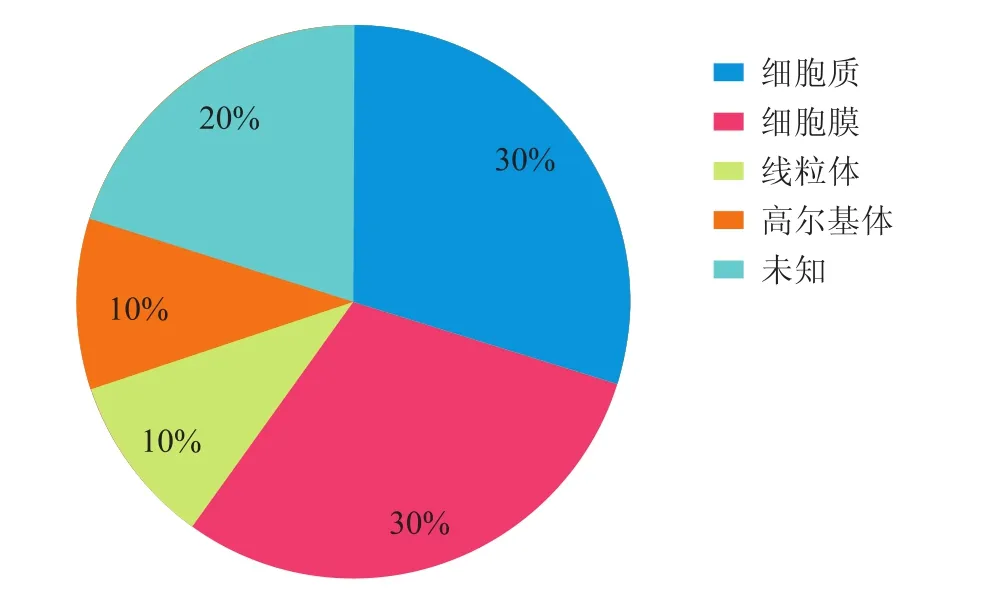
图3 差异蛋白质的细胞定位Eig.3 The subcelluar location of differential protein
2.5 差异蛋白质表达水平的验证情况为验证蛋白质组学研究的结果,分别选取12例高分化贲门腺癌患者和10例低分化贲门腺癌患者的病理组织切片,采用免疫组化方法检测1号差异蛋白质点HSP27在高分化和低分化贲门腺癌组织中的表达情况。结果显示:HSP27在两组中的表达量分别为140.516± 5.311和149.126±2.673,两组间有显著性差异(P<0.05)。表明HSP27的表达与贲门腺癌的分化程度有关,在高分化贲门腺癌中的表达与低分化腺癌相比明显升高。与蛋白质组学研究结果一致(表1)。
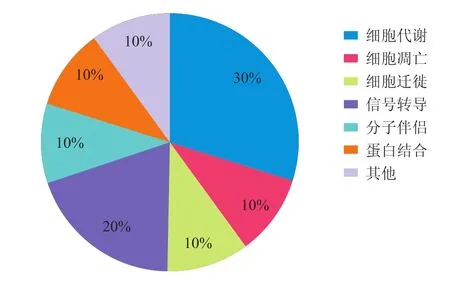
图4 差异蛋白质的功能分类Eig.4 The functional distribution of differential protein
3 讨 论
本实验应用NLCM与蛋白质组学技术比较高分化及低分化贲门腺癌肿瘤细胞中的蛋白质表达差异,有助于发现与贲门腺癌恶性程度相关的特异蛋白质,这些蛋白质不仅可为研究肿瘤发病机制提供线索,而且可作为肿瘤预后的生物标志物[8]。本研究发现的这些差异蛋白涉及多种功能,如细胞分子伴侣、参与细胞代谢、细胞凋亡、信号转导以及细胞转移等。
3.1 热休克蛋白热休克蛋白(heat shock proteins,HSPs)是一种在不良环境因素作用下产生的具有高度保守性的应激蛋白,普遍存在于整个生物界。按蛋白分子量大小,热休克蛋白共分为五类,分别为HSP100,HSP90,HSP70,HSP60以及小分子热休克蛋白(small heat shock proteins,s HSPs)(分子量在16~40 ku之间)等几个主要家族。热休克蛋白属于细胞内分子伴侣蛋白,对细胞应激、代谢、增殖以及凋亡等生理过程均具有重要的调控作用[9]。目前,已有较多HSPs与肿瘤相关的报道,如在胃癌[10-11]、食管鳞癌[12]、直结肠癌[13]及肝细胞癌[14]等肿瘤中HSPs均表现为过度表达。因此,HSPs是一项诊断肿瘤的有效指标[15]。与HSPs还与肿瘤的恶性程度有关,可作为独立判断多种肿瘤预后不良的分子指标。有研究报道HSP27与胃癌肿瘤分期、浸润深度有关,在胃癌中HSP27高表达提示胃癌恶性程度高,预后不良。本实验结果显示HSP27在高分化贲门腺癌中表达高于低分化贲门腺癌,表明其可能与贲门腺癌的预后有关。
3.2 代谢酶醛酮还原酶家族1C3(aldo-keto reductase family 1member C3,AKR1C3)有显著的11-醛酮还原酶活性,能转化醛和酮变为醇,并参与前列腺素的代谢过程,催化(PG)D2成为PGE2。(PG)D2具有化学不稳定性,首先变为PGJ2,后转化成15-PGJ2,即过氧化物酶体活化受体γ(PPARγ)的天然配基,AKR1C3可调控细胞的分化与生长,是一种细胞分化抑制因子。已有报道显示AKR1C3在胃癌、胰腺癌[16]、乳腺癌,前列腺癌[17]等多种肿瘤中高表达。利用基因芯片技术发现AKR1C3的表达还与TSGH-S3胃癌细胞对奥沙利铂化疗耐受有关[18]。AKR1C3的酶活性可被NSAIDs明显抑制,成为NSAIDs的非环氧合酶依赖的抗肿瘤作用的靶点[19]。本研究发现AKR1C3在低分化腺癌表达高于高分化腺癌,提示AKR1C3可能与贲门腺癌的发展、化疗效果及预后有关。AKR1C3在贲门腺癌化疗耐受中的作用有待进一步研究。
3.3 线粒体相关蛋白线粒体是真核生物能量和代谢的中心,其内含有多种蛋白质酶系,约占整个细胞蛋白质种类的5%~10%,线粒体在调控细胞信号转导、细胞凋亡中起决定性作用。本实验中鉴定出的ATP合酶亚单位α为线粒体蛋白,它广泛分布于线粒体内膜,参与氧化磷酸化和光合磷酸化,在跨膜质子动力势的推动下合成ATP。在病理条件下,活性氧(ROS)生成明显增加,Bax与bcl-2结合,线粒体渗透性转变核孔(PTP)开放,细胞色素C从线粒体内释放到胞质中,caspase家族激酶激活,引起细胞凋亡的级联反应[20]。此外,线粒体氧化磷酸化功能降低可促进肿瘤细胞增殖,线粒体呼吸酶复合体表达减少与肿瘤细胞侵袭性增加密切相关[21]。本研究显示ATP合酶亚单位α在低分化腺癌中表达高于高分化腺癌,提示ATP合酶亚单位α可能与贲门腺癌的预后有关。
本研究应用比较蛋白质组学技术筛选了不同分化程度的贲门腺癌组织间差异表达的10个蛋白质,这些差异蛋白质可能与贲门腺癌的发生及预后等有关。我们将进一步对差异表达的蛋白质及其相关基因进行研究,将基因与蛋白质相结合进行分析,为贲门腺癌的发生发展机制提供理论依据。
[1]WALTHER C,ZILLING T,PERFEKT R,et al.Strongly increasing incidence of adenocarcinoma of the esophagus and gastric cardia[J].Lakartidningen,2004,101(3):180-183.
[2]BLOT WJ,DEVESA SS,KNELLER RW.Rising incidence of adenocarcinoma of the esophagus and gastric cardia[J].JAJM,1991,265(10):1287-1289.
[3]TYTGAT GN,BARTELINK H,BERNARDS R,et al.Cancer of the esophagus and gastric cardia:recent advances[J].Dis Esophagus,2004,17:10-26.
[4]陈主初,梁宋平.肿瘤蛋白质组学[M].长沙:湖南科技出版社,2002:1-7.
[5]LIU Y,LI Y,TAN BB,et al.Technique appraisement of comparative proteomics andscreening of differentiation-related protein in gastric carcinoma[J].Hepatogastroenterology,2013,60(123):633-637.
[6]DECARLO K,EMLEY A,DADZIE OE,et al.Laser capture microdissection:methods and applications[J].Methods Mol Biol,2011,755:1-15.
[7]程妍,张军,张蓉,等.导向激光捕获显微切割技术在贲门腺癌差异蛋白质组学的应用研究[J].西安交通大学学报:医学版,2014,35(4):557-561.
[8]ORNSTEIN DK,PETRICOIN EF.Proteomics to diagnose human tumors and provide prognostic information[J].Oncology,2004,18(4):521-529.
[9]KAMPINGA HH.Chaperones in preventing protein denaturation in living cells and protecting against cellular stress[J]. Handb Exp Pharmacol,2006,172:1-42.
[10]KAPRANOS N,KOMINEA A,KONSTANTINOPOULOS PA,et al.Expression of the 27-k Da heat shock protein(HSP27)in gastric carcinomas and adjacent normal,metaplastic,and dysplastic gastric mucosa,and its prognostic significance[J].J Cancer Res Clin Oncol,2002,128(8):426-432.
[11]ZHU Y,LIU Y,QIAN Y,et al.Research on the efficacy of Celastrus Orbiculatus in suppressing TGF-β1-induced epithelialmesenchymal transition by inhibiting HSP27 and TNF-α-induced NF-κB/Snail signaling pathway in human gastric adenocarcinoma[J].BMC Complement Altern Med,2014,14(5):433.
[12]黄志勇,熊刚,张军,等.应用二维电泳和质谱技术筛选食管癌及癌旁组织的差异表达蛋白质[J].南方医科大学学报,2007,27(9):1406-1409.
[13]LAWRIE LC,CURRAN S,MCLEOD I,et al.Application of laser capture microdissection and proleomics in colon cancer[J].Mol Pathol,2001,54(4):253-258.
[14]GRUDEN G,CARUCCI P,LOLLI V,et al.Serum heat shock protein 27 levels in patients with hepatocellular carcinoma[J].Cell Stress Chaperones,2013,18(2):235-241.
[15]WANG X,CHEN M,ZHOU J,et al.HSP27,70 and 90,antiapoptotic proteins,in clinical cancer therapy(Review)[J].Int J Oncol,2014,45(1):18-30.
[16]CHANG TS,LIN HK,ROGERS KA,et al.Expression of aldoketo reductase family 1 member C3(AKR1C3)in neuroendocrine tumors&adenocarcinomas of pancreas,gastrointestinal tract,and lung[J].Int J Clin Exp Pathol,2013,6(11):2419-2429.
[17]LIN HK,STECKELBROECK S,FUNG KM,et al.Characterization of a monoclonal antibody for human aldo-keto reductase AKR1C3(type 2 3alpha-hydroxysteroid dehydrogenase/ type 5 17beta-hydroxysteroid dehydrogenase);immunohistochemical detection in breast and prostate[J].Steroids,2004,69(13-14):795-801.
[18]CHEN CC,CHU CB,LIU KJ,et al.Gene expression profiling for analysis acquired oxaliplatin resistant factors in human gastric carcinoma TSGH-S3 cells:the role of IL-6 signaling and Nrf2/AKR1C axis identification[J].Biochem Pharmacol,2013,86(7):872-887.
[19]YEPURU M,WU Z,KULKARNI A,et al.Steroidogenic enzyme AKR1C3 is a novel androgen receptor-selective coactivator that promotes prostate cancer growth[J].Clin Cancer Res,2013,9(20):5613-5625.
[20]GARRIDO C,GALLUZZI L,BRUNET M,et al.Mechanisms of cytochreme c release from mitochondria[J].Cell Death Differentiation,2006,13(9):1432-1433.
[21]SIMONNET H,ALAZARD N,PFEIFFER K,et al.Low mitochondrial respiratory chain content correlated with tumor aggressiveness in renal cell carcinoma[J].Carcinogenesis,2002,23(5):759-768.
(编辑 韩维栋)
Differential proteomics analysis of navigated laser capture microdissection of well and poor differentiated human gastric cardia adenocarcinoma
CHENG Yan1,LI Yang2,LIU Dong1,SONG Ya-hua1,ZHANG Jun1,GONG Jun1
(1.Department of Digestive Diseases;2.Department of Otolaryngology Head and Neck Surgery,the Second Affiliated Hospital of Xi'an Jiaotong University Health Science Center,Xi'an 710004,China)
Objective To obtain protein biomarkers used for malignant degree and prognosis of human gastric cardiac adenocarcinoma(GCA)tissues captured by navigated laser capture microdissection(NLCM)and proteomics technology.Methods We performed navigated LCM to enrich the malignant gastric cardiac cells from surgical specimens of human GCA.The proteins extracted from these cells were then separated.Differential protein spots were identified by peptide mass fingerprint(PMF)based on matrix-assisted laser desorption/ionization time-of-flight mass spectrometry(MALDI-TOF MS)and database searching.To validate the expression patterns of HSP27,immunohistochemistry was performed using formalin-fixed and paraffin-embedded tissue specimens.Results ①We obtained the 2-DE patterns of high resolution and reproducibility of well(group A)and poorly(group B)differentiated human GCA tissues captured by NLCM.②The detected spots between them were as follows:846± 52 and 923±84 between group A and group B.The percentage of matched spots between them was 85.4%.③With mass spectrometry technology(peptide mass fingerprint),10 protein spots were successfully identified.Six proteins had significantly higher expression in poorly differentiated GCA than in well differentiated GCA.Another 4 proteins had a significantly lower expression in poorly differentiated GCA than in well differentiated GCA.④The identified proteins of GCA were classified in terms of their cellular localization and physiological function usinginformation from SWISS-PROT and NCBI websites.Most of the proteins were involved in cell signal transduction,cell metabolism,apoptosis and migration.⑤The expression of HSP27 in well differentiated GCA was higher than in poorly differentiated GCA group(P<0.05),which was in agreement with proteomic results.Conclusion Ten differentially expressed proteins identified between the poorly differentiated and well differentiated GCA tissues indicate that they may be associated with the malignance degree of GCA and the prognosis of GCA.
gastric cardia adenocarcinoma;laser capture microdissection;proteomics;biomarker
R735.2
A
10.7652/jdyxb201505021
2015-04-26
2015-05-22
国家自然科学基金资助项目(No.30470785)Supported by the National Natural Science Foundation of China(No.30470785)
张军.E-mail:jun3z@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150721.1604.008.html(2015-07-21)

