小鼠骨关节炎模型中胫骨软骨下骨微结构的Micro-CT分析
吉 喆,党晓谦,王坤正,周 虹
(1.西安交通大学医学部第二附属医院骨科,陕西西安 710004;2.悉尼大学ANZAC研究所,澳大利亚悉尼 2139)
小鼠骨关节炎模型中胫骨软骨下骨微结构的Micro-CT分析
吉 喆1,党晓谦1,王坤正1,周 虹2
(1.西安交通大学医学部第二附属医院骨科,陕西西安 710004;2.悉尼大学ANZAC研究所,澳大利亚悉尼 2139)
目的 应用显微CT(Micro-CT)技术观察和分析小鼠骨关节炎模型中软骨下骨微结构的变化,为进一步了解软骨下骨在骨关节炎疾病发展中的作用提供一定的实验基础。方法 野生型小鼠12只,随机均分为内侧半月板-胫骨韧带切断术组(DMM组)和对照组(假手术组)。术后8周,取两组动物术侧全膝关节置于Micro-CT仪器中进行扫描,应用三维重建处理和分析软件对内侧胫骨平台软骨下骨全部及其外、中、内1/3三个亚区域的骨体积分数(BV/ TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)和组织骨密度(TMD)进行检测,并行膝关节的病理组织学染色。结果 与对照组比较,DMM实验组小鼠在Micro-CT成像和组织学染色上均出现软骨下骨骨小梁增宽、致密、排列紊乱不均匀等表现,关节内侧缘可见骨赘形成;在全部亚区域的Tb.Th、外1/3亚区域的BV/TV与TMD、中1/3亚区域的BV/TV、Tb.Th与TMD、内1/3亚区域的Tb.Th均升高,而在全部亚区域的Tb.N、外1/3亚区域的Tb.Sp、中1/3亚区域的Tb.N与Tb.Sp、内1/3亚区域的BV/TV与Tb.N均降低。结论 对小鼠DMM骨关节炎模型的胫骨软骨下骨多个亚区域进行微结构的Micro-CT测量分析可获得小鼠模型更加全面的数据资料。
Micro-CT;骨关节炎;软骨下骨;骨微结构
骨关节炎(osteoarthritis,OA)是一种慢性退行性关节疾病,并常有软骨、软骨下骨、滑膜、半月板、韧带、肌腱及关节表面肌肉受累[1]。而在中老年人群中,OA多数表现为膝关节的退行病变,临床上患者长期受关节疼痛、肿胀、僵硬及活动功能障碍的困扰,严重影响其生活质量。实验研究发现,在OA的病理生理过程中,不仅仅存在着软骨的损伤和修复[2],同时,也存在关节软骨下骨的结构和功能改变[3-5]。虽然目前尚缺乏足够的证据证明软骨下骨的病变是OA疾病发生的启动因素,但大量的研究不仅证实了软骨下骨的改变是OA疾病发生发展的重要方面,而且软骨下骨微结构与生物力学的改变也可以促使软骨的退变[5-7]。因此,对软骨下骨微结构的研究可以更深层次地认识软骨下骨在OA疾病发生发展过程中的作用。
骨结构研究主要采取的是体视学研究方法,即将骨组织切片扫描得到图像,建立数学模型,计算得到骨的各项指标[8]。而计算机X射线断层扫描(computed tomography,CT)由于其分辨率有限,无法研究骨微结构。随着Micro-CT技术的出现和进步,人们不仅可以在活体上研究骨微结构,如骨小梁形态,而且在不破坏骨组织的前提下,还能更快得到更多、更精细的数据,比如骨组织图像的三维重建和骨组织各项参数的定量分析等[9-11]。由于其在骨组织分析中的这些优点,该技术在骨科研究中的应用具有许多不可替代的优势[9-10,12]。本研究旨在通过应用Micro-CT技术对小鼠OA模型中软骨下骨微结构的变化进行观察和分析,为进一步研究OA疾病的发展提供更多的理论依据。
1 材料与方法
1.1 实验动物健康5月龄雄性野生型小鼠12只,体质量为50~60 g。实验动物由悉尼大学动物实验中心提供。小鼠饲养在恒温(21~22℃)的SPE(specific pathogen free)房间,每隔12 h光暗循环,实验期间动物自由摄食和饮水(消毒自来水)。实验选取的时间段为9∶00~12∶00。实验中对动物的处置符合《澳大利亚关于善待和使用实验动物的科学研究准则》以及中华人民共和国科学技术部颁布的《关于善待实验动物的指导性意见》的相关要求。
1.2 主要材料、仪器和软件SkyScan 1172高分辨率台式Micro-CT系统,比利时Bruker公司的CTVox V3.0、Data Viewer V1.5.1、CT Analyser V1.14.4软件。
1.3 动物分组及骨关节炎建模方法采用随机数字表将实验小鼠均分为2组,每组6只,即内侧半月板-胫骨韧带切断术组(DMM组)和对照组(假手术组)。DMM组小鼠即骨关节炎模型组,具体建模方法为:用含75 g/L氯胺酮与10 g/L盐酸甲苯噻嗪的生理盐水腹腔注射进行麻醉,仰卧固定,右下肢膝关节及周围备皮、消毒、铺无菌手术巾,于解剖显微镜下行右膝关节髌骨内侧切口,将髌骨翻向外侧,显露内侧半月板-胫骨韧带(图1),镜下切断此韧带,避免损伤关节软骨,通过内侧半月板的被动移位来确认韧带的完全横断[12-13]。复位髌骨,缝合关节囊及皮肤。对照组小鼠给予假手术处理,即显微镜下行右膝关节髌骨内侧表浅皮肤切开后立即关闭切口。术后实验动物分组分笼饲养,不限制其自由活动。术后8周进行以下检测。
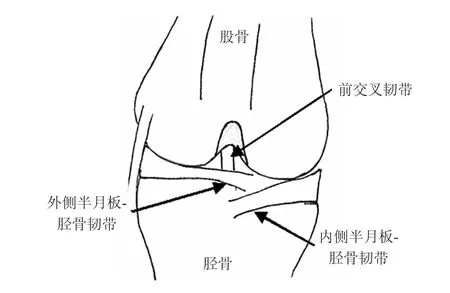
图1 小鼠正常膝关节模式图Eig.1 Diagram of the normal knee joint of the mouse
1.4 Micro-CT扫描术后8周处死小鼠。取小鼠右侧全膝关节(包括全膝关节及邻近股骨远端和胫骨近端),置于40 g/L多聚甲醛溶液中固定48 h。制备好的全膝关节标本进行Micro-CT扫描,条件为源电压59 k V、源电流167μA、深度16 bit、曝光时间295 ms,分辨率为9.18μm,对同一标本获得500张不同横截面1 000×1 000像素的BMP图片。
1.5 软骨下骨三维重建及测量指标应用Data Viewer V1.5.1三维重建处理软件和CT Analyser V1.14.4组织分析软件,对全膝关节的Micro-CT扫描图片进行三维图像重建,选取2组小鼠重组图像相同位置的软骨下骨感兴趣区域(region of interest,ROI)进行定量分析。具体分析指标如下:骨体积分数(bone volume fraction,BV/TV)以%表示;骨小梁厚度(trabecular thickness,Tb.Th)以像素值表示;骨小梁数量(trabecular number,Tb.N)以1/像素值表示;骨小梁分离度(trabecular separation,Tb. Sp)以像素值表示;组织骨密度(tissue mineral density,TMD)以g/cm3表示。
1.6 组织学检查全膝关节标本经脱钙、脱水、石蜡包埋处理与冠状位多层次连续组织切片后,进行甲苯胺蓝-固绿溶液组织学染色。
1.7 统计学方法
运用SPSS V22.0软件对实验数据进行两组间比较的独立样本t检验分析,所有数据均采用±s表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 Micro-CT成像图小鼠右侧膝关节Micro-CT成像结果如图2所示。DMM造模方法主要造成内侧半月板失稳,故本实验着重观察了膝关节内侧胫骨平台处的软骨下骨微结构变化(图3):DMM实验组软骨下骨骨小梁出现增宽、致密等表现并呈现“融合”现象,部分骨小梁排列紊乱不均匀、网状结构消失,关节内侧边缘处可见不同程度的椭圆形或圆形骨赘形成;对照组软骨下骨骨小梁均匀、形状规则、排列较为整齐有序。另外,可观察到实验组内侧胫骨平台软骨下骨的外、中、内3个亚区域微结构变化也存在差异,即内、中部亚区域骨小梁改变较明显,外部亚区域则改变较小,故对小鼠膝关节内侧胫骨平台软骨下骨进行了分区域研究。
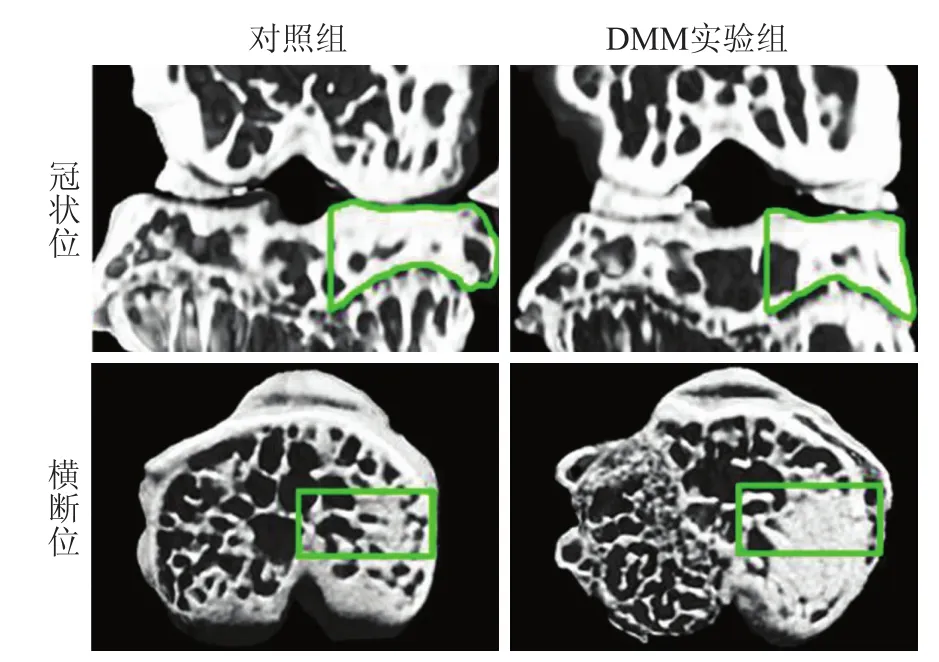
图2 小鼠膝关节冠状位及胫骨近端横断位的Micro-CT成像图及ROIEig.2 Micro-CT images and ROI of the coronary sections of knee joint and the transverse sections of proximal tibia between the two groups
2.2 软骨下骨微结构参数变化
2.2.1 BV/TV测量结果 DMM实验组和对照组小鼠在膝关节内侧胫骨平台软骨下骨全部亚区域的BV/ TV相近且差异无统计学意义,而在3个亚区域的测量值差异均有统计学意义,即在外1/3亚区域,实验组为(75.49±1.02)%,显著大于对照组的(69.64±1.85)%(P=0.0197);在中1/3亚区域,实验组为(79.44± 0.76)%,显著大于对照组的(73.56±1.39)%(P= 0.004 1);在内1/3亚区域,实验组为(65.87± 1.83)%,显著小于对照组的(73.25±1.06)%(P= 0.005 8,图4)。
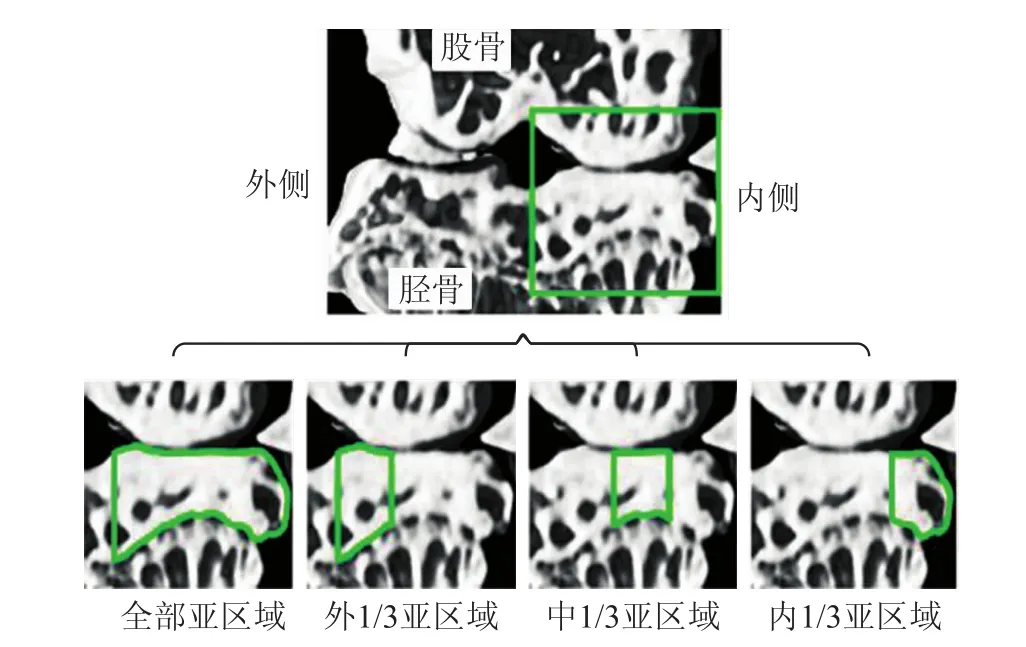
图3 膝关节内侧胫骨平台软骨下骨的亚区域Micro-CT成像结果及ROIEig.3 Micro-CT images and ROI of the compartments of subchondral bone from medial tibial plateau of knee joint
2.2.2 Tb.Th测量结果 DMM实验组和对照组小鼠在膝关节内侧胫骨平台软骨下骨外1/3亚区域的Tb.Th值差异无统计学意义,而在其他区域的测量值则差异均有统计学意义,即在全部亚区域,实验组为(25.16±0.48)%,显著大于对照组的(20.71± 0.49)%(P=0.0001);在中1/3亚区域,实验组为(21.23±0.72)%,显著大于对照组的(17.71± 0.57)%(P=0.0032);在内1/3亚区域,实验组为(21.57±0.76)%,显著大于对照组的(18.78± 0.62)%(P=0.0173,图4)。
2.2.3 Tb.N测量结果 DMM实验组和对照组小鼠在膝关节内侧胫骨平台软骨下骨外1/3亚区域的Tb.N值相近且差异无统计学意义,而在其他区域的测量值则差异均有统计学意义,即在全部亚区域,实验组为(0.029±0.001)%,显著小于对照组的(0.035 ±0.001)%(P=0.000 5);在中1/3亚区域,实验组为(0.038±0.001)%,显著小于对照组的(0.042± 0.001)%(P=0.028 5);在内1/3亚区域,实验组为(0.031±0.001)%,显著小于对照组的(0.039± 0.001)%(P=0.000 2,图4)。
2.2.4 Tb.Sp测量结果 DMM实验组和对照组小鼠在膝关节内侧胫骨平台软骨下骨全部亚区域和内1/3亚区域的Tb.Sp值差异均无统计学意义,而在其他区域的测量值差异则均有统计学意义,即在外1/3亚区域,实验组为(10.87±0.84)%,显著小于对照组的(14.31±0.72)%(P=0.011 0);在中1/3亚区域,实验组为(6.51±0.35)%,显著小于对照组的(9.01±0.53)%(P=0.002 8,图4)。
2.2.5 TMD测量结果 DMM实验组和对照组小鼠在膝关节内侧胫骨平台软骨下骨全部亚区域的TMD值相近且差异无统计学意义,在内1/3亚区域的TMD值差异无统计学意义,而在其他区域的测量值差异则均有统计学意义,即在外1/3亚区域,实验组为(0.773±0.012)%,显著大于对照组的(0.713± 0.012)%(P=0.005 2);在中1/3亚区域,实验组为(0.859±0.013)%,显著大于对照组的(0.798± 0.018)%(P=0.021 7,图4)。
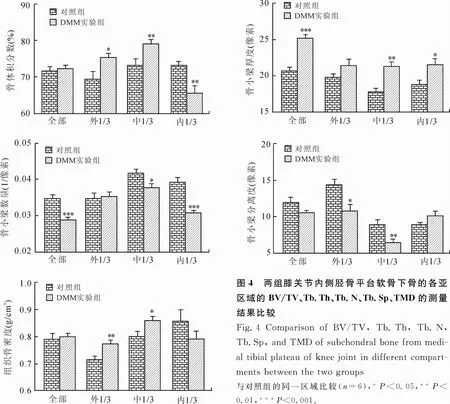
图4 两组膝关节内侧胫骨平台软骨下骨的各亚区域的BV/TV、Tb.Th、Tb.N、Tb.Sp、TMD的测量结果比较Eig.4 Comparison of BV/TV,Tb.Th,Tb.N,Tb.Sp,and TMD of subchondral bone from medial tibial plateau of knee joint in different compartments between the two groups
2.3 甲苯胺蓝-固绿溶液组织学染色结果软骨组织染为深紫蓝色,骨组织染为浅青绿色;DMM实验组小鼠的膝关节内侧胫骨平台处(图5黑框区域)较对照组的表面软骨退化、变薄,软骨下骨致密、孔隙少,且内侧边缘可见明显的椭圆形或圆形骨赘形成(图5)。
3 讨 论
骨生物力学的研究分为“量”、“质”两个方面,分别包括数量、容积、微结构、骨基质矿化等多个方面[14]。Micro-CT通过X线扫描和三维重建技术,一次扫描同时测量骨微结构与骨密度等的多项参数[10],在三维重建模型上得到的骨结构数据更精确,解决了骨组织在切片过程中的不固定性和所得二维图像局限性的问题,并且符合实验动物使用的替代(Replacement)、减少(Reduction)和优化(Refinement)的“3R”原则[15],Micro-CT已成为研究分析骨微观结构的理想研究工具。本文即使用Micro-CT技术对小鼠全膝关节进行高分辨率三维成像,显示并定量分析了DMM术后影响最大的内侧胫骨平台软骨下骨的详细三维参数,进而完善了小鼠早中期OA模型软骨下骨发展变化的理论。
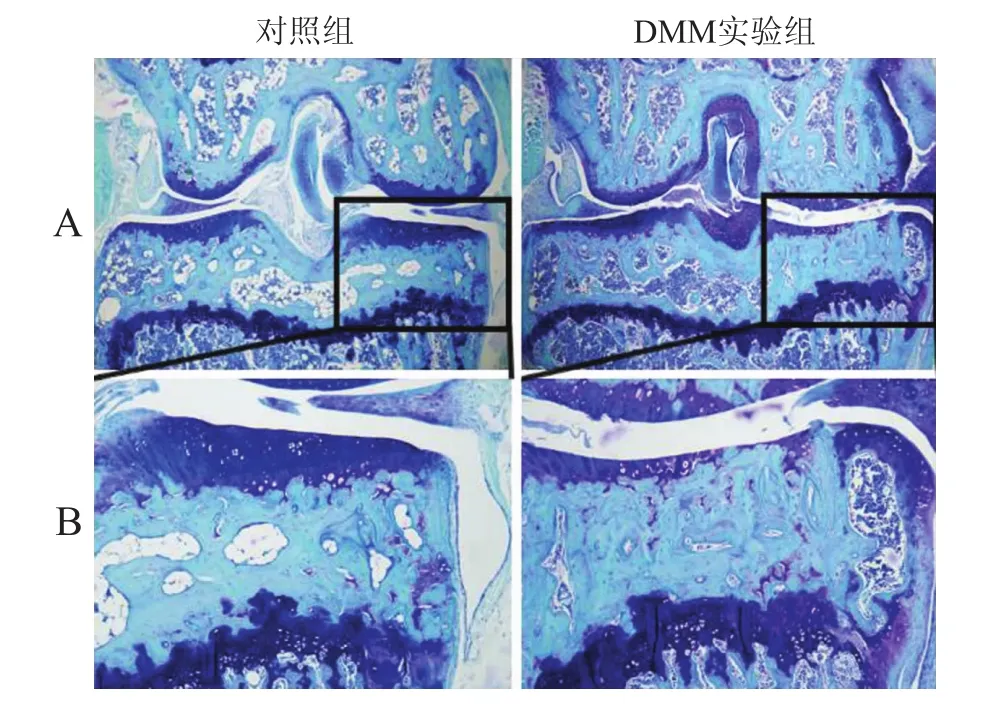
图5 两组小鼠右侧膝关节的甲苯胺蓝-固绿溶液组织学染色结果Eig.5 Histological comparison of right knee joints between the two groups
目前有学者认为,软骨下骨结构和功能改变可能是导致OA发病的重要因素之一[7,16-17]。GLASSON等[13]已经证实了DMM诱导的小鼠是可靠的小鼠骨关节炎模型,而且DMM术后8周的小鼠具有早中期骨关节炎病理变化的特征。而IIJIMA等[12]又发现,DMM诱导的大鼠骨关节炎模型内侧胫骨平台软骨下骨在早期即有缺损且被纤维组织填充,并且内侧胫骨平台表面软骨也有不同区域的变化。本实验中DMM小鼠模型膝关节内侧胫骨平台的软骨下骨微结构变化和组织学检查与GLASSON等[13]实验的小鼠模型表型一致,如软骨下骨骨小梁出现增宽、致密等表现并呈现“融合”现象,部分骨小梁排列紊乱不均匀,关节内侧边缘处可见不同程度的椭圆形或圆形骨赘形成等。
在本实验Micro-CT的宏观成像图(图2)中,可以大致观察到两组小鼠内侧胫骨平台软骨下骨的骨质变化有差异,于是划分亚区域进行Micro-CT参数分析。其中,BV/TV反映骨组织体积所占总体积的比值,TMD指骨密度或骨矿物质密度,反映骨组织矿化水平;两组小鼠的BV/TV和TMD数据初步证实:OA小鼠早中期的软骨下骨骨量和骨矿化水平在内侧胫骨平台的外1/3和中1/3亚区域均明显升高,而在内1/3亚区域则明显下降(或下降趋势),但在全部亚区域均无明显差异。这提示小鼠OA发展的早中期可能存在软骨下骨局部邻近亚区域之间的骨量转移,使总骨量和矿化水平尚能维持不变,而这些变化与骨细胞、成骨细胞、破骨细胞之间的相互作用有关[18-19]。Tb.Th、Tb.N和Tb.Sp分别指骨小梁的平均厚度、数量和稀疏程度;两组间的这些数据显示:OA小鼠各亚区域(除外1/3亚区域)的骨小梁平均厚度均明显增宽;OA小鼠各亚区域(除外1/3亚区域)的Tb.N均明显减少;OA小鼠外1/3和中1/3亚区域的骨小梁均较致密;两组小鼠在每单一亚区域的Tb.Th、Tb.N及Tb.Sp变化趋势中均有不同。这些数据提示:小鼠早中期OA的软骨下骨内1/3亚区域的各项参数变化可能与骨赘形成有关;中1/3亚区域的骨质致密,可能与DMM术后局部承重负荷变大引起骨组织重塑有关;外1/3亚区域的骨小梁致密,可能与软骨下骨部分承重有关。
本研究存在的局限性:探讨了小鼠OA疾病发展的中期阶段(术后8周)内侧胫骨平台软骨下骨亚区域的骨质变化,未对其早、晚期阶段的骨质变化进行研究;未深入探讨DMM引起软骨下骨微结构变化的机制,如分子生物学机制,尤其是骨代谢的信号通路在OA软骨下骨微结构变化过程中的作用机制。
综上所述,应用Micro-CT技术对小鼠DMM骨关节炎模型的胫骨软骨下骨多个亚区域进行微结构测量分析,获得了有关小鼠OA模型更加全面的数据资料,有助于分析软骨下骨在OA疾病发展过程中的作用,为进一步的相关基础和临床研究奠定实验理论基础。
[1]LOZITO TP,ALEXANDER PG,LIN H,et al.Three-dimensional osteochondral microtissue to model pathogenesis of osteoarthritis[J].Stem Cell Res Ther,2013,4 Suppl 1:S6.
[2]杨益民,王民,李萌.氨基胍对兔骨关节炎软骨细胞凋亡的影响[J].西安交通大学学报:医学版,2008,29(3):285-288.
[3]ABRAMSON SB,ATTUR M.Developments in the scientific understanding of osteoarthritis[J].Arthritis Res Ther,2009,11(3):227.
[4]FELSON DT.An update on the pathogenesis and epidemiology of osteoarthritis[J].Radiol Clin North Am,2004,42(1):1-9.
[5]FELSON DT,NEOGI T.Osteoarthritis:is it a disease of cartilage or of bone?[J].Arthritis Rheum,2004,50(2):341-344.
[6]MANSELL JP,COLLINS C,BAILEY AJ.Bone,not cartilage,should be the major focus in osteoarthritis[J].Nat Clin Pract Rheumatol,2007,3(6):306-307.
[7]ZAMLI Z,ROBSON BK,TARLTON JF,et al.Subchondral bone plate thickening precedes chondrocyte apoptosis and cartilage degradation in spontaneous animal models of osteoarthritis[J].Biomed Res Int,2014,2014:606870.
[8]WANG X,ZAUEL RR,RAO DS,et al.Cancellous bone lamellae strongly affect microcrack propagation and apparent mechanical properties:separation of patients with osteoporotic fracture from normal controls using a 2D nonlinear finite element method(biomechanical stereology)[J].Bone,2008,42(6):1184-1192.
[9]GIELKENS PF,SCHORTINGHUIS J,DE JONG JR,et al.A comparison of micro-CT,microradiography and histomorphometry in bone research[J].Arch Oral Biol,2008,53(6):558-566.
[10]BOUXSEIN ML,BOYD SK,CHRISTIANSEN BA,et al.Guidelines for assessment of bone microstructure in rodents using microcomputed tomography[J].J Bone Miner Res,2010,25(7):1468-1486.
[11]王佰亮,丁铭.Micro-CT技术在股骨头微观结构分析中的应用[J].中华骨科杂志,2010,30(2):209-212.
[12]IIJIMA H,AOYAMA T,ITO A,et al.Destabilization of the medial meniscus leads to subchondral bone defects and site-specific cartilage degeneration in an experimental rat model[J]. Osteoarthr Cartil,2014,22(7):1036-1043.
[13]GLASSON SS,BLANCHET TJ,MORRIS EA.The surgical destabilization of the medial meniscus(DMM)model of osteoarthritis in the 129/SvEv mouse[J].Osteoarthr Cartil,2007,15(9):1061-1069.
[14]RUBIN C,TURNER AS,MULLER R,et al.Quantity and quality of trabecular bone in the femur are enhanced by a strongly anabolic,noninvasive mechanical intervention[J].J Bone Miner Res,2002,17(2):349-357.
[15]FLECKNELL P.Replacement,reduction and refinement[J]. Altex,2002,19(2):73-78.
[16]LEYH M,SEITZ A,DURSELEN L,et al.Subchondral bone influences chondrogenic differentiation and collagen production of human bone marrow-derived mesenchymal stem cells and articular chondrocytes[J].Arthritis Res Ther,2014,16(5):453.
[17]FINDLAY DM,ATKINS GJ.Osteoblast-chondrocyte interactions in osteoarthritis[J].Curr Osteoporos Rep,2014,12(1):127-134.
[18]ATKINS GJ,FINDLAY DM.Osteocyte regulation of bone mineral:a little give and take[J].Osteoporos Int,2012,23(8):2067-2079.
[19]BONEWALD LF.The amazing osteocyte[J].J Bone Miner Res,2011,26(2):229-238.
(编辑 国 荣)
Micro-CT analysis on subchondral-bone microstructure of tibia in a mouse model of osteoarthritis
JI Zhe1,DANG Xiao-qian1,WANG Kun-zheng1,ZHOU Hong2
(1.Department of Orthopedics,the Second Affiliated Hospital of Xi'an Jiaotong University Health Science Center,Xi'an 710004,China;2.ANZAC Research Institute,the University of Sydney,Sydney 2139,Australia)
Objective To analyze the subchondral-bone microstructure in a mouse model of osteoarthritis(OA)via micro-CT technology so as to provide experimental basis for further study of subchondral bone during the development of osteoarthritis.Methods Twelve wild-type mice were randomly divided into DMM(destabilization of the medial meniscus)group and control(sham operation)group.All the knee joints for surgery from the two groups were scanned by micro-CT equipment,reconstructed and analyzed to acquire data of bone volume fraction(BV/TV),trabecular thickness(Tb.Th),trabecular number(Tb.N),trabecular separation(Tb.Sp)and tissue mineral density(TMD)from the total,outer,middle,and inner 1/3 compartments of subchondral bone in medial tibial plateau 8 weeks after surgery.Histological staining was also applied.Results Compared with those in control group,extended,denser and uneven trabeculae and osteophyte formation from micro-CT imaging and histology were observed in the subchondral bone of DMM-induced mice.There were higher Tb.Th in total,BV/TV and TMD in outer 1/3,BV/TV,Tb.Th and TMD in middle 1/3,and Tb.Th in inner 1/3 compartments,while there were correspondingly lower Tb.N in total,Tb.Sp in outer 1/3,Tb.N and Tb.Sp in middle 1/3,BV/TV and Tb.N in inner 1/3 compartments.Conclusion More comprehensive data could be acquired from the microstructureof subchondral-bone compartments by micro-CT analysis in the mouse model of DMM-induced OA.
micro-CT;osteoarthritis;subchondral bone;bone microstructure
R684.3
A
10.7652/jdyxb201505010
2015-02-27
2015-05-01
国家留学基金资助项目(No.201306280099)Supported by the State Scholarship Fund from the China Scholarship Council(No.201306280099)
党晓谦.E-mail:dangxiaoqian@vip.163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150717.0925.006.html(2015-07-17)

