EZH2抑制剂对宫颈癌HeLa细胞的抑制作用
丁沐阳,蒋文军,张 力,崔雨蒙,张 航,史丽云,高艳娥
(1.西安交通大学医学部第二附属医院妇产科,陕西西安 710004;2.杭州师范大学医学院,浙江杭州 310012)
EZH2抑制剂对宫颈癌HeLa细胞的抑制作用
丁沐阳1,蒋文军1,张 力1,崔雨蒙1,张 航2,史丽云2,高艳娥1
(1.西安交通大学医学部第二附属医院妇产科,陕西西安 710004;2.杭州师范大学医学院,浙江杭州 310012)
目的 探讨EZH2(enhancer of zeste homolog 2)抑制剂对宫颈癌HeLa细胞增殖与转移能力的抑制作用。方法 将EZH2抑制剂GSK343作用于体外培养的人宫颈癌HeLa细胞,用MTT及克隆形成率实验检测细胞生长和增殖的变化,细胞划痕实验测定细胞迁移能力的变化,Western blot检测上皮间质转化相关蛋白E-cadherin和N-cadherin的表达;同时以等体积GSK343溶剂DMSO为对照。结果 MTT结果显示,GSK343对HeLa细胞的生长具有明显抑制作用,呈时间依赖性;克隆形成和细胞划痕实验显示,GSK343能显著抑制HeLa细胞的增殖及迁移能力;Western blot结果显示,GSK343处理后细胞上皮标志蛋白E-cadherin表达明显增高,间质标志蛋白N-cadherin表达明显减低。结论 EZH2抑制剂GSK343可抑制人宫颈癌HeLa细胞的增殖与迁移,其机制之一可能是通过抑制HeLa细胞上皮间质转化过程来实现的。
EZH2抑制剂;宫颈癌细胞;细胞增殖与迁移;上皮间质转化
宫颈癌(cervical cancer)是全世界范围内威胁女性健康的第二大恶性肿瘤,在肿瘤相关死亡疾病中排名第四[1]。恶性肿瘤的增殖转移是一个多基因参与、多阶段相互作用的过程。目前,恶性肿瘤转移的分子机制众说纷纭。上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤进展的重要事件,其以上皮细胞极性的丧失并获得间充质细胞表型和运动能力为特征,在肿瘤细胞的侵袭和转移中发挥着重要作用。
果蝇zeste基因增强子(enhancer of zeste homolog 2,EZH2)是一种甲基化酶,属于PRC2(polycomb repressive complex 2)复合物中重要的催化亚基,能够使组蛋白27位赖氨酸发生3甲基化,从而发挥表观遗传学作用。研究发现,EZH2在宫颈癌组织中存在异常高表达,可能参与肿瘤细胞的增殖、侵袭与转移等过程[2]。
本研究将EZH2抑制剂GSK343作用于人宫颈癌HeLa细胞,检测HeLa细胞在增殖转移等方面的改变,探讨EZH2抑制剂对宫颈癌HeLa细胞的调控作用。
1 材料与方法
1.1 菌株和试剂人宫颈癌细胞株He La购自美国ATCC;EZH2抑制剂GSK343购自美国Selleck公司,按照说明书溶于DMSO中使浓度为1 mol/L,分装后-80℃冰箱保存;DMEM高糖培养基、胎牛血清及2.5 g/L胰酶购自美国Gibco公司;青-链霉素溶液购自杭州吉诺生物公司;兔抗E-cadherin、N-cadherin及鼠抗β-actin抗体购自美国CST公司;MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]、Giemsa染料及Ripa裂解液,购自美国Sigma公司;BCA蛋白定量试剂盒为上海博彩生物公司产品;软琼脂购自北京鼎国昌盛生物技术公司。
1.2 细胞培养和实验分组将HeLa细胞置于含100 m L/L胎牛血清及1×青链霉素的DMEM高糖培养基中培养,至对数生长期,2.5 g/L胰酶消化,离心弃上清,重悬细胞,细胞计数,根据不同目的的实验分别接种于6孔板、96孔板及100 mm培养皿中,同时设立实验组及对照组。实验组即EZH2抑制剂GSK343处理组(EZH2 inhibitor,EI),将EZH2抑制剂GSK343保存液稀释于含100 m L/L胎牛血清及1×青链霉素的DMEM高糖培养基中,至作用浓度50μmol/L;对照组(negative control,NC)则在相同培养基中加入同体积溶剂DMSO。
1.3 MTT法检测细胞的生长变化取对数生长期的HeLa细胞,用胰酶消化、培养基重悬后计数,将细胞铺于96孔板中,每孔细胞约5×103个,补充培养基至每孔200μL,设置实验组(EI),等体积溶剂DMSO处理组作为对照(NC)。每组每个时间点5个复孔,置于37℃、50 m L/L CO2培养箱内培养。分别培养24、48、72 h后,加入10μL MTT(终质量浓度5 mg/m L),37℃孵育4 h后加入DMSO,分光光度计测各孔在490 nm的吸光度值(A),绘制细胞生长曲线。
1.4 克隆形成率的计数取对数生长期的He La细胞,用胰酶消化、培养基重悬后计数,将软琼脂与培养基1∶1混匀后,加入EZH2抑制剂GSK343制备的实验组培养基,使作用浓度为50μmol/L;对照组(NC)培养基含等体积DMSO。铺于6孔板中,每孔200个细胞,每组3个复孔,置于37℃、50 m L/L CO2培养箱内培养12 d后,观察细胞的生长情况。每孔用100 g/L Giemsa溶液500μL染色20 min,置于低倍显微镜下计数≥50个细胞数的集落数。每孔取3个视野进行计数。
1.5 细胞划痕实验取对数生长期的He La细胞,用胰酶消化、培养基重悬后计数,将细胞铺于6孔板中(每孔4×105个),实验组(EI)与对照组(NC)分别换用相应的培养基,置于37℃、50 m L/L CO2培养箱内培养48 h,用200μL枪头垂直划线,1×PBS冲洗3遍后两组均加入含100 m L/L EBS的DMEM培养基,于24 h后显微镜下照相,比较划痕空隙间细胞的生长变化。
1.6 Western blot检测上皮间质转化相关蛋白E-cadherin及N-cadherin的表达取对数生长期的He La细胞,用胰酶消化、培养基重悬后计数,将细胞铺于6孔板中(每孔4×105个),分为实验组(EI)与对照组(NC),置于37℃、50 m L/L CO2培养箱内培养48 h;提取实验组和对照组细胞总蛋白,用BCA法测定提取蛋白浓度。取80μg蛋白质100 g/L SDSPAGE电泳,电转移至PVDE膜,50 g/L脱脂牛奶室温封膜1 h,分别加入1∶1 000稀释的兔抗E-cadherin及N-cadherin,4℃过夜,TBST洗膜后,加入相应的辣根过氧物酶标记的二抗,室温孵育2 h,TBST洗膜后,ECL化学发光显色系统显色。以β-actin为内参。
1.7 统计学分析 使用SPSS 17.0统计学软件进行数据处理。计量资料以均数±标准差表示,多组数据之间的差异性比较采用单因素等方差t检验的方法进行比较,P<0.05为差异有统计学意义。
2 结 果
2.1 EZH2抑制剂GSK343对宫颈癌HeLa细胞生长增殖力的抑制作用MTT结果显示,随时间推移,实验组(EI)细胞生长速度明显低于对照组(NC),差异具有统计学意义(P<0.01,图1),GSK343对HeLa细胞生长的抑制呈时间依赖性(图2)。细胞克隆形成率实验结果提示,细胞接种12 d以后,EZH2抑制剂处理组克隆数量为24±1.741,显著少于对照组的(42±1.345),差异具有统计学意义(P<0.01,图3)。以上结果提示,EZH2抑制剂具有明显抑制人宫颈癌He La细胞的生长增殖能力。
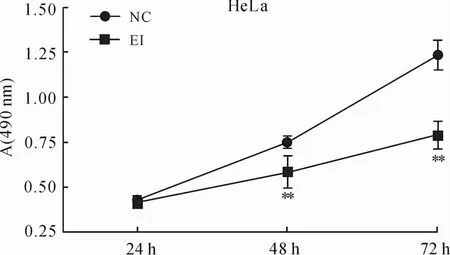
图1 实验组(EI)与对照组(NC)处理后吸光值的变化Eig.1 Changes of optical density(A)measured after EZH2 inhibitor or vehicleadministration
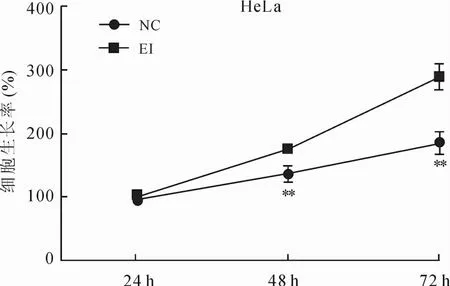
图2 实验组(EI)与对照组(NC)处理后细胞生长率的变化Eig.2 Changes of cell viability after EZH2 inhibitor or vehicle administration

图4 实验组与对照组细胞划痕愈合情况的对比Eig.4 Comparison of wound healing between the two groups
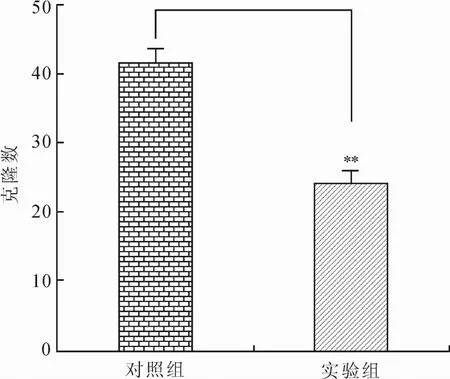
图3 实验组与对照组克隆形成的对比Eig.3 Changes of clone formation rate after EZH2 inhibitor or vehicle administration**P<0.01。
2.2 EZH2抑制剂GSK343对宫颈癌HeLa细胞迁移能力的抑制作用细胞经划痕处理24 h后,观察细胞生长变化。对照组划痕区域细胞生长旺盛,细胞形态正常,占据空隙面积较大,为(72.415± 1.326)%;实验组划痕区域细胞生长呈局限性,细胞形态较小,占据空隙面积为(49.99±1.252)%,两组比较差异具有统计学意义(P<0.05,图4)。提示EZH2抑制剂可以明显抑制人宫颈癌HeLa细胞的迁移能力。
2.3 EZH2抑制剂GSK343对宫颈癌HeLa细胞上皮间质化相关蛋白表达的影响用EZH2抑制剂GSK343预处理HeLa细胞48 h后(EI),上皮细胞标志蛋白E-cadherin表达较对照组(NC)明显升高,而间质细胞标志蛋白N-cadherin表达明显降低(图5)。说明EZH2抑制剂处理He La细胞48 h后,细胞较对照组更呈现出上皮特征改变,提示EZH2抑制剂可以明显抑制He La细胞的EMT改变。
3 讨 论
宫颈癌是常见妇科恶性肿瘤之一,肿瘤的复发转移是导致临床宫颈癌患者死亡的主要原因。因此,如何减少肿瘤的复发和转移、延长患者的生存期和提高其生活质量是我们需要解决的关键问题。目前,研究认为宫颈癌的发生与发展是多基因作用、多因素参与和多阶段发展的病理过程,涉及众多癌基因的激活与抑癌基因的异常。
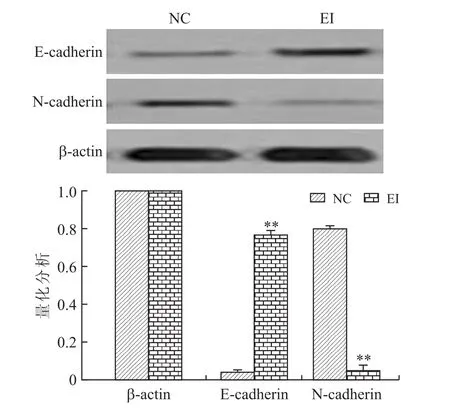
图5 实验组(EI)与对照组(NC)E-cadherin and N-cadherin的Western blot结果Eig.5 E-cadherin and N-cadherin expressions determined by Western blot assay
近来研究表明,表观遗传调控因子PcG蛋白表达异常与肿瘤的发生和恶性进展密切相关。EZH2基因在PcG基因家族中起着核心作用。EZH2通过对核小体组蛋白H3的9、27位赖氨酸进行甲基化修饰抑制抑癌基因的转录而发挥作用,其高表达提示预后不良[3]。EZH2具有组蛋白甲基转移酶、组蛋白去乙酰化酶和多种基因外的调控作用,参与基因的转录抑制,通过抑制染色质中的靶基因而调节细胞增殖,其在宫颈癌、子宫内膜癌、卵巢癌、前列腺癌等多种肿瘤组织中都有异常高表达,可能参与了肿瘤的增值、侵袭与转移等过程[4]。
目前,很多研究支持EZH2在多种恶性肿瘤的发展过程中充当致癌基因,参与肿瘤的转移与复发等相关机制。在EZH2敲除的前列腺癌细胞系中,肿瘤的生长与侵袭能力明显降低。EZH2抑制剂3-Deazaneplanocin A(DZNep)可以显著加速肿瘤细胞的凋亡而不影响正常细胞,明显抑制肿瘤细胞的增殖、侵袭和转移能力[5-6]。一些高选择性的小分子EZH2抑制剂已经被研制出来,如EPZ-6438、EPZ005687、EI1以及本研究中的GSK343等,这些抑制剂可以高效地抑制淋巴瘤Y641的EZH2活性。目前,EPZ-6438已临床试验用来治疗B细胞淋巴瘤及一些实体肿瘤[7]。本研究提示,EZH2抑制剂作用于宫颈癌HeLa细胞后,MTT检测细胞生长情况,发现处理48 h及72 h均能明显抑制细胞的生长增殖与迁移能力;细胞克隆形成实验发现,EZH2抑制剂处理组的克隆形成数量显著低于对照组;细胞划痕实验结果显示,EZH2抑制剂预处理后细胞转移能力明显降低。以上实验说明,EZH2抑制剂具有抑制宫颈癌HeLa细胞增殖与转移能力。
有研究表明,在恶性肿瘤的侵袭和转移初始阶段,肿瘤上皮细胞即可发生EMT,相应地抑制或逆转EMT可抑制肿瘤的侵袭和转移[8]。EMT的发生,可促使肿瘤发生早期的浸润和转移,其中E-cadherin蛋白的分解是促使细胞发生EMT的一个关键步骤。KRISHNAMACHARY等人[9]研究发现,E-cadherin蛋白表达缺失在肿瘤的侵袭和转移的中起重要作用。另有研究表明,N-cadherin可以通过抗凋亡机制促进癌细胞生长[10]。在前列腺癌、恶性黑色素瘤中,E-cadherin和N-cadherin的表达呈负相关;而且,E-cadherin的缺失可以诱导N-cadherin的表达[11]。本实验结果提示,EZH2抑制剂处理人宫颈癌HeLa细胞48 h后,E-cadherin蛋白的表达较对照组明显升高,N-cadherin的表达明显抑制,提示EZH2抑制剂可以抑制HeLa细胞的EMT过程。提示EZH2抑制剂抑制HeLa细胞增殖和转移能力的机制之一为抑制宫颈癌HeLa细胞的EMT过程,它有可能成为有效抑制宫颈癌细胞生长的重要手段。这提示我们在未来进一步的研究中,应将重点放在转移相关蛋白与EZH2活性的相互作用关系的研究上。
本研究提示的EZH2与EMT相关表型与潜在机制对宫颈癌认识和治疗具有深远的指导意义。提示,通过特异性的抑制剂作用这条通路,可以导致表观遗传学的再修饰,包括E-cadherin蛋白的表达上调。使侵袭性的宫颈癌细胞向低侵袭性的具有上皮特性的细胞转化,可能作为未来的抑制肿瘤发展及转变EZH2生物活性的长远策略。
[1]JEMAL A,BRAY F,CENTER MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):6990.
[2]刘莹,高庆,高艳娥,等.宫颈癌中EZH2的表达与细胞增殖和血管生成的关系[J].西安交通大学学报:医学版,2013,34(5):580-584.
[3]KHAN SN,JANKOWSKA AM,MAHFOUZ R,et al.Multiple mechanisms deregulate EZH2 and histone H3 lysine 27 epigenetic changes in myeloid malignancies[J].Leukemia,2013,27(6):1301-1309.
[4]HIROHITO Y,MIEN-CHIE H.Regulation and role of EZH2 in cancer[J].Cancer Res Treat,2014,46(3):209-222.
[5]ALIMOVA I,VENKATARAMAN S,HARRIS P,et al.Targeting the enhancer of zeste homologue 2 in medulloblastoma[J].Int J Cancer,2012,131(8):1800-1809.
[6]KEMP CD,RAO M,XI S,et al.Polycomb repressor complex-2 is a novel target for mesothelioma therapy[J].Clin Cancer Res,2012,18(1):77-90.
[7]KNUTSON SK,KAWANO S,MINOSHIMA Y,et al.Selective inhibition of EZH2 by EPZ-6438 leads to potent antitumor activity in EZH2-mutant non-Hodgkin lymphoma[J].Mol Cancer Ther,2014,13(4):842-854.
[8]GUARINO M.Epithelial mesenchymal transition and tumor invasion[J].Int J Biochen Cell Bio,2007,39(12):2153-2160.
[9]KRISHNAMACHARY B,ZAGZAG D,NAGASAWA H,et a1. Hypoxia-inducible factor-1-dependent repression of E.cadherin in von Hippel-Lindau tumor suppressor-null renal cell carcinoma mediated by TCF3,ZFHZl A,and ZFHZlB[J].Cancer Res,2006,66(5):2725-2731.
[10]GWAK GY,YOON JH,YU SJ,et a1.Anti-apoptotic N-cadherin signaling and its prognostic implication in human hepatocellular carcinomas[J].Oncol Rep,2006,15(5):1117-1123.
[11]KUPIIAL S,BOSSERHOFF AK.Influence of the cytoplasmic domain of E-cadherin on endogenous N-cadherin expression in malignant melanoma[J].Oncogene,2006,25(2):248-259.
(编辑 卓选鹏)
Inhibitory effect of EZH2 inhibitor on cervical cancer HeLa cells
DING Mu-yang1,JIANG Wen-jun1,ZHANG Li1,CUI Yu-meng1,
ZHANG Hang2,SHI Li-yun2,GAO Yan-e1
(1.Department of Obstetrics and Gynecology,the Second Affiliated Hospital of Xi'an Jiaotong University Health Science Center,Xi'an 710004;
2.Medical School,Hangzhou Normal University,Hangzhou 310012,China)
Objective To explore the inhibitory effect of enhancer of zeste homolog 2(EZH2)inhibitor on the proliferation and migration of cervical cancer He La cells.Methods Cervical cancer He La cells were cultured with the conditioned-medium containing EZH2 inhibitor GSK343 or the same volume of the vehicle DMSO as control.The cell growth rate was measured by MTT assay and cloning formation assay.The cell migration ability was detected by wound scratch assay.Western blot assay was used to test the epithelial-mesenchymal transition related proteins,E-cadherin and N-cadherin.Results MTT assay results showed that GSK343 inhibited the growth of He La cells in a time-dependent manner.Cloning formation and wound scratch assays exhibited that GSK343 dramatically reduced both the proliferation and migration of He La cells.In addition,Western blot assay demonstrated that GSK343-treated cells were associated with upregulation of epithelial marker E-cadherin and downregulation of mesenchymal marker N-cadherin.Conclusion EZH2 inhibitor GSK343 can significantly restrain the proliferation and migration of cervical cancer He La cells,probably by inhibiting the process of epithelial-mesenchymal transition of the cells.
enhancer of zeste homolog 2(EZH2)inhibitor;cervical cancer cell;cell proliferation and migration;epithelial-mesenchymal transition
R737.33
A
10.7652/jdyxb201505012
2014-10-29
2015-04-15
国家自然科学基金资助项目(No.81000956);陕西省科学技术研究发展计划项目(No.2014SE2-19)Supported by the National Natural Science Eoundation of China(No.81000956)and the Sci-tech Program Eoundation of Shaanxi Province(No.2014SE2-19)
高艳娥.E-mail:yanegao@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150721.1051.006.html(2015-07-21)

