大鼠脑皮质星形胶质细胞的体外优化培养及鉴定
靳 辉,冯改丰,杨蓬勃,2,贾 宁,杨维娜,钱亦华,王唯析
(西安交通大学医学部:1.人体解剖与组织胚胎学系;2.神经生物学研究所,陕西西安 710061)
◇技术方法研究◇
大鼠脑皮质星形胶质细胞的体外优化培养及鉴定
靳 辉1,冯改丰1,杨蓬勃1,2,贾 宁1,杨维娜1,钱亦华1,王唯析1
(西安交通大学医学部:1.人体解剖与组织胚胎学系;2.神经生物学研究所,陕西西安 710061)
目的旨在获得高纯度的星形胶质细胞,并对不同培养时期的细胞进行鉴定,为进一步研究奠定基础。方法常规分离新生SD大鼠大脑皮质并制备单细胞悬液,采用差速黏附加摇床震荡法对所获得的细胞进行纯化。倒置相差显微镜及HE染色观察细胞形态,GFAP免疫荧光对获得细胞进行鉴定。结果原代培养的皮质细胞从3 d开始迅速增殖,9~12 d即可铺满瓶底,此时细胞呈明显的分层生长,星形胶质细胞位于底层,形态多样,阳性率为(67.2± 7.1)%;经过1次传代后,GFAP阳性率有所提升(84.0±6.0)%,但不能完全去除小胶质细胞及少突胶质细胞,细胞仍呈分层生长;至第3次传代后,获得大量几乎为单一种类的星形胶质细胞,其胞体较大、突起较短粗,一般2~3个,胞核圆形或椭圆形,常偏于一侧,GFAP染色呈强阳性,阳性率可达(97.6±2.4)%。结论通过差速黏附与摇床震荡相结合的方法,获得了高纯度且生长状态良好的星形胶质细胞。
星形胶质细胞;大脑皮质;细胞培养;大鼠
星形胶质细胞是神经组织内数量最多、分布最广的胶质细胞,在神经系统发育、突触传递、神经系统内环境的稳定等多种正常生理活动以及神经系统疾病的病理机制中都起着十分重要的作用[1]。目前,用于实验研究的星形胶质细胞在很大程度上来源于啮齿类动物脑组织的原代培养,其中最常用的方法是MCCARTHY等[2]建立的恒温摇床震摇法。该方法根据不同细胞贴壁能力的差异,将贴壁较差的神经前体细胞、少突胶质细胞以及小胶质细胞等从星形胶质细胞层上进行分离,从而获得较纯的星形胶质细胞。然而,在制备单细胞悬液的过程中,尤其对初学者而言,脑膜很难完全剥离干净,而脑膜中的成纤维细胞增殖速度快,也是影响星形胶质细胞纯度的一个重要因素[3]。另外,体外星形胶质细胞的培养周期长,一般需要4周左右[4],以往的研究只对经过几次传代后最终获得的纯度较高的星形胶质细胞进行鉴定[5-6],而对不同培养阶段星形胶质细胞的生长状况及纯度等鲜有报道。因此,本研究应用改良的MCCARTHY方法对新生SD大鼠大脑皮质进行原代培养及纯化,并在不同培养阶段,通过倒置相差显微镜、HE染色及GFAP免疫荧光对细胞整体生长状况、星形胶质细胞的形态及纯度进行观察及分析,从而为星形胶质细胞的深入研究提供帮助。
1 材料与方法
1.1 材料新生1~2 d SD大鼠,由西安交通大学医学部实验动物中心提供。DMEM培养基、胎牛血清购自Gibico公司,胰蛋白酶为Sigma公司产品,小鼠抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体为Neomarker产品,Cy3标记的山羊抗鼠Ig G荧光二抗购自Proteintech公司。
1.2 方法
1.2.1 星形胶质细胞的原代培养 参照MCCARTHY[2]的混合胶质细胞培养及分离方法。取出生1~2 d的SD大鼠,750 m L/L乙醇浸泡5 min消毒,颈椎脱臼处死后取脑。迅速将分离的脑组织移入预冷的D-Hanks液中,小心剥除脑表面的脑膜及脑血管后,剥离两侧大脑皮质放入新的D-Hanks液中洗涤。尽量将其剪碎并转移至10 m L离心管中,2.5 g/L胰蛋白酶37℃消化20 min,加入等量含150 m L/L胎牛血清的DMEM完全培养基,充分混合以终止消化,1 000 r/min离心5 min。小心将上清吸除干净以去除残留胰蛋白酶对细胞的进一步消化,沉淀则用完全培养基重悬,吸管反复轻柔吹打制成单细胞悬液,200目滤网过滤。将制备的单细胞悬液接种至未铺多聚赖氨酸的玻璃培养瓶中,于37℃、50 m L/L CO2培养箱中孵育15 min进行差速黏附处理[7]。轻轻翻转培养瓶吸出瓶中的细胞悬液,将其接种至L-多聚赖氨酸包被的50 m L玻璃培养瓶(一只大鼠脑组织接种至一个培养瓶,每瓶约3×106个细胞)中,置于37℃、50 m L/L CO2培养箱中培养。每3 d换液1次,至细胞长满瓶底时(约12 d)传代。
1.2.2 星形胶质细胞的纯化培养 待细胞铺满瓶底后,D-Hanks液洗涤,并用完全培养基于37℃、50 m L/L CO2培养箱中平衡2 h。将培养瓶固定于恒温摇床振荡(37℃,250 r/min)18 h,倒掉上清液。DHanks液洗涤2次,每瓶加入300μL 2.5 g/L胰蛋白酶消化,待细胞突起回缩并有部分细胞开始脱落时加入完全培养基终止消化。反复吹打瓶壁,收集细胞悬液接种于培养瓶。细胞铺满瓶底后,再次进行恒温摇床振荡并传代。若用于HE染色及免疫荧光染色,则细胞接种于铺有盖玻片的24孔板中,接种密度为4.5×104个/孔。
1.2.3 形态学观察及HE染色 倒置相差显微镜下连续观察细胞形态学变化,并分别取原代培养12 d、第1次及第3次传代后24 h的细胞爬片各3张,经PBS洗涤及40 g/L多聚甲醛固定后,行常规HE染色。
1.2.4 GFAP免疫荧光检测 取原代培养24 h、12 d及第3次传代后24 h的细胞爬片各3张,固定方法同HE染色。固定后进行GFAP免疫荧光染色。首先以含100 m L/L山羊血清、1 m L/L Triton-100的0.01 mol/L PBS在37℃条件下孵育封闭30 min。然后加入小鼠抗GFAP IgG(1∶100稀释),4℃过夜。0.01 mol/L PBS漂洗后加入Cy3标记的羊抗小鼠IgG(1∶100),避光,在37℃水浴箱内孵育30 min。0.01 mol/L PBS漂洗3次,用含有DAPI的抗荧光淬灭剂封片。每张爬片随机选取3个视野,Olympus荧光显微镜下观察、拍照,并分别计数GFAP及DAPI阳性细胞数。星形胶质细胞纯度用GFAP细胞阳性率反映。阳性率=GFAP+/DAPI+×100%。
2 结 果
2.1 细胞的生长状况倒置相差显微镜下观察,见星形胶质细胞在分离纯化过程中细胞的生长情况与文献报道一致[2]。分离的大鼠脑皮层细胞在种植24 h后,绝大多数细胞已经贴壁,其中以体积较小、折光性好的神经元居多,散在有体积大、折光性差的星形胶质细胞以及其他杂细胞(图1A)。3 d细胞数量开始明显增多,突起延长并相互接触形成神经网络。9~12 d细胞可铺满瓶底,光镜下可见细胞呈明显的分层生长(图1B、图2A)。其中星形胶质细胞在底层,彼此接触紧密,体积大且胞核浅淡,突起不易观察;而上层则生长着数量较多的,大小、形状不同的少突胶质细胞和小胶质细胞等,其折光性好且突起明显。第1次传代后的细胞仍然呈分层生长,但上层生长的细胞不仅种类明显减少,数量也较原代培养细胞有显著降低(图1C、图2B)。至传代3次后,细胞为单层生长,星形胶质细胞铺满瓶底,几乎看不到上层生长的小胶质细胞及少突胶质细胞(图1D、图2C)。

图1 倒置相差显微镜下大脑皮质细胞的形态学变化Fig.1 Morphological changes of the cerebral cortical cells under inverted phase contrast microscope(×200)
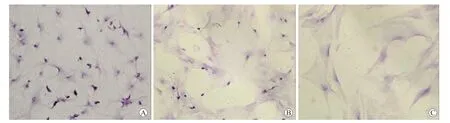
图2 不同培养阶段大脑皮质细胞的分层生长Fig.2 Stratification growth of different stage of the cerebral cortical cells(HE,×200)
2.2 星形胶质细胞的形态学变化及细胞内GFAP的表达原代培养24 h,贴壁细胞中可见散在的GFAP阳性星形胶质细胞,其体积小,突起不明显,荧光强度弱(图3 A~C)。随着培养时间延长,培养物中星形胶质细胞的比例增多,荧光强度也逐渐增强,突起延长并相互接触形成神经网络。原代培养12 d,可见培养物中有大量GFAP高表达的星形胶质细胞,在细胞融合处,突起不明显,其边缘则细胞形态多样,大小不一,突起细长(图3D~F)。经过3次传代后,星形胶质细胞的比例更高,几近呈单一星形胶质细胞,其形态趋于一致,胞体较大、突起较短粗,一般2~3个分支,胞核圆形或椭圆形,常偏于一侧(图3G~I)。
2.3 不同培养时期GFAP细胞阳性率的比较免疫荧光双标结果(图4)显示,原代接种24 h,仅有(5.4± 2.0)%的细胞为GFAP+/DAPI+的星形胶质细胞。随着培养时间延长,培养物中星形胶质细胞的比例逐渐增大,至培养12 d细胞长满瓶底时阳性率可达(67.2± 7.1)%(与接种后24 h相比,P<0.01)。经过1次传代后,大部分少突胶质细胞及小胶质细胞被去除,GFAP细胞阳性率较原代培养12 d有显著性提高(P<0.01),达到(84.0±6.0)%,而第3次传代后的培养物几乎全部为GFAP+/DAPI+的星形胶质细胞,阳性率高达(97.6±2.4)%(与第1次传代后相比,P<0.01)。
3 讨 论
在以星形胶质细胞为研究对象的相关实验中,星形胶质细胞的分离、培养及纯化是体外功能及机制研究的重要步骤[8-9]。本研究通过差速黏附与恒温摇床震荡相结合的改良MCCARTHY方法,从新生SD大鼠大脑皮质中培养出了纯度为98%且生长状态良好的星形胶质细胞。
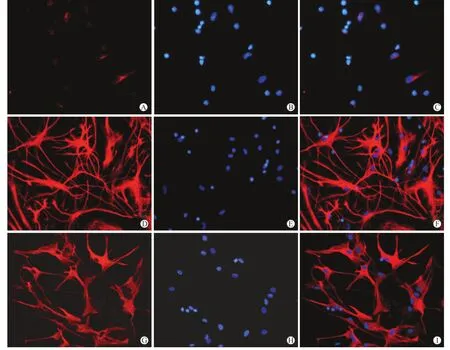
图3 GFAP(红)与DAPI(蓝)免疫荧光双标染色Fig.3 Double-labeling immunofluorescence of GFAP(red)and DAPI(blue)(×200)
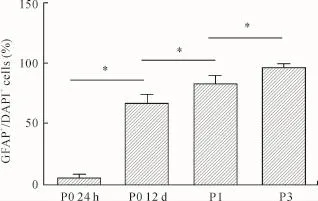
图4 不同培养时期GFAP细胞阳性率的比较Fig.4 GFAP positive rate at different stages of culture
在神经系统发育过程中,神经元与胶质细胞的增殖高峰期不同,神经元增殖在胚胎期完成,而神经胶质细胞的大量增殖却发生在胚胎晚期和出生后[10]。本研究以出生1~2 d的大鼠富含胶质细胞的大脑皮质进行混合培养,接种24 h,贴壁细胞中仅观察到少量GFAP弱阳性的星形胶质细胞,而多数细胞则为圆形或椭圆形、周围有光晕且折光性强的神经元。这也进一步说明了神经元与胶质细胞生长的不同步性。血清是胶质细胞生长的有力刺激[11],本研究在培养基中添加高浓度的胎牛血清。可以看出,从接种第3天开始,胶质细胞即开始迅速增殖,并伴随有GFAP荧光强度的加强。与此同时,神经元的生长受到极大抑制。由于出生后神经元不再分裂,随着时间延长,培养物中神经元与胶质细胞的比例逐渐降低,至培养12 d,培养物中几乎没有神经元。此时,细胞呈明显的分层生长,星形胶质细胞生长于底层、相互融合,而少突胶质细胞等其他细胞由于生长缓慢、无法融合而悬浮于星形胶质细胞之上。利用不同细胞对瓶壁黏附力的差异,MCCARTHY等[2]通过恒温摇床强烈震摇15~18 h的方法,将少突胶质细胞与星形胶质细胞进行了分离。然而我们发现,即使转速达到250 r/min,时间为18 h,1次传代仍然不能很好地将少突胶质细胞和小胶质细胞完全清除。在HE染色的爬片上,仍能清楚地看到细胞的分层生长,但此时上层细胞的种类及数量较传代之前明显减少。免疫荧光结果则显示,GFAP阳性率可达到84%。由于少突胶质细胞和小胶质细胞的分裂增殖速度慢于星形胶质细胞,经过3次恒温摇床震摇及传代后,细胞分层生长现象逐渐消失,星形胶质细胞阳性率达到98%。
在培养过程中,我们将常规的恒温摇床震荡法与差速贴壁法相结合。差速贴壁法是利用成纤维细胞贴壁能力强、贴壁时间短(在细胞接种1 h之内就可直接贴壁在未经多聚赖氨酸包被的光滑玻璃平面上)的特性,将其与星形胶质细胞和成鞘细胞等进行分离的方法[12]。脑内成纤维细胞主要位于脑膜等疏松结缔组织中。尽管出生1~2 d的动物脑膜较易剥离,但在分离的脑皮质单细胞悬液中仍不可避免的混杂有成纤维细胞,且其分裂增殖速度快,因而也是影响星形胶质细胞纯度的一个重要因素。本研究于原代接种前成纤维细胞数量相对较少时进行差速黏附处理。考虑到黏附时间越长细胞丢失越多,以及首次细胞接种密度对后续星形胶质细胞分裂增殖的影响[13],研究中选用15 min作为差速黏附时间[7]。结果表明,原代培养过程中星形胶质细胞的增殖速度与文献报道一致[2],约在接种后9~12 d左右长满瓶底,且在几次传代的细胞中,均未见到呈梭形或扁的星状,且GFAP阴性的成纤维细胞。由此看出,通过差速黏附与恒温摇床震荡相结合的方法,可以在保证小胶质细胞和少突胶质细胞有效分离的基础上,最大程度地抑制成纤维细胞的混杂与增殖,提高了星形胶质细胞的纯度。
综上所述,通过差速黏附与恒温摇床震荡相结合的改良MCCARTHY方法,我们从新生SD大鼠脑皮质中获得了高纯度且生长状态良好的星形胶质细胞,并对不同培养阶段细胞的整体生长状况、星形胶质细胞的形态及阳性比例进行了观察及分析,从而为星形胶质细胞的深入研究提供了重要的实验室资料。
[1]PARPURAV,HENEKA MT,MONTANA V,et al.Glial cells in(patho)physiology[J].J Neurochem,2012,121(1):4-27.
[2]MCCARTHY KD,DE VELLIS J.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue[J].J Cell Biol,1980,85(3):890-902.
[3]ULLIAN EM,SAPPERSTEIN SK,CHRISTOPHERSON KS,et al.Control of synapse number by glia[J].Science,2001,291(5504):657-661.
[4]MACK AF,TIEDEMANN K.Cultures of astroglial cells derived from brain of adult cichlid fish[J].J Neurosci Methods,2013,212(2):269-275.
[5]WANG W,SHI W,LI H.A modified in vitro method to obtain pure astrocyte cultures induced from mouse hippocampal neural stem cells using clonal expansion[J].Cell Mol Neurobiol,2012,32(3):373-380.
[6]LOSCIUTO S,DORBAN G,GABEL S,et al.An ef ficient method to limit microglia-dependent effects in astroglial cultures[J].J Neurosci Methods,2012,207(1):59-71.
[7]周欣,明晓云,康颂建,等.差速贴壁技术对大鼠脑皮质星形胶质细胞纯化率的影响[J].中国组织工程研究与临床康复,2007,2(15):2829-2831.
[8]马红霞,周运恒,范列英,等.酸性肽对体外培养大鼠星形胶质细胞增殖的影响[J].郑州大学学报:医学版,2010,45(3):392-395.
[9]臧卫东,张雁儒,李鸣,等.大鼠闭合性脑损伤后星形胶质细胞的形态及GAP-43、ET-1 mRNA表达的变化[J].郑州大学学报:医学版,2006,41(2):321-323.
[10]MORROW T,SONG MR,GHOSH A.Sequential specification of neurons and glia by developmentally regulated extracellular factors[J].Development,2001,128(18):3585-3594.
[11]MABIE PC,MEHLER MF,MARMUR R,et al.Bone morphogenetic proteins induce astroglial differentiation of oligodendroglial-astroglial progenitor cells[J].J Neurosci,1997,17(11):4112-4120.
[12]VAN DER SLUIJS JP,BAERT MR,PLOEMACHER RE.Differential adherence of murine hematopoietic stem cell subsets to fibronectin[J].Exp Hematol,1994,22(13):1236-1243.
[13]YANG Z,WATANABE M,NISHIYAMA A.Optimization of oligodendrocyte progenitor cell culture method for enhanced survival[J].J Neurosci Methods,2005,149(1):50-56.
(编辑 卓选鹏)
The optimized culture and identification of astrocytes from rat cortical tissue
JIN Hui1,FENG Gai-feng1,YANG Peng-bo1,2,JIA Ning1,YANG Wei-na1,QIAN Yi-hua1,WANG Wei-xi1
(1.Department of Human Anatomy and Histo/Embryology;2.Institute of Neurobiology,Xi’an Jiaotong University Health Science Center,Xi’an 710061,China)
ObjectiveTo obtain highly purified astrocytes and identify the cells in each stage to support further studies.MethodsThe cerebral cortex of a neonatal SD rat was isolated and prepared into single cell suspension.The obtained cells were purified by dif ferential adherence and shook at a constant temperature.By inverted phase contrast microscopy and HE staining,cell morphology was observed.The immunofluorescence staining with anti-mouse GFAP was used to identify the cells.ResultsThe primary cortical cells developed rapidly at 3 d after culture and covered the flasks at 9-12 d.At this time,the cells showed stratification and the astrocytes lay at the lower layer.GFAP positive rate was only about(67.2±7.1)%.After the first passage,GFAP positive rate increased obviously(84.0±6.0)%.However,oligodendrocytes and microglias could not be removed completely,and the cells also showed stratification.Through 3 times of passages,we obtained many single species of astrocytes showing satellite shape with 2 or 3 processes,big cell body and round or oval-shaped nuclei leaned to one side.Immunofluorescence staining showed that nearly all of the cells were strong positive and the positive rate reached as high as(97.6±2.4)%.ConclusionThrough differential adherence and shaking at a constant temperature,more astrocytes of high purity and in good state can be obtained.
astrocyte;cerebral cortex;cell culture;rat
Q25
A
10.7652/jdyxb201506027
2015-03-20
2015-06-15
陕西省自然科学基金资助项目(No.2012JQ4011,2014JM4096);中央高校基本科研业务费专项资金资助项目(No.xjj2012011)
Supported by the Natural Science Foundation of Shaanxi Province(No.2012JQ4011,2014JM4096)and Fundamental Research Funds for the Central Universities(No.xjj2012011)
王唯析.E-mail:wangwx@mail.xjtu.edu.cn
优先出版:http://w ww.cnki.net/kcms/detail/61.1399.R.20150928.1813.034.html(2015-09-28)

