CCL18通过N-Ras/c-myc/lin28下调乳腺癌细胞miR98的表达
赵瑞华,李向柯,姜文静,张伟杰,宗 红
(郑州大学第一附属医院肿瘤科,河南省高等学校临床医学重点学科开放实验室,河南郑州 450052)
◇基础研究◇
CCL18通过N-Ras/c-myc/lin28下调乳腺癌细胞miR98的表达
赵瑞华,李向柯,姜文静,张伟杰,宗 红
(郑州大学第一附属医院肿瘤科,河南省高等学校临床医学重点学科开放实验室,河南郑州 450052)
目的探讨CCL18是否参与了乳腺癌miRNAs的表达调控。方法采用miRNAs芯片筛查CCL18处理前后乳腺癌细胞miRNAs的表达差异,QRT-PCR和Luciferase Reporter Assay对芯片结果进行验证。瞬时转染法分别改变乳腺癌细胞miR98和c-myc的表达,应用QRT-PCR和Western blot检测c-myc和lin28 m RNA和蛋白的表达。结果miRNAs芯片结果显示CCL18处理后乳腺癌细胞共20种miRNAs发生变化,QRT-PCR和Luciferase Reporter Assay证实CCL18下调乳腺癌细胞miR98的表达。CCL18可上调乳腺癌细胞c-myc和lin28 mRNA和蛋白的表达,转染c-myc siRNAs可逆转CCL18调控lin28和miR98表达的功能。CCL18通过miR98转录后调控乳腺癌细胞N-Ras蛋白的表达。结论CCL18通过N-Ras/c-myc/lin28通路下调miR98,下调的miR98通过转录后调控增加N-Ras蛋白的表达,从而进一步激活c-myc/lin28通路,维持miR98的持续降低,形成了一个正反馈环路。
CCL18;乳腺癌;miR98;miRNA;c-myc;N-Ras;lin28
既往研究证实,TAMs通过分泌CCL18激活乳腺癌细胞MAPK/AKT通路促进乳腺癌浸润及迁移[1]。深入揭示CCL18促乳腺癌转移过程中的分子机制,寻找合适的靶点来干预CCL18的功能,对控制乳腺癌进展有着重要意义。
miRNAs既可作为癌基因,又可以作为抑癌基因,在人类肿瘤中发挥着重要作用。目前的研究初步发现,人类肿瘤中miRNAs的表达异常是由多种机制参与调控的结果,如表观遗传学的改变、DNA拷贝数的改变、miRNAs生物合成过程的异常等[2]。另外,环境的改变,如缺氧、炎症等可通过不同的机制调节miRNAs的表达[3-4]。本研究从miRNAs的角度,研究了乳腺癌微环境重要组成部分的CCL18是否参与了乳腺癌miRNAs的表达调控及促乳腺癌浸润和转移的相关机制。
1 材料与方法
1.1 细胞培养与处理方法MDA-MB-231和MCF-7乳腺癌细胞来源于ATCC,常规应用含100 m L/L胎牛血清的高糖DMEM培养基在37℃、含50 m L/L CO2培养箱中贴壁培养。CCL18激活实验应用重组CCL18(rCCL18),质量浓度为100 ng/m L,处理乳腺癌细胞至所需时间。
1.2 细胞转染转染前1 d,2×104个/孔乳腺癌细胞培养至细胞汇合度约为50%~60%,分组分别进行转染实验。miRNAs、miRNAs抑制剂、siRNA来自吉玛公司(上海),序列见表1,浓度为50μmol/L。应用瞬时转染的方法,转染试剂为Lipofectamine 2000(Invitrogen),根据转染说明进行转染。转染细胞在正常培养条件下培养48 h,应用QRT-PCR验证转染效率。
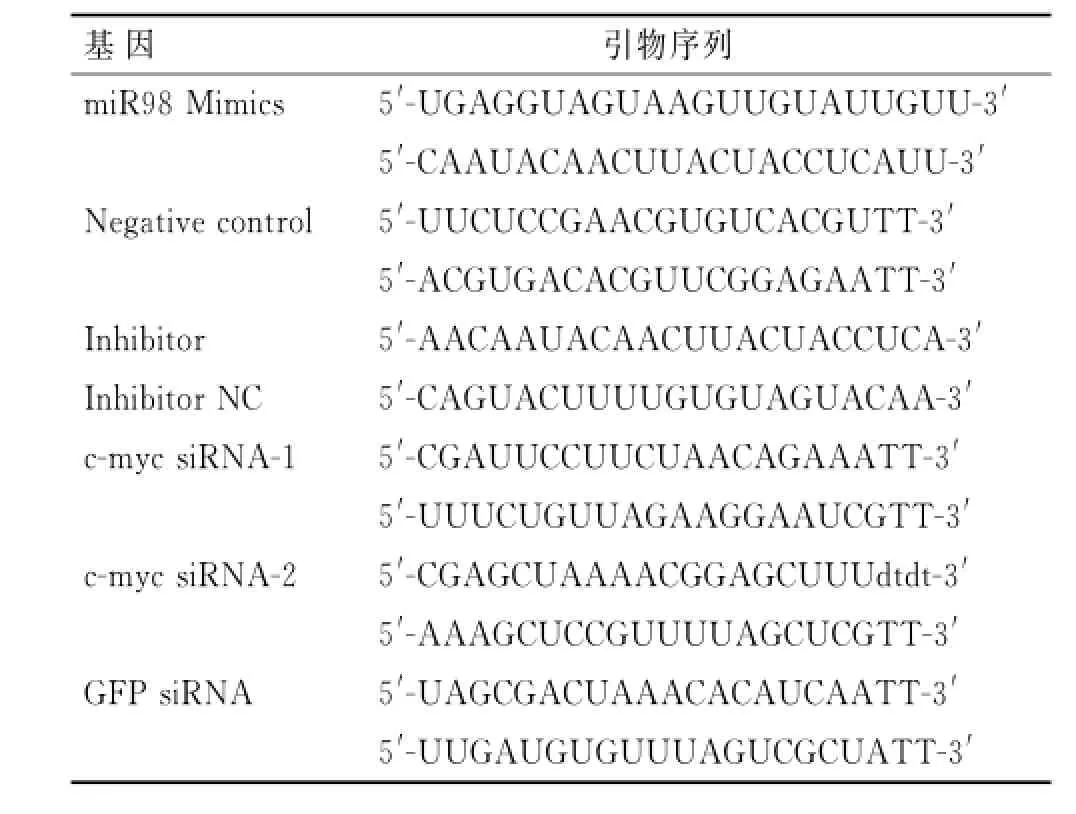
表1 转染相关基因序列Tab.1 Gene sequences for transfection
1.3 miRNAs芯片检测应用Trizol法提取总RNA,然后用mir VanaTMmiRNA提取试剂盒(Ambion)提取总miRNAs。在miRNAs样品的3′加入Poly(A)尾,用mir Vana miRNA标记试剂盒(Ambion)标记Cy3或Cy5染料(Amersham Pharmacia Biotech)。然后用QIAGEN PCR纯化试剂盒(Qiagen)进行纯化。
用NCodeTMmiRNA Microarray探针系列(Invitrogen)孵育纯化好的样品。所采用的NCodeTMmiRNA Microarray探针系列共含有703个人类成熟的miRNAs。采用第3代阵列扫描仪(mersham Pharmacia)进行荧光信号的搜集。采用信号强度大于阴性对照信号强度加上3倍的标准差,对杂交信号进行筛选。采用校正后两个样品间杂交信号强度的比值大于2或小于0.5作为显著性变化的标准。但对于仅在其中一个样品中具有有效杂交信号的数据,将表达变化显著性的标准调整为上下3倍。
1.4 QRT-PCR检测Trizol法提取总RNA,Prime Script RT试剂盒(TaKaRa)进行逆转录。U6:5′-CGCTTCACGAATTTGCGTGTCAT-3′;miR98:5′-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGACAACAAT-3′。用SYBR Premix Ex TaqTM(TaKaRa)试剂盒和罗氏LightCycler 480检测系统进行实时定量PCR反应。所有的反应均为20μL。成熟miR98、pri-miR98、c-myc、NRas、U6和GAPDH的引物来自Invitrogen,序列见表2。经过95℃30 s变性后,进行PCR反应,扩增45个循环,每个循环包括95℃30 s和60℃1 min。采用2-△△Ct法,分别根据GAPDH和U6计算普通基因和miR98的相对表达量。
1.5 双荧光素酶报告基因检测为了检测内源性成熟miR98的表达,实验构建了含有3个成熟miR98完全互补序列(mature miR98)或突变的互补序列(mutmiR98)(表2)的psiCHECK-2质粒(Promega)[5]。应用Lipofectamine 2000(Invitrogen)将上述质粒转染至乳腺癌细胞中,在CCL18处理后(MDA-MB-231 12 h和MCF-7 24 h),应用Dual-Luciferase Reporter Assay System(Promega)检测荧光素酶信号。萤火虫荧光素酶活性为F,海肾荧光素酶活性为R,样品活性倍数=(R/F)样品/(R/F)对照。转染psiCHECK2-miR98载体的细胞荧光素酶信号反映了内源性miR98的表达,其信号高低与内源性miR98的表达成反比。而转染了psiCHECK2-mut-miR98载体的细胞荧光素酶信号则不能反映内源性miR98的表达。

表2 QRT-PCR引物序列Tab.2 Sequences of QRT-PCR primers
1.6 Western blot检测提取蛋白后,每个泳道加入10~50μg蛋白,在80~150 g/L SDS-PAGE凝胶中电泳,转移至PVDF膜,洗膜3次,50 g/L BSA室温封闭1 h,一抗4℃孵育过夜,洗膜,用连接辣根过氧化酶的IgG二抗室温孵育1 h,抗原抗体结合后,洗膜3次,用化学发光剂显影。所需一抗分别来自:c-myc(CST)、lin28(Abcam),N-Ras(Santa Cruz),GAPDH(CST),抗体工作浓度均为1∶100。
1.7统计学方法所有实验均重复3次。本实验所有数据以均数±标准差表示,应用SPSS 19.0和Graph-Pad Prism 5.01统计软件处理数据。采用单因素方差分析和非配对t检验,分析各组间差异。P值为双向性检验,检验水准为α=0.05。
2 结 果
2.1 CCL18下调乳腺癌细胞miR98的表达采用miRNAs芯片检测CCL18处理前后乳腺癌MDAMB-231细胞miRNAs的表达,结果显示CCL18处理后,共有20种miRNAs发生显著变化(表3)。

表3 CCL18处理乳腺癌MDA-MB-231细胞后差异表达的miRNAsTab.3 miRNAs differentially expressed in MDA-MB-231 breast cancer cells treated with CCL18
选取miR98在乳腺癌MDA-MB-231和MCF-7两种细胞株进行验证。结果证实CCL18可显著下调乳腺癌MDA-MB-231细胞和MCF-7细胞的miR98表达水平(P分别为0.02和0.049,图1A和1B)。
进一步应用双荧光素酶报告基因检测技术对乳腺癌细胞miR98的表达进行检测,与QRT-PCR结果一致。两株细胞在转染了miR98完全互补序列后,经CCL18处理后,荧光素酶信号显著增高(P分别为<0.000 1和0.002),而转染随机对照序列的细胞的荧光素酶信号经CCL18处理后没有明显变化(图1C和1D),进一步证实CCL18显著下调乳腺癌细胞内源性miR98的表达。

图1 CCL18下调乳腺癌细胞miR98的表达Fig.1 CCL18 downregulated the expression of miR98 in breast cancer cells
2.2 CCL18通过N-Ras/c-myc/lin28通路下调miR98的表达将MDA-MB-231和MCF-7细胞用CCL18处理后,应用QRT-PCR检测pri-miR98的水平。结果显示,CCL18不影响乳腺癌细胞pri-miR98的表达(P分别为0.10和0.28),证实CCL18在转录后水平调控乳腺癌细胞miR98的表达(图2)。
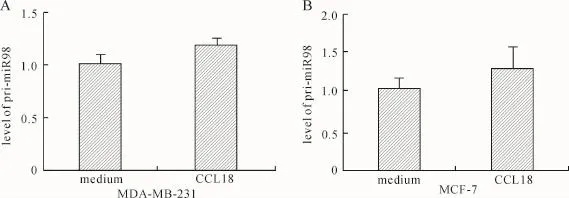
图2 QRT-PCR检测CCL18处理后乳腺癌细胞MDA-MB-231(A)和MCF-7(B)pri-miR98的表达Fig.2 Quantitative analysis of pri-miR98 expression in breast cancer cells MDA-MB-231(A)and MCF-7(B)treated with CCL18
为进一步验证CCL18是否通过MAPK/c-myc/ lin28通路调控miR98的表达。对CCL18处理两种细胞前后c-myc和lin28 m RNA和蛋白的表达变化,QRT-PCR和Western blot检测结果显示,CCL18可增加乳腺癌细胞c-myc(P分别为0.004和0.009)和lin28(P分别为0.023和<0.0001)mRNA和蛋白的表达(图3A~3D)。
进一步应用瞬时转染方法将乳腺癌MDA-MB-231细胞转染c-myc siRNAs(c-myc-1和c-myc-2)、GFP siRNA、单加转染试剂组(mock)或空白组(Un),并加入CCL18刺激,QRT-PCR检测细胞中lin28 mRNA的水平,Western blot检测c-myc和lin28蛋白的表达。QRT-PCR及Western blot的结果显示,与对照组(Un)相比,转染c-myc siRNAs可使lin28 m RNA(P为0.004)及蛋白的表达水平显著降低(图3E、3F)。
另外,将按照相同的方法转染MDA-MB-231细胞,分为c-myc siRNAs(c-myc-1和c-myc-2)及对照组GFP siRNA和单加转染试剂组(mock)或空白组(Un),均加入CCL18刺激,另一组为空白对照即无转染试剂及CCL18组(medium),应用QRT-PCR检测miR98的表达。结果显示,与空白对照组相比,CCL18可使转染对照序列细胞的miR98的表达显著下调,而即便在CCL18刺激下,转染c-myc siRNAs(c-myc-1和c-myc-2)组的miR98水平反而显著增加(P<0.05,图3G)。结果证实CCL18通过增加c-myc的转录,调节乳腺癌细胞lin28的表达,从而下调其miR98的表达。

图3 CCL18通过c-myc/lin28通路下调miR98的表达Fig.3 CCL18 downregulated miR98 via c-myc/lin28 pathway
之后,应用QRT-PCR和Western blot检测CCL18对乳腺癌细胞N-Ras mRNA和蛋白表达的影响。结果显示,CCL18刺激可以使乳腺癌两个细胞株N-Ras蛋白明显增加,却不影响其mRNA的表达(P分别为0.19和0.34,图4A和4B),说明CCL18在转录后水平调节N-Ras的表达。
在MDA-MB-231细胞中转染了miR98 mimics、 inhibitor或对照序列,在应用CCL18处理前后,检测N-Ras mRNA和蛋白的表达。结果显示,在CCL18刺激下,转染miR98 mimics后,N-Ras蛋白的表达显著下调,而转染miR98 inhibitor的N-Ras蛋白表达显著增高,但N-Ras m RNA水平不随miR98表达变化而变化(图4C~4E)。

图4 miR98转录后负性调控N-Ras的表达Fig.4 miR98 negatively regulated N-Ras at post-transcription level
3 讨 论
本研究首次将CCL18与乳腺癌细胞miRNAs的表达调控联系起来,从一个新的视角揭示了乳腺癌细胞miRNAs表达异常的机制。miR98是Let-7/ miR98家族的一员,该家族通常被认为是一个抑癌miRNAs家族,其成员在多种肿瘤中表达下调,其表达水平与肿瘤的分化程度和患者的预后呈负相关[6]。目前对Let-7/miR98家族在肿瘤中异常表达的机制尚不明确。既往研究报道,lin28在Let-7/miR98家族的转录后调控中起着重要作用[7],转录因子c-myc可以调控lin28的表达[8]。而之前的研究发现CCL18可激活乳腺癌细胞的MAPK通路。本研究结果显示,CCL18可增加乳腺癌细胞c-myc和lin28的转录,使其mRNA和蛋白的表达均增高;干扰c-myc的表达,可逆转CCL18调控lin28及miR98表达的功能。这表明CCL18通过c-myc调节lin28的表达从而在转录后水平下调miR98。
尽管既往的研究发现c-myc和lin28这两种蛋白参与了多种miRNAs转录和加工过程的调控[9]。而lin28则可以选择性抑制Let-7/miR98家族的转录后加工过程,调控了众多Let-7家族成员的表达[7]。为什么CCL18没有导致广泛的miRNAs表达异常?分析原因,可能为:细胞系的选择不同,miRNAs的表达是受到精确调控的结果,不同细胞中miRNAs表达调控的机制可能完全不同;miRNAs表达异常是多种因素相互作用的结果,可能在乳腺癌细胞中CCL18激活了其他通路,尚有多种因子或其他多种机制参与了CCL18调节miRNAs的过程,如在lin28调节Let-7/miR98各个成员转录后加工过程中,或许存在着一系列的伴随分子阻断或增强lin28的功能。因此,需要进一步研究其他参与CCL18调节miRNAs表达调控的机制,进一步探讨miR98对乳腺癌细胞功能的影响以及是否介导了CCL18促乳腺癌转移的功能。
总之,本研究证实CCL18可以通过c-myc/lin28通路下调乳腺癌细胞miR98的表达,而下调的miR98可以在转录后水平上调N-Ras蛋白,进一步激活c-myc/lin28通路,形成了一个正反馈环路。
[1]CHEN J,YAO Y,GONG C,et al.CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3[J].Cancer Cell,2011,19(4):541-555.
[2]ADAMS BD,KASINSKI AL,SLACK FJ.Aberrant regulation and function of microRNAs in cancer[J].Curr Biol,2014,24(16):R762-R776.
[3]QIN Q,FURONG W,BAOSHENG L.Multiple functions of hypoxia-regulated mi R-210 in cancer[J].J Exp Clin Cancer Res,2014,33:50.
[4]RANJHA R,APUI J.Micro-RNAs in inflammatory diseases and as a link between inflammation and cancer[J].Inflamm Res,2013,62(4):343-355.
[5]LEE JY,KIM S,HWANG DO W,et al.Development of a dual-luciferase reporter system for in vivo visualization of MicroRNA biogenesis and posttranscriptional regulation[J].J Nucl Med,2008,49(2):285-294.
[6]YU F,YAO H,ZHU P,et al.let-7 regulates self renewal and tumorigenicity of breast cancer cells[J].Cell,2007,131(6):1109-1123.
[7]NEWMAN MA,THOMSON JM,HAMMOND SM.Lin-28 interaction with the Let-7 precursor loop mediates regulated micro RNA processing[J].RNA,2008,14(8):1539-1549.
[8]DANGI-GARIMELLA S,YUN J,EVESEM,et al.Raf kinase inhibitory protein suppresses a metastasis signalling cascade involving LIN28 and let-7[J].EMBO J,2009,28(4):347-358.
[9]CHANG TC,YU D,LEE YS,et al.Widespread micro RNA repression by Myc contributes to tumorigenesis[J].Nat Genet,2008,40(1):43-50.
(编辑 国 荣)
CCL18 downregulates the expression of miR98 in breast cancer cells via N-Ras/c-myc/lin28 pathway
ZHAO Rui-hua,LI Xiang-ke,JIANG Wen-jing,ZHANG Wei-jie,ZONG Hong
(Department of Oncology,the First Affiliated Hospital of Zhengzhou University;Key Discipline Open Laboratory,Institute of Clinical Medicine of Henan Province,Zhengzhou 450052,China)
ObjectiveTo explore whether CCL18 is involved in regulating the expression of miRNAs in breast cancer.MethodsThe expression profile of miRNAs in the breast cancer cell following CCL18 treatment was determined by miRNAs microarray analysis.Then we per formed QRT-PCR and Luciferase Reporter Assay to validate the results from the miRNAs microassay.We used transient transfection to change the expression of miR98 and c-myc in breast cancer cells.We then used QRT-PCR and Western blot to analyze the mechanism by which CCL18 downregulates the expression of miR98 in breast cancer cells.ResultsmiRNAs microarray analysis showed that cells treated with CCL18 dif ferentially expressed 20 miRNAs genes compared with those in the control group. Our QRT-PCR and Luciferase Reporter Assay confirmed the result.The m RNA and protein expressions of C-myc and lin28 were increased after CCL18 stimulation in breast cancer cells.Transfection with c-myc siRNAs rescued the increase of lin28 and loss of miR98 expression caused by CCL18 stimulation.Our results also showed that CCL18 could upregulate the expression of N-Ras at post-transcription level.ConclusionCCL18 downregulates the expression of miR98 via N-Ras/c-myc/lin28 pathway.The downregulated miR98 increases the expression of N-Ras after transfection,which further activates c-myc/lin28 pathway and forms a positive feedback loop.
CCL18;breast cancer;miR98;miRNA;c-myc;N-Ras;lin28
R737.9
A
10.7652/jdyxb201506012
2014-11-19
2015-03-27
郑州大学第一附属医院院内青年基金资助项目
Supported by the Young Scientists Foundation of the First Affiliated Hospital of Zhengzhou University
宗红.E-mail:zonghong522@126.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150907.1558.002.html(2015-09-07)

