肠道菌群失调对内脏敏感性的影响及其机制
邵 珲,王进海,张 杰,杨龙宝,谢丹红
(西安交通大学医学部第二附属医院:1.消化内科,陕西省肠胃动力疾病研究重点实验室,陕西省胃肠疾病临床研究中心;2.核医学科,陕西西安 710004)
◇基础研究◇
肠道菌群失调对内脏敏感性的影响及其机制
邵 珲1,王进海1,张 杰2,杨龙宝1,谢丹红1
(西安交通大学医学部第二附属医院:1.消化内科,陕西省肠胃动力疾病研究重点实验室,陕西省胃肠疾病临床研究中心;2.核医学科,陕西西安 710004)
目的检测肠道菌群失调大鼠的内脏敏感性变化及紧密连接蛋白(ZO-1)、Toll样4受体(TLR4)的表达,探讨肠道菌群失调对内脏敏感性的影响及其机制。方法SPF级SD大鼠30只,随机分为正常对照组(12只)、菌群失调组(18只)。菌群失调组采用盐酸林可霉素(300 mg/m L)灌胃,1 m L/(次·只),1次/d,连续给药7 d;正常对照组采用等量生理盐水灌胃。第8天随机抽取菌群失调组和正常对照组大鼠各6只,检测模型是否成功。模型建立成功后,将其余12只菌群失调组大鼠随机分组:阴性对照组、益生菌干预组,每组6只。益生菌干预组给予双歧杆菌三联活菌胶囊(培菲康)灌胃,1粒/3 m L生理盐水,1 m L/(次·只),1次/d,连续给药7 d;阴性对照组给予同等量生理盐水灌胃。第8天进行粪便菌群培养、检测内脏敏感性、检测结肠组织中ZO-1及TLR4的mRNA和蛋白表达、检测血清中炎性因子IL-10、TNFα的表达。结果与正常对照组比较,菌群失调组大鼠结肠ZO-1的mRNA含量及蛋白表达显著降低,而结肠TLR4的含量及蛋白表达显著升高,且血清中促炎因子TNFα表达显著升高,而抑炎因子IL-10的表达显著降低(P<0.05)。与菌群失调组相比,益生菌干预组结肠ZO-1的m RNA含量及蛋白表达显著升高,而结肠TLR4的mRNA含量及蛋白表达显著降低,且血清中促炎因子TNFα表达显著降低而抑炎因子IL-10的表达显著升高(P<0.05)。结论通过抑制结肠中ZO-1的表达及升高TLR4的表达,进而导致慢性低度炎症的发生可能是肠道菌群失调导致内脏高敏感的作用机制之一,同时益生菌制剂可能通过恢复肠道菌群变化进而改善内脏高敏感。
肠道菌群失调;内脏高敏感;肠易激综合征;低度炎症;紧密连接蛋白(ZO-1);Toll样4受体(TLR4);益生菌
肠易激综合征(irritable bowel syndrome,IBS)是以腹痛或者腹部不适伴排便习惯或大便性状改变为特征,症状持续或间歇发作,经相关检查无器质性病变证据的综合征。IBS发病机制复杂,其中内脏高敏感是其最主要的病理机制之一[1],也是评价IBS造模成功与否的重要标志。近年来,研究发现肠道菌群失调在IBS的发生发展中起了重要作用[2-4]。目前,有学者发现IBS患者原来稳定的肠道菌群出现紊乱会影响感觉功能和内脏敏感性[5-8],部分IBS患者肠黏膜中存在低度炎症[1,9-11],而肠道菌群改变导致的感觉异常又由变化的生理性炎症所调节,故其提议将“肠道菌群失调—肠道低度炎症—内脏高敏感”建立在一个新的概念模型里[10],但尚没有学者去验证这一想法。因此,本课题建立了肠道菌群失调大鼠模型,通过观察菌群失调组大鼠结肠中紧密连接蛋白(tight junction protein,ZO-1)、Toll样4受体(Tolllike receptor 4,TLR4)的表达水平,及血清中促炎因子TNFα、抑炎因子IL-10的表达水平,探索肠道菌群对内脏敏感性的影响及可能的调控机制,从而为IBS的发病机制提供一个新的理论依据,为IBS的治疗及药物研发提供新的思路。
1 材料与方法
1.1 动物、试剂及仪器SPF级雄性SD大鼠30只,体质量180~220 g,西安交通大学医学部实验动物中心提供。德国Braun 8F导尿管;数字显示隔水式电热恒温培养箱,西安交通大学实验室提供;法国BioMerieux厌氧培养袋;双歧三联活菌胶囊(培菲康)购自上海信谊药厂有限公司;Trizol、PrimeScript RT Master Mix试剂盒、SYBR Premic Ex TaqⅡ试剂盒均购自日本Ta KaRa公司;美国Bio-red公司荧光定量PCR仪;冷冻离心机(北京时代);兔抗大鼠ZO-1抗体购自武汉博士德生物技术有限公司;兔抗大鼠TLR4抗体购自北京博奥森生物技术有限公司;SP免疫组化试剂盒及DAB显色剂试剂盒购自北京中杉金桥生物技术有限公司;日本Olympus光学显微镜;大鼠TNF-αELISA试剂盒、大鼠IL-10 ELISA试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 造模及指标检测 SPF级雄性SD大鼠30只,随机分为正常对照组(12只)、菌群失调组(18只)。分笼饲养,每笼6只,适应饲养环境1周后,采用盐酸林可霉素(300 mg/m L)灌胃建立肠道菌群失调大鼠模型[12],1 m L/(次·只),1次/d;正常对照组采用等量生理盐水灌胃。连续给药7 d,第8天随机抽取正常对照组及菌群失调组大鼠各6只,观察大鼠一般行为,取新鲜粪便进行菌群培养[13],用腹部回撤反应(abdominal withdrawal reflex,AWR)检测内脏敏感性[14],并处死取结肠组织以检测ZO-1及TLR4的m RNA和蛋白表达,取静脉血以检测血清中炎性因子IL-10、TNFα的表达。模型建立成功后,将其余12只菌群失调组大鼠随机分为阴性对照组、益生菌干预组,每组6只。益生菌干预组给予培菲康1粒溶于3 m L生理盐水中灌胃,1 m L/(次·只),1次/d;阴性对照组给予同等量生理盐水灌胃。7 d后同样观察大鼠的一般行为,粪便菌群培养,检测内脏敏感性及ZO-1、TLR4的m RNA和蛋白表达,检测血清中IL-10、TNFα的表达。
1.2.2 肠道菌群检测 取新鲜无污染大便0.5 g,加入4.5 mL无菌生理盐水混匀,按10倍连续稀释法用无菌生理盐水稀释至10-8,取10-4、10-5、10-6稀释液各50μL分别接种在选择性培养基上。选择性培养基分别为肠杆菌(EMB)、肠球菌(EF)、双歧杆菌(BS)、乳酸杆菌(LBS)。肠杆菌及肠球菌于需氧环境下,37℃培养24~48 h,双歧杆菌及乳酸杆菌于厌氧环境下37℃培养48 h。观察结果以每克粪便中菌落形成单位的对数值表示(log CFU/g),并计算双歧杆菌和肠杆菌的比值(B/E值)代表肠道定植抗力[3]。公式:log CFU/g(m L)=同一稀释度3次重复的菌落平均数×稀释倍数/接种体积(m L)[15]。
1.2.3 内脏敏感性的测定 AWR评分标准:0分,大鼠对结直肠扩张无行为学反应;1分,结直肠扩张时身体静止不动,头部运动减少;2分,结直肠扩张时腹肌轻微收缩,但腹部未抬离桌面;3分,结直肠扩张时腹肌明显收缩并且腹部抬离桌面;4分,结直肠扩张时腹肌强烈收缩,骨盆抬起,身体呈弓形。AWR是一种半定量指标,为尽可能减少主观误差,本实验以AWR评分3分时球囊容量作为容量阈值[14]。
检测前禁食24 h、不禁水,将清醒状态下的大鼠放入固定器内,限制大鼠的各项活动,但能观察到腹壁收缩。将Braun 8F气囊导尿管外涂石蜡油后经肛门插入,导管末端距肛门1 cm,用胶布将导尿管固定于大鼠尾根部。15 min后大鼠适应环境呈安静状态,经导尿管外口向球囊内注入常温水(26~28℃生理盐水)扩张,记录大鼠出现AWR评分各分值时所需的最小注水量为最小容量阈值。重复扩张3次,每次间隔15 min,3次扩张数据均值作为该鼠直肠扩张引起AWR的最小容量阈值。休息30 min,分别测定注水量为0.8、1.2、1.6 m L时1 min内大鼠腹部收缩反射的次数,每次间隔15 min。用引起大鼠AWR的最小容量阈值和直肠内球囊不同容量扩张时1 min内大鼠腹部收缩反射的次数,评价大鼠对直肠内扩张刺激的内脏敏感性[14]。
1.2.4 Real-time PCR测定结肠组织ZO-1、TLR4的m RNA表达水平 ①RNA提取及引物的设计合成。引物设计及合成由奥科鼎盛生物公司完成:ZO-1上游引物:AATGAATGATGGTTGGTATGG,下游引物:TGACAGGTAGGACAGACG;TLR4上游引物:AAGTTATTGTGGTGGTGTC,下游引物:CTGCTAAGAAGGCGATAC;内参β-actin上游引物:CTATCGGCAATGAGCGGTTC,下游引物TGTGTTGGCATAGAGGTCTTTACG。②逆转录反应。取2μL RNA模板做逆转录反应,反应体系如下:5×PrimeScript RT Master Mix 4μL,模板RNA 2μL,RNase free d H2O 14μL。其中5×PrimeScript RT Master Mix含有RTase,RNase Inhibitor,Oligo d T Primer,Random 6mers,d NTP Mixture和反应buffer。反应条件:37℃15 min,然后85℃5 s,降至4℃。③RT-PCR反应。反应体系及条件:SYBR®Premix Ex TaqⅡ(2×)10μL,PCR上游引物(10 μmol/L)0.8μL,PCR下游引物(10μmol/L)0.8μL,模板cDNA 2.0μL,DH2O(sterile distilled water)6.4μL。总体积为20μL。其中SYBR Premix Ex TaqⅡ含有Ex Taq HS,d NTP,Mg2+,Tli RNase H和SYBR®Green I。反应条件:95℃30 s 1个循环;95℃5 s,60℃20 s 40个循环;95℃0 s,65℃15 s,95℃0 s。反应结束后由电脑自动得出荧光曲线及CT值,采用2-△△CT计算出ZO-1、TLR4的相对表达量。
TLR4蛋白的免疫组织化学方法同上,一抗(TLR4)稀释浓度为1∶300。
显微镜观察,拍照。组织切片均以细胞质和(或)细胞膜出现棕黄色或棕褐色颗粒为阳性,用计算机图像分析系统计算蛋白表达的阳性面积。
1.2.6 ELISA法检测血清中炎性因子IL-10、TNFα的表达水平 严格按照试剂盒说明书进行操作。
1.3 统计学处理采用SPSS 18.0统计软件对资料进行统计学分析。计量资料以表示,所有数据均进行正态性检验和方差齐性检测,满足正态分布及方差齐性后,各组之间的比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠的一般情况与正常对照组相比,菌群失调组大鼠精神状态略显萎靡、反应迟钝、毛色光泽度降低、摄食减少,且大便较稀;益生菌干预组大鼠较模型组大鼠各方面状态较好;而阴性对照组大鼠各方面一般情况不如益生菌干预组,但好于菌群失调组。
2.2 大鼠结肠组织观察肉眼观察:各组大鼠结肠组织的黏膜结构完整,均无充血、水肿、溃疡形成;常规HE染色显微镜下观察正常对照组及益生菌干预组结肠组织的黏膜形态完好,上皮细胞排列整齐,炎症细胞很少,无上皮细胞坏死、糜烂等;菌群失调组及阴性对照组的黏膜层及黏膜下层可见少量炎症细胞,组织稍充血,但腺体排列尚整齐,无上皮细胞坏死、糜烂等(图1)。

图1 各组大鼠结肠组织的病理变化Fig.1 Pathological changes of colonic mucosa in rats of each group(HE,×40)
2.3 肠道菌群的检测与比较如表1所示,与正常对照组相比,菌群失调组的有益菌即双歧杆菌(BS)、乳酸杆菌(LBS)明显减少(P<0.05),而条件致病菌即肠杆菌(EMB)明显增多(P<0.05),肠道定植抗力(B/E值)<1(P<0.05);益生菌干预组相比菌群失调组而言,肠道菌群有所恢复,表现为BS、LBS明显升高(P<0.05),EMB明显减少(P<0.05),B/E值>1(P<0.05);阴性对照组的4种肠道细菌含量与菌群失调组相比,EMB、BS无明显差异(P>0.05),但EF、LBS相比有统计学差异(P<0.05),说明阴性对照组的大鼠肠道菌群还是有部分恢复的。菌群培养见图2~图4。
随着与城镇及工矿用地的距离增加各项指标均有不同程度的减小,但趋势各不相同。距离在2 000 m范围内的农村居民点面积占比达64.8%,景观所占比例高达5.26%,农村居民点平均面积与标准差显著高于其他区域,表明城镇与工矿用地对于农村居民点的规模特征有较大的影响。城镇是区域发展的经济中心,聚集着区域大量的人口与公共服务,对农村居民点产生较强的吸引。工矿用地所需大量劳动力且为农村居民带来的经济效应高于农业耕作,因此影响着农村居民点的形成与发展。各区域内农村居民点数量、斑块密度、景观形态指数及形状指数差异并不明显,表明城镇及工矿用地对于农村居民点的数量分布及其形态影响程度相对较低。
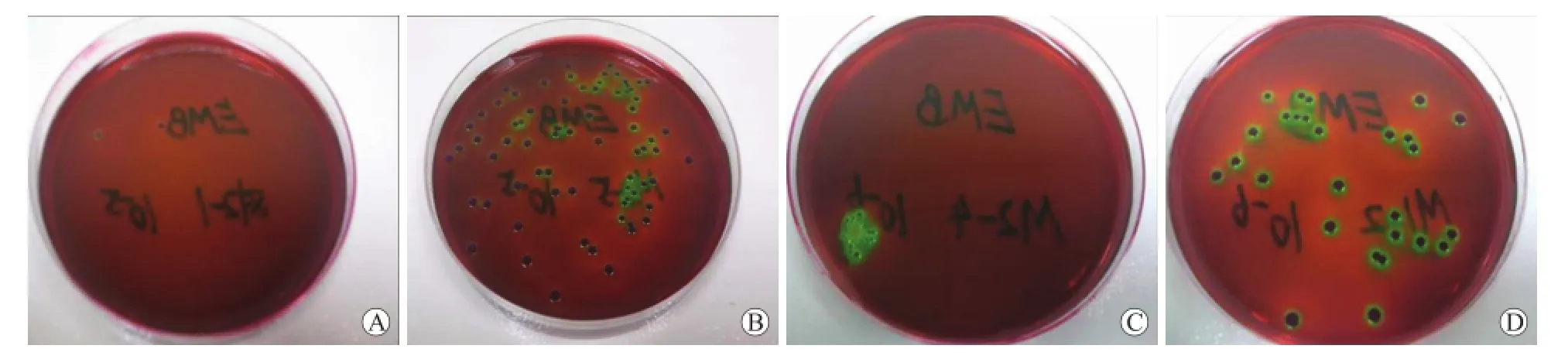
图2 各组大鼠粪便培养中的EMB菌落Fig.2 EMB colonies of fecal culture in rats of each group

图3 各组大鼠粪便培养中的BS菌落Fig.3 BS colonies of fecal culture in rats of each group

图4 各组大鼠粪便培养中的LBS菌落Fig.4 LBS colonies of fecal culture in rats of each group
表1 不同组别粪便培养菌落总数及B/E值Tab.1 The total number of colonies of fecal culture and the ratio of B/E in different groups()

表1 不同组别粪便培养菌落总数及B/E值Tab.1 The total number of colonies of fecal culture and the ratio of B/E in different groups()
与正常对照组相比,*P<0.05;与菌群失调组相比,#P<0.05。
2.4 内脏敏感性的测定结果如表2所示,与正常对照组相比,菌群失调组有较高内脏敏感性(P<0.05);益生菌干预组与菌群失调组相比,内脏敏感性有所缓解(P<0.05);阴性对照组与菌群失调组比较,内脏敏感性有所降低(P<0.05),但与正常对照组相比仍有差异(P<0.05),说明阴性对照组的大鼠内脏敏感性有所恢复,但尚未达到正常。按照设计测定腹壁收缩次数应在0.8、1.0、1.2 m L 3个容量下进行,但当球囊容积达到1.0 m L及1.2 m L时,部分大鼠出现腹壁强直收缩,无法统计收缩次数,因此仅选用0.8 m L作为收缩次数的验证容量。观察到菌群失调组大鼠在球囊达到0.8 m L时,腹壁收缩次数明显高于另外3组(P<0.05);益生菌干预组与正常对照组、阴性对照组相比均无统计学差异(P>0.05),内脏敏感性有所恢复;阴性对照组与菌群失调组相比,内脏敏感性有所恢复(P<0.05)。
表2 各组AWR评分为3分时的球囊容量及相同容量时的收缩次数的比较Tab.2 The balloon capacity when AWR score was 3 points and the number of contractions at the same capacity in each group()

表2 各组AWR评分为3分时的球囊容量及相同容量时的收缩次数的比较Tab.2 The balloon capacity when AWR score was 3 points and the number of contractions at the same capacity in each group()
与正常对照组相比,*P<0.05;与菌群失调组相比,#P<0.05。
2.5 各组大鼠结肠组织ZO-1、TLR4的mRNA的表达水平Real-time PCR结果显示,各组大鼠的结肠组织均有ZO-1 mRNA的表达。与正常对照组相比,菌群失调组的ZO-1 mRNA表达明显减少(P<0.05);与菌群失调组相比,益生菌干预组的ZO-1 mRNA表达明显增多(P<0.05);阴性对照组与菌群失调组相比,ZO-1 mRNA表达有所增多,较正常对照组还是减少的,但均无明显统计学差异(P>0.05,表3)。
各组大鼠的结肠组织均有TLR4 mRNA的表达。与正常对照组相比,菌群失调组的TLR4 mRNA表达明显增多(P<0.05);与菌群失调组相比,益生菌干预组的TLR4 mRNA表达明显减少(P<0.05);阴性对照组与菌群失调组相比,TLR4 mRNA表达有所降低,较正常对照组还是有所增多的,但均无统计学差异(P>0.05,表3)。
表3 各组ZO-1 mRNA、TLR4 m RNA的表达量Tab.3 The expressions of ZO-1 m RNA and TLR4 m RNA in each group()

表3 各组ZO-1 mRNA、TLR4 m RNA的表达量Tab.3 The expressions of ZO-1 m RNA and TLR4 m RNA in each group()
与正常对照组相比,*P<0.05;与菌群失调组相比,#P<0.05。
2.6 各组大鼠结肠组织ZO-1、TLR4的蛋白表达水平
2.6.1 ZO-1的蛋白表达 免疫组化结果显示(图5),各组ZO-1的表达均主要集中在结肠组织黏膜上皮细胞的胞膜顶端。正常对照组的ZO-1表达明显最多,呈现棕黄色颗粒或团块;菌群失调组的ZO-1表达部位没有明显改变,但表达量明显降低;益生菌干预组的ZO-1表达较菌群失调组有所恢复;阴性对照组的ZO-1表达仍明显较少。阳性面积统计分析(表4),菌群失调组ZO-1表达阳性面积较正常对照组明显降低(P<0.05),益生菌干预组ZO-1表达阳性面积较菌群失调组明显有所增多(P<0.05),阴性对照组ZO-1蛋白阳性面积较菌群失调组无明显差异(P>0.05)。
表4 免疫组化检测各组ZO-1、TLR4蛋白表达的阳性面积Tab.4 The positive area of ZO-1 and TLR4 protein expression in each group detected by immunohistochemical method(,%)
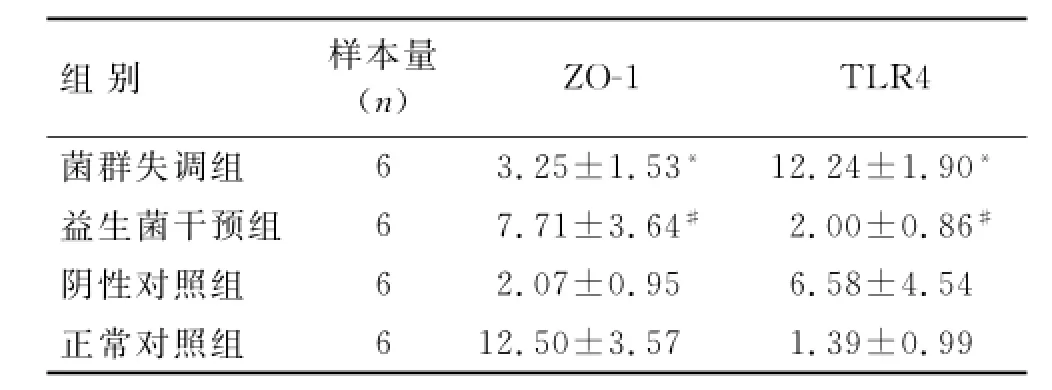
表4 免疫组化检测各组ZO-1、TLR4蛋白表达的阳性面积Tab.4 The positive area of ZO-1 and TLR4 protein expression in each group detected by immunohistochemical method(,%)
与对照组相比,*P<0.05;与菌群失调组相比,#P<0.05。

图5 各组大鼠结肠组织ZO-1的表达Fig.5 The expression of ZO-1 in the colon of rats in each group(Immunohistochemistry,×40)
2.6.2 TLR4的蛋白表达 免疫组化结果显示(图6),正常对照组结肠组织黏膜上皮细胞及固有层细胞胞质有极少量的TLR4表达;菌群失调组结肠组织黏膜上皮细胞及固有层细胞胞质均有TLR4表达,以固有层细胞的胞质表达为著,明显多于正常对照组;益生菌干预组的TLR4表达主要集中在固有层细胞胞质内,但可看出表达量明显低于菌群失调组;阴性对照组的结肠组织黏膜上皮细胞及固有层细胞胞质内尚有不少TLR4的表达,对比可见多于益生菌干预组和正常对照组。阳性面积统计分析(表4):菌群失调组TLR4表达阳性面积较正常对照组明显增多(P<0.05),益生菌干预组ZO-1表达阳性面积较菌群失调组明显有所减少(P<0.05),阴性对照组ZO-1蛋白阳性面积较菌群失调组降低,差异有统计学意义(P<0.05)。

图6 各组大鼠结肠组织TLR4的表达Fig.6 The expression of TLR4 in the colon of rats in each group(Immunohistochemistry,×40)
2.7 各组大鼠血清中炎性因子TNF-α、IL-10的表达水平如表5所示,与正常对照组相比,菌群失调组的TNF-α含量明显增多(P<0.05);与菌群失调组相比,益生菌干预组的TNF-α含量明显减少(P<0.05);阴性对照组与菌群失调组相比,TNF-α含量明显减少(P<0.05),较正常对照组也是较高的,但二者比较无明显统计学差异(P>0.05)。
血清中IL-10的表达,与正常对照组相比,菌群失调组的IL-10含量明显减少(P<0.05);与菌群失调组相比,益生菌干预组的IL-10含量明显增多(P<0.05);阴性对照组与菌群失调组相比,IL-10含量有所增多,而与正常对照组相比还是有所减少,但均无统计学差异(P>0.05)。
3 讨 论
目前,IBS的具体发病机制尚不明确。近年来,随着研究的深入,肠道菌群失调在IBS发生发展中的作用已不容忽视[5-8]。
表5 各组血清中TNF-α、IL-10含量的比较Tab.5 The content of TNF-αand IL-10 in the serum in each group(,pg/m L)

表5 各组血清中TNF-α、IL-10含量的比较Tab.5 The content of TNF-αand IL-10 in the serum in each group(,pg/m L)
与对照组相比,*P<0.05;与菌群失调组相比,#P<0.05。
罗马Ⅲ诊断标准根据粪便性状,参照粪便Bristol分级,对IBS粪便性状加以量化分型:①IBS腹泻型(IBS-D):>25%糊状或水样粪便,<25%块状或干硬粪便;②IBS便秘型(IBS-C):>25%块状或干硬粪便,<25%糊状或水样粪便;③IBS混合型(IBSM):块状或干硬粪便、糊状或水样粪便均>25%;④IBS不定型(IBS-U):粪便性状不符合上述诊断标准者,还常伴有排便费力或排便不尽感。目前,针对IBS-D的研究居多。抗生素是引起菌群失调的主要因素之一,虽然其在治疗某些疾病方面有着不可替代的作用,但是不合理的使用抗生素会使其在杀死敏感菌的同时引起非敏感菌的大量繁殖,导致菌群失调[1,10]。文献报道,抗生素灌胃一般导致腹泻症状及肠动力的改变,类似于IBS-D。本文目的即是验证肠道菌群失调是否能够产生IBS-D的相应症状及表现。通过查阅大量文献,本实验选择盐酸林可霉素灌胃造模,用粪便菌群培养方法来判定模型成功与否[]。
紧密连接(TJ)是细胞间最重要的连接方式,Occludin蛋白是TJ的主要功能蛋白之一,可与ZOs蛋白连接,ZOs蛋白对于TJ的形成和屏障功能的维持具有重要作用,被认为是免疫组织化学检查时TJ的标志性蛋白。ZOs是一种外周膜蛋白,属膜相关鸟氨酸酶家族,有3种异构体,即ZO-1、ZO-2、ZO-3。ZO-1蛋白可将occludin蛋白和肌动蛋白骨架系统连接在一起,构成稳定的连接系统。TJ结构一旦受损,肠黏膜通透性就会增加,从而引发LPS入血,与TLR4发生反应。Toll受体是炎症信号传递的门户蛋白,它主要参与机体的固有免疫,并在固有免疫和获得性免疫之间起着桥梁作用,是引起机体炎症反应的关键受体。其中TLR4主要介导内毒素的信号转导。目前国内外已有不少研究报道IBS(主要是D-IBS)患者肠道黏膜存在高表达TLR4[7,16],正常的肠上皮细胞(IEC)低表达TLR4,使IEC对共生菌保持免疫耐受,有利于肠道菌群与肠黏膜保持稳态,当有细菌入侵时,IEC迅速识别并诱导TLR4由基底侧转至肠腔侧,启动信号转导,激活其下游的NF-κB,进而调控各种基因的表达,如炎性因子等。
有研究报道,腹泻型IBS(D-IBS)患者及各亚型IBS大鼠存在肠道菌群失调[4]及肠黏膜机械屏障不足,表现为ZO-1表达下降[7],而肠道菌群失调可以通过破坏肠黏膜屏障、改变肠道通透性,进而使肠道内毒素水平升高,促炎因子产生,从而导致慢性低度炎症[17]。目前IBS肠道存在慢性低度炎症已基本达成共识。有大量研究发现,部分IBS患者存在肠黏膜炎症和免疫细胞功能活化,这种炎症就被称为低度炎症,而且肠黏膜的低度炎症可导致胃肠运动功能紊乱、并激活内脏感觉系统,从而参与IBS的发生发展[1,10]。
本实验造模后菌群失调组大鼠肠道内的有益菌即双歧杆菌和乳酸杆菌含量显著下降,条件致病菌即大肠杆菌明显增多,且肠道定植抗力<1,说明肠道菌群失调模型建立成功,肠球菌无增多趋势,这也与部分文献结果保持一致[4]。再通过内脏敏感性的比较,与正常对照组相比,菌群失调组有较高的内脏敏感性,可以说肠道菌群失调在一定程度上可以引起内脏高敏感,与文献报道一致[2,9,18]。同时HE染色结果也显示,菌群失调组大鼠的肠道并无明显炎症发生,只有少数炎性细胞的浸润,属低度炎症,而且本实验中进一步检测血清中TNF-α、IL-10炎性因子的表达情况,菌群失调组相比正常对照组而言,TNF-α明显升高(P<0.05),IL-10明显降低(P<0.01),也更加印证了菌群失调组低度炎症的存在。结合菌群失调、内脏高敏感性及低度炎症的改变,说明肠道菌群失调导致内脏高敏感模型的成功建立,这在以往国内外研究中尚未见报道,可为以后内脏高敏感动物模型的建立提供新的思路及方法。同时通过对TLR4和ZO-1的表达检测,不管是蛋白水平还是m RNA水平,菌群失调组的TLR4表达明显高于正常对照组,而ZO-1的表达明显低于正常对照组,更加说明了肠黏膜屏障与低度炎症参与到IBS的发病过程,也更加清楚地阐明了肠道菌群失调与内脏高敏感的相关性及其可能机制。
再者有关益生菌干预组的各项检测指标结果表明,相比菌群失调组而言,益生菌干预组的肠道菌群失调及内脏高敏感性明显恢复,结肠ZO-1及TLR4 mRNA及蛋白的表达也均有不同程度地恢复和降低,同时血清中TNF-α、IL-10炎性因子的表达情况也有不同程度地改善。说明益生菌治疗可以从一定程度上改善肠道微生态,同时可通过升高ZO-1、降低TLR4的表达,以及调节促炎因子与抑炎因子平衡的机制来进一步缓解内脏敏感性,也与以往研究结果统一[1,2,6]。
基于上述理论,本课题即将“肠道菌群失调-肠道低度炎症-内脏高敏感”联系在了一起,对IBS来讲是一种新的理论模型[10]。我们推测,通过抑制结肠中ZO-1的表达及升高TLR4的表达,进而导致慢性低度炎症的发生可能是肠道菌群失调导致内脏高敏感的作用机制之一,同时益生菌制剂可能通过恢复肠道菌群变化进而改善内脏高敏感。这就为IBS的发病机制提供了新的理论指导,也为IBS的治疗及药物研发提供新的思路。
[1]AKIHO H,IHARA E,NAKAMURA K.Low-grade inflammation plays a pivotal role in gastrointestinal dysfunction in irritable bowel syndrome[J].World J Gastrointest Pathophysiol,2010,1(3):97-105.
[2]PONNUSAMY K,CHOI JN,KIM J,et al.Microbial community and metabolomic comparison of irritable bowel syndrome faeces[J].J Med Microbiol,2011,60(Pt 6):817-827.
[3]胡乐义,王巧民,姜彬言,等.肠易激综合征患者肠道菌群的变化及意义[J].安徽医科大学学报,2012,47(1):86-89.
[4]MATTO J,MAUNUKSELA L,KAJANDER K,et al.Composition and temporal stability of gastrointestinal microbiota in irritable bowel syndrome—a longitudinal study in IBS and control subjects[J].FEMS Immunol Med Microbiol,2005,43(2):213-222.
[5]VERDU EF,BERCIK P,VERMA-GANDHU M,et al.Specific probiotic therapy attenuates antibiotic induced visceral hypersensitivity in mice[J].Gut,2006,55(2):182-190.
[6]EUTAMENE H,LAMINE F,CHABO C,et al.Synergy between Lactobacillus paracasei and its bacterial products to counteract stress-induced gut permeability and sensitivity increase in rats[J].J Nutr,2007,137(8):1901-1907.
[7]GHOSHAL UC,SHUKLA R,GHOSHAL U,et al.The gut microbiota and irritable bowel syndrome:friend or foe?[J].Int J Inflam,2012:151085.
[8]GHOSHAL UC,PARK H,GWEE KA.Bugs and irritable bowel syndrome:The good,the bad and the ugly[J].J Gastroenterol Hepatol,2010,25(2):244-251.
[9]LEE BJ,BAK YT.Irritable bowel syndrome,gut microbiota and probiotics[J].J Neurogastroenterol Motil,2011,17(3):252-266.
[10]COLLINS SM,DENOU E,VERDU EF,et al.The putative role of the intestinal microbiota in the irritable bowel syndrome[J].Dig Liver Dis,2009,41(12):850-853.
[11]MARSHALL JK,THABANE M,GARG AX,et al.Intestinal permeability in patients with irritable bowel syndrome after a waterborne outbreak of acute gastroenteritis in Walkerton,Ontario[J].Aliment Pharmacol Ther,2004,20(11-12):1317-1322.
[12]郝秀春,李丽秋,张晓波,等.双歧杆菌对菌群失调大鼠血清NO及NOS的影响[J].中国微生态学杂志,2011,23(2):101-103.
[13]BALSARI A,CECCARELLI A,DUBINI F,et al.The fecal microbial population in the irritable bowel syndrome[J].Microbiologica,1982,5(3):185-194.
[14]张芳芹,徐桂芳,赵东,等.微生态制剂对内脏高敏感模型大鼠内脏敏感性影响的研究[J].胃肠病学,2012,17(4):198-201.
[15]FLOWER RL,KAMHIEH S,MCLEAN L,et al.Human Borna disease virus infection in Australia:serological markers of infection in multi-transfused patients[J].APMIS,2008,(124):89-93.
[16]王雪梅,刘玉兰.肠易激综合征腹泻型患者结肠黏膜Toll样受体2和4的表达[J].中华消化杂志,2009,29(2):105-108.
[17]易园骊,姚萍.脂代谢与肠道菌群关系的研究进展[J].医学综述,2013,19(6):991-994.
[18]MENDALL MA,KUMAR D.Antibiotic use,childhood affluence and irritable bowel syndrome(IBS)[J].Eur J Gastroenterol Hepatol,1998,10(1):59-62.
(编辑 卓选鹏)
The influence of intestinal dysbacteriosis on visceral sensitivity and possible mechanisms
SHAO Hui1,WANG Jin-hai1,ZHANG Jie2,YANG Long-bao1,XIE Dan-Hong1
(1.Department of Gastroenterology,Shaanxi Key Laboratory of Gastrointestinal Motility Disorders,Shaanxi Clinical Research Center of Gastrointestinal Diseases;2.Department of Nuclear Medicine,the Second Affiliated Hospital of Xi’an Jiaotong University Health Science Center,Xi’an 710004,China)
ObjectiveTo detect the changes of visceral sensitivity in rats presenting intestinal dysbacteriosis and the expressions of tight junction protein(ZO-1)and Toll-like receptor 4(TLR4)so as to explore the ef fect of intestinal dysbacteriosis on visceral sensitivity and the possible mechanisms.MethodsWe randomly divided 30 male SD rats of SPF grade into normal control group(n=12)and dysbacteriosis group(n=18).Rats in dysbacteriosis group were administered with lincomycin hydrochloride(300 mg/m L),1 m L each time per rat once a day for 7 consecutive days;those in normal control group were fed with the same amount of saline.On the eighth day,six rats were randomly selected from normal control group and dysbacteriosis group respectively to detect whether the model was successful.After the model was successfully constructed,the remaining 12 dysbacteriosis rats were randomly divided into the negative control group and the probiotics intervention group with 6 in each.Rats in the intervention group were given probiotic bifidobacterium triple viable capsules(Bifico)orally,one capsule with 1/3 m L of saline,1 m L each time per rat once a day for 7 consecutive days;those in the negative control group
the same amount of saline.On the eighth day,fresh feces was cultured for flora to detect visceral sensitivity by abdominal withdrawal reflex(AWR),the m RNA and protein expressions of ZO-1 and TLR4 in the colon,and the expression of serum inflammatory cytokines IL-10 and TNFα.ResultsThe expression of ZO-1in the colonwas significantly lower in the rats of dysbacteriosis group than those in the control group,and the expression of TLR4 was also significantly increased.Correspondingly,the expression of pro-inflammatory factor TNFαin the serum of the rats in dysbacteriosis group was significantly increased,while that of anti-inflammatory factor IL-10 was significantly lower than in the control group(P<0.05).Furthermore,compared with dysbacteriosis group,the expression of ZO-1 was increased significantly and TLR4 was decreased in probiotics group in varying degrees. Similarly,the expression of TNFαwas obviously lower while that of IL-10 in the serum was higher(P<0.05).ConclusionInhibiting the expression of ZO-1 and increasing the expression of TLR4,thus leading to chronic lowgrade inflammation,may be one mechanism of visceral hypersensitivity caused by intestinal dysbacteriosis. Probiotics may restore the dysbacteriosis and thus improve visceral hypersensitivity.
intestinal dysbacteriosis;visceral hypersensitivity;irritable bowel syndrome;low-grade inflammation;tight junction protein(ZO-1);Toll-like receptor 4(TLR4);probiotics
R57
A
10.7652/jdyxb201506009
2014-12-16
2015-06-12
王进海.E-mail:jinhaiwang@hotmail.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150929.0855.008.html(2015-09-29)

