大蒜新素减少Rac1/Cdc42、MMP2表达抑制Hela细胞转移能力的研究
宋旭日,胡 静,张松波,郭中奎,滕淑静*
(1.岳阳职业技术学院,湖南岳阳 414000;2.漯河医学高等专科学校,河南漯河 462000)
大蒜新素(allicin)是大蒜的主要有效成分,化学名为二烯丙基三硫,具有较强的抗肿瘤作用[1]。研究报道,大蒜新素对膀胱癌[2]、直肠癌[3]的转移有一定的抑制作用。本课题组在前期的研究中发现,大蒜新素对宫颈癌Hela细胞的转移能力也有抑制作用[4],但具体机制还有待阐明。Rho蛋白家族是小G蛋白Ras超家族成员,在细胞形态改变、细胞骨架重组调控等方面发挥重要作用。研究发现,Rho蛋白在多种恶性肿瘤细胞中异常高表达[5],提示其所介导的细胞运动可能与瘤细胞的转移有着密切的关系。Rac1(Ras-related C3botulinum toxin substrate 1)和 Cdc42(cell division cycle 42)是研究最多的两个Rho蛋白。Rac1可诱导层状伪足的形成,Cdc42可诱导丝状伪足的形成。细胞伪足的形成是其发生转移的起始步骤。另外,在肿瘤细胞转移的过程中涉及到基底膜的突破和细胞外基质(extracellular matrix,ECM)的降解,而基质金属蛋白酶(matrix metalloproteinases,MMPs)能降解细胞外基质和基底膜[6],说明其在肿瘤的转移过程中也发挥着重要的作用。本试验拟探讨大蒜新素是否通过影响Rho蛋白和MMPs的表达抑制Hela细胞的转移能力。
1 材料和方法
1.1 材料
1.1.1 细胞株 宫颈癌细胞株Hela细胞,由中南大学肿瘤研究所提供。
1.1.2 主要试剂 大蒜新素为上海禾丰制药有限公司产品,纯度>99.5%;RPMI-1640培养基为Gibco公司产品;新生小牛血清为杭州四季青生物工程有限公司产品;鼠抗人Rac1单抗、鼠抗人Cdc42单抗、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、辣根过氧化物酶标记的羊抗鼠和羊抗兔二抗为Santa Cruz产品;Western印迹荧光检测试剂盒为南京赛博生物科技有限公司产品;Trizol及RT-PCR试剂盒为Fermentas公司产品。
1.2 方法
1.2.1 细胞培养 用含100mL/L新生小牛血清、1×105U/mL青霉素和10mg/mL链霉素的RPMI 1640培养液中培养HeLa细胞,置于37℃、体积分数为5%CO2、饱和湿度培养箱中培养。试验组加大蒜新素使其终浓度为100μmol/L,对照组加等量PBS,置于37℃孵育24h。
1.2.2 Western blot检测Rac1和Cdc42的表达收集试验组和对照组细胞各5×106个,加入预冷的细胞裂解液并置冰上裂解30min,离心吸取上清液,加5×蛋白上样缓冲液,煮沸5min;电泳后转膜;50g/L脱脂牛奶室温封闭2h,加抗人Rac1、Cdc42或 GAPDH 抗体(1∶1 000)4℃孵育过夜;TBST洗3次,加相应的辣根过氧化物酶标记的二抗(1∶2 000),37 ℃孵育约1h;TBST 洗膜后用 Western印迹荧光检测试剂盒于X光片上显示结果。
1.2.3 半定量RT-PCR法检测Hela细胞 MMP2 mRNA的表达水平 取对数生长期的细胞经接种贴壁生长后,试验组加大蒜新素使其终浓度为100μmol/L,对照组加等量PBS,24h后收集细胞并提取细胞的总RNA,各取2μg按RT-PCR试剂盒操作说明逆转录合成cDNA并扩增MMP-2基因片段,扩增 MMP-2所用引物序列为5′-TGACGGTAAGGACGGACTC-3′, 5′-TGCCCTGGAAGCGGAATGG-3′,产物347bp,扩增条件:94℃变性30s,60℃退火30s,72℃延伸1min,30个循环;延伸10min,终止反应。10g/L琼脂糖电泳分析,以GAPDH为内参照。
2 结果
2.1 大蒜新素对Hela细胞Rac1和Cdc42蛋白表达的影响
大蒜新素试验组表达Rac1和Cdc42比加PBS对照组有所减少。以GAPDH为内参进行灰度扫描后统计分析,试验组与对照组相比有显著性差异(P<0.05),结果见图1。
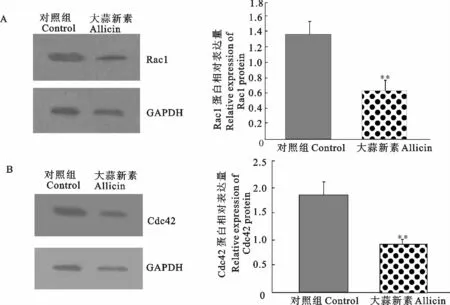
图1 大蒜新素对Hela细胞Rac1和Cdc42蛋白表达的影响(**P<0.05,n=3)Fig.1 Effect of allicin on Rac1and Cdc42expression by Hela cells(** P<0.05,n=3)
2.2 大蒜新素对Hela细胞MMP2mRNA表达的影响
试验组Hela细胞MMP2mRNA的表达明显减少,其条带灰度比值为0.204 6±0.085,与对照组的表达(条带灰度比值为0.893 6±0.271)比较,统计分析具有显著差异(P<0.01)。如图2所示。
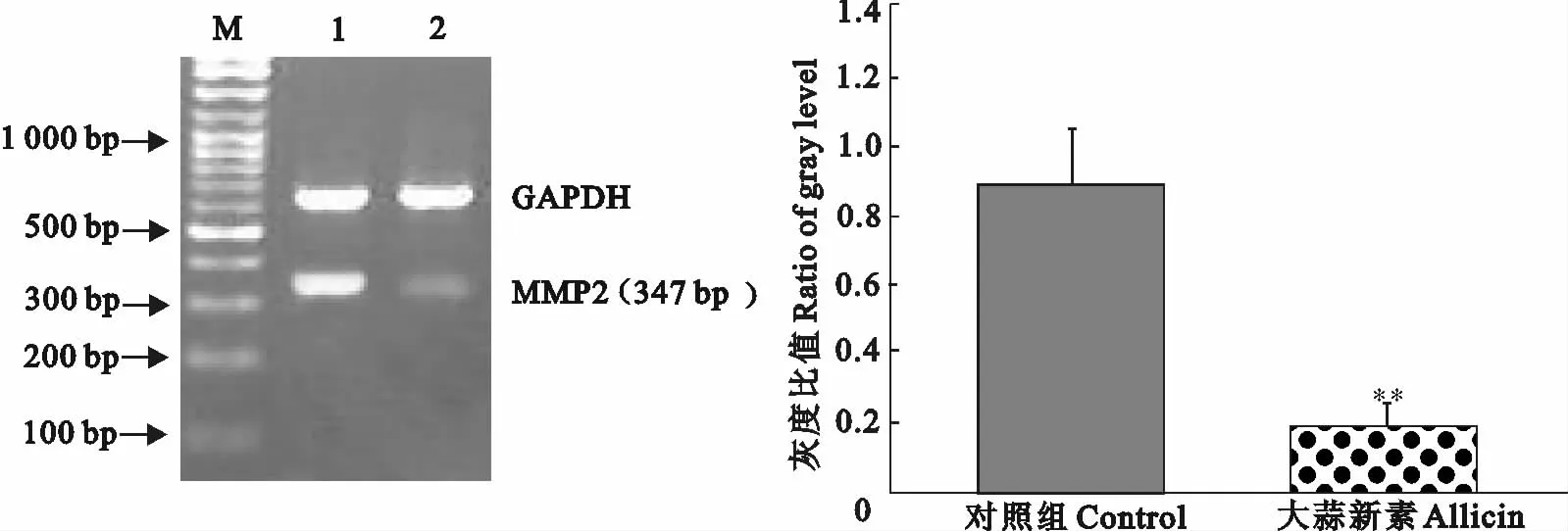
图2 大蒜新素对Hela细胞 MMP2mRNA表达的影响(**P<0.01,n=3)Fig.2 Effect of allicin on MMP2mRNA expression by Hela cells(** P<0.01,n=3)
3 讨论
Rho蛋白家族是小G蛋白Ras超家族成员,相对分子质量介于20ku~25ku,具有GTP酶活性,被称为Rho GTP酶。该家族成员根据结构和功能不同大致分为Rho亚家族(RhoA、RhoB、RhoC),Rac亚家族 (Rac1、Rac2、Rac3),Cdc42 亚 家 族(Cdc42、TC10、TCL、Wrch1、chp/Wrch2),Rnd亚家族(Rnd1、Rnd3/RhoE、Rnd2),Rho BTB 亚家族(Rho BTB1和 Rho BTB2)等 5 个亚家族。Rho GTP酶在调控细胞骨架重组、改变细胞形态、增强细胞运动能力方面起着非常重要的作用。研究显示,Rac和Cdc42通过与 WiskottAldrich综合征蛋白相互作用激活Arp2/3复合物促进肌动蛋白聚合,诱导伪足的形成[7-8];而Rho通过激活Rho相关卷曲螺旋形成蛋白激酶(Rho associated coiledcoil forming protein kinase,ROCK),增加肌动-肌球蛋白的收缩力、使细胞体尾部收缩、促使细胞在ECM中的迁移;并且Rho还可通过活化mDia蛋白促进张力纤维形成、增加黏着斑上肌动蛋白依赖性的c-Src募集,诱导黏着斑解离[9]。恶性肿瘤具有向邻近组织浸润和向远处转移的生物学特性。研究显示,胃癌、乳腺癌、肝癌、直结肠癌等多种恶性肿瘤细胞异常高表达Rho蛋白[5]。由此推测,Rho蛋白在恶性肿瘤的发生发展过程中有可能通过增强肿瘤细胞的运动能力、使肿瘤细胞发生迁移、向邻近组织浸润或远处转移。Montalvo-Ortiz B L等[10]用 Rac的抑制剂EHop-016处理高表达Rac的人乳腺癌细胞MDA-MB-435,瘤细胞Rac1的表达及活性明显受到抑制且转移能力减弱;Zins K等[11]用合成的化合物AZA197处理人直肠癌细胞,Cdc42表达减少,瘤细胞的迁移和侵袭能力受到抑制。本研究结果显示,大蒜新素处理的Hela细胞表达Rac1和Cdc42也明显减少,提示大蒜新素抑制Hela细胞的转移能力与下调Rho蛋白的表达有关。
肿瘤细胞在迁移运动的过程中,要突破细胞外基质和基底膜才能向邻近组织浸润或远处转移。MMPs是一类锌依赖的内源性蛋白水解酶,几乎能降解ECM的各种成分,是降解ECM的主要酶类。研究表明,异常高表达MMPs可增强肿瘤细胞的侵袭能力[12]。Song N R等[13]研究发现白皮杉醇可通过抑制人乳腺癌细胞MMP-2的表达减弱其转移能力;Moroz A等[14]研究发现下调人前列腺癌细胞MMP-2和MMP-9的表达可抑制癌细胞的侵袭能力;王云彬等[2]在用大蒜新素处理人膀胱癌T24细胞时发现T24细胞表达MMP-9明显减少且侵袭能力减弱。本研究显示,大蒜新素处理的Hela细胞MMP-2表达明显减少,提示大蒜新素抑制Hela细胞的侵袭能力与下调MMPs表达有关。
Rho蛋白必须与鸟苷酸交换因子(guanine nucleotide exchange factors,GEFs)结合并活化、具有GTP酶活性后才能激活下游分子转导信号。Montalvo-Ortiz B L等[10]发现 EHop-016通过干扰 Rac1与其GEF Vav2的结合影响Rac1的活化而发挥作用;EHop-016还可抑制Rac1的下游分子PAK1的活性。Zins K等[11]也发现随着 Rac1/Cdc42活性的下降,其下游分子PAK和AKT的活性也减弱。MMPs受多条信号通路调控。Lu K W 等[15]研究发现转移能力下降的癌细胞表达MMP-2、MMP-9减少与ERK1/2信号通路有关。本研究的结果显示大蒜新素抑制Hela细胞的转移能力与下调Rac1/Cdc42、MMP-2的表达有关,但具体的机制尚不清楚;而且,Rac1/Cdc42与 MMP-2之间有无关联,都有待进一步探讨。
[1]王广彬,赵瑞杰,王文魁,等.大蒜素诱导肿瘤细胞凋亡研究进展[J].动物医学进展,2010,31(1):73-76.
[2]王云彬,谢立平,秦杰,等.大蒜提取物二烯丙基化三硫对人膀胱癌T24细胞侵袭转移的影响[J].内蒙古医学院学报,2010,32(1):1-5.
[3]Lai K C,Hsu S C,Kuo C L,et al.Diallyl sulfide,diallyl disulfide,and diallyl trisulfide inhibit migration and invasion in human colon cancer colo 205cells through the inhibition of matrix metalloproteinase-2,-7,and-9expressions[J].Environ Toxicol,2013,28(9):479-488.
[4]滕淑静,宋旭日,段 智.二烯丙基三硫抑制Hela细胞的迁移和侵袭能力观察[J].中国现代医药杂志,2012,14(11):5-6.
[5]Li H,Peyrollier K,Kilic G,et al.Rho GTPases and cancer[J].Biofactors,2014,40(2):226-235.
[6]Gupta A,Kaur C D,Jangdey M,et al.Matrix metalloproteinase enzymes and their naturally derived inhibitors:novel targets in photocarcinoma therapy[J].Ageing Res Rev,2014,13:65-74.
[7]Smits K,Iannucci V,Stove V,et al.Rho GTPase Cdc42is essential for human T-cell development[J].Haematologica,2010,95(3):367-375.
[8]Fernández-Espartero C H,Ramel D,Farago M,et al.GTP exchange factor Vav regulates guided cell migration by coupling guidance receptor signalling to local Rac activation[J].J Cell Sci,2013,126(10):2285-2293.
[9]Morin P,Flors C,Olson M F.Constitutively active RhoA inhibits proliferation by retarding G(1)to S phase cell cycle progression and impairing cytokinesis[J].Eur J Cell Biol,2009,88(9):495-507.
[10]Montalvo-Ortiz B L,Castillo-Pichardo L,Hernández E,et al.Characterization of EHop-016,novel small molecule inhibitor of Rac GTPase[J].J Biol Chem,2012,287(16):13228-13238.
[11]Zins K,Lucas T,Reichl P,et al.A Rac1/Cdc42GTPasespecific small molecule inhibitor suppresses growth of primary human prostate cancer xenografts and prolongs survival in mice[J].PLoS One,2013,8(9):e74924.
[12]Chia C Y,Kumari U,Casey P J.Breast cancer cell invasion mediated by Gα12signaling involves expression of interleukins-6and-8,and matrix metalloproteinase-2[J].J Mol Signal,2014,9:6.
[13]Song N R,Hwang M K,Heo Y S,et al.Piceatannol suppresses the metastatic potential of MCF10Ahuman breast epithelial cells harboring mutated H-ras by inhibiting MMP-2 expression[J].Int J Mol Med,2013,32(4):775-784.
[14]Moroz A,Delella F K,Almeida R,et al.Finasteride inhibits human prostate cancer cell invasion through MMP2and MMP9downregulation[J].PLoS One,2013,8(12):e84757.
[15]Lu K W,Chen J C,Lai T Y,et al.Gypenosides inhibits migration and invasion of human oral cancer SAS cells through the inhibition of matrix metalloproteinase-2-9and urokinaseplasminogen by ERK1/2and NF-kappa B signaling pathways[J].Hum Exp Toxicol,2011,30(5):406-415.

