Hela 细胞早孕因子基因的克隆与原核表达
郑玮璐,刘为民,陈 芳,王丙云*,梁梓森,计慧琴,谢莹佳
(1.佛山科学技术学院,广东佛山 528231;2.华南农业大学,广东广州 510642)
早孕因子(early pregnancy factor,EPF)是哺乳动物受精后最早在血清中检测到的具有免疫抑制和生长调节作用的妊娠相关蛋白[1-2]。国外学者通过玫瑰花环抑制试验(RIT)在妊娠小鼠血清中检测到早孕因子的活性,因为其早在小鼠受精后4h~6h即可被检测到,将其命名为早孕因子[3]。研究发现,在妊娠妇女以及羊、猪、牛、马和兔等妊娠母体血清中也检测到了EPF活性。
EPF是一种糖蛋白,耐透析、对酸碱度的耐受性较强,温度低于56℃时很稳定,但超过72℃时容易失活,EPF无动物品种特异性[4]。人、猪和牛EPF的氨基酸序列完全相同,分子质量均为10.93 ku,等电点约为6.5。EPF对妊娠具有很高的特异性,是最早确认妊娠的生化指标之一[5-6]。研究表明,小鼠交配后6h,兔交配后16h,大鼠、绵羊、牛、猪交配后24h即可从母体内测出EPF,远远早于人绒毛膜促性腺素(hCG),而且EPF的活性在妊娠期存在时间较长,在小鼠可持续至产仔前4d,绵羊、猪则几乎持续整个孕期,直至分娩结束,并且猪怀孕3周~4周时EPF活性最高,但卵子如不受精则测不出[7],EPF对人和动物的超早期妊娠诊断具有重要意义。除了妊娠妇女以及羊、猪、牛、马和兔等妊娠哺乳动物母体血清中能检测到EPF活性之外,一些学者们还在肿瘤细胞中发现了EPF,并且证实其有促细胞生长的功能[8-9]。本研究从人肿瘤细胞系Hela细胞成功克隆到EPF基因,尝试采用原核表达方法获得大量EPF,为进一步制备EPF单克隆抗体和开发母猪早孕检测试剂盒奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒 大肠埃希菌BL21(DE3)、Hela细胞均由华南农业大学兽医学院微生物学教研室惠赠;基因工程菌大肠埃希菌DH5α、pREST-A质粒由佛山科学技术学院生命科学学院基础兽医学实验室保存。
1.1.2 主要试剂和材料 Premix ExTaq、XhoI、EcoRI、DNA Marker均为大连TaKaRa公司产品;T4DNA连接酶为NEB公司产品;低分子质量蛋白Marker、DNA凝胶回收试剂盒为上海生工生物工程技术服务有限公司产品;质粒提取试剂盒为Omega公司产品;NC膜、脱脂奶粉、BSA、丙烯酰胺,亚甲叉丙烯酰胺、甘氨酸、AP、Amp、咪唑、Tris base、透析袋等为北京鼎国公司产品;胰蛋白胨大豆肉汤(TSB)、酵母提取物(Yeast Extract)为 OXOID公司产品;一站式His标记蛋白质微量纯化套装为北京天恩泽产品;兔抗人EPF抗体、HRP羊抗兔二抗、HRP驴抗羊二抗为Proteintech公司产品。
1.2 方法
1.2.1 Hela细胞的培养 冻存的Hela细胞置于水浴锅中37℃快速解冻复苏,离心洗涤后重悬细胞,37℃、体积分数为5%的CO2培养箱中培养,当细胞生长密度到达80%~90%汇合度时进行传代,选用第3代细胞抽提RNA,备用。
1.2.2 引物设计与合成 用Primer5.0对Gen-Bank上已经发表的EPF基因(CR407688)设计一对特异性引物,在引物的5′端加入XhoⅠ、EcoRⅠ 酶切位点(下划线部分),设计时加入保护性碱基。引物序列如下:

引物由生工生物工程(上海)有限公司合成,预期扩增片段长度为309bp。
1.2.3 RT-PCR 参照TaKaRa公司的AMV逆转录酶使用说明进行。反转录体系如下:向4μL 5×AMV buffer中加入10mmol/L 的 dNTP 2μL,RNA 酶抑制剂1μL,Oligo(dT)1μL,AMV 1μL,模板RNA 11μL,反应总体积20μL,离心混匀后,42℃作用1h。获得的cDNA作为模板进行PCR。在 PCR管中依次加入:Premix ExTaq酶12.5μL,模板DNA 1μL,10μmol/L的EPF-1和10μmol/L的EPF-1各1μL,灭菌的双蒸水9.5μL,使反应体系总体积为25μL。PCR反应条件 :94℃5min;94℃30s,53℃30s,72℃45s,循环30次;72℃10 min。采用10g/L琼脂糖凝胶电泳检测EPF基因的扩增结果。
1.2.4 表达载体的构建 将纯化后的PCR产物和表达载体pREST-A分别用XholⅠ和EcoRⅠ双酶切。将获得的双酶切产物与已双酶切纯化后的pREST-A在16℃连接过夜,连接产物转化DH5α感受态细胞,对转化成功的重组质粒进行菌落PCR,将鉴定为阳性的克隆菌落进行挑菌过夜培养,小量制备质粒,经酶切分析与测序鉴定。
1.2.5 组蛋白的诱导表达 将鉴定为阳性的重组表达载体pREST-A转化宿主菌BL21(DE3),用1.0 mmol/L IPTG诱导,37℃恒温摇床200r/min振荡培养5h。将诱导表达的重组菌进行离心,12 000 r/min 10min,收集沉淀,PBS洗涤两次,再将沉淀用PBS(10%原液体积)重悬。于冰浴中超声波裂解细菌,裂解至菌液变清亮,12 000r/min离心20 min,分别收集上清和沉淀,通过SDS-PAGE分析目的蛋白的表达情况和可溶性,大量培养细菌,用于重组蛋白的纯化。
1.2.6 重组蛋白的纯化 按照一站式His标记蛋白质微量纯化套装说明书的操作步骤进行纯化,收集洗脱液。采用脱盐柱去除洗脱液中的盐离子和多余水分子,采用PEG2000对脱盐后的目的蛋白进一步透析浓缩。以紫外分光光度计测定获得的蛋白浓度,以SDS-PAGE法测定目的蛋白的纯度,用Wes tern blot检测蛋白的抗原特异性。
1.2.7 Western blot检测 纯化后的蛋白加入上样缓冲液水沸煮5min后电泳;200mA恒流电转;结束后,将NC膜用PBST洗3×5min;而后加入一抗37℃温育2h,PBST洗3×5min,加入酶标二抗,37℃温育1h,取出用PBST洗3×5min;DAB显色。
2 结果
2.1 EPF-cDNA的RT-PCR克隆
以Hela细胞总RNA为模板对EPF mRNA全长进行RT-PCR扩增,扩增后采用琼脂糖凝胶电泳检测,结果显示扩增出长约309bp的条带,与预期设计的大小一致(图1)。

图1 EPF目的片段PCR产物电泳Fig.1 Electrophoresis of PCR products of EPF genes
2.2 重组表达载体pREST-A-EPF的双酶切鉴定
用限制性内切酶XholⅠ和EcoRⅠ对重组表达载体pREST-A-EPF进行双酶切,其中一条大小约为2 897bp,与pREST-A载体分子质量大小一致,另一条大小约309bp,与EPF cDNA大小相符(图2)。测序结果与目的片段同源性为100%。
2.3 目的蛋白的表达
将IPTG 诱导的 摇菌 过夜 的 BL21(DE3)-pREST-A-EPF菌液和BL21(DE3)-pREST-A菌液用SDS-PAGE电泳鉴定。结果显示,摇菌过夜的连接载体表达菌液出现特异条带,条带大小约为16 ku,与预期蛋白大小相符,而摇菌过夜的空载体表达菌液没有此特异性条带(图3)。

图2 重组表达载体pREST-A-EPF酶切鉴定Fig.2 Identication of recombinant pREST-A-EPF plasmid by enzyme digestion
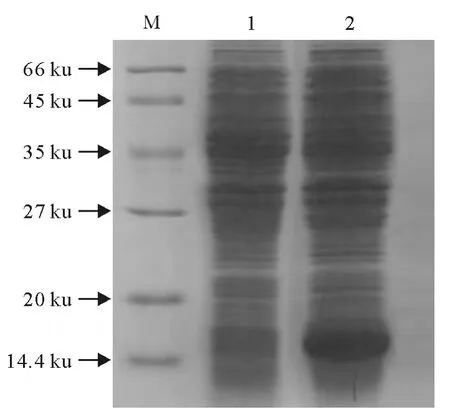
图3 重组蛋白的SDS-PAGEFig.3 SDS-PAGE analysis of recombinant protien
将摇菌过夜的BL21(DE3)-pREST-A-EPF菌液于超声波裂解,分别取上清和沉淀用SDS-PAGE电泳鉴定。结果显示,重组目的蛋白主要以可溶性形式表达(图4)。
2.4 表达产物的纯化
用HIS标签蛋白纯化试剂盒纯化重组蛋白。纯化后的样品进行SDS-PAGE电泳。结果表明,得到纯度高的融合蛋白,其分子质量约为16ku,与预期相符(图5)。
2.5 表达产物的 Western blot检测
将纯化的重组蛋白进行Western blot检测。结果显示,纯化的重组蛋白能被抗EPF抗体识别,并发生特异性结合(图6)。

图4 菌体超声裂解产物的SDS-PAGEFig.4 SDS-PAGE analysis of bacterial ultrasound pyrolysis product
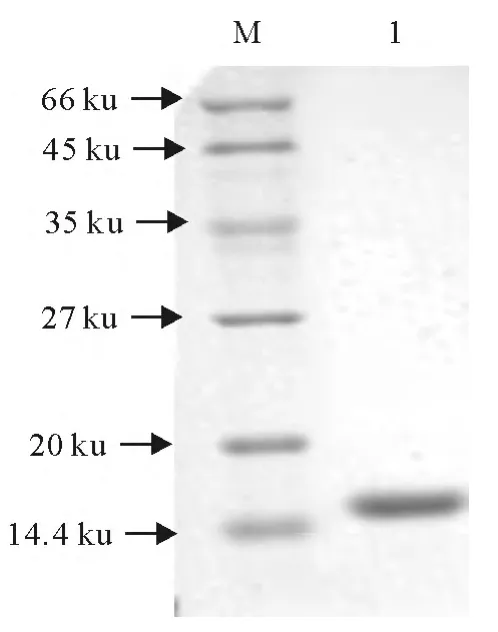
图5 纯化的重组EPF蛋白SDS-PAGEFig.5 SDS-PAGE analysis of purified recombinant EPF protein
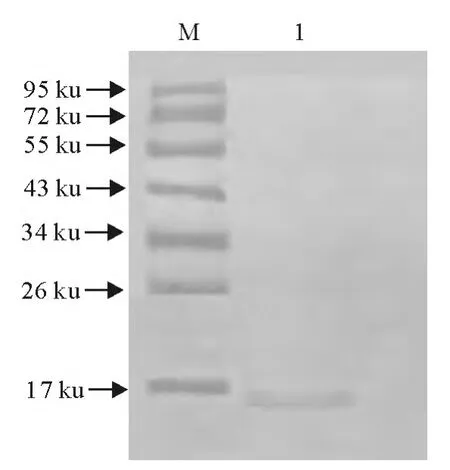
图6 纯化的重组EPF蛋白Western blot检测Fig.6 Western blot analysis of purified recombinant EPF protein
3 讨论
Morton H等[10]运用原核表达系统制备了重组EPF,采用真核表达系统制备重组EPF,并通过玫瑰花环抑制试验证明了重组EPF的活性与天然EPF活性相当,无明显差别[11]。也有通过原核表达成功获得EPF的报道[12-14]。这些研究成果为解决从血清中分离EPF的难题提供了新的途径与方法。
本试验采用的pRSET-A原核表达系统有两个优点:①pRSET-A质粒带有34个氨基酸前导肽序列的融合标签,为小多肽融合标签,在大多数情况下,由于多肽标签相对较小,对融合蛋白质结构影响很小,不需要从融合蛋白质中切除,因而多肽融合标签较蛋白质标签更为实用;②该质粒带有His6-tag,可以采用His柱亲和层析法对表达的重组蛋白进行纯化,该方法不使蛋白质变性,最大限度地保留目的蛋白的免疫原性。在诱导表达时,发现当IPTG浓度低于0.05mmol/L时细菌仍能表达目的蛋白,并且还发现无需IPTG诱导,只要摇菌37℃过夜,也能得到目的蛋白。经SDS-PAGE电泳和 Wes tern blot分析证实为目的蛋白。分析出现这种现象可能原因:①pRSET-A原核表达系统受lacO的调控,而lacO本身不是严谨操纵子,所以出现了泄漏表达;②在培养基中会含有一些乳糖的成分,导致本底表达。因为这不是本试验的内容,所以不做进一步研究。将表达细菌体经超声波破碎后,离心收集上清和沉淀,通过SDS-PAGE电泳分析发现目的蛋白存在上清中,为可溶性蛋白。以可溶形式表达的目的蛋白,具有天然的四级结构,能够保持目的蛋白的天然构象,从而可以简化目的蛋白的纯化,减少纯化过程中目的蛋白的损失。
母猪妊娠诊断技术的趋势是向着诊断时间早、诊断准确率和灵敏度高的方向发展。所以,母猪超早期妊娠诊断的价值很大,对确诊已妊娠的母猪,保证胎儿正常发育,防止流产以及预测分娩日期;对未妊娠的母猪,可以及时进行检查,找出未孕原因,采取相应的治疗措施,能有效地提高母猪繁殖效率和减少经济损失[15-16]。而EPF作为具有生长调节活性的妊娠相关蛋白,是最早确认妊娠的生化指标之一,在超早期妊娠诊断中有着至关重要的检测意义和应用价值。
研究证明,EPF无动物以及品种特异性[17],而且人和猪的EPF的氨基酸序列完全相同[11]。所以,本研究获得的重组人EPF蛋白同样适用于对EPF蛋白的相关研究以及母猪早孕诊断试剂盒的开发。
[1]温志锋,练玉银,王家骥,等.早孕因子分离纯化方法的优化[J].免疫学杂志,2012,28(12):1073-1076.
[2]王乃东,薛立群.早孕因子的研究进展及应用前景[J].动物医学进展,2005,26(4):5-8.
[3]Morton H,Hegh V,Clunie G J A.Immunosuppression detected in pregnant mice by the rosette inhibition test[J],Nature,1974,249:456-459.
[4]Corrao S,Campanella C,Anzalone R,et al.Human Hsp10 and Early Pregnancy Factor(EPF)and their relationship and involvement in cancer and immunity:current knowledge and perspectives[J].Life Sci,2010,86(5-6):145-152.
[5]杨 杰,张海涛,翟 频,等.早孕因子多克隆抗体的制备及应用[J].江苏农业学报,2011,27(6):321-324.
[6]Campbell K L,Rockett J C.Biomarkers of ovulation,endometrial receptivity,fertilisation,implantation and early pregnancy progression[J].Paediatr Perinat Epidemiol,2006,20(S1):13-25.
[7]王晓申,魏丽军,叶绍辉.早孕因子研究进展[J].生物技术通讯,2008(2):313-316.
[8]邓松华,苏宝田,徐振山.早孕因子对淋巴细胞增殖的影响[J].中国病理生理杂志,1998,14(4):410-413.
[9]杜晓明.人早孕因子表达与促细胞生长模型的初步建立[D].河南郑州:郑州大学,2011.
[10]Morton H,Mckay D A,Murphy R M,et al.Production of a recombinant form of early pregnancy factor that can prolong allogeneic skin graft survival time in rats[J].Immunol Cell Biol,2000,78(6):603-607.
[11]Somodevilla-Torres M J,Morton H,Zhang B,et al.Purification and characterisation of functional early pregnancy factor expressed in sf9insect cells and in escherichia coli[J].Protein Expr Purif,2003,32(2):276-287.
[12]杜晓明,张改平,王 丽,等.重组人早孕因子的表达与纯化[J].中国农学通报,2011,27(14):40-44.
[13]练玉银,王家骥.重组早孕因子(EPF)的表达、纯化及鉴定[J].生殖与避孕,2012,32(3):156-160.
[14]王 丽,杜晓明,王林林,等.人热休克蛋白10和鼠热休克蛋白10的克隆、序列分析及其原核表达[J].华北农学报,2011,26(3):56-59.
[15]边艳超,刘 颖,王 未,等.家畜早期妊娠诊断技术研究进展[J].畜牧与兽医,2014(8):100-102.
[16]张宏刚,陈树林,王晓珊,等.孕牛血清早孕因子的生物活性检测及妊娠率分析[J].动物医学进展,2010,31(8):30-33.
[17]Ghaffari L V,Ghaffari L R,Pirany N,et al.Measurement of EPF for detection of cow pregnancy using rosette inhibition test[J].Theriogenology,2008,70(1):105-107.

