结核分支杆菌Rv3117基因的克隆与原核表达
刘 杨,宋纪伟,曾范利,时 坤,李健明,杜 锐,4*
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.吉林市人民医院,吉林吉林 132001;3.吉林农业大学中药材学院,吉林长春 130118;4.教育部动物生产及产品质量安全重点实验室,吉林省药用动物二级实验室,吉林长春 130118)
鹿结核病(Deer tuberculosis)是由结核分支杆菌(Mycobacteriumtuberculosis)引起的一种慢性、传染性疾病,该病呈世界分布,给养鹿业带来了严重的经济损失[1-2]。我国鹿结核病检测目前尚无规定性的诊断方法,主要采取结核分支杆菌PPD皮内变态反应试验。但该方法存在诸多问题,如只能进行活体试验,不能区分各种分支杆菌,不能对保存的样品进行回顾性分析,尤其是它的特异性较低,经BCG免疫的鹿变态反应检测均呈现阳性[3-5],因此,不能从免疫过的动物中检测出患病动物,致使结核菌素皮内变态反应的特异性受到质疑[6-9]。为解决以上难题,人们对鹿结核分支杆菌进行探索性试验,期望能找到鹿结核病检测的新方法。
2012年,汤俊明等研究发现了一个活性较强的B细胞抗原Rv3117[10],虽然已进行了初步研究,但有关Rv3117抗原性的研究国内外鲜有报道。Rv3117是RD5区编码的蛋白[11-12],该基因存在于结核分支杆菌中,而在卡介苗中缺失。本研究成功构建了pGEX-4T-1-Rv3117重组质粒,并对其进行诱导表达,对获得的目的蛋白进行抗原性分析,以期该重组蛋白成为结核病诊断研究候选抗原的可能。
1 材料与方法
1.1 材料
结核分支杆菌H37Rv菌株购自中国兽医菌种保藏中心;pGEX-4T-1载体由军事兽医研究所惠赠;E.coliBL21感受态细胞、pMD-18TVector、ExTaqDNA聚合酶、T4DNA连接酶、EcoRⅠ、SamⅠ等限制性内切酶均为TaKaRa公司产品;DNA凝胶回收试剂盒杭州维特洁生化技术有限公司产品;鹿结核多克隆抗血清和HRP标记的兔抗鹿IgG由吉林农业大学经济动物疫病实验室保存。
1.2 方法
1.2.1 结核分支杆菌的培养和染色体DNA的提取 将结核分支杆菌H37Rv接种于改良罗氏培养基中培养。6周后按照如下方法对染色体DNA进行抽提:取100mL液体培养菌于85℃水浴中灭活1h;5 000r/min离心集菌15min;将沉淀用2.5 mL TE buffer溶解,于-20℃冻存4h使溶菌酶更为有效;加入0.5mL TE buffer溶解悬浮细胞;再加入等量的氯仿、甲醇(2∶1)摇匀;5 000r/min离心20min,去除上下两层,留下中间的细胞层;将细胞层于55℃开盖水浴10min~15min,以去除有机溶剂;加入0.5mL TE buffer剧烈振荡;加入50μL的pH 为9.0的 Tris-HCl和10μL浓度为50 mg/mL的溶菌酶,37℃孵育12h~16h,加入后勿振荡;加入0.1体积浓度为100mL/L的SDS和适量的蛋白酶K裂解液;加入等体积的苯酚:氯仿:异戊醇(25∶24∶1),轻轻摇匀30min;5 000r/min离心30min,小心吸取水相;用2.5倍体积700mL/L的乙醇沉淀2h;1 000r/min离心10min,沉淀用30μL的TE buffer溶解,于-4℃保存备用。
1.2.2 引物的设计与合成 根据GenBank中的结核分支杆菌H37Rv株的Rv3117的基因序列设计
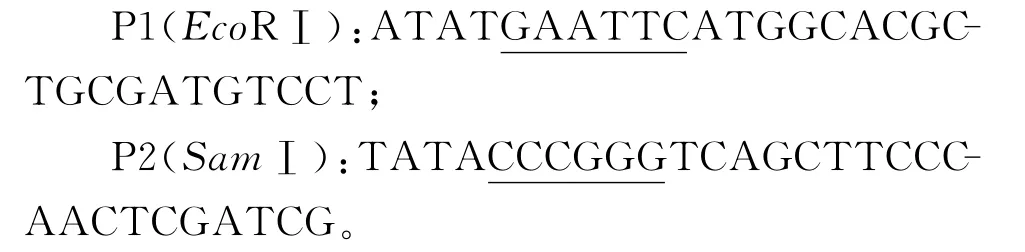
1.2.3 目的基因的PCR扩增及产物的纯化 以结核分支杆菌H37Rv染色体DNA为模板,以P1、P2为引物,对Rv3117基因进行PCR扩增。PCR反应条件为:95℃5min;94℃1min,55℃1min,72℃1min,共35个循环;最后再于72℃延伸10min。对PCR产物进行琼脂糖凝胶电泳分析,并用DNA回收纯化试剂盒对其进行纯化,操作方法按产品说明书进行。
1.2.4 重组质粒的构建与鉴定 将上述纯化的PCR产物与pMD-18TVector连接,转化E.coliJm109感受态细胞,获得重组质粒pMD18TRv3117。经酶切和PCR鉴定的重组质粒并送上海生工生物工程技术服务有限公司进行测序,用EcoRⅠ和SamⅠ酶切pMD18T-Rv3117并应用凝胶回收Rv3117片段,将其连入经酶切处理的pGEX-4T-1载体,转化DH5α感受态细胞,经酶切和PCR鉴定后获得重组质粒pGEX-4T-1-Rv3117。
1.2.5 重组质粒的诱导表达和SDS-PAGE分析将重组质粒pGEX-4T-1-Rv3117转化E.coliBL21感受态细胞,涂布于Amp+(50mg/mL)的LB琼脂平板上,挑取单菌落接种于5mL Amp+的LB液体培养基,37℃振摇OD600约0.6。加IPTG至终浓度为1mmol/L,继续振摇6h,离心集菌,用SDSPAGE电泳分析重组蛋白质的表达情况,同时设pGEX-4T-1空载体和IPTG诱导前的转化菌作为对照。
1.2.6 Western blot分析 表达产物经120mL/L的SDS-PAGE后,按文献[13]的方法转印至PVDF移膜上,经牛血清白蛋白(BSA)封闭后,依次加入鹿结核多克隆抗血清、辣根过氧化物酶标记兔抗鹿IgG,最后在联苯胺(DAB)溶液中显色。一对引物。引物由上海生物工程股份有限公司合成。其序列如下:
2 结果
2.1 重组质粒的构建及鉴定
以重组质粒pGEX-4T-1-Rv3117为模板,P1,P2为引物进行PCR扩增,得到约800bp的基因片段(图1)。以EcoRⅠ和SamⅠ双酶切pGEX-4T-1-Rv3117重组质粒,得到约4 900bp的pGEX-4T-1载体片段和800bp的插入片段(图1)。序列测定证实该DNA片段大小为834bp,与GenBank中MycobacteriumtuberculosisH37Rv株 Rv3117 基因序列的同源性为100%。
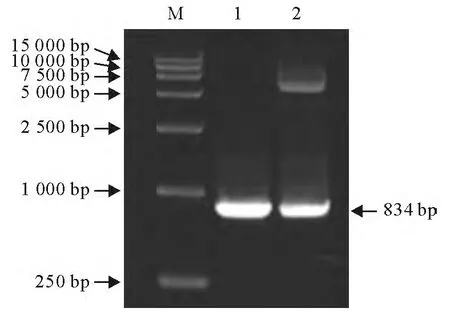
图1 重组质粒pGEX-4T-1-Rv3117的PCR和双酶切鉴定Fig.1 PCR and double restriction enzyme digestion identification of recombinant plasmid pGEX-4T-1-Rv3117
2.2 SDS-PAGE分析
经IPTG诱导的pGEX-4T-1-Rv3117于E.coliBL21中在各时间的表达情况见图2,Rv3117基因获得了表达,其表达量随诱导时间的延长而增加,诱导6h达到高峰,融合蛋白的相对分子量约为60 ku(含约30ku的pGEX-4T-1部分肽段和约30ku的Rv3117肽段),与预期结果相一致。而对照的含空载体的pGEX-4T-1的E.coliBL21和诱导前则未见该蛋白质表达。
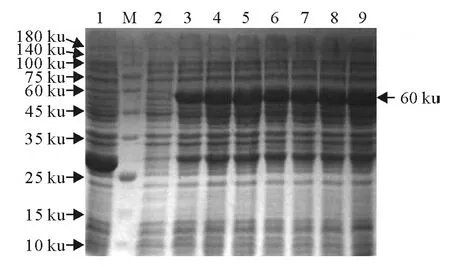
图2 重组蛋白的SDS-PAGE分析Fig.2 Identification of recombinant protein by SDS-PAGE
2.3 Western blot分析
表达产物经SDS-PAGE后电转移至PVDF转移膜上,以鹿结核多克隆抗血清为一抗,辣根过氧化物酶标记的兔抗鹿IgG的抗体为酶标二抗,联苯胺(DAB)为底物,进行蛋白印迹分析(图3)。从图中可见约60ku处有一条明显的蛋白印迹带,说明该表达产物具有结核分支杆菌抗原性。
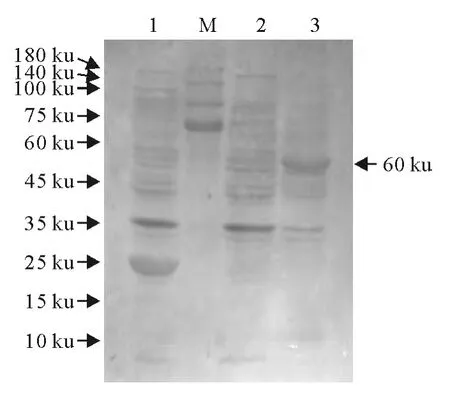
图3 表达蛋白的Western blot分析Fig.3 Western blot analysis of expressed protein
3 讨论
在鹿结核病早期,对其进行快速、精确的诊断,可以降低其致病率和病死率,目前常用PPD变态反应试验,染色镜检,PCR检测相结合的方法来诊断结核病,但这种方法灵敏度低,耗时较长,导致结核病最佳治疗时机的延误。因此,寻找新的检测方法显得尤为重要。
近年来,通过DNA序列杂交技术,DNA微阵列技术和全基因序列比对,对结核分支杆菌的流行株与卡介苗进行比较,发现了RD区[14],其存在于结核分支杆菌中,而在卡介苗中缺失。表明RD区编码的蛋白抗原可能对提高结核病免疫诊断的敏感度和特异性有特殊作用。RD5区存在于结核分支杆菌中,而在卡介苗(BCG-Danish,BCG-Pasteur[15]我国常用菌株)中缺失。张苗苗等研究发现RD5区的RV3117基因可能作为结核血清免疫诊断的潜在标志物[16]。生物信息学分析结果显示,结核分支杆菌Rv3117开放阅读框编码的产物可能为硫代硫酸盐硫转移酶,它可能参与硫代硫酸盐形成磺基转移酶,也可能参与中间代谢和呼吸。
本研究采用了分子克隆的方法,经PCR扩增H37Rv标准株和其他不同的临床分离株均在同一位置处出现834bp片段,可以认为H37Rv标准株和临床株均存在该目的基因Rv3117。对该重组工程菌进行诱导、表达,SDS-PAGE分析显示一条大小约60ku(含30ku的pGEX-4T-1部分肽段和30 ku的Rv3117肽段)的蛋白诱导条带,与预期结果相一致。经Western blot分析证实其具有结核分支杆菌的反应原性。因此,Rv3117有望成为结核病检测的诊断抗原,从而为结核病诊断方法的建立奠定基础。
[1]杜 锐.中国养鹿与疾病防治[M].吉林长春:中国农业出版社,2010:404.
[2]Stermann M,Sedlaeek L,Maass S,et al.A Promoter mutation causes differential nitrate reduetase activity ofMycobacterium tuberculosisandMycobacteriumbovis[J].J Bacteriol,2004,186:2856-2861.
[3]陈颖钰,郭爱珍.牛结核病防控技术研究进展[J].中国奶牛,2014(16):1-7.
[4]Casal C J,Bezos A,Diez-Guerrier J,et al.Evaluation of two cocktails containing ESAT-6,CFP-10and Rv-3615cin the intradermal test and the interferon-gamma assay for diagnosis of bovine tuberculosis[J].Prev Vet Med,2012,105:149-154.
[5]李 丹.3种结核菌检测方法在结核病诊断中的应用研究[D].吉林长春:吉林大学,2014:7.
[6]刘增再.牛结核病诊断研究进展[J].动物医学进展,2005,26(5):13-16.
[7]高玉然,张翠英,刘 琳,等.结核抗体检测及结核菌素试验在结核病诊断中的价值[J].中国热带医学,2011,11(5):542-544.
[8]匡有吉.梅花鹿结核抗体检测方法的建立和应用[D].湖北武汉:华中农业大学,2008:10-11.
[9]鑫 婷.重组牛分枝杆菌特异性蛋白在牛结核病诊断中的初步应用研究[D].北京:北京畜牧兽医研究所,2013:6.
[10]Zhang M M,Zhao J W,Sun Z Q,et al.Identification of RD5-encodedMycobacteriumtuberculosisproteins as B-cell antigens used for serodiagnosis of tuberculosis[J].Clin Dev Immunol,2012:738043.
[11]孟 闯.结核分枝杆菌抗原蛋白的表达、免疫特性分析及在牛结核病检测中的初步应用[D].江苏扬州:扬州农业大学,2011:19-21.
[12]Mehta P K,Kalra M,Khuller G K ,et al.Development of an ultrasensitive polymerase chain reaction-amplified immunoassay based on mycobacterial RD antigens:implications for the serodiagnosis of tuberculosis[J].J Diagn Microbiol Infect Dis,2012,72(2):166-174.
[13]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].黄培堂,王嘉玺,朱厚础,等,译.北京:科学出版社,2002.
[14]刘东旭.鹿结核菌野毒株与卡介苗差异基因文库的构建[D].吉林长春:吉林农业大学,2012:6-11.
[15]ParkashO,Singh B P,Pai M.Regions of differences encoded antigens as targets for immunodiagnosis of tuberculosis in humans[J].Scand J Immunol,2009,70(4):345-57.
[16]张苗苗.结核分枝杆菌特异的RD5区编码蛋白应用于结核血清免疫诊断的初步研究[D].新疆乌鲁木齐:新疆医学院,2013:28.

