江西省汉坦病毒分离及其S和M基因特征分析
刘师文,徐 刚,施 勇,龚 甜,李健雄,刘晓庆,熊 英
江西省汉坦病毒分离及其S和M基因特征分析
刘师文,徐 刚,施 勇,龚 甜,李健雄,刘晓庆,熊 英
目的 对2011年江西省采集的鼠肺标本进行汉坦病毒的分离鉴定,了解分离病毒株的基因特征。方法 采用Vero-E6细胞对阳性鼠肺标本进行病毒分离,采用直接免疫荧光法和RT-PCR方法对毒株进行鉴定。扩增分离株的S、M片段基因进行克隆测序。运用DNAstar软件包和MEGA3.1软件对序列进行分析。结果 从15份标本分离到2株来自褐家鼠的汉城型汉坦病毒。对其中1株病毒的S、M片段进行了克隆和序列测定,其中S片段含1 772个核苷酸,编码429个氨基酸;M片段含3 651个核苷酸,编码1 133个氨基酸。经核苷酸和氨基酸同源性分析,新分离株与国内外汉城型病毒核苷酸同源性94.8 %~98.0%,氨基酸同源性98.2%~99.6%。与汉城型标准株80-39株相比,S片段仅1个氨基酸位点发生变异;M片段有9个氨基酸位点发生变异,糖基化位点的数目和位置没有发生变化。结论 从江西省褐家鼠分离到两株汉城型病毒,病毒基因变异较小,型别相对稳定。
汉坦病毒;病毒分离;M基因;S基因;序列分析
Support by the Provincial Health Department of Jiangxi Province (No. 20123156)
汉坦病毒(Hantavirus,HV)属布尼亚病毒科(Bunyaviridae)汉坦病毒属(Hantavirus),是有包膜的负链 RNA 病毒。HV基因组由大(L)、中(M)、小(S)3个基因片段组成。目前已经有40多个血清型或者基因型,并且至少有22个型的HV能引起人类疾病[1-2]。
鼠类等啮齿动物是HV的自然储存宿主,人类主要通过吸入受感染动物的分泌物或排泄物而获得病毒感染。在世界上很多国家,鼠源的HV感染导致的人类肾综合征出血热(Hemorrhagic fever with renal syndrome,HFRS)或汉坦病毒肺综合症是非常重要的人兽共患病。中国是HFRS流行最严重的国家之一, 发病数和死亡数在全世界最多[3-4]。
目前国内外已分离到很多HV,江西地区早在20世纪80年代就由刘佩琴等人分别从社鼠和罗赛鼠中分离到HV C94株和 L99株[5]。L99株曾作为疫苗株制备肾综合征出血热地鼠肾灭活疫苗[6]。之后再未见江西地区分离到HV的报道,关于HV的检测一直停留在免疫检测水平。本研究对2011年采集的HV阳性鼠肺标本进行病毒分离,并对分离株进行了S和M片段基因测序分析,以了解我省HV的基因特征和遗传变异情况,为HFRS的防控提供科学依据。
1 材料和方法
1.1 标本来源 于2011年春秋季,在江西省高安、安义、新建、上饶、上高和浮梁县(市)捕鼠,共捕获鼠类616只鼠,对鼠肺进行了直接免疫荧光HV抗原检测,从41份HV阳性鼠肺中选取15份保存较好的鼠肺标本进行病毒分离。
1.2 主要试剂和材料 Vero-E6细胞来自中国疾病预防控制中心病毒病所出血热室,荧光素标记的汉坦病毒抗体、(第四军医大学)、小牛血清(杭州四季青)、胎牛血清(GIBCO)、MEM(GIBCO)、Rneasy Mini Kit (Qiagen)、SuperScript®Ш First-Strand synthesis system for RT-PCR(Invitrogen)、2 000 bp DNA Marker、Pyrobest®DNA Polymerase(TaKaRa)、聚合酶链反应(PCR)相关试剂(Promega)和细胞刮刀(Corning)。
1.3 病毒分离 将HV阳性的鼠肺标本经液氮研磨后用MEM溶液(含1%青霉素和链霉素,pH7.4)制成10%悬液,3 000 g离心10 min,取1 mL上清接种于Vero-E6细胞,37 ℃孵育2 h;吸去残留液体加入2%牛血清的维持液,37 ℃培养。每3~4 d换1次维持液,28 d传代1次。分别在每代第7、14、21、28 d用细胞刮刀刮取少量细胞涂片进行直接免疫荧光检测。连续传代3次仍为HV阴性者,则放弃培养。
1.4 培养物的直接免疫荧光检测 用细胞刮刀刮取少量细胞至载玻片,在生物安全柜干燥,冷丙酮固定20 min,PBS冲洗2次,蒸馏水漂洗1次,吹干,加荧光素标记汉坦病毒抗体,置湿盒内37 ℃孵育30 min取出, PBS冲洗3次,蒸馏水漂洗1次,吹干,甘油封片后在荧光显微镜下观察结果。
1.5 核酸提取、扩增、克隆和测序 对出现免疫荧光阳性结果的培养物,采用德国QIAGEN公司的RNeasy Mini Kit提取,具体步骤参照产品说明书。引物见表1,逆转录及汉坦病毒鉴定引物和方法参照2004版《全国肾综合征出血热监测方案(试行)》。采用P14引物及SuperScript®Ш First-Strand synthesis system for RT-PCR试剂盒合成cDNA, 反应体系和反应条件参照试剂盒说明书。S片段采用1对引物,M片段采用2对引物扩增,PCR反应条件:95 ℃ 变性5 min;94 ℃ 1 min, 54 ℃ 1 min,72 ℃ 3 min,共扩增40个循环,72 ℃延伸 20 min。1.5%琼脂糖凝胶电泳检测PCR产物,目的片段扩增产物送上海生工生物工程有限公司进行克隆并测序。

表1 汉坦病毒逆转录及扩增引物
1.6 基因序列分析 运用DNAStar 软件(SeqMan)对测定的序列进行拼接,得到S和M片段基因的核苷酸序列,并推导出相应的氨基酸序列。选择GenBank公布的国内外HV代表株基因序列用于比较分析,运用MEGA3.1和DNAstar软件包进行系统发生分析。参考毒株信息见表2。
2 结 果
2.1 病毒分离 从江西省新建县的褐家鼠中分离到2株HV,命名为JiangxiXinjianRn-07-2011和JiangxiXinjianRn-09-2011。对培养物进行直接免疫荧光实验,这两份标本均在第1代第21 d开始出现特异性的荧光颗粒,第2代第7 d,所有细胞带特异的荧光颗粒。而其他培养物培养3代都没有出现特异性荧光颗粒。
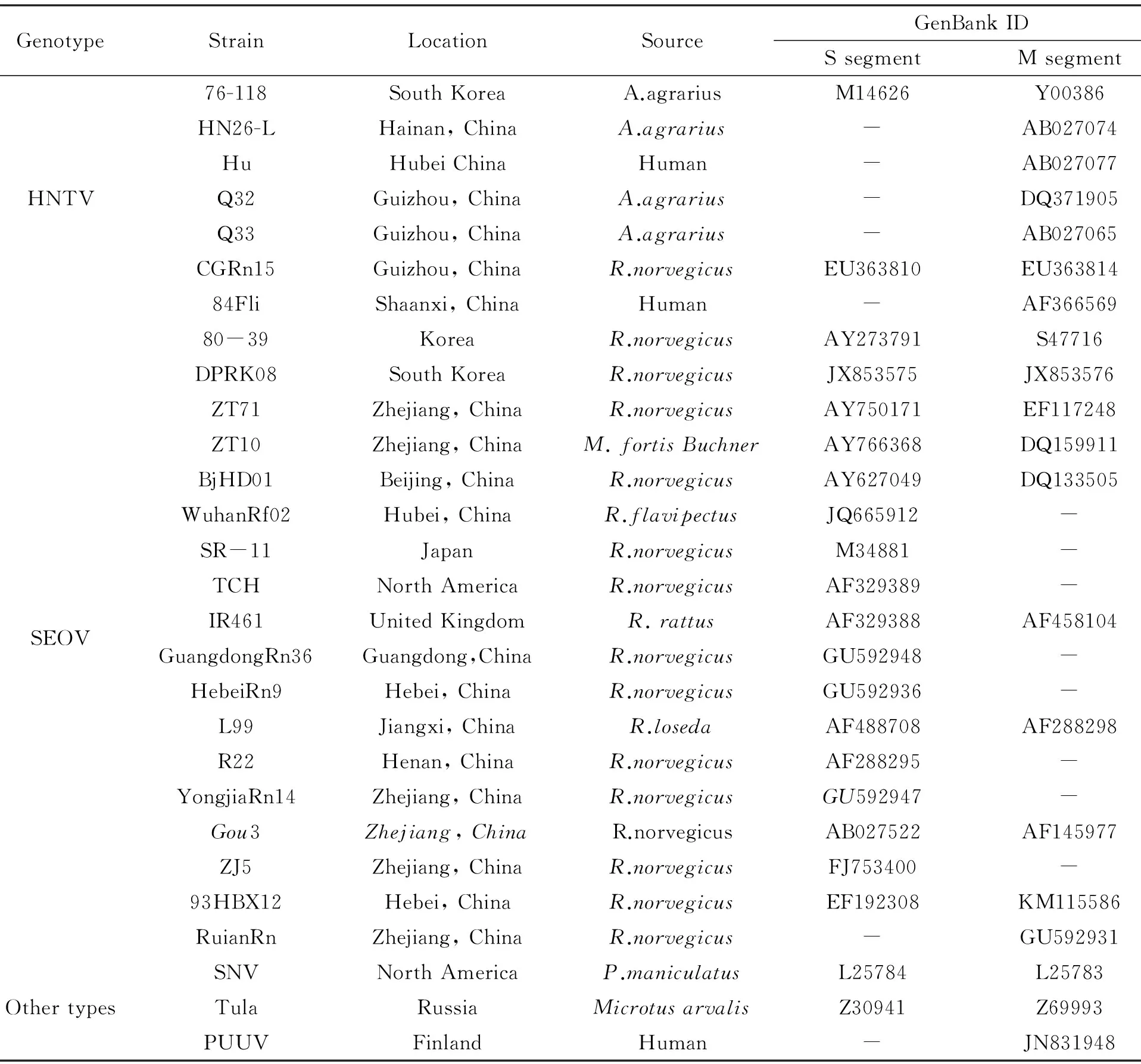
表2 参考毒株的来源信息
2.2 病毒鉴定 采用HV特异性引物(HV-MG2F、HV-MG2R)扩增新分离两株病毒,均获得一个445 bp (1 910~2 354 bp) 目的片段。基于M片段300个核苷酸序列(2 003~2 302 bp)构建系统发生树见图1。这2株病毒均分布在汉城型病毒(SEOV)分支并由此得出这两株病毒均为SEOV型HV。
2.3 S和M片段核酸扩增 选择JiangxiXinjianRn-09-2011株进行S和M基因片段扩增(图1),一条S目的片段大小1.7 kb, M片段分两段扩增,目的片段大小分别为2.2 kb和1.7 kb,与预期结果相符。
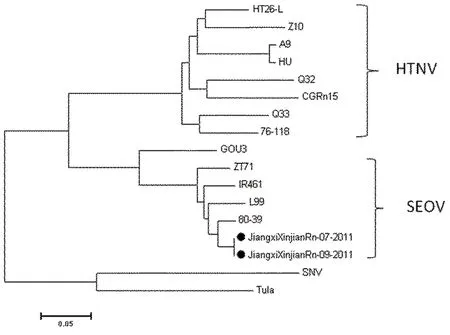
图1 HV部分M片段核苷酸系统发生树(2 003~2 302 bp)
Fig.1 Phylogenetic tree of HV based on partial M segment (2 003-2 302 bp)
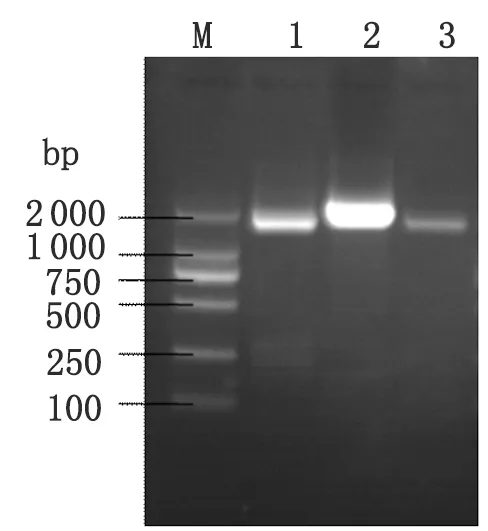
M: Marker; 1: PCR products of S segment; 2: PCR products of M1; 3: PCR products of M2.
图2 JiangxiXinjianRn-09-2011病毒株S、M片段扩增电泳图
Fig.2 Electrophoresis patterns of complete S, M segments PCR products of JiangxiXinjianRn-09-2011 using the specific primers
2.4 S和M片段核苷酸序列分析 JiangxiXinjianRn-09-2011病毒株S片段基因序列(GenBank登陆号为KP859512)为1 772 bp,其中 A、T、C、G的比例分别为31.60%、26.41%、18.91%、23.08%,A+T含量58.01%,C+G含量为41.99%。JiangxiXinjianRn-09-2011的S片段核苷酸与GenBank公布的14株SEOV核苷酸同源性达95.7%~98.0%,与SEOV国际标准株80-39株的同源性为97%;与WuhanRf02株同源性为98.0%;与GOU3株同源性为88.2%,与汉滩型(HTNV)、多不拉伐型(DOBV)等其他型别的HV同源性均低于75%。
JiangxiXinjianRn-09-2011病毒株的M片段基因序列(GenBank登陆号为KP859514)为3 651个核苷酸,其中A、T、C、G的比例分别为30.65%、30.35%、18.49%、20.51%,A+T含量61.00%,C+G含量为39.00%。M片段核苷酸与GenBank公布的8株SEOV核苷酸同源性94.8%~96.1%,与朝鲜分离株DPRK08同源性最高为96.1%,与80-39株同源性为95.5%;与GOU3株核苷酸同源性为84.6%,与HTNV型同源性为71.1%~71.3%,与其他型别HV核苷酸同源性均低于70%。
运用MEGA3.1和DNAStar软件,以邻位相连法(Neighbor-Joining)分别构建S和M片段核苷酸系统发生树(图3和图4),JiangxiXinjianRn-09-2011株分布在SEOV分支。图3还显示JiangxiXinjianRn-09-2011与WuhanRf02株亲缘关系最近。
2.5 氨基酸序列分析 JiangxiXinjianRn-09-2011株S基因片段只存在1个开放阅读框(43~1 332 nt),编码429个氨基酸, 5′端和3′末端分别含43个和440个核苷酸的非编码区。其编码的氨基酸序列与SEOV氨基酸同源性98.2%~99.8%,国际标准株80-39株同源性为99.8%,仅第186位的氨基酸发生变异,变异率为0.23%;与江西地区分离的疫苗株L99株氨基酸同源性99.3%, 氨基酸变化情况为T43A、S186F、A288S。与HTNV型76-118株的氨基酸同源性为84.4%,与其他型别HV氨基酸同源性均低于85%。

图3 S片段核苷酸系统发生分析
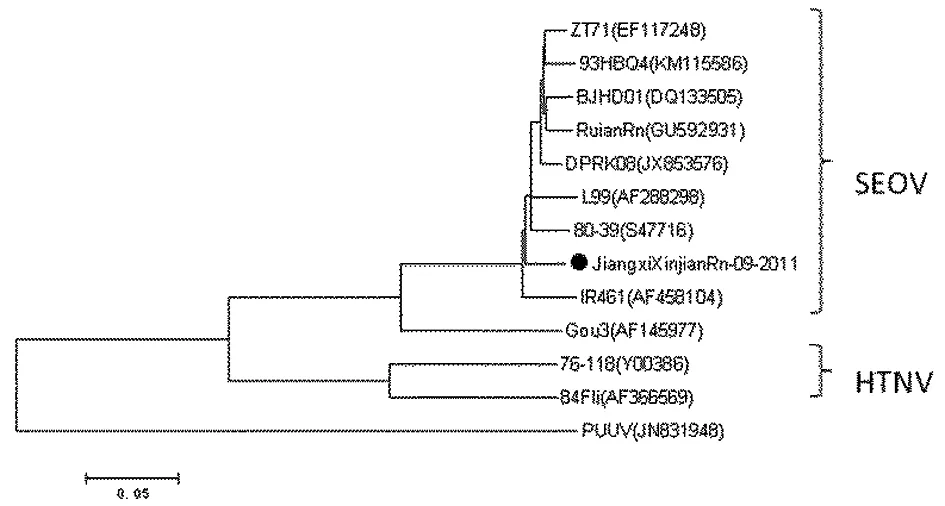
图4 M片段核苷酸系统发生分析
JiangxiXinjianRn-09-2011株M基因片段只存在1个开放阅读框(47~3 448 nt),编码1 133个氨基酸,5′端和3′末端分别含46个和203个核苷酸的非编码区。其编码的氨基酸序列与SEOV同源性98.7%~99.6%,与HTNV 76-118株的同源性为77.8%,与其他型别HV氨基酸同源性更低。
氨基酸序列分析发现,G1区末端存在保守氨基酸序列642WAASA647,是前体蛋白的裂解信号。G1区存在5个潜在的天门冬酰氨糖基化位点,分别为第132、233、345、397、560位,G2区926位存在1个潜在糖基化位点。与80-39株、L99株比较,M片段糖基化位点的数目和位置没有发生变化。G1区含34个半胱氨酸,G2区含28个半胱氨酸,同80-39株、L99株相比增加了一个半胱氨酸。与标准株80-39株相比JiangxiXinjianRn-09-2011 M片段氨基酸共有9个氨基酸位点发生了变化,变异率为0.79%,氨基酸的变化情况详见表3。
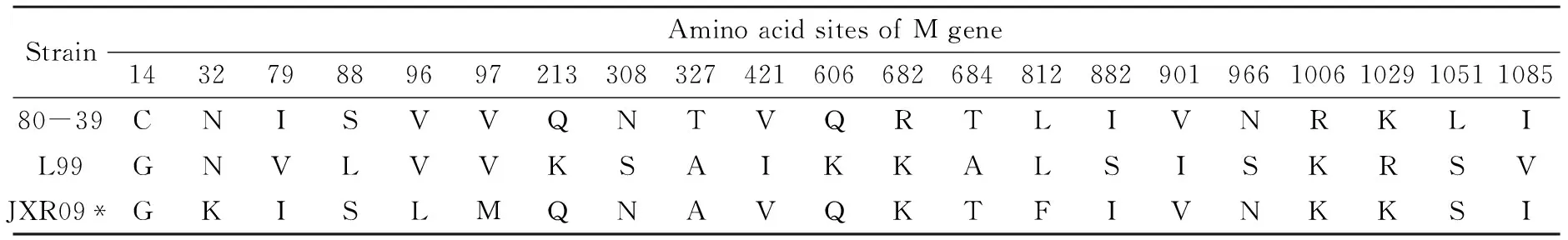
表3 M片段氨基酸变化情况
注:JXR09 代表毒株JiangxiXinjianRn-09-2011
Note : "JXR09" is JiangxiXinjianRn-09-2011.
3 讨 论
病毒分离对病毒性传染病的研究至关重要,获得病毒株就能全面系统的进行研究,且有较好的重复性和可信度,还能为疫苗的研制打下基础。本研究在2011年对江西省6个县区开展了HV的分子流行病学调查,共采集了616份鼠肺标本,其中41份通过直接免疫荧光法检测到HV抗原。随着爱国卫生运动开展灭鼠,捕鼠的工作难度也加大,捕鼠时间过长,现场解剖不及时,基层冷冻保存的条件有限等原因,导致我们收到标本时大部分的标本已经发黑甚至腐烂。我们选取了15份较新鲜和份量较多的HV阳性鼠肺标本进行了病毒分离,最终成功分离出2株HV,通过S和M片段序列分析表明,这两株病毒同为SEOV。这两株病毒均来自新建县的褐家鼠(该县共4份标本用于病毒分离)。分析原因,新建县的采样点离本实验室最近,标本采集当天立即送往实验室放入-70 ℃保存,由此我们认为标本的采集保存和运输过程对HV的病毒分离率存在很大的影响。为了保证原始标本质量,提高病毒分离率,最好能携带液氮罐到基层采样,及时将采集标本置液氮保存。
HV基因组L、M、S 3个基因片段分别编码 RNA 依赖的 RNA 聚合酶、糖蛋白(GP)Gn 和 Gc 的前体糖蛋白及核衣壳蛋白(NP)。在HV 3个片段中M片段的重组率较高,可能与M基因编码的糖蛋白承受来自HV宿主免疫压力最大有关[10];L片段最保守,这可能是L片段编码蛋白功能的保守性需要所致[11]。自从1984年江西分离到L99和C94株HV以后,时隔30年再次分离到HV,因此为了解现今分离毒株基因特点和遗传变异情况,我们选择S和M片段进行基因序列分析。
JiangxiXinjianRn-09-2011与国内外其他SEOV核苷酸同源性为94.8%~98.0%,但氨基酸的同源性在98%以上。与 L99株S片段核苷酸同源性为95.7%,氨基酸同源性为99.3%;M片段核苷酸和氨基酸同源性分别为95.2%、98.7%,说明年代对SEOV的基因变化影响不大;JiangxiXinjianRn-09-2011与国际标准株80-39株的S片段只发生一个氨基酸位点变异,变异率0.23%;M片段有9个氨基酸位点变异,变异率为0.79%,但糖基化位点的数目和位置没有发生变化。结果表明褐家鼠携带的SEOV基因变异较小,相对稳定。 这也为疫苗保护效果和HFRS防控提供了有利的分子生物学依据。
[1]Vaheri A, Strandin T, Hepojoki J, et al. Uncovering the mysteries of hantavirus infections[J]. Nat Rev Microbiol, 2013, 11(8): 539-550.
[2]Zhang HL, Zhang YZ. Distribution and gene-typing of Hantaviruses in China[J]. China J Vector Bio Ctrl, 2011, 22(5): 417-420. (in Chinese) 张海林,张云智.中国汉坦病毒基因型及分布[J].中国媒介生物学及控制杂志,2011, 22(5):417-420.
[3]Zhang Y, Zou Y, Fu ZF, et al. Hantavirus infections in humans and animals, China[J]. Emerg Infect Dis, 2010, 16(8): 1195-1203.
[4]Wang W, Wang M, Lin X, et al. Ongoing spillover of Hantaan and Gou hantaviruses from rodents is associated with hemorrhagic fever with renal syndrome (HFRS) in China[J]. PLoS Negl Trop Dis, 2013, 7(10): 623-626.
[5]Liu PQ, Liao HX, Fu JL, et al. Isolation and Identification of EHF from R. rattoides losea swinhoe and R. confucianus in vero-E6 cell cultutes[J]. J Nanchang Univ Med Sci, 1984, 3: 1-5. (in Chinese) 刘佩芹,廖化新,傅建林,等.从罗赛鼠及社鼠中分离出流行性出血热病毒及其抗原性鉴定[J]. 南昌大学学报:医学版, 1984, (3).1-5.
[6]Song G, Huang Y, Hang C, et al. Preliminary human trial of inactivated golden hamster kidney cell (GHKC) vaccine against haemorrhagic fever with renal syndrome (HFRS)[J]. Vaccine, 1992, 4(10): 214-216.
[7]Zhang WZ. Isolation and characterization of Hantavirus in epidemic areas of Hebei province[D]. Shijiazhuang: Epidemiology and Health Statistic Hebei Medical University. 2007. (in Chinese) 张文增.河北省汉坦病毒的分离及其代表毒株 S 片段全基因序列分析[D].石家庄:河北医科大学流行病与卫生统计学系, 2007.
[8]Shi X, McCaughey C, Richard M. et al. Genetic characterization of a Hantavirus isolated from a laboratory-acquired infection[J]. J Med Virol, 2003, 71(1): 105-109.
[9]Shi X, Liang M, Hang C, et al. Nucleotide sequence and phylogenetic analysis of the medium (M) genomic RNA segments of three hantaviruses isolated in China[J]. Virus Res, 1998, 56(1): 69-76.
[10]Yang DJ, Chen JY, Li L, et al. Cloning and sequencing of the M gene fragment from Hantavirus strain TJJ16 isolated in Tianjin area[J]. Chin J Zoonoses, 2008, 24(8): 696-699. (in Chinese) 杨东靖,陈锦英,李力,等.天津地区汉坦病毒分离株TJJ16 M基因片段克隆和序列分析[J]. 中国人兽共患病学报, 2008, 24(8):696-699.
[11]Li MZ, Liu JS, Guo DC, et al. Cloning and prokaryotic expression of Hantavirus L gene[J]. Chin J Prevent Vet Med, 2012, 34(2):143-145. (in Chinese) 李茂中,刘家森,郭东春,等.汉坦病毒L基因的分段克隆及原核表达[J].中国预防兽医学报, 2012, 34(2):143-145.
Hantavirus isolation and the complete S, M segments genetic analysis of the isolates in Jiangxi Province, China
LIU Shi-wen,XU Gang,SHI Yong,GONG Tian,LI Jian-xiong,LIU Xiao-qing,XIONG Ying
(JiangxiProvincialCenterforDiseaseControlandPrevention,Nanchang330029,China)
We isolated Hantavirus from the rodents' lung samples in order to know the genetic characteristic of new isolates in Jiangxi Province. Samples were collected in 2011, and Hantavirus was isolated through Vero-E6 cells culture, the strains were identified by direct immunofluorescence assay and RT-PCR. The complete S, M segments of one strain were amplified and sequenced, the gene sequences were analyzed with DNAStar and MEGA3.1 software. Two Seoul viruses (SEOV) were isolated and identified from 15 samples. The complete S segment contained 1 772 nucleotides with a single open reading frame coding 429 amino acids; M segment contained 3 651 nucleotides in length with a single open reading frame coding 1 133 amino acids. The similarities to other SEOVs based on S/M nucleotides and amino acid sequences were 94.8%-98.0% and 98.2%-99.6% respectively. Compared to 80-39 strain, there was only one amino acid site changed in the S amino acid sequence and 9 amino acid sites changed in the M amino acid sequence. Results showed that comparing to other SEOVs the genes of new isolates are highly conserved.
Hantavirus; virus isolation; M and S segments; sequence analysis
Xiong Ying, Email: xiongying8300087@hotmail.com
10.3969/j.issn.1002-2694.2015.12.014
熊英,Email:xiongying8300087@hotmail.com
江西省疾病预防控制中心,南昌 330029
373R
A
1002-2694(2015)12-1157-05
2015-02-28;
2015-06-12
江西省卫生厅科技计划项目(No. 20123156)

