猪伪狂犬病毒Jiangxi-FZ株的分离鉴定及其重要毒力基因分子特征
范克伟,戴爱玲,吴德峰,林炜明,卢马英,杨小燕
猪伪狂犬病毒Jiangxi-FZ株的分离鉴定及其重要毒力基因分子特征
范克伟1,2,戴爱玲1,2,吴德峰3,林炜明1,2,卢马英1,杨小燕1,2
目的 研究伪狂犬病病毒(PRV)新流行毒株重要毒力基因的分子特征。方法 本研究从江西省某规模化猪场疑似猪伪狂犬病发病仔猪的脑组织中分离到1株病毒,通过PCR鉴定、病毒分离培养、细胞免疫荧光及易感动物试验证实该病毒为PRV野毒株并命名为PRV Jiangxi-FZ株。并对其重要毒力基因TK、gB、gC、gD及gE的分子特征和遗传进化关系进行分析。结果 Jiangxi-FZ株与其他PRV参考毒株的TK、gB、gC、gD及gE基因在核苷酸和氨基酸水平均具有很高的保守性,尤其是与2012年分离的2株PRV变异株的同源性较高。但在高度保守的基础上,仍存在一些差异,且部分差异具有特征性。遗传进化树分析结果显示,PRV Jiangxi-FZ株与2012年国内不同省份分离的PRV变异株亲缘关系较近,而与Becker等欧美洲毒株亲缘关系相对较远。结论 Jiangxi-FZ株具有当前PRV流行毒株的代表性,属近年来流行的PRV变异毒株。
伪狂犬病病毒;分离鉴定;毒力基因;分子特征
猪伪狂犬病是由伪狂犬病病毒(Pseudorabies virus, PRV)引起的一种急性传染病,以新生仔猪的腹泻及神经症状,妊娠母猪繁殖障碍、流产、死胎及呼吸道症状,成年猪隐形感染,长期带毒排毒为特征[1]。在中国,猪伪狂犬病的流行范围很广,给养猪业造成的经济损失仅次于猪瘟[2-3]。PRV属于疱疹病毒科、α-疱疹病毒亚科,基因组为双链DNA,全长约150 kb,基因组G+C含量最高达73%,至少含有70个基因,编码约100种蛋白质,成熟的病毒粒子约含有50种蛋白质[2]。PRV毒力由几种基因协同控制,其中TK基因编码的胸苷激酶参与病毒的复制和潜伏感染,对病毒在宿主中枢神经系统中的复制起重要作用,TK基因一旦灭活,则病毒毒力丧失或明显降低[4-6]。gB基因编码的糖蛋白参与病毒在细胞间的传播,促进病毒的细胞融合过程,并诱导机体产生中和抗体[7-8]。糖蛋白gC作为PRV最主要的保护性抗原之一,能诱导细胞免疫,产生中和抗体,参与补体系统的激活。另外,gC参与病毒吸附、释放,对病毒毒力也起着十分重要的作用[9-11]。gD基因所编码的糖蛋白是PRV入侵机体细胞所必需的,同时也是病毒主要的免疫原性蛋白之一,能刺激动物机体产生中和抗体[12-13]。gE基因是PRV的主要的毒力基因,决定PRV在细胞间的扩散,对病毒侵染神经系统也具有重要作用,对PRV毒力至关重要。同时,它也是所有的PRV野毒株均含有的一个非必需基因,缺失后可保持其免疫原性且毒力也大大降低,目前在许多国家都在使用gE基因的缺失疫苗[14-15]。中国也主要选用gE基因缺失疫苗防控猪伪狂犬病,虽然偶尔有病毒分离的报道[16],但总体而言该病得到了有效的控制。
但自2012年以来,我国多个省份的猪伪狂犬基因缺失疫苗免疫猪场发生猪伪狂犬病的流行,发病率和死亡率明显上升,且出现了新的发病特征,给我国养猪业造成了重大的经济损失[17-19]。分析原因可能有两个:一是现在流行的毒株发生变异,并存在免疫逃逸现象;二是现在流行的PRV毒株毒力变强,从而导致免疫失败。但究竟是何种原因引起猪群中PRV突然大面积暴发,是当前迫切需要解决的一个重大问题。因此,为了研究PRV新流行株的特征,本研究对2014年12月,龙岩学院动物医学研究所接诊的一例典型猪伪狂犬病发病仔猪脑组织进行了PRV新流行毒株的分离鉴定及其重要毒力基因的克隆与序列分析,以期为该病的病因探索及新型疫苗的研制提供理论依据。
1 材料和方法
1.1 病料、细胞及实验动物 病料采集于2014年12月,龙岩学院动物医学研究所接诊的江西省抚州市某免疫PRV Bartha-k61 弱毒疫苗的规模化猪场临床症状疑似为PRV感染的4头23日龄发病仔猪。发病仔猪临床表现为:精神萎靡、体温升高、流清鼻涕、打喷嚏、眼结膜分泌物增多、运动不协调及拉稀等症状;Vero 细胞由本实验室保存;BALB/c小鼠购自上海斯莱克实验动物有限公司。
1.2 主要试剂 DMEM 购自Gbico公司;胎牛血清购于杭州四季青生物有限公司。DL 2 000 DNA Marker、LATaq DNA 聚合酶、2×GC Buffer I、dNTP、Universal Genomic DNA Extraction Kit,pMD18-T克隆载体均购自宝生物工程(大连)有限公司;PRV阳性血清购自中国兽药监察所;FITC标记山羊抗猪二抗购自Jackson公司。
1.3 引物设计与合成 根据GenBank中登录的PRV基因组序列(NC_006151)设计6对特异性引物,分别用于疑似PRV感染组织病料检测和TK、gB、gC、gD及gE全基因扩增(表1)。引物均由上海英骏生物技术有限公司合成。
1.4 DNA的提取及PCR扩增 根据TaKaRa公司Universal Genomic DNA Extraction Kit试剂盒说明书提取PRV DNA,利用上述引物分别扩增PRVTK、gB、gC、gD及gE基因片段。PCR体系总体积25 μL:DNA模板1 μL、2×GC Buffer I 12.5 μL、dNTP 4 μL、上下游引物各1 μL、LATaq酶0.25 μL,用ddH2O补至 25 μL。 PCR程序: 94 ℃预变性5 min;94 ℃变性1 min,67.5 ℃(TK)、53 ℃(gC)、62.5 ℃(gD)或 64 ℃(gE-JD、gE、gB)退火50 s, 72 ℃延伸1 min(gE-JD、TK)、2 min(gC、gD、gE)或3 min(gB),35个循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测。
1.5 病毒的分离鉴定
1.5.1 病毒的分离培养 将PCR鉴定为阳性的脑组织匀浆液,-20 ℃反复冻融3次,12 000 r/min离心20 min,取上清经0.22 μm滤器过滤除菌后接种 Vero 单层细胞进行培养,逐日观察细胞病变(CPE),待 CPE 达到80%时左右时收毒,冻融1次后,连续在 Vero 细胞中传代扩大培养。
1.5.2 IFA鉴定 将经6轮空斑纯化后的病毒接种Vero细胞,约24 h后弃培养液,用PBS洗2次。用 500 μL 4%预冷多聚甲醛固定30 min,然后加入5%BSA室温封闭30 min,弃去BSA,加入500 μL用0.5%BSA稀释的阳性血清,室温孵育2 h。洗涤后加入FITC标记山羊抗猪二抗,室温孵育1 h。吸弃二抗,用PBS洗干净后,封片。置荧光显微镜下观察。
1.5.3 小鼠感染试验 选取6周龄BALB/c小鼠6只,其中3只经腹股沟皮下接种经6轮空斑纯化后的F3代分离毒每只0.1 mL,另外3只小鼠注射等体积DMEM培养液作为阴性对照,观察小鼠发病及死亡情况。

表1 PRV TK、gB、gC、gD和gE基因扩增引物
1.6TK、gB、gC、gD及gE基因序列分析 分别采用TK、gB、gC、gD及gE特异性引物,以提取的病毒分离株细胞培养物DNA为模板,对TK、gB、gC、gD及gE基因编码区进行PCR扩增,并将扩增产物克隆于pMD18-T载体中进行序列测定。利用生物学分析软件DNAStar7.1将分离株与GenBank中登录的其他PRV参考毒株的TK、gB、gC、gD及gE核苷酸序列进行比对,分析分离株的序列特征。
2 结 果
2.1 病料样品检测 将4头疑似PR发病猪的脑组织进行匀浆,提取总DNA,以其为模板利用gE基因特异性引物进行PCR扩增。结果显示4头发病猪的脑组织样品在400 bp左右均有一特异性条带,与预期结果相符,表明送检样品均为PRV阳性(图1)。
2.2 病毒的分离培养 将其中1头发病仔猪的脑组织病料匀浆液经0.22 μm滤器过滤除菌后,接种Vero细胞,24 h后即可以观察到细胞圆缩、聚集,36 h后出现典型的拉网CPE,有的形成合胞体(图2A),48 h后细胞开始脱落。而空白对照组细胞形态正常(图2B)。利用gE特异性引物对培养物进行PCR鉴定,能够扩增到预期片段,这表明能从病料中分离出PRV野毒株。
2.3 病毒的IFA鉴定 将经6轮空斑纯化后的病毒接种Vero细胞,约24 h后将适宜稀释度的阳性血清作为一抗孵育进行IFA鉴定,结果表明病毒感染能产生典型的细胞病变,同时荧光显微镜下能够显示强烈的绿色荧光(图3A)。阴性对照细胞形态正常,无特异荧光出现(图3B)。上述这些结果均表明从发病仔猪的脑组织中分离到一株PRV野毒,将其命名为PRV Jiangxi-FZ株。

M: DNA Marker (DL2 000); 1-4: Pig brain samples; 5: Negative control
图1 脑组织样品伪狂犬病毒PCR鉴定结果
Fig.1 PCR amplification of PRV gE fragment from pig brain samples

A: Infected Vero cells; B: Normal Vero cells.
图2 PRV Jiangxi-FZ株感染Vero细胞产生的CPE情况(200×)
Fig.2 Cytopathogenic effects of Vero cells infected with PRV Fujian-LY strain (200×)

A:IFA was performed on Vero cells infected with Jiangxi-FZ using PRV antibody; B: IFA was performed on normal Vero cells using pig serum
图3 PRV Jiangxi-FZ株感染Vero细胞间接免疫荧光检测结果(200×)
Fig.3 IFA identification of PRV Jiangxi-FZ strain (200×)
2.4 小鼠感染试验 BALB/c小鼠接种PRV Jiangxi-FZ株后出现了典型的伪狂犬病症状:发病鼠食欲废绝,狂躁不安,频频舔咬接种部位,致使局部被毛脱落、皮肤出血,随后四肢麻痹,倒地不起,最后衰竭死亡(图4);对照组小鼠无异常。

图4 PRV Jiangxi-FZ株感染小鼠发病情况
2.5TK、gB、gC、gD及gE基因序列分析
2.5.1TK、gB、gC、gD及gE基因的扩增、克隆与测序 以提取的PRV Jiangxi-FZ株Vero细胞培养物DNA为模板,用5对特异性引物进行PCR扩增,分别获得大小约 960 bp (TK)、2 800 bp (gB)、1 400 bp (gC)、1 200 bp (gD)及1 700 bp (gE)的PCR产物,片段大小与预期目的基因大小相一致(图5)。将这些PCR产物分别纯化回收后连接于pMD18-T载体中送Invitrogen公司测序,分别获得正确序列。
2.5.2 TK基因序列分析 测序结果表明Jiangxi-FZ株TK基因序列全长963 bp,共编码320个氨基酸。将其与其他8株PRV参考毒株TK基因核苷酸序列比对结果显示,核苷酸和氨基酸序列同源性分别为99.2%~99.8%和98.1%~99.4%。其中,与2012年国内分离的2株PRV变异株(HeN1、TJ)的核苷酸和氨基酸序列同源性最高为99.8%和99.4%,而与Min-A株的核苷酸及氨基酸序列同源性最低为99.2%和98.1%。同时,发现TK基因核苷酸序列保守性很高,只有少数位点存在突变。核苷酸序列比对发现Jiangxi-FZ株在47位和385位发生了独特性的碱基突变,由A→G。氨基酸多序列比对结果发现,与核苷酸序列类似,TK基因氨基酸序列保守性较高,只有少数位点发生突变,其中有2个位点突变较为集中,分别是氨基酸215位由T→V和284位A→V。但值得注意的是与参考毒株相比,Jiangxi-FZ株氨基酸序列最有特征性的是发现上述47位和385位的碱基突变(A→G)引起第16位氨基酸由K→R和第129位氨基酸由S→G,其中,第16位氨基酸突变导致TK蛋白ATP结合结构域由- G**G*GK-转变为- G**G*GR-,这种保守序列的转变是否会对其功能产生影响还有待进一步研究。基于TK基因氨基酸序列进行遗传进化树分析结果显示,PRV毒株共分为2个大群,毒株Min-A与其他毒株距离都很远,为单独一群;其余分离毒株为一群。进一步分析发现,Jiangxi-FZ株与国内Ea株处于一个相对独立的遗传进化分支,亲缘关系较近;而与Bartha株等欧美洲毒株亲缘关系相对较远(图6)。

M: DNA Marker (DL2000); 1:TKgene; 2:gDgene; 3:gCgene; 4:gEgene; 5:gBgene; 6: Negative control.
图5 PRV Jiangxi-FZ株TK、gB、gC、gD及gE基因全序列PCR扩增结果
Fig.5TK,gB,gC,gDandgEgenes PCR products of PRV Jiangxi-FZ strain
2.5.3gB基因序列分析 Jiangxi-FZ株gB基因测序结果表明,序列全长2 743 bp,共编码914个氨基酸。将其与其他13株国内外PRV参考毒株gB基因核苷酸序列比对结果显示,核苷酸和氨基酸序列同源性分别为98.3%~100%和97.2%~100%。其中,与7株2012年国内分离的PRV变异株(HeN1、TJ、SDWF1、SDWF2、HNBA、HNQX、HNXX)的核苷酸和氨基酸序列同源性较高分别为99.9%~100%和99.8%~100%,而与4株国外PRV经典株(Becker、Namyangju、Kaplan、Bartha)的核苷酸和氨基酸序列同源性较低分别为98.3%~98.7%和96.7%~97.7%。核苷酸多序列比对结果发现,Jiangxi-FZ株gB基因核苷酸序列之间有大量的碱基替换,主要是 G-C和 G-A之间的替换。同时,序列对比发现,Jiangxi-FZ株与7株PRV变异株gB基因核苷酸序列在几个部位均发生了一致性的特征性变化,即在207~208 bp发生了 GA→CG的替换,215~217 bp发生了TCC→GGA的替换,223 bp发生了A→G替换,240~241 bp发生了CA→AG的替换,245发生了A→G替换,247 bp发生了G→T替换, 260 bp发生了C→A替换及285~286 bp发生了GT→CG 的替换;279~281 bp有连续 3 个碱基 CGG的插入;此外,还存在两个部位的连续缺失,与 Bartha 株相比,224~231 bp和233 bp存在不连续的8+1个碱基的缺失。氨基酸多序列比对发现,Jiangxi-FZ株gB基因氨基酸序列和国内分离株的同源性较高,尤其是与7株PRV变异株gB基因氨基酸序列有很多相同的特征性氨基酸替换,其中最有特征性的是aa 75~aa 77 位缺失了 3 个氨基酸SPG,aa 81~aa 83位氨基酸NDV替换为DGF,aa 94位插入1个氨基酸(G),以及aa 93~aa 97 位表位 DGAVS 不同于其他4株国外PRV经典株。这些特征性的变异可能会导致Jiangxi-FZ株和Bartha疫苗株的抗原性发生较大变化。gB基因氨基酸序列遗传进化树分析结果显示,Jiangxi-FZ株与HeN1、TJ等PRV变异株处于一个相对独立的亚遗传分支,亲缘关系较近。进一步分析发现国内经典株Ea与Jiangxi-FZ株及7株PRV变异株位于同一分支中,说明近年来流行的PRV变异毒株与Ea株的亲缘关系最近。而与Bartha疫苗株等4株国外经典毒株位于不同的大分支中亲缘关系较远(图7)。

图6 PRV Jiangxi-FZ株与参考毒株TK基因氨基酸序列系统进化分析
Fig.6 Phylogenetic analysis based on amino acid sequences ofTKbetween Jiangxi-FZ strain and other isolations of PRVs
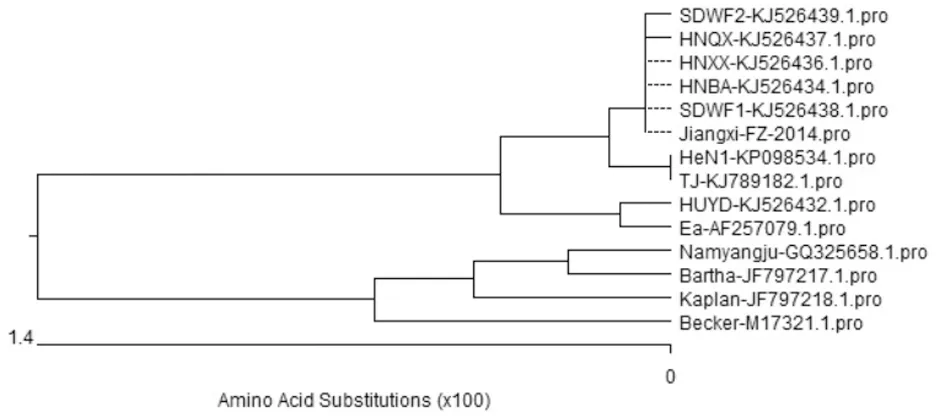
图7 PRV Jiangxi-FZ株与参考毒株gB基因氨基酸序列系统进化分析
Fig.7 Phylogenetic analysis based on amino acid sequences ofgBbetween Jiangxi-FZ strain and other isolations of PRVs
2.5.4gC基因序列分析 序列测定结果表明,Jiangxi-FZ株gC完整编码区全长1 464 bp,共编码487个氨基酸。Jiangxi-FZ株gC基因与国内外HeN1、TJ、Ea、Becker及Bartha等12株PRV参考毒株gC基因核苷酸和氨基酸序列同源性分别为95.2%~99.7%和91.7%~99.4%。其中与2株PRV变异株(HeN1、TJ)的核苷酸和氨基酸序列同源性最高分别为99.7%和99.4%,而与Bartha株的核苷酸和氨基酸序列同源性最低分别为95.2%和91.7%。核苷酸多序列比对结果发现,Jiangxi-FZ株gC基因核苷酸序列和国内不同时期分离的PRV株(HeN1、TJ、Ea及Fa)gC基因核苷酸序列中有很多点突变一致,尤其是与2012年分离的2株PRV变异株(HeN1、TJ)核苷酸突变位点的一致性最高,且分布比较集中。最有特征性的是,Jiangxi-FZ株及国内最近几年的分离株gC基因核苷酸序列在175~222 bp之间存在1个集中突变区和2个缺失区,即175~179 bp碱基序列由CCCGA突变为GGGAC,186~188 bp 插入3个连续碱基GGC以及205~222 bp 18个连续碱基GCGGCCGTCTCGACGCCC的插入。另外,还发现只有当175~179 bp碱基序列为GGGAC时,186~188 bp及205~222 bp才存在上述连续碱基的插入。氨基酸多序列比对发现,Jiangxi-FZ株gC基因氨基酸序列和国内分离株的同源性较高,有很多相同的特征性氨基酸替换,其中最有特征性的是第aa 52~aa 69和aa 186~aa 194 位氨基酸的替换和插入。这些特征性的变异导致Jiangxi-FZ株和Bartha疫苗株的抗原性发生了较大变化。gC基因氨基酸序列遗传进化树分析结果显示,Jiangxi-FZ株与HeN1株、TJ株、Ea株、Fa株及P-Prv株位于同一个大分支中,其中与HeN1株、TJ株及Ea株又形成了一个相对独立的亚遗传分支,亲缘关系较近,说明近年来流行的PRV变异毒株与Ea株的亲缘关系最近。而与Bartha疫苗株位于不同的大分支中亲缘关系较远(图8)。
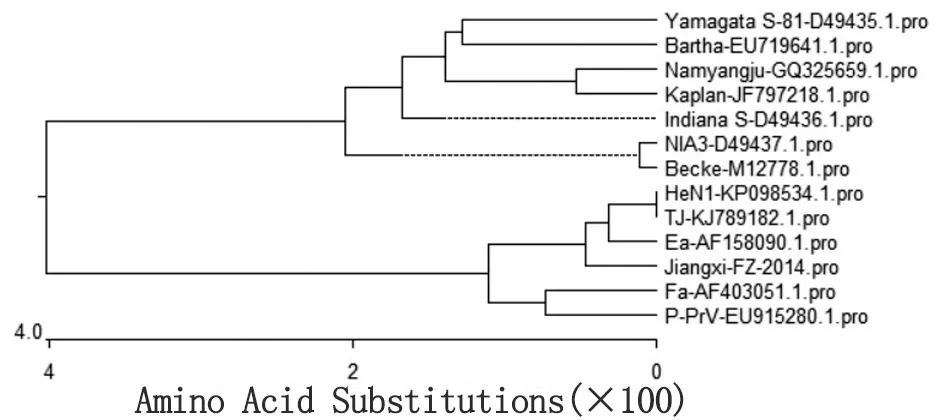
图8 PRV Jiangxi-FZ株与参考毒株gC基因氨基酸序列系统进化分析
Fig.8 Phylogenetic analysis based on amino acid sequences ofgCbetween Jiangxi-FZ strain and other isolations of PRVs
2.5.5gD基因序列分析 对Jiangxi-FZ株gD基因序列测定结果表明,gD基因序列全长1 209 bp,共编码402个氨基酸。与国内外HeN1、TJ、Ea、Becker及Bartha等12株PRV参考毒株gD基因核苷酸和氨基酸序列同源性分别为98.3%~99.9%和97.5%~100%。其中与2株PRV变异株(HeN1、TJ)的核苷酸和氨基酸序列同源性最高分别为99.9%和100%,而与Bartha疫苗株的核苷酸和氨基酸序列同源性最低分别为98.3%和97.5%。核苷酸多序列比对结果发现,gD基因核苷酸序列保守性较高,只有少数位点存在突变。最有特征性的是在831~836 bp之间插入了连续的 6 个碱基CCGGCC。虽然部分经典株(Fa、Yangsan、Becker)在该位点也有连续6 个碱基的插入,但Jiangxi-FZ株与2株PRV变异株(HeN1、TJ)在此位点却高度一致。此外,Jiangxi-FZ株与2株PRV变异株(HeN1、TJ)在826位发生了一致的碱基突变,由C→A。氨基酸多序列比对发现,Jiangxi-FZ株gD基因氨基酸序列和国内分离株的同源性较高,仅有少数位点发生氨基酸替换,但在上述gD基因核苷酸序列插入连续的 6 个碱基的位置增加了2个氨基酸RP。gD基因氨基酸序列遗传进化树分析结果显示,Jiangxi-FZ株与国内TJ株、HeN1株、Fa株、Min-A株、LA株、PRV-FZ株及韩国分离株Yangsan位于一个相对独立的遗传分支内,亲缘关系较近。而与Bartha疫苗株位于不同的大分支中,亲缘关系较远(图9)。
2.5.6gE基因序列分析 序列测定结果表明扩增片段大小为1 755 bp(其中gE基因编码区1 740 bp,共编码580个氨基酸)。与其他10株PRV参考毒株gE基因核苷酸序列比对结果表明,核苷酸和氨基酸序列同源性分别为97.4%~99.8%和94.6%~99.5%。其中与PRV变异株TJ的核苷酸和氨基酸序列同源性最高分别为99.8%和99.5%。同时,发现不同毒株间gE基因核苷酸序列存在很多的碱基替换,其中主要是G-A和T-C之间的替换。另外,Jiangxi-FZ株gE核苷酸序列中最具特征性的变化就是在2个部位存在3个连续碱基的插入,分别是第142~144 bp位GAC的插入以及1 488~1 490 bp位CGA的插入。氨基酸多序列比对发现,与核苷酸序列类似,不同毒株间gE氨基酸序列存在很多的氨基酸替换。在上述同时出现特征性碱基插入的2个位置,在氨基酸序列上增加了2个天冬氨酸(D),即gE氨基酸序列第48位和第496位各有1个D插入。虽然部分经典株(Ea 、LA、P-Prv)在48位也有D插入,且LA株在496位还有D插入,但Jiangxi-FZ株与2株PRV变异株(HeN1、TJ)在这2个位点却高度一致。氨基酸系统进化树分析结果显示,11株PRV共形成两大遗传分支,Jiangxi-FZ株与Ea株、LA株、TJ株、HeN1株等7株亚洲毒株位于同一个大遗传分支,亲缘关系相对较近。其余4株欧美毒株位于另一个大遗传分支内。进一步分析发现,Jiangxi-FZ株与国内经典株LA形成一个相对独立的分支内,亲缘关系较近(图10)。

图9 PRV Jiangxi-FZ株与参考毒株gD基因氨基酸序列系统进化分析
Fig.9 Phylogenetic analysis based on amino acid sequences ofgDbetween Jiangxi-FZ strain and other isolations of PRVs

图10 PRV Jiangxi-FZ株与参考毒株gE基因氨基酸序列系统进化分析
Fig.10 Phylogenetic analysis based on amino acid sequences ofgEbetween Jiangxi-FZ strain and other isolations of PRVs
3 讨 论
目前,猪伪狂犬病疫情形势严峻,2012年以来在中国多个省份许多使用PRV基因缺失活疫苗进行免疫的规模化猪场出现了猪狂犬病的流行,且发病特点和流行形势也发生了变化[12-13,16,20-22]。面对 PRV新毒株的广泛流行,对PRV新流行毒株进行分离鉴定及遗传进化分析,发现流行株的变异情况,对于从分子水平上揭示当前规模化猪场伪狂犬病的存在和再次暴发的原因,提出科学有效的防治措施具有重要意义。
本研究通过PCR鉴定、病毒分离培养、免疫荧光、小鼠模型及序列分析等方法,证实从发病仔猪脑组织中分离到了1株PRV野毒株并命名为PRV Jiangxi-FZ株。PRV属于疱疹病毒科,毒力由几种基因协同控制,其中TK及gE基因是PRV的主要毒力基因[12]。gB、gC及gD基因编码的糖蛋白是PRV最主要的保护性抗原,能刺激动物产生中和抗体和病毒特异性的细胞免疫应答反应[7-8,13]。因此,对PRV流行毒株TK、gB、gC、gD及gE基因进行序列分析及遗传进化分析能在一定程度上反映病毒变异情况。对其重要毒力基因TK、gB、gC、gD及gE的全序列分析结果显示,Jiangxi-FZ株与其他PRV参考毒株的TK、gB、gC、gD及gE基因在核苷酸和氨基酸水平均具有很高的保守性,尤其是与2012年分离的2株PRV变异株的同源性较高。但在高度保守的基础上,仍存在一些差异,且部分差异具有特征性。其中,最具特征性的是Jiangxi-FZ株TK基因核苷酸序列第47位和385位出现了独特性的碱基突变,均由A→G,并造成第16位氨基酸由K→R和第129位氨基酸由S→G。其中第16位氨基酸突变,导致TK蛋白ATP结合结构域,即- G**G*GK-发生改变,转变为- G**G*GR-。TK蛋白ATP结合结构域由3个甘氨酸(G)残基形成一个疏水的袋状构象,它们对疱疹病毒的毒力有很大影响,若3个G中有一个发生突变,就会影响 TK蛋白的构象及其与ATP的结合,进而导致TK蛋白活性丧失[23]。虽然,Jiangxi-FZ株TK蛋白中这3个位点发生突变,但其第16位氨基酸的突变,是否会对PRV的毒力产生影响还有待进一步研究。Jiangxi-FZ株gE基因核苷酸序列和国内分离株的同源性较高,尤其是与2株PRV变异株gE基因有很多相同的特征性碱基替换,其中最具特征性的变化就是在2个部位存在3个连续碱基的插入,进而导致gE基因氨基酸序列第48位和第496位各有一个天冬氨酸(D)的插入,该插入特征为PRV变异毒株的重要标志[12-15],表明Jiangxi-FZ株为PRV变异毒株。
gB、gC及gD基因序列分析结果显示,Jiangxi-FZ株与7株PRV变异株gB基因核苷酸序列同源性较高,在几个部位均发生了一致性的特征性变化,进而导致gB基因氨基酸序列有很多相同的特征性氨基酸替换。gC基因核苷酸序列最有特征性的是核苷酸序列第175~222 bp之间存在1个集中突变区和2个缺失区,并且发现只有当175~179 bp碱基序列为GGGAC时,186~188 bp及205~222 bp 才存在上述连续碱基的插入,这与前人报道一致[11]。氨基酸序列中最有特征性的是第 aa 52~aa 69和aa 186~aa 194位氨基酸的替换和插入。gD基因核苷酸序列最有特征性的是在831~836 bp之间插入了连续的6个碱基CCGGCC,进而引起氨基酸序列在相应位置增加了2个氨基酸RP。虽然部分参考毒株在该位置也有连续6 个碱基的插入,但Jiangxi-FZ株与2株PRV变异株在此位点却高度一致。这些特征性的变异导致Jiangxi-FZ株和Bartha疫苗株的抗原性发生了较大变化。基于Jiangxi-FZ株TK、gB、gC、gD及gE基因氨基酸序列的进行遗传进化树分析结果表明,Jiangxi-FZ株与HeN1、TJ等PRV变异株处于一个相对独立的遗传分支,亲缘关系较近。进一步分析发现,在PRV经典株Jiangxi-FZ株与国内Ea株亲缘关系较近;而与Becker等欧美洲毒株亲缘关系相对较远。
综上所述,本研究中所分离培养的PRV Jiangxi-FZ野毒株具有一定的当前PRV流行毒株的代表性,属于PRV变异毒株。研究结果对猪伪狂犬病病因的探索及PRV新型疫苗的研制提供理论依据。
[1]Yin Z, Liu JH. Animal virology[M].2nded.Beijing: Science Press, 1997: 998-1009. (in Chinese) 殷震,刘景华.动物病毒学[M].2版.北京:科技出版社,1997:998-1009.
[2]Hao F, Tang DY, Li CY, et al. Identification and pathogenicity study of pseudorabies virus Guizhou-DY strain[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(11): 1851-1856. (in Chinese) 郝飞,汤德元,李春燕,等.伪狂犬病病毒Guizhou-DY株的分离鉴定及致病性研究[J].畜牧兽医学报,2013,44(11):1851-1856.
[3]Wei CH, Liu JK, Yang XY, et al. Isolation and identification of porcine pseudorabies virus and sequence analysis of thegEgene of the strain[J]. Fujian J Anim Husband Vet, 2012, 34(4): 1-3. DOI: 10.3969/j.issn.1003-4331.2012.04.002 (in Chinese) 魏春华,刘建奎,杨小燕,等.猪伪狂犬病病毒的分离鉴定及其gE基因序列分析[J].福建畜牧兽医,2012,34(4):1-3. DOI: 10.3969/j.issn.1003-4331.2012.04.002
[4]Coen DM, Kosz-Vnenchak M, Jacobson JG, et al. Thymidine kinase-negative herpes simplex virus mutants establish latency in mouse trigeminal ganglia but do not reactivate[J]. Proc Natl Acad Sci, 1989, 86(12): 4736-4740. DOI: 10.1073/pnas.86.12.4736
[5]Qiu HJ, Zhou YJ, Kong LD, et al. Extraction and purification of pseudorabies virus Bartha-k61 strainTKgene[J]. Chin J Vet Sci Technol, 2000, 30(3): 6-7. DOI: 10.3969/j.issn.1673-4696.2000.03.002 (in Chinese) 仇华吉,周彦君,孔令达,等.伪狂犬病病毒Bartha-K61株TK基因的分离鉴定[J].中国兽医科技,2000,30(3):6-7. DOI: 10.3969/j.issn.1673-4696.2000.03.002
[6]Zhong C, Liu L, Zhang LT, et al. Sequences analysis of virulence associated genesgEandTKof pseudorabies virus strain BJ/YT[J]. Chin Anim Husband Vet Med, 2014, 41(11): 73-79. (in Chinese) 钟承,刘蕾,张乐天,等.伪狂犬病病毒BJ/YT株毒力相关基因gE和TK序列分析[J].中国畜牧兽医,2014,41(11):73-79.
[7]Chen ZH, Lin TL, Chen SY, et al. Cloning and sequence analysis ofgB,gC,gDgenes of pseudorabies virus strain Fa[J]. Fujian J Agricultura Sci, 2007, 22(2): 120-125. (in Chinese) 陈振海,林天龙,陈少莺,等.伪狂犬病毒Fa株gB,gC,gD基因的克隆与序列分析[J].福建农业学报, 2007, 22(2): 120-125.
[8]Zhang XP, Wei CH, Liu JK, et al. Cloning and sequences analysis ofgBandgDgene of pseudorabies virus Fujian strain[J]. Chin Anim Husband Vet Med, 2014, 41(5): 62-65. (in Chinese) 张新平, 魏春华,刘建奎,等. 猪伪狂犬病病毒福建株gB,gD基因的克隆和序列分析[J].中国畜牧兽医, 2014, 41(5): 62-65.
[9]Flynn SJ, Ryan P. The receptor-binding domain of pseudorabies virus glycoproteingCis composed of multiple discrete units that are functionally redundant[J]. J Virol, 1996, 70(3): 1355-1364.
[10]Ober BT, Teufel BW, Karl HJ, et al. The porcine humoral immune response against pseudorabies virus specifically targets attachment sites on glycoproteingC[J]. J Virol, 2000, 74(4): 1752-1760.DOI: 10.1128/JVI.74.4.1752-1760.2000
[11]Wang JY, Guo WZ, Xu ZW, et al. Cloning ofgCgene of porcine pseudorabies viruses and analyses of its partial biological characteristics[J]. Chin Vet Sci, 2008, 38(10): 830-836. (in Chinese) 王键义,郭万柱,徐志文,等. 猪伪狂犬病病毒gC基因的克隆及其部分生物学特性的分析[J]. 中国兽医科学,2008,38(10): 830-836.
[12]Chang HT, Liu HM, Guo ZD, et al. Investigation of etiology of massive infection with porcine pseudorabies virus in Henan and neighboring provinces[J]. Chin J virol, 2014, 30(4): 441-449. (in Chinese) 常洪涛,刘慧敏,郭占达,等.河南省及周边省份猪群中大面积感染猪伪狂犬病毒的病因分析[J].病毒学报,2014,30(4):441-449.
[13]Yu QY, Chang HT, Chen WD, et al. Isolation and identification of pseudorabies virus prevailing from 2012 to 2013 and sequence analysis ofgE,TK,gDgene[J]. Chin J Vet Sci Oct, 2014, 34(10): 1573-1578. (in Chinese) 余秋颖,常洪涛,陈文定,等. 2012-2013年新流行猪伪狂犬病病毒的分离鉴定及其gE,TK,gD基因序列分析[J].中国兽医学报,2014,34(10):1573-1578.
[14]Jiang Y, Chen PY. Research advance of pseudorabies virus glycoproteingE[J]. Chin J Vet Med, 2002, 38(12): 31-33. DOI: 10.3969/j.issn.0529-6005.2002.12.016 (in Chinese) 姜焱,陈溥言.伪狂犬病病毒的囊膜糖蛋白gE的研究进展[J].中国兽医杂志,2002,38(12):31-33. DOI:10.3969/j.issn.0529-6005.2002.12.016
[15]Wang Q. Research advance ofgEgene of pseudorabies virus[J]. Anim Husband Vet Med, 2002, 34(10): 42-44. DOI: 10.3969/j.issn.0529-5130.2002.10.026 (in Chinese) 王勤.猪伪狂犬病病毒gE基因的研究进展[J].畜牧与兽医,2002,34(10):42-44. DOI:10.3969/j.issn.0529-5130.2002.10.026
[16]Zhao HY, Peng JM, An TQ, et al. Identification of glycoprotein E characteristic in pseudorabies virus variants from swine[J]. Chin J Prevent Vet Med, 2014, 36(7): 506-509. DOI: 10.3969/j.issn.1008-0589.2014.07.02 (in Chinese) 赵鸿远,彭金美,安同庆,等.猪伪狂犬病病毒变异株的分离鉴定及其gE基因的分子特征[J].中国预防兽医学报,2014,36(7):506-509. DOI:10.3969/j.issn.1008-0589.2014.07.02
[17]An TQ, Peng JM, Tian ZJ, et al. Pseudorabies virus variant in Bartha-K61-vaccinated pigs, China, 2012[J]. Emerg Infect Dis, 2013, 19(11): 1749-1755. DOI: 10.3201/eid/1911.130177
[18]Sozzi E, Moreno A, Lelli D, et al. Genomic characterization of pseudorabies virus strains isolated in Italy[J]. Transbound Emerg Dis, 2014, 61(4): 334-340. DOI: 10.1111/tbed.12038
[19]Tong W, Zheng H, Shan TL, et al. Pathogenicity of variant strain JS-2012 of pseudorabies virus in piglets[J]. Chin J Anim Infect Dis, 2014, 22(5): 10-14. DOI: 10.3969/j.issn.1674-6422.2014.05.002 (in Chinese) 童武,郑浩,单同领,等.伪狂犬病毒变异株(JS-2012)对仔猪的致病性研究[J].中国动物传染病学报, 2014,22(5): 10-14. DOI:10.3969/j.issn.1674-6422.2014.05.002
[20]Yu X, Zhou Z, Hu D, et al. Pathogenic pseudorabies virus, China, 2012[J]. Emerg Infect Dis, 2014, 20(1): 102-104.DOI: 10.3201/eid2001.130531
[21]Peng JM, An TQ, Zhao HY, et al. Identification and antigenic variation of new epidemiology of pseudorabies virus from swine[J]. Chin J Prevent Vet Med, 2013, 35(1): 1-4. DOI: 10.3969/j.issn.1008-0589.2013.01.01 (in Chinese) 彭金美,安同庆,赵鸿远,等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013,35(1):1-4. DOI: 10.3969/j.issn.1008-0589.2013.01.01
[22]Tong W, Zhang QZ, Zheng H, et al. Identification and characterization of a pseudorabies virus isolated from a dead piglet born to vaccinated sow[J]. Chin J Anim Infect Dis, 2013, 21(3): 1-7. DOI: 10.3969/j.issn.1674-6422.2013.03.001 (in Chinese) 童武,张青占,郑浩,等.免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J].中国动物传染病学报,2013,21(3):1-7. DOI:10.3969/j.issn.1674-6422.2013.03.001
[23]Huang YZ, Zhang YK, Wei JC, et al. Identification andTKgene sequence analysis of porcine pseudorabies virus SD strain[J]. Anim Husband Vet Med, 2013, 45(4): 62-67. (in Chinese) 黄艺珠,张渊魁,魏建超,等.猪伪狂犬病毒SD株的分离鉴定及TK基因序列分析[J].畜牧与兽医,2013,45(4):62-67.
Identification and molecular characteristics of important virulence genes of porcine pseudorabies virus strain Jiangxi-FZ
FAN Ke-wei1,2,DAI Ai-ling1,2,WU De-feng3,LIN Wei-ming1,2,LU Ma-ying1,YANG Xiao-yan1,2
(1.CollegeofLifeSciences,LongyanUniversity,Longyan364000,China; 2.FujianProvincialKeyLaboratoryofPreventiveVeterinaryMedicineandVeterinaryBiotechnology,Longyan364000,China; 3.CollegeofAnimalScience,FujianAgricultureandForestryUniversity,Fuzhou350002,China)
To study the molecular characteristics of important virulence genes of Porcine pseudorabies virus (PRV) new epidemic strains, one local strain of PRV was isolated from the brain of a 23-day old pig in Jiangxi Province, and was identified by necropsy, PCR, virus isolation and culture, IFA and animal test. It was named as the PRV Jiangxi-FZ strain. The analysis of molecular characteristic and phylogenetic relationship of its important virulence genes TK, gB, gC, gD and gE showed that the TK, gB, gC, gD and gE gene sequences of Jiangxi-FZ strain shared a strictly conservative with other reference PRV strains at the nucleotide and amino acid levels, especially shared higher homology with 2 PRV variants isolated in 2012. However, there were still some differences between the nucleotide sequences and amino acid sequences of TK, gB, gC, gD and gE genes of Jiangxi-FZ strain and other reference PRV strains on the highly conservative basis, and a part of these differences were characteristic. Phylogenetic analysis showed that the PRV Jiangxi-FZ strain and the PRVs isolated from different provinces in China since 2012 had more closely relationship far away from the European and American PRV strains. Jiangxi-FZ strain had a certain representative of the PRV current epidemic strains, which belong to the PRV variants prevailing in China in recent years.
pseudorabies virus; isolation and identification; virulence gene; molecular characteristic
Yang Xiao-yan, Email:lyyxy1988@126.com
10.3969/j.issn.1002-2694.2015.12.004
杨小燕,Email:lyyxy1988@126.com
1.龙岩学院生命科学学院,龙岩 364012; 2.福建省预防兽医学与兽医生物技术重点实验室,龙岩 364012; 3.福建农林大学动物科学学院,福州 350002
R373.9
A
1002-2694(2015)12-1103-08
2015-07-13;
2015-10-27
福建省农业科技重大专项项目(No.2014NZ01060015)和福建省教育厅资助省属高校项目(No.JK2013052)联合资助
Supported by the Fujian Agricultural Science and Technology Major Project (No.2014NZ01060015), and the Fujian Provincial Department of Education Funding Universities Project (No.JK2013052).

