Streptomyces sp.(S-msu2)菌株对几种树木病原拮抗效应的研究
庞丽杰,王文革
(黑龙江省尚志国有林场管理局,黑龙江 哈尔滨150000)
我国每年因森林病虫害致死树木4 000多万株,年均造成损失1 100多亿元[1]。目前,对树木病害的主要防治手段是采用化学农药杀菌,而化学农药对人畜的副作用、残留问题及污染环境问题已成为当今世界首要解决的问题之一[2]。生物防治是植物病害防治的一种有效方法,特别是近年来利用微生物进行植物病害的防治倍受人们的高度重视,在土传病害[3,4]、叶部病害[5,6]等的生物防治中发挥了重要的作用,并形成了多个商品化的品种,在生物农药中占据了重要的地位。但目前在我国能够广泛推广应用的生防微生物制剂种类还极为有限,在大力挖掘本土高效微生物生防菌株的同时,积极对国外优良菌株的引进,是加快我国生物型农药开发和应用的有效途径。
本研究以从俄罗斯莫斯科国立大学生物系引进的Streptomycessp.(S-msu2)菌株为研究对象,通过对常见的林木植物病原真菌的抗菌试验,测定了该菌株的抑菌谱及其发酵产物对病原菌丝的生长及孢子萌发的抑制能力,旨在为该菌株的推广应用奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 生防菌株:链霉菌Streptomycessp.,代号为S-msu2,由俄罗斯莫斯科国立大学生物系提供。
植物病原真菌:樟子松红斑病(Dothistromapini)、杨树烂皮病(Valsasordida)、樟子松枯梢病(Diplodiapinea)、落叶松早落病(Mycosphaerella laricileptolepis)、落 叶松枯 梢病(Botryosphaeria laricina)、落叶松芽枯病菌(Cladosporiumtenuissimum)。以上菌株由黑龙江省尚志国有林场管理局森防站保存。
1.1.2 培养基 PDA培养基:马铃薯去皮洗净,称取200g切成小块,加水煮沸20min,用八层纱布过滤,取滤液加蒸馏水定容至1 000mL,加入20g葡萄糖、20g琼脂,高压灭菌(PD培养基内不需加入琼脂)。
1.2 试验方法
1.2.1 生防菌及病原菌的扩大培养 将灭过菌的PDA培养基在无菌条件下倒入培养皿,每个培养皿倒入约15mL,倒置过夜后,在培养皿中央接入生防菌和病原真菌,每种微生物接种3~4个平皿,在25℃恒温培养箱培养7d,并留菌种。
1.2.2Streptomycessp.(S-msu2)菌株对林木病原菌抑制效果
(1)采用对峙培养法测定S-msu2对树木病原真菌的拮抗活性。在直径为9cm的PDA培养基平皿上接入直径1cm的S-msu2和树木病原菌菌饼,两接种点相距3.0cm,病原菌或拮抗菌单独接种在PDA平板上作对照,每个处理5个重复。于25℃生化培养箱中培养7d后,测量抑菌带的宽度。
(2)采用生长速率法测定S-msu2发酵液对病原菌菌丝生长的抑菌作用。取活化好的S-msu2菌饼3片,接入装有PD培养基300mL的500mL三角瓶中,25℃、160r·min-1振荡培养7d。将培养液用8层纱布过滤后,滤液在50℃水浴下旋转蒸发浓缩,以10%吐温80定容至25mL。取浓缩液25mL与100mL 50℃PDA培养基混合倒平板,接种直径1cm的病原菌菌饼,在25℃恒温培养箱中培养,7d后测量菌落直径。以10%吐温80作对照,每个处理5个重复。抑制效果的计算公式:
抑菌率=(对照净生长量-处理净生长量)/对照净生长量×100%。
(3)S-msu2发酵液对病原真菌孢子萌发的影响[7]。将供试病原菌孢子制备孢子悬浮液(显微镜100倍下100个孢子/视野)再加入S-msu2菌株的发酵浓缩液,采用载玻片上萌发法,10h后镜检孢子萌发情况及萌发孢子芽管的畸形情况。
孢子萌发相对抑制率=(对照处理孢子萌发率-处理孢子萌发率)/对照孢子萌发率×100%
1.3 分析方法
采用Excel和SPSS软件上对数据进行统计分析。
2 结果与分析
2.1 S-msu2菌株对不同植物病原真菌拮抗谱
从表1的数据可以看出,采用对峙法培养手段,S-msu2对实验选用的8种植物病原真菌都有一定的拮抗能力,但S-msu2与不同病原真菌共培养之间的抑菌带宽度却存在着显著的差异(P<0.05)。S-msu2对樟子松枯梢病的病原真菌抑制效果较好,抑菌带宽度达到了13.6mm,其次对B.laricina、C.tenuissimum、V.sordida病原也表现出了较好的抑制效果。而与D.pini之间的抑菌带宽度最窄,只有4.5mm。S-msu2菌和各种病原真菌作为对照培养的平板,2个接种点之间没有抑菌带,菌落已经交融在一起了。

表1 S-msu2菌株对不同植物病原菌的拮抗谱
2.2 S-msu2菌株发酵液对病原菌菌丝生长的抑菌效果
为验证菌株S-msu2对不同植物病原菌的抑制作用是由菌株的营养、空间竞争的效果,还是该菌产生的细胞外抑菌物质的作用效果,进一步采用生长速率法测定S-msu2发酵液对病原菌的抑菌作用。从表2数据可以看出,S-msu2发酵液能够对树木不同病原菌菌丝的生长产生抑制作用,且抑菌率也存在一定的差异。对D.pinea的抑制效果最好,抑制率高达70.6%,对杨树烂皮病的病原菌V.sordida也比较好,抑制率为66.3%,而对樟子松红斑病D.pini的抑制效果最差,只有23.6%(表2),但仍然可以表明S-msu2菌株在发酵培养过程中能够分泌细胞外抑菌物质,从而对病原菌的菌丝生长产生抑制作用。
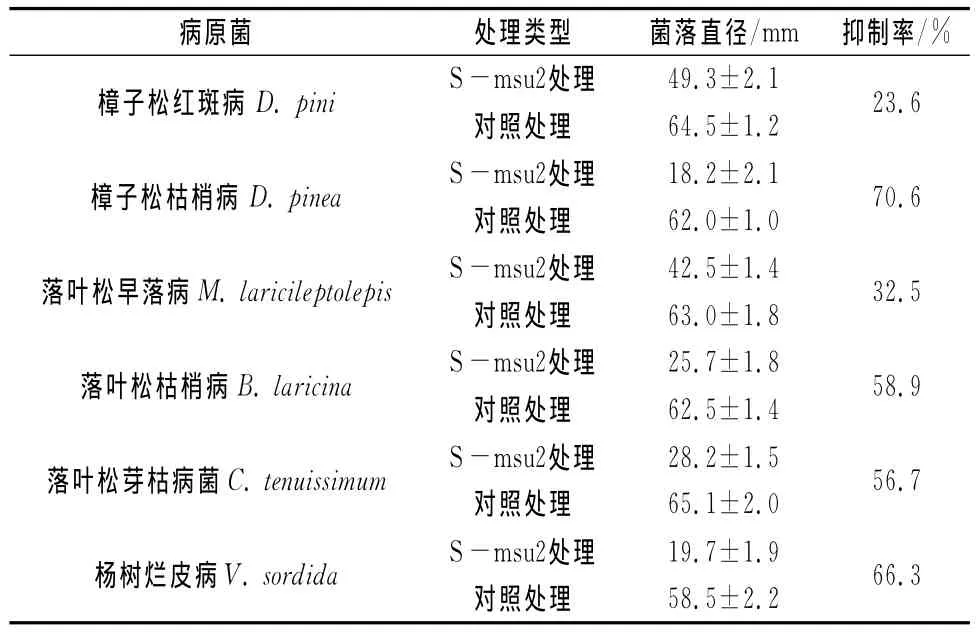
表2 S-msu2菌株发酵液对不同植物病原菌菌丝的抑制结果
2.3 S-msu2菌株发酵液对病原真菌孢子萌发的影响
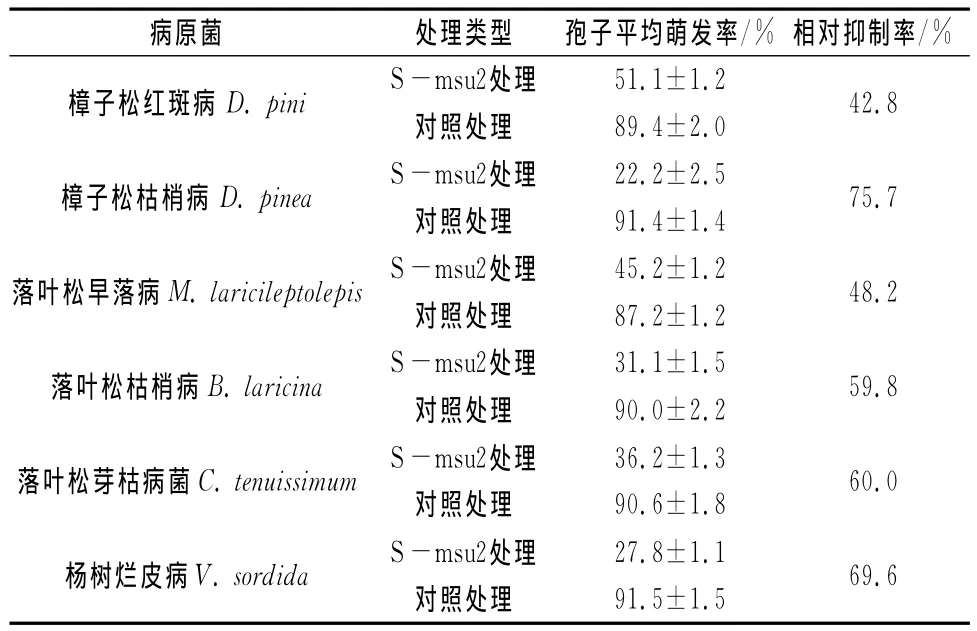
表3 S-msu2菌株对不同植物病原菌孢子萌发的结果
表3的实验数据表明,S-msu2菌株发酵产物对供试的6种树木病原真菌的孢子萌发具有显著的抑制作用,相对抑制率均超过40%,其中相对抑制率最高的是对樟子松枯梢病菌(D.pinea),相对抑制率高达75.7%,同时对杨树烂皮病病原菌V.sordida孢子萌发相对抑制率也较高(69.6%),而对樟子松红斑病病原菌D.pini孢子萌发相对抑制率最低,只有42.8%。通过显微观察,S-msu2菌株发酵产物能够引起萌发孢子的芽管畸变,先端出现膨大、泡状甚至串珠状,即使萌发的孢子,其芽管长度也显著小于对照。有些没有萌发的病原菌孢子体积膨大,并出现空洞甚至外溢胞内原生质。
3 结论
3.1Streptomycessp.(S-msu2)菌株与供试的6种树木病原真菌(Dothistromapini、Valsasordida、Diplodiapinea、Mycosphaerellalaricileptolepis、Botryosphaerialaricina、Cladosporiumtenuissimum)平板对峙培养,发现S-msu2对6种病原真菌均有一定的抑制作用,表明其抗菌谱较宽。
3.2 菌株发酵产物能够有效抑制6种树木病原菌丝的生长和孢子萌发,特别是对D.pinea和V.sordida病原真菌抑制效果最为显著。表明S-msu2菌株作为樟子松枯梢病和杨树烂皮病的生防菌株具有一定的应用潜力。
[1]徐茂文.浅谈常见树木的病虫害防治方法及措施[J].林业科技,2014,8(31):127-128
[2]纪丽莲,张强华,崔桂友.芦竹内生真菌F0238对植物病原菌的拮抗作用[J].微生物学通报,2004,31(2):82-86
[3]Leandro L F S,Guzman T,Ferguson L M,et al.Population dynamics ofTrichodermain fumigated and compost-amended soil and on strawberry roots[J].Applied Soil Ecology,2007,35:237-246
[4]Harman G E,Howell C R,Viterbo A,et al.Trichoderma species-opportunistic,avirulent plant symbionts[J].Nat.Rev.2004(2):43-56
[5]Freeman1S,Minz D,Kolesnik I.Trichoderma biocontrol ofColletotrichumacutatumandBotrytiscinereaand survival in strawberry[J].European Journal of Plant Pathology 2004,110:361-370
[6]Porras M,Barrau C,Romero F.Effects of soil solarization andTrichodermaon strawberry production[J].Crop Protection,2007,26:782-787
[7]谢凤行,任安芝,王银华,等.内生真菌对草坪植物病原真菌抑制作用的比较[J].生态学报,2008,28(8):3913-3920

