右美托咪定对老年颈内动脉内膜剥脱术患者脑损伤的影响
周 南,金 强,高明涛,周 锦,张铁铮
沈阳军区总医院麻醉科,辽宁沈阳 110016
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是颈内动脉内膜剥脱术后常见并发症,这不仅因该病老年患者居多,还与术中阻断和开放颈内动脉等操作引发的血流动力学剧烈波动、血管痉挛和缺血-再灌注损伤,以及炎性介质的释放密切相关。右美托咪定(dexmedetomidine,Dex)是高选择性的α2肾上腺素受体激动药,国内应用适应证为“用于全身麻醉的手术患者气管插管和机械通气时的镇静”,具有镇静、镇痛、抗交感和降低手术应激反应等作用。近年来研究显示,该药还对实验动物具有中枢神经系统保护作用[1-2],且可改善重症监护室机械通气患者的认知功能[3]。本文选择沈阳军区总医院2013年8月至2014年10月在全麻下行颈内动脉内膜剥脱术的患者40例,通过观察其对血流动力学、S100β和神经元特异性烯醇化酶(neuron-specific enolase,NSE)蛋白的影响。并应用简易智能量表(mini mental state examination,MMSE)进行评分[4],探讨该药对老年颈内动脉内膜剥脱术患者脑损伤的影响是否改善术后认知功能。现报告如下。
1 资料与方法
1.1 临床资料 本组患者40例,其中男性21例,女性19例;年龄65~75岁;体重52~73 kg;美国麻醉师协会(ASA)分级[5]Ⅱ~Ⅲ级;初中以上文化水平,术前MMSE评分>23分,且以往均未接受过类似心理学测试。按随机数字表法均分为Dex组(D组)和对照组(C组),每组各20例。排除标准:长期服用镇静药、抗抑郁药、酗酒者;严重的视力和听力障碍者;术后因主观原因不能完成MMSE评分者;明确的精神心理疾病者;严重系统疾病者;严重高血压、明显心动过缓者。2组患者性别、年龄、身高、体重、ASA分级、颈内动脉阻断时间和手术时间差异无统计学意义。见表1。
表1 2组患者一般资料比较(±s)

表1 2组患者一般资料比较(±s)
组别 男性(例)女性(例)年龄(岁)身高(cm) 体重(kg)ASA分级(例)Ⅱ级 Ⅲ级颈内动脉阻断时间(min)手术时间(min)C组 9 11 52.2±6.1 164.2±9.3 61.5±8.3 16 4 25.2±6.5184.2±29.1 D组 12 8 51.5±8.6 163.8±10.1 63.2±10.1 17 3 26.8±5.2 179.1±30.5
1.2 麻醉方法 按照择期手术患者标准进行术前准备,均不使用术前药物。患者入手术室后建立静脉通路,连接Datex-Ohmeda多功能监护仪(美国GE公司)。局麻下行桡动脉穿刺置管和手术对侧颈内静脉逆行穿刺置管,监测连续动脉血压、心电图、脉搏氧饱和度以及脑电双频谱指数(bispectral index,BIS)。并于30 min内输注乳酸林格液 8~10 ml/kg。D组于麻醉诱导前15 min内静脉泵注负荷剂量 0.004%Dex 1 μg/kg,然后以0.5 μg/(kg·h)速度持续泵注至手术结束前30 min;C组应用等容量生理盐水代替Dex。麻醉诱导依次静注咪达唑仑0.05 mg/kg、舒芬太尼 1 μg/kg、丙泊酚 1.0 ~ 1.5 mg/kg和罗库溴铵0.8 mg/kg,待BIS≤50后,经可视喉镜行气管插管,连接麻醉机行机械通气,并调整呼吸机参数(潮气量8~10 ml/kg,呼吸频率10~12次/min,吸呼比1:2,保持呼气末二氧化碳分压35~45 mmHg)。麻醉维持采用吸入1.5% ~2.0%七氟烷、静脉持续泵注瑞芬太尼0.2 μg/(kg·h)和丙泊酚4~6 mg/(kg·h),并维持BIS在45~60之间,按需静注罗库溴铵保持患者无体动。术毕拔出气管导管转送患者至神经外科监护室。
1.3 观察指标 记录入手术室(T0)、麻醉诱导前(T1)、气管插管前(T2)、气管插管后(T3)、切皮前(T4)、切皮后(T5)、气管拔管前(T6)和气管拔管后(T7)平均动脉压(mean arterial pressure,MAP)和心率(HR);计算应用负荷剂量Dex、气管插管、切皮和气管拔管等重要刺激前后MAP和HR的变化幅度[(T1-T0)/T0、(T3-T2)/T2、(T5-T4)/T4、(T7-T6)/T6],作为术中血流动力学是否稳定的指标。于患者入手术室、术毕和术后1 d各时点,取对侧颈内静脉球部血样3 ml,静置分离血清,3 000 r/min离心10 min,取上清液于-70℃冰箱冻存待测。采用酶联免疫吸附方法(美国Biokey公司试剂盒)检测血清S100β和NSE蛋白浓度。记录术前1 d,术后1、3和7 d的MMSE评分,评测患者认知功能。
1.4 统计学方法 采用SPSS 13.0软件进行统计学分析,计数资料比较采用χ2检验。计量资料以均数±标准差(±s)表示,组内比较采用单因素方差分析,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血流动力学指标 2组T0时点和(T1-T0)/T0的MAP和HR差异无统计学意义,表明负荷计量的Dex对循环无明显作用。D组(T3-T2)/T2、(T5-T4)/T4、(T7-T6)/T6的MAP和HR,均明显小于C组,差异有统计学意义(P<0.05),表明Dex可明显减轻气管插管、切皮和气管拔管等重要手术刺激引发的血压升高和心率增快,有利于保障术中血流动力学的稳定。见表2。
表2 2组患者血流动力学指标(±s)

表2 2组患者血流动力学指标(±s)
注:与C组比较,a P<0.05。
(T1-T0)/T0(%)(T3-T2)/T2(%)(T7-T6)/T6(%)(T5-T4)/T4(%)组别 例数MAP HR C组 20 99.1±18.1 69.1±9.9 1.0±0.2 1.5±0.2 14.1±2.9 16.0±4.2 10.2±5.3 9.5±4.1 11.2±4.4 13.1±4 T0 MAP(mmHg)HR(次/min)MAP HR MAP HR MAP HR.9 D组 20 95.7±16.3 71.0±7.6 1.2±0.2 1.7±0.1 5.2±3.2a 4.9±2.3a 6.2±1.1a 4.9±1.0a 5.1±1.6a 4.6±1.6a
2.2 脑损伤标志物指标 2组颈静脉窦血清S100β和NSE蛋白水平,术前差异无统计学意义;2组术毕和术后1 d均明显高于术前,且C组明显高于D组,差异有统计学意义(P<0.05)。见表3。
表3 2组患者S100β和NSE蛋白水平的变化(μg/L,±s)
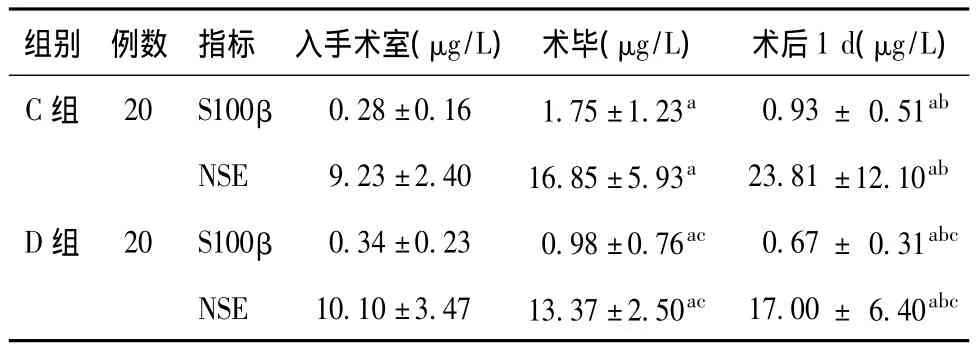
表3 2组患者S100β和NSE蛋白水平的变化(μg/L,±s)
注:2组S100β和NSE蛋白水平,与入手术室比较,a P<0.05;与术毕比较,b P<0.05;D组与C组比较,c P<0.05。
组别 例数 指标 入手术室(μg/L) 术毕(μg/L) 术后1 d(μg/L)C组 20 S100β 0.28±0.16 1.75±1.23a 0.93± 0.51ab NSE 9.23±2.40 16.85±5.93a 23.81 ±12.10ab D组 20 S100β 0.34±0.23 0.98±0.76ac 0.67± 0.31abc NSE 10.10±3.47 13.37±2.50ac 17.00± 6.40abc
2.3 认知功能指标 采用MMSE评分,2组术前1 d比较,差异无统计学意义;2组术后1、3和7 d均明显低于术前1 d,差异有统计学意义(P<0.05)。D组在手术后1、3和7 d各时点MMSE评分虽然数值均高于C组,但差异均无统计学意义。见表4。
表4 2组患者MMSE评分的变化(±s)

表4 2组患者MMSE评分的变化(±s)
注:2组患者MMSE评分与术前1 d比较,a P<0.05。
组别 例数 术前1 d 术后1 d 术后3 d 术后7 d C组 20 27.5±1.6 23.3±1.8a 22.4±1.9a 21.5±2.1a D组 20 27.1±1.3 24.1±1.9a 23.5±1.7a 22.5±2.3a
3 讨论
POCD是老年患者常见的术后心理学并发症,好发于65岁以上行长时间大手术术后患者。一项基于多中心、大样本的研究显示,非心脏大手术后1周内POCD的发生率高达25.8%[6]。POCD发病机制目前尚未明确,但与高龄、应激、创伤、疼痛、脑血管微栓子、低氧血症、过度通气和术后炎症反应等因素有关[6-7]。颈动脉内膜剥脱手术是临床上外科治疗动脉粥样硬化性颈动脉狭窄的常用方法。由于颈内动脉的阻断、开放和粥样斑块内膜的剥脱,造成不同程度的缺血-再灌注损伤、脑血管微栓子栓塞损伤和炎性损伤。同时,患者多为高龄并伴高血压、高血脂、糖尿病和心脏疾病者,术中极易出现血流动力学的剧烈波动,因此,此类患者更易出现脑损伤和POCD。
既往,临床上多采用颈动脉转流、浅低温、血液稀释等方法减轻脑损伤的发生,但效果并不理想且可能伴发心律失常等并发症。Dex是新型的高选择性α2受体激动药,通过作用于蓝斑核发挥中枢性镇静、镇痛、抗交感、降低应激反应等作用,临床上主要作为辅助药物用于手术麻醉。近期研究显示,Dex还通过抗炎、抗氧化和抗细胞凋亡等途径对实验动物发挥脑保护作用[8],且可有效预防术后谵妄的发生[9]。因此,本研究将Dex用于颈内动脉内膜剥脱术中,观察其对老年患者脑损伤和POCD的影响。
S100β是S100家族成员之一,是星形胶质细胞的特异性蛋白,主要分布于中枢神经系统的胶质细胞内。NSE是参与糖酵解的关键酶,主要分布于中枢神经细胞和神经内分泌细胞胞浆。正常情况下,体液内S100β和NSE蛋白含量很低。而脑损伤发生时,二者随着神经元的破坏而进入脑脊液,之后经受损的血脑屏障大量入血。因此,S100β和NSE蛋白分别作为胶质细胞和神经细胞的损伤标志物,其血清浓度不仅代表脑损伤的严重程度,也可作为评价POCD和神经系统预后的良好指标[10-11]。本研究直接抽取颈静脉球血样,比外周血和动脉血更能反应脑损伤的严重程度。结果显示,2组术毕和术后1 d的S100β和NSE蛋白均明显高于术前,且对照组明显高于Dex组,表明老年患者颈动脉内膜剥脱术后发生了不同程度的脑损伤,而Dex对此具有明显的脑保护作用。笔者分析其脑保护作用与以下因素有关:(1)Dex组患者气管插管、切皮和气管拔管等重要手术刺激前后的血压升高和心率增快幅度明显低于对照组,减少了血流动力学波动引起的脑内微血栓栓塞和缺血-再灌注损伤的发生;(2)Dex不仅不降低脑损伤区域附近组织氧分压[12],反而具有降低脑代谢率和优化脑血流/脑代谢比值,进而改善脑的氧供需平衡作用[13];(3)Dex具有抗应激和抗炎性介质分泌作用,可减弱创伤性炎性反应综合征引发的脑损伤。
因为POCD的发生与小胶质细胞炎症和海马区S100β水平增加有关[14],所以Dex可能通过降低血浆S100β和NSE蛋白水平,影响颈内动脉内膜剥脱术患者POCD的发生。对此,本研究对患者进行了MMSE评分测量。MMSE评分主要包括对记忆力、回忆能力、定向能力、计算力、注意力和语言能力等方面的检测[15]。为避免“学习效应”,本研究选取术前1 d和术后1、3、7 d 4个时点进行MMSE检测。结果表明,2组术后1、3和7 d均明显低于术前1 d。而Dex组在手术后1、3和7 d各时点MMSE评分虽然数值上均高于C组,但差异均无统计学意义。结果提示,应用负荷剂量 Dex 1 μg/kg,然后以 0.5 μg/(kg·h)速度持续泵注仍无法减少此类患者POCD的发生。其原因考虑与以下因素有关:(1)POCD的发生是多因素、多途径、多机制共同作用的结果,脑损伤只是其中一个促发因素;(2)Dex的应用并未将升高的S100β和NSE蛋白恢复至正常(D组术毕和术后1 d的S100β和NSE蛋白仍明显高于术前);(3)可能与Dex的应用剂量和给药方法,以及研究样本量的不足有关。
综上所述,Dex有利于维持老年颈内动脉内膜剥脱术患者血流动力学稳定,降低血清S100β、NSE蛋白水平,但对MMSE评分无明显影响。
[1]Gul S,Hanci V,Bahadir B,et al.The effectiveness of dexmedetomidine in experimental spinal cord injury compared to methylprednisolone in rats[J].J Clin Neurosci,2010,17(4):490-494.
[2]Slosberg PS.The neuroprotective effect of dexmedetomidine in the hippocampus of rabbits after subarachnoid hemorrhage[J].Surg Neurol,2009,72(6):648-649.
[3]Pandharipande PP,Pun BT,Herr DL,et al.Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients:the MENDS randomized controlled trial[J].JAMA,2007,298(22):2644-2653.
[4]Folstein MF,Folstein SE,McHugh PR.“Mini-mental state”.A practical method for grading the cognitive state of patients for the clinician[J].J Psychiatr Res,1975,12(3):189-198.
[5]Protopapa KL,Simpson JC,Smith NC,et al.Development and validation of the Surgical Outcome Risk Tool(SORT)[J].Br J Surg,2014,101(13):1774-1783.
[6]Moller JT,Cluitmans P,Rasmussen LS,et al.Long-term postoperative cognitive dysfunction in the elderly ISPOCD1 study.ISPOCD investigators.International Study of Post-Operative Cognitive Dysfunction[J].Lancet,1998,351(9106):857-861.
[7]Monk TG,Price CC.Postoperative cognitive disorders[J].Curr Opin Crit Care,2011,17(4):376-381.
[8]李爱梅,石翊飒.盐酸右美托咪啶在神经外科麻醉的应用进展[J].国际麻醉学与复苏杂志,2013,34(3):256-259.
[9]Zhang H,Lu Y,Liu M,et al.Strategies for prevention of postoperative delirium:a systematic review and meta-analysis of randomized trials[J].Crit Care,2013,17(2):R47.
[10]Li YC,Xi CH,An YF,et al.Perioperative inflammatory response and protein S-100β concentrations-relationship with post-operative cognitive dysfunction in elderly patients[J].Acta Anaesthesiol Scand,2012,56(5):595-600.
[11]Gu XH,Zhang G,Zhang XQ,et al.Clinical values of detection of serum levels of S100B and NSE in diagnosis of brain injuries at early period after cardiopulmonary bypass[J].Zhonghua Yi Xue Za Zhi,2007,87(14):975-977.
[12]Drummond JC,Sturaitis MK.Brain tissue oxygenation during dexmedetomidine administration in surgical patients with neurovascular injuries[J].J Neurosurg Anesthesiol,2010,22(4):336-341.
[13]Drummond JC,Dao AV,Roth DM,et al.Effect of dexmedetomidine on cerebral blood flow velocity,cerebral metabolic rate,and carbon dioxide response in normal humans[J].Anesthesiology,2008,108(2):225-232.
[14]Cao XZ,Ma H,Wang JK,et al.Postoperative cognitive deficits and neuroinflammation in the hippocampus triggered by surgical trauma are exacerbated in aged rats[J].Prog Neuropsychopharmacol Biol Psychiatry,2010,34(8):1426-1432.
[15]Pendlebury ST,Markwick A,de Jager CA,et al.Differences in cognitive profile between TIA,stroke and elderly memory research subjects:a comparison of the MMSE and MoCA[J].Cerebrovasc Dis,2012,34(1):48-54.

