血根碱安全性试验研究
李志,曹燕,伍勇,3∗,白霞,王楠,戴滨阳,肖倩文,郑殿重,孙志良,3
(1.湖南农业大学动物医学院,长沙410128;2.岳阳职业技术学院生物医药系,湖南岳阳414000;3.湖南省植物功能成分利用协同创新中心,长沙410128)
血根碱安全性试验研究
李志1,曹燕2,伍勇1,3∗,白霞1,王楠1,戴滨阳1,肖倩文1,郑殿重1,孙志良1,3
(1.湖南农业大学动物医学院,长沙410128;2.岳阳职业技术学院生物医药系,湖南岳阳414000;3.湖南省植物功能成分利用协同创新中心,长沙410128)
为观察大鼠连续给予血根碱30 d所产生的毒性反应及停药后恢复情况,为临床应用提供理论依据,将血根碱分别按高、中、低剂量[21、10.5、2.1 mg/(kg·d)]给大鼠连续灌胃给药30 d,观察给药期间及停药后14 d大鼠的临床体征、血液常规和生化指标、脏器指数等方面的变化。结果表明,连续给药30 d后与对照组比较,高、中剂量组体重明显增加(P<0.05),高剂量组的谷丙转氨酶、谷草转氨酶水平升高(P<0.05),其他剂量组的血液生化指标,各剂量组的血液常规、脏器指数均未见显著性变化(P>0.05);停药后14 d,高、中剂量组比对照组体重明显增加(P<0.05),其他各项检查指标无显著差异性(P>0.05)。本研究对血根碱的安全性进行了初步评价,结果可为血根碱的临床应用提供理论依据。
血根碱;大鼠;毒性;安全性评价
血根碱是一种存在于罂粟科、蓝堇科与芸香科植物中的苯菲啶异喹啉类生物碱,能抑制弧菌[1]、金黄色葡萄球菌、蜡样芽孢杆菌、四连球菌、枯草芽孢杆菌等细菌的生长[2],亦能抑制黄曲霉、根霉等8种真菌[3],还能杀灭鱼类指环虫和抑制6种水产病原菌[4]。有效成分为血根碱的博落回注射液,对猪的传染性肠胃炎和仔猪黄白痢、伤寒等疗效好[4]。在火鸡日粮中添加博落回提取物(含血根碱1.5%),能增加火鸡的日采食量,提高日增重比[6]。在28日龄断奶仔猪饲料中添加含3.75 mg/kg血根碱的博落回生物碱,能有效地改善仔猪的日增重、采食量及饲料的利用效率,促进其生长[7]。
为将血根碱开发为兽药应用于细菌性疾病,促进动物生长,拟通过观察大鼠连续灌胃血根碱30 d所产生的生理指标变化及停药后恢复情况,对血根碱的安全性进行初步评价,以期为临床剂量的确定提供理论基础。
1 材料和方法
1.1 试剂与仪器 血根碱(湖南美可达股份有限公司,批号20130712,纯度>98%),称取适量用纯净水依次配制成2.1、1.05和0.21 mg/mL三种浓度;谷丙转氨酶试剂盒(批号140306)、谷草转氨酶试剂盒(批号140311)、尿素氮试剂盒(批号131215)、肌酐试剂盒(批号140108)、血糖试剂盒(批号131207)、白蛋白试剂盒(批号131122)、总蛋白试剂盒(批号140107)、总胆固醇试剂盒(批号131219)、甘油三脂试剂盒(批号140224)均购自南京建成生物工程研究所。
UV2100紫外-可见光分光光度计(美国莱伯泰克公司)、KT6HB全自动生化分析仪(美国雅培公司)、BC-2800动物血液自动分析仪(深圳迈瑞医疗国际有限公司)、Z383K低温高速离心机(德国HERMLE公司)、Sartorius TE 212-L电子天平(北京赛多利斯公司)。
1.2 实验动物 健康SPF级SD大鼠,雌雄各半,体重90~110 g,购于上海斯莱克景达实验动物有限公司湖南分公司(许可证号SCXK(湘)2009-0012)。
1.3 检测指标 大鼠试验前饲养1周,观察进食、排便、活动等无异常后,按体重随机分为4组,每组24只,雌雄各半。根据血根碱经口急性毒性试验半数致死量LD50,以及参考相关文献[8-9],设定高、中、低剂量组分别为21、10.5、2.1 mg/(kg·d),空白对照组灌胃给予等体积纯净水,每日给药1次,按体重定量给药。大鼠于连续给药30 d和停药恢复期14 d后24 h(禁食不禁水12 h),每组取12只大鼠(雌雄各半)眼眶静脉采血0.5 mL,用全自动血液分析仪检测血常规指标后,剖杀大鼠取自凝血分离血清,采用谷丙转氨酶、谷草转氨酶、尿素氮、肌酐、血糖、白蛋白、总蛋白、总胆固醇、甘油三脂等试剂盒与全自动生化分析仪,测定血液生化指标;取心、肝、脾、肺、肾脏称重,计算脏器指数。
1.4 数据分析 试验结果采用x±s表示,用SPSS18.0统计软件对各组参数进行单因素方差分析,计量资料采用t检验。
2 结果
2.1 血根碱对大鼠体重的影响 与空白对照组比较,血根碱高、中剂量组雄性、雌性大鼠体重增重显著(P<0.05),低剂量组大鼠体重与对照相比没有显著性差异(P>0.05),血根碱在连续30 d给药期和停药14 d内对雄性大鼠体重影响见表1,对雌性大鼠体重的影响见表2。

表1 血根碱对雄性大鼠体重的影响(n=12,只)

表2 血根碱对雌性大鼠体重的影响(n=12,只)
2.2 血常规指标检查 空白对照组大鼠血常规各指标水平均在正常范围内,连续给药30 d和停药14 d,血根碱各剂量组雄性的血红蛋白、红细胞计数、白细胞计数、嗜中性粒细胞、嗜酸性粒细胞、淋巴细胞、单核细胞的百分比与空白对照组比较无显著性差异(P>0.05),见表3-表4;各剂量组雌性大鼠的血常规与空白对照组比较无显著性差异(P>0.05),见表5-表6。

表3 连续给予血根碱30 d对雄性大鼠血常规指标的影响(n=6,只)

表4 血根碱停药14 d后对雄性大鼠血常规指标的影响(n=6,只)

表5 连续给予血根碱30 d对雌性大鼠血常规指标的影响(n=6,只)

表6 血根碱停药14 d后对雌性大鼠血常规指标的影响(n=6,只)
2.3 生化指标检查 空白对照组大鼠的谷丙转氨酶、谷草转氨酶、尿素氮、肌酐、血糖、白蛋白、总蛋白、总胆固醇、甘油三脂等指标均在正常范围内,高剂量血根碱能升高雄性大鼠的谷丙转氨酶、谷草转氨酶水平,与空白对照组有显著性差异(P<0.05),但对其他生化指标没有影响(P>0.05),中、低剂量组的生化指标与空白对照组比较无显著性差异(P>0.05),见表7;在停药14 d后,高剂量组的谷丙转氨酶、谷草转氨酶水平恢复正常(P>0.05),各剂量组未见其他明显的后遗效应和继发毒性变化,见表8;雌性大鼠各剂量组的生化指标在连续给药30 d后及停药14 d后的变化情况同雄性大鼠,见表9-表10。

表7 给予血根碱30 d对雄性大鼠血液生化指标的影响(n=6,只)

表8 血根碱停药14 d后对雄性大鼠血液生化指标的影响(n=6,只)

表9 连续给予血根碱30 d对雌性大鼠血液生化指标的影响(n=6,只)

表10 血根碱停药14 d后对雌性大鼠血液生化指标的影响(n=6,只)
2.4 脏器指数测定 解剖大鼠后精密称取脏器质量,计算其脏/体,结果进行组间t检验,结果显示,空白对照组的心、肝、脾、肺、肾等脏器指数在正常范围内,各剂量组的脏器指数与空白对照组比较均无显著性异(P>0.05),见表11-表12。

表11 连续给予血根碱30 d后大鼠脏器指数(n=12,只)
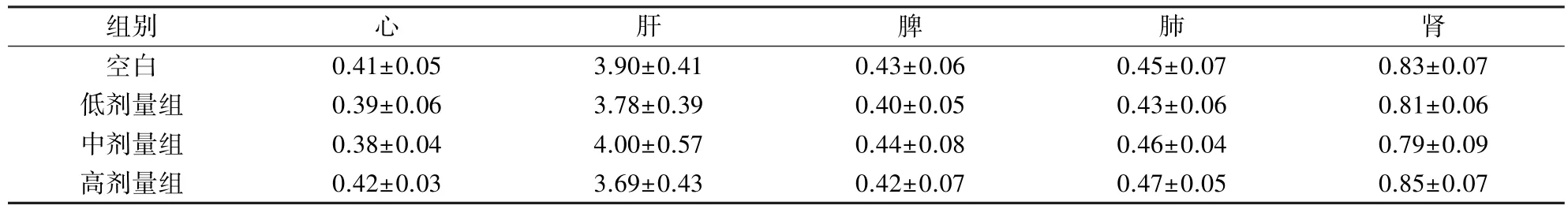
表12 血根碱停药14 d后大鼠脏器指数(n=12,只)
3 讨论与小结
有研究表明,在28日龄断奶仔猪饲料中添加含3.75 mg/kg血根碱的博落回生物碱进行90 d的饲养试验,料肉比较空白对照组降低了5.12%[7]。本试验中,大鼠每日灌胃2110.5 mg/kg血根碱能促进其生长发育,可能是由于血根碱具有抑制胆脂酶活性,刺激唾液分泌,并具有利尿外周抗肾腺素解交感作用,同时有能抑制芳香族氨基酸脱羧酶的作用,血根碱通过这一作用调节色氨酸-5-色胺代谢途径,从而增加饲养动物的采食量,亦有可能是血根碱在肠道中发挥抗菌和抗炎作用,从而降低断奶仔猪腹泻率,保障肠道健康,改善饲料利用率提高动物生产性能,此机理有待进一步研究。
有研究报道单剂量给予大鼠腹腔注射10 mg/kg的血根碱能升高血清中谷丙转氨酶和谷草转氨酶水平[10],从本试验血根碱对大鼠的血清生化指标的影响情况来看,高剂量组谷丙转氨酶、谷草转氨酶水平要高于空白对照组,其他各剂量组指标与空白对照组比较无显著性差异,且谷丙转氨酶、谷草转氨酶可在停药后恢复正常,进一步证实高剂量的血根碱能升高血清中谷丙转氨酶和谷草转氨酶水平,同时提示高剂量的血根碱可能引起肝脏、骨骼肌、心肌的损伤,但这种损伤在血根碱停药后可以恢复。
有研究表明大鼠口服血根碱的LD50为1658 mg/kg,静脉注射的LD50为29 mg/kg,在大鼠日粮中添加150 μg/g血根碱喂养15 d,以及以0.6 mg/kg剂量灌胃30 d后未见大鼠出现毒性反应,家兔肌肉注射血根碱的LD50为1658 mg/kg[11]。本试验结果表明,大鼠经灌胃分别给予21、10.5、2.1 mg/kg血根碱,给药期间各组动物的活动、毛色、饮水、摄食、粪便正常,21、10.5 mg/kg剂量组能促进大鼠体质量增长,21 mg/kg剂量组的谷丙转氨酶、谷草转氨酶要高于空白对照组,其他组的血液常规与生化指标、脏器指数均正常。
本试验结果对血根碱的安全性进行了初步评价,得出30 d喂饲不同剂量的血根碱对大鼠引起有害效应的剂量和靶器官,为血根碱临床剂量的确定提供数据支持。
[1] Nandi R,Maiti M,Chaudhuri K,et al.Sensitivity of vibrios to sanguinarine[J].Experientia,1983,39:524-525.
[2] 赵东亮,郁建平,周晓秋,等.博落回生物碱的抑菌作用研究[J].食品科学,2005,26(1):45-47.
[3] 郁建平,赵东亮,孟祥斌,等.博落回生物碱对8种真菌的抑菌作用[J].山地农业生物学报,2006,25(1):89-91.
[4] 王高学,王建福,原居林,等.博落回杀灭鱼类指环虫和病原菌活性成分的研究[J].西北植物学报,2007,27(8):1650-1655.
[5] 叶培根,郭定宗,毕丁仁,等.博落回注射液治疗仔猪黄、白痢及抑制大肠杆菌的试验[J].中兽医医药杂志,1988,6:17-18.
[6] Vieira S L,Berres J,Reis R N,et al.Studies with sanguinarine like alkaloids as feed additive in broiler diets[J].Brazilian Journalof Poultry Science,2008,10(1):67-71.
[7] Pavel Kosina,Daniela Walterova,Jit ka Ulrichova.Sanguinarine and chelerythrine:assessment of safety on pigs in ninety days feeding experiment[J].Food and Chemical Toxicology.2004,42:85-91.
[8] 农业部兽药评审中心.兽药研究技术指导原则汇编[M].北京:化学工业出版社,2012:84-87.
[9] 高艳艳,王祝义,王芳,等.苦参苍术口服液长期毒性试验[J].中国兽药杂志,2013,47(1):17-19.
[10]Dalvi R R.Sanguinarine:its potential as a liver toxicalkaloid present in the seeds of Argemone mexicana[J].Experientia,2007,41:77-78.
[11]Peter J Becci,Harold Schwartz,Hamlin H Barnes,et al.Shortterm toxicity studies of Sanguinarine and of two alkaloid extracts of Sanguinaria Canadensis L.[J].Journal of Toxicology and Envi⁃ronmental Health,1987,20:199-208.
(编辑:陈希)
Safety Test of Sanguinarine
LI Zhi1,CAO Yan2,WU Yong1,3∗,BAI Xia1,WANG Nan1,DAI Bin-yang1,XIAO Qian-wen1,ZHENG Dian-zhong1,SUN Zhi-liang1,3
(1.College of Veterinary Medicine,Hunan Agricultural University,Changsha 410128,China;2.Yueyang Polytechnical College,Yueyang,Hunan 414000,China;3.Hunan Collaborative Innovation for Ultilization of Botanical Function Ingredients,Changsha 410128,China)
To provide theoretical evidence for clinical applications,the toxicity of sanguinarine in rats after feeding the drug for 30 d and the recovery after drug withdrawal was observed.Three treatment groups and control group were divided up.Rats in high-dose,middle-dose and low-dose groups were respectively administrated sanguinarine at 21,10.5 and 2.1 mg/(kg·d)orally for 30 consecutive days.The clinical signs,hematological index,blood biochemical index and organ index of rats were investigated during 30 d drug administration period and 14 d after drug withdrawal.The results indicated that sanguinarine in high-dose and middle-dose could induce body weight increasing in rats compared with control group(P<0.05).The level of alanine aminotrans ferase(ALT)and partate aminotransferase(AST)in rats from high-dose group was higher than those from control group(P<0.05).Compared with control group,there was no evident effect in hematological index,and organ index(P>0.05).The body weight of rats from the high-dose group and middle-dose group had significantdifference compared with control group(P<0.05),but the other indexes had no significant difference after another 14 d recovery(P>0.05).The safety evaluation of sanguinarine laid a theoretical foundation for its clinical application.
sanguinarine;rat;toxicity;safety evaluation
2014-12-08
A
1002-1280(2015)03-0035-05
S853.74
国家大学生研究性学习和创新性实验计划资助项目(Gscx1316);湖南农业大学东方科技学院青年基金项目(14QNZ13);国家自然科学基金青年项目(31402255)
李志,从事中药有效成份与药物代谢研究。
伍勇。E-mail:wuyong712@126.com

