猪瘟活疫苗效力检验替代方法的研究
王海光,宁宜宝∗,赖月辉,吴文福,王芳,刘灿,张文利,黄秋雪,陈坚,林旭埜,张毓金,范学政,徐璐,王琴,赵启祖,丁家波
(1.中国兽医药品监察所,北京100081;2.广东永顺生物制药股份有限公司,广州511356)
猪瘟活疫苗效力检验替代方法的研究
王海光1,宁宜宝1∗,赖月辉2,吴文福2,王芳1,刘灿1,张文利1,黄秋雪2,陈坚2,林旭埜2,张毓金2,范学政1,徐璐1,王琴1,赵启祖1,丁家波1
(1.中国兽医药品监察所,北京100081;2.广东永顺生物制药股份有限公司,广州511356)
目前,我国猪瘟活疫苗效力检验最常用的方法是测定猪瘟疫苗中病毒的兔体感染量(RID),但是用该方法易受到检验兔品种、个体和饲养环境的影响。为了探索一种不依赖动物的疫苗效力检验新方法,本研究将待检猪瘟活疫苗系列稀释后分别接种易感细胞,使用抗原捕获ELISA、RT-nestPCR和RT-PCR三种方法检测不同稀释度疫苗中活病毒在感染细胞后增殖的子代病毒,计算疫苗病毒的最高细胞感染剂量,建立了猪瘟疫苗病毒的细胞感染量(CID)的效力检验方法。结果显示:疫苗中活病毒粒子越多,CID就越高;对不同类型猪瘟疫苗的检测结果表明,该方法适用于传代细胞源和细胞源猪瘟活疫苗的效力效检。使用CID和RID两种检测方法同时对12批猪睾丸传代细胞源(传代细胞源)和3批牛睾丸原代细胞源(细胞源)猪瘟活疫苗进行了比对效检,结果表明,用CID测定方法检验,12批猪瘟活疫苗(传代细胞源)每头份均含105CID,3批猪瘟活疫苗(细胞源)每头份含量均为104CID;用兔子感染体温测定法,12批猪瘟活疫苗(传代细胞源)每头份含量在2.6×104~3.0×104RID之间,3批猪瘟活疫苗(细胞源)每头份含7.0×103~8.0×103RID。试验证明:本实验室建立的CID检测结果与现有质量标准RID的结果存在良好的相关性,能够较好反映疫苗中活病毒的含量,有望成为RID的替代方法。
猪瘟活疫苗;效力检验;替代方法;兔体感染量;细胞感染量;抗原捕获ELISA;RT-nestPCR;RT-PCR
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起的一种猪的烈性、急性传染性疾病,我国将其列为一类动物传染病。我国培育的猪瘟兔化弱毒疫苗是国际上公认最安全、有效的猪瘟疫苗之一,为我国乃至世界猪瘟的防控和消灭起到了重要的作用[1-2]。为了保证猪瘟活疫苗安全有效,疫苗的效力检验方法显得尤为重要。到目前为止,我国猪瘟兔化弱毒疫苗效力检验方法一直是延用20世纪50年代建立的兔体感染量测定法[3]。由于不同品种、不同个体的试验兔对猪瘟兔化弱毒的敏感性存在差异[4],同批猪瘟疫苗用不同品种的兔在不同地区进行效力检验,有时会出现不同的结果,用兔子进行猪瘟疫苗效力检验存在费时、费力,可重复性差等缺点,因此建立不依赖动物的效力检验替代方法是势在必行。猪瘟活疫苗对宿主的免疫效力是通过病毒感染宿主细胞激活免疫系统而实现的,在一定范围内,宿主免疫疫苗的病毒量越大,对宿主免疫系统的激活就越强,免疫效力就越好[5]。因此,猪瘟兔化弱毒疫苗的免疫效力可以通过测定疫苗中有细胞感染性活病毒的量(浓度)来评价。钟明华等曾报道用新城疫病毒增强猪瘟病毒的致细胞病变来测定猪瘟疫苗的活病毒滴度替代动物效力检验的方法,但由于该方法致细胞病变不稳定未能推广使用。本试验旨在建立一种能够客观准确检测猪瘟疫苗中活病毒含量的效力检验替代方法。
1 材料与方法
1.1 猪瘟疫苗冻干制品和猪瘟细胞毒湿毒
1.1.1 监督抽检猪瘟疫苗 14批猪瘟活疫苗,为中国兽医药品监察所从5个猪瘟疫苗生产企业监督抽检获得。其中猪瘟活疫苗(传代细胞源)4批,批号分别为201202、201209、201210和201211;猪瘟活疫苗(细胞源)3批,批号为:201212、201213和201203批;猪瘟活疫苗(脾淋源)7批,批号为:201201、201204、201205、201206、201207、201208和201214批,所有疫苗均在有效期内。
1.1.2 猪瘟兔化弱毒细胞液湿毒 不同代次收获的猪瘟兔化弱毒细胞毒,由广东永顺生物制药股份有限公司制备和提供。
1.1.3 RID与CID测定法比较检测用猪瘟活疫苗12批猪瘟活疫苗(传代细胞源),批次分别为:ST2012036、ST2012037、ST2012038、ST2012041、ST2012042、ST2012043、ST2012044、ST2012046、ST2012047、ST2011054、ST2011055和ST2011056;3批猪瘟活疫苗(细胞源),批次分别为:2012124、2012125和2012126。以上疫苗均由广东永顺生物制药股份有限公司提供,所有疫苗均在有效期内。
1.2 细胞及试验动物
1.2.1 ST传代细胞 由中国兽医药品监察所和广东永顺生物制药有限公司提供。
1.2.2 猪瘟抗原捕获ELISA检测试剂盒 购自美国IDEXX公司。
1.2.3 猪瘟RT-PCR检测试剂盒 购于北京世纪元亨动物防疫技术有限公司。
1.2.4 RT-nestPCR检测方法 本实验室自建[2]。
1.2.5 兔 新西兰大耳白兔,体重1.5~3.0 kg,由广东永顺生物制药有限公司自繁自养。
1.2.6 RID测定 按2010版《中国兽药典》规定的方法测定[3]。
1.3 体外CID检测方法的建立
1.3.1 细胞培养、病毒接种和样品收获
1.3.1.1 细胞准备 细胞营养液:取90 mL MEM(Invitrogen)培养液,加入10 mL新生牛血清(Invitrogen),4℃保存。细胞维持液:取97 mL MEM,加入3 mL新生牛血清,4℃保存。取生长良好单层的ST细胞瓶,用胰酶消化后,再用营养培养液配制成每毫升含1×106个细胞的细胞悬液,接种于25 cm2细胞瓶中,每瓶6 mL,于37℃、5%CO2条件下培养24~36 h,当细胞长成良好单层后备用。
1.3.1.2 病毒接种和样品收获 弃去细胞培养板中的上清液,将每头份猪瘟兔化弱毒湿毒稀释成10-1~10-6,每个稀释度分别接种于4瓶长成良好ST细胞单层的25 cm2细胞瓶,每瓶0.6 mL,留4瓶细胞不接种病毒作为空白对照,置于37℃、5% CO2温箱中吸附4 h后,吸出毒液,每瓶加入6 mL维持液,继续培养。每4 d收一次毒,将上清液混合,另每次从每个稀释度病毒液接种的4个细胞瓶中取出一瓶,吸出一半细胞上清,另一半留下连同细胞一起置于-20℃冻溶两次以裂解细胞,以比较细胞上清液和细胞内的猪瘟病毒含量。共收获4次。1.3.2 抗原捕获ELISA检测法对待检抗原最佳收获代次、最高阳性稀释度和处理方式的比较 按猪瘟抗原捕获ELISA检测试剂盒说明书的操作程序对猪瘟疫苗进行检测。将检测样品分成两组,一种按裂解液与样品原液1∶1的比例混合裂解处理,一组不加裂解液处理,比较裂解液处理样品对检测结果的影响;用ELISA分别测定各稀释度毒液接种细胞后1~4收次样品中的猪瘟病毒,按试剂盒说明书标准判定检测结果。以确定检验的疫苗样品最佳收获时间和最高稀释度。
1.3.3 不同类型猪瘟疫苗的比较检测 采用抗原捕获ELISA对14批3种不同类型的猪瘟疫苗成品进行检验,以确定该效检方法适用检测疫苗的类型。细胞培养、收毒和检测操作流程同1.3.1和1.3.2。
1.3.4 几种CID测毒方法的比较检测 采用抗原捕获ELISA、RT-PCR和RT-nestPCR方法对疫苗接种ST细胞后不同时间收集的样品进行检测,将检测结果进行比较。
1.4 CID与RID检测结果的比较 用细胞维持液将12批猪瘟活疫苗(传代细胞源)和3批猪瘟活疫苗(细胞源)稀释成10-1~10-6,取疫苗10-3~10-6每个稀释度各0.6 mL接种1瓶细胞,吸附4 h后,吸出病毒液,按6 mL/瓶加入维持液,继续在37℃、5%CO2条件下培养。每4 d收获细胞上清液1次,连续收获3次。采用猪瘟抗原捕获ELISA试剂盒对所有样品进行检测,并用猪瘟RT-nestPCR和RT-PCR检测试剂盒进行确认。同时,对同一批次的疫苗按2010年版《中国兽药典》规定的兔体检测方法测定每批疫苗每头份中的RID含量,并与CID方法检测得到的结果进行比对。
2 结果
2.1 CID测定法对不同时间收获猪瘟病毒湿毒样品的检测结果 猪瘟抗原捕获ELISA对不同稀释度猪瘟兔化弱毒接种ST细胞后不同时间细胞病毒感染的测定结果见表1。
表1结果表明:不同稀释度猪瘟病毒接种细胞后第4天,仅在10-3和10-4稀释度病毒液接种的细胞中检测到猪瘟病毒,第8天时,可以在10-5和10-6稀释度病毒液接种的细胞中检测到猪瘟病毒,第12天可以在10-6稀释度病毒液接种的所有细胞中检测到猪瘟病毒,12 d与16 d收获样品的结果没有差异;结果证明接种12 d,细胞中猪瘟病毒增殖已达高峰;细胞内和细胞上清中猪瘟病毒含量没有明显差异,这与早期报道的结果基本相一致[6];检测样品用裂解液处理在早期似乎能提高检测阳性水平,但对12 d收集的样品,不影响抗原捕获ELISA的检测结果;用RT-nestPCR的检测,在接毒后第4天就能在10-6稀释度病毒液接种收获的ST细胞上清中检测到猪瘟病毒核酸,这一点与ELISA方法不一致;结果同时显示,用猪瘟抗原捕获ELISA检测为“可疑”的12 d以上收获的病毒样品,用RT-nestPCR的检测结果均为阴性,证明这种可疑反应为非特异性反应。因此,在最终判定结果时,ELISA检测结果“可疑”的样品一律视为阴性。
2.2 CID测定方法对不同种类疫苗的检测结果按所建立的抗原捕获ELISA操作流程对14批不同厂家生产的猪瘟活疫苗(传代细胞源)、猪瘟活疫苗(细胞源)、猪瘟活疫苗(兔脾淋源)三种类型的猪瘟活疫苗进行活病毒测定,结果见表2。

表1 不同稀释度猪瘟兔化弱毒湿毒接种细胞后第4~16天收获样品的病毒检测结果
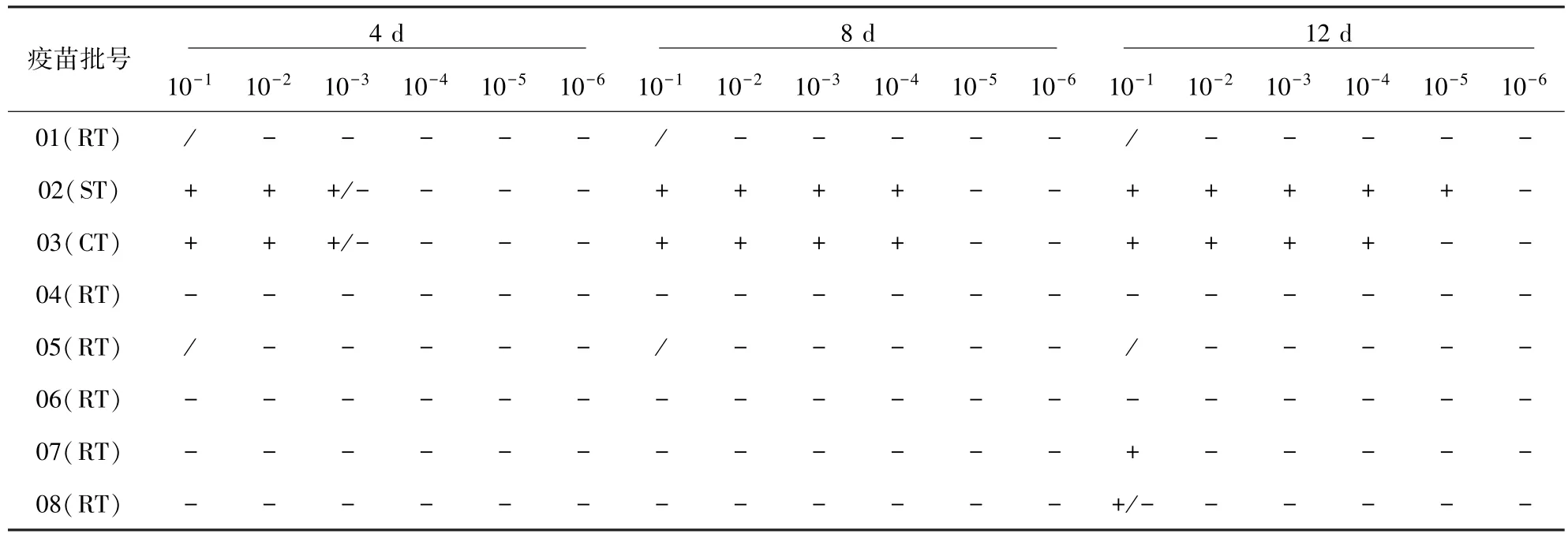
表2 不同类型疫苗接种细胞后不同时间所收获细胞上清样品的猪瘟抗原捕获ELISA检测结果
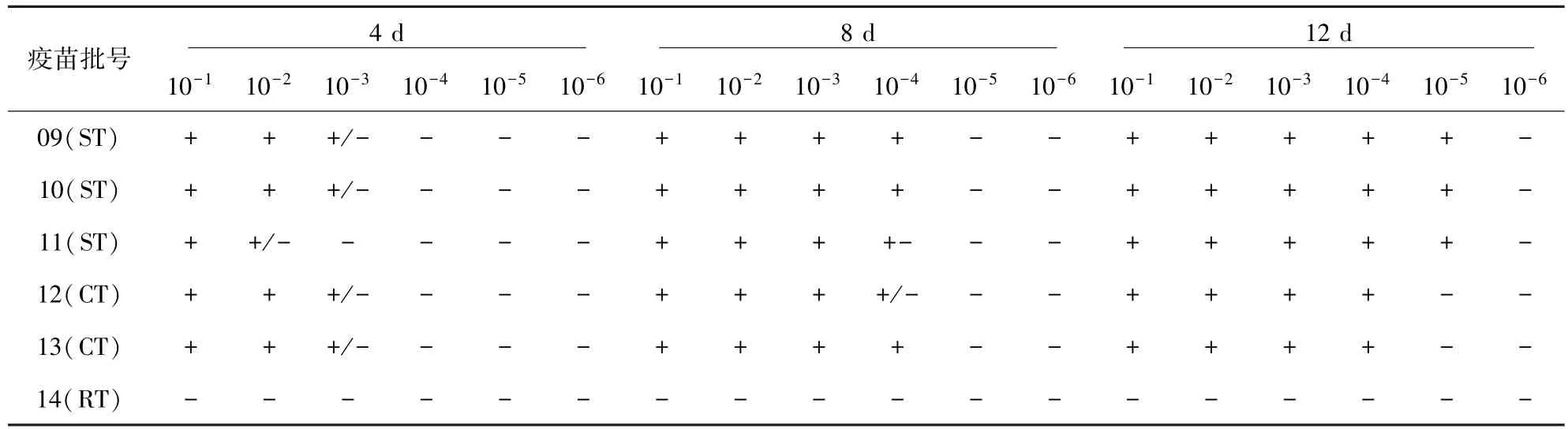
续表
表2结果表明:同表1显示的结果一样,稀释病毒样品接种后12天,病毒达到增殖高峰,以12天收获细胞上清的检测结果作为判定标准,将4批猪瘟活疫苗(传代细胞源)每头份稀释到10-5接种的ST细胞,均可检测到猪瘟病毒;3批猪瘟活疫苗(细胞源)只有稀释10-4/头份接种的细胞上清能检测到猪瘟病毒,病毒含量比猪瘟活疫苗(传代细胞源)的CID低10倍。而7批猪瘟活疫苗(兔源)所有稀释度接种的细胞都没有检测到猪瘟病毒。由此可见,猪瘟活疫苗(传代细胞源)和猪瘟活疫苗(细胞源)适于使用CID替代方法进行效检,而在所有稀释度猪瘟活疫苗(兔源)接种的细胞上清液中均没有检测到猪瘟病毒,是方法问题,还是疫苗质量问题,还有待进一步研究。
2.3 细胞感染量与兔体定型热对猪瘟成品疫苗的比较检测结果 将广东永顺生物制药股份有限公司生产的12批猪瘟活疫苗(传代细胞源)和3批猪瘟活疫苗(细胞源)用CID和RID测定法进行比较检测,结果见表3。
表3结果表明:抗原捕获ELISA、RT-nestPCR和RT-PCR 3种方法对15批疫苗细胞感染毒量检测结果完全一致;用3种方法检测感染细胞上清液,所有12批猪瘟活疫苗(传代细胞源)的病毒含量均为105CID/头份,3批猪瘟活疫苗(细胞源)每头份均为104CID;用兔检测,12批猪瘟活疫苗(传代细胞源)每头份中的病毒含量均在2.6×104~3.0×104RID之间,3批猪瘟活疫苗(细胞源)每头份含在7.0×103~8.0×103RID之间。
考虑到猪瘟活疫苗(传代细胞源)的规程标准为每头份≥7500 RID,根据此次猪瘟活疫苗(传代细胞源)体外活病毒含量测定其阳性稀释度均能够达到105CID/头份的检测结果,初步可将体外动物替代方法活病毒含量检测的质量合格标准定为疫苗稀释度≥104.5CID/头份检测阳性为合格。
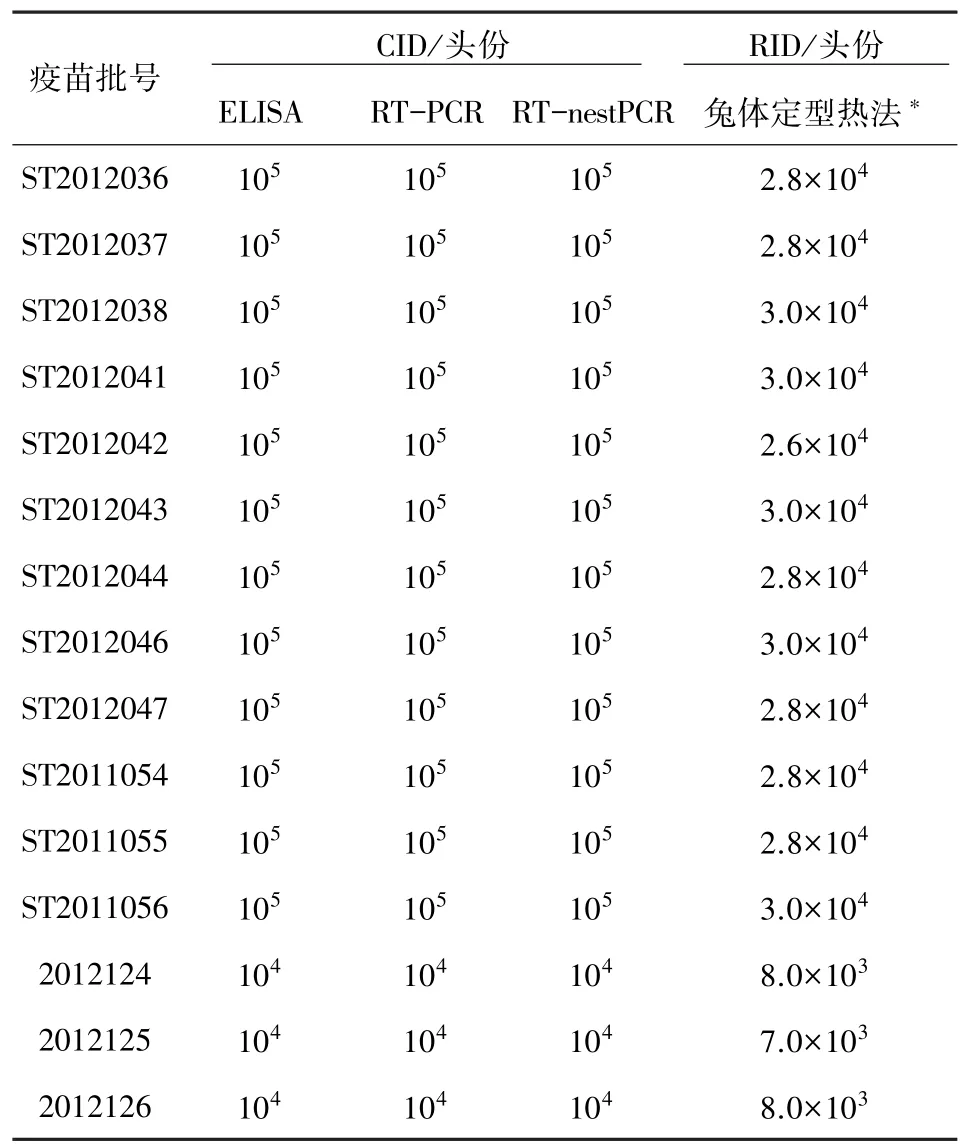
表3 效检替代方法与兔体定型热法检测结果
3 讨论
猪瘟兔化弱毒可以在多种细胞上生长,但均不产生细胞病变(CPE),因此无法通过直接观察感染细胞的CPE来判定疫苗中猪瘟病毒的细胞感染量。本实验室建立的用稀释后的猪瘟疫苗接种细胞,使用特异敏感的方法来测定细胞上清液中的病毒。多次试验证明:该方法客观准确,特异性强,敏感性高,有效克服了兔子品种和饲养环境对猪瘟疫苗检测结果的影响,这是本研究的一个重大突破。
在病毒接种细胞后的早期检测中,虽然ELISA的检测方法没有检测到病毒,而RT-nestPCR检测到了,但试验同时证明,只有到病毒增殖到足够量时,ELISA才能检测到阳性结果,这证明ELISA方法检测到的病毒是接种后的增殖到一定量的子代猪瘟病毒,因此在使用ELISA对猪瘟兔化弱毒疫苗进行效检时,应采用接种病毒后10~12 d收获的细胞上清液进行检测。RT-nestPCR检出细胞中猪瘟病毒的时间比ELISA早得多,一方面是前者的敏感性比后者要高,另一方面是因为该方法检测的病毒基因,不能区别死毒与活毒,4 d时在10-6疫苗接种的细胞上清中检测的病毒核酸有可能是早期接种到细胞中尚未增殖的病毒,而疫苗效力检验是要检测活的有感染性的猪瘟病毒,所以RT-nestPCR早期的检测病毒核酸结果只能作为参考[7-8]。
从细胞感染量与兔体定型热对12批猪瘟活疫苗(传代细胞源)比较检测得到的结果来看,两种方法存在良好的对应关系,检测阳性滴度均为105,引起细胞感染与引起兔产生定型热的猪瘟病毒含量基本是一致的。但是本试验中所测定的疫苗批次还比较少,应增加不同企业利用同一种方法对多批疫苗的比较检测,以得到一个更加准确的疫苗质量临界判定值。
7批猪瘟活疫苗(兔脾淋源)的所有稀释度毒液接种的ST细胞4~16 d收获的细胞上清液中均没有检测到猪瘟病毒抗原,有可能是疫苗质量问题,也有可能是用兔脾脏、淋巴结组织对ST细胞的病毒增殖能力有干扰抑制作用。因为表2的结果显示,有两批猪瘟活疫苗(兔源)用10-1稀释度接种细胞后4 d可见到ST细胞脱落死亡的现象。到底是方法问题,还是疫苗质量问题,有待进一步做深入研究。
[1] 宁宜宝.兽用疫苗学[M].北京:中国农业出版社,2009.
[2] Wang H,Ning Y,Ying C,et al.Development and application of a RT-nestPCR assay for differential detection of c-strain and wild-type viruses of classical swine fever virus[J].Sustainable Agriculture Research,2013,2:27.
[3] 中华人民共和国兽药典[S].北京:中国农业出版社,2010.
[4] 曾彦钦,吴润生,林志坤,等.酷暑对兔体温和猪瘟定型热比率的影响[J].福建农业学报,2007,22(3):283-287.
[5] van Oirschot J T.Vaccinology of classical swine fever:from lab to field[J].Veterinary Microbiology,2003,96(4):367-384.
[6] Keelapang P,Sriburi R,Supasa S,et al.Alterations of pr-M cleavage and virus export in pr-M junction chimeric dengue viruses[J].J Virol,2004,78(5):2367-2381.
[7] 陈玉栋,张楚瑜,邹俊煊,等.建立快速定量检测猪瘟兔化弱毒苗的荧光定量PCR技术[J].中国病毒学,2003,18(2):124-128.
[8] 陈锴,姚华伟,王长江,等.荧光定量PCR作为猪瘟兔化弱毒疫苗效价检验替代方法的研究与应用[J].中国农业科学,2013,46(1):162-169.
(编辑:李文平)
WANG Hai-guang1,NING Yi-bao1∗,LAI Yue-hui2,WU Wen-fu2,WANG Fang1,LIU Can1,ZHANG Wen-li1,HUANG Qiu-xue2,CHEN Jian2,LIN Xu-ye2,ZHANG Yu-jin2,FAN Xue-zheng1,XU Lu1,WANG Qin1,ZHAO Qi-zu1,DING Jia-bo1
(1.China Institute of Veterinary Drug Control,Beijing 100081,China;2.Guangdong Win-sun Bio-pharmaceutical Co.Ltd,Guangzhou 511356,China)
classical swine live vaccine;potency test;alternative strategy;CID;RID;ELISA;RT-nestPCR;RT-PCR
2015-02-01
A
1002-1280(2015)03-0001-06
S859.79
农业部“948”项目(2011-G4)
王海光,硕士,从事动物病毒研究。
宁宜宝。E-mail:ningyibao@ivdc.org.cn
Development of an Alternative Potency Test Method for Classical Swine Fever Live Vaccine
Abstract:The potency detection method of C-strain vaccine based on classical swine fever virus rabbit infection dose(RID)is widely used in China,however,this method is greatly influenced by bread,individual difference and housing environment.In order to establish an alternative potency test strategy avoid using experimental animals,the permissive cell was inoculated with serial diluted vaccine,and then the antigen-capture ELISA,RT-nestPCR and traditional RT-PCR were utilized to detect the progeny virus.The highest positive dilution was termed as the indicator of the vaccine’s potency.The method of cell infection dose(CID)was established.The results showed that the higher live virus particles in vaccine,the higher dose of cell infection virus.Results from the potency tests of different types of C-strain vaccines indicated that the alternative strategy could be applied to potency test of ST cell-line produced C-strain vaccine and bovine testicular cell produced C-strain vaccine.Potency tests of 12 batches of ST cell-line produced C-strain vaccines and 3 batches of bovine testicular cell produced C-strain vaccines were conducted with both the alternative strategy CID and the RID test parallel.The results showed,the positive dilution of all 12 batches of ST cell-line produced C-strain vaccine were 105CID/dose,and 2.6×104~3.0×104RID/dose.And the positive dilution of 3 batches of bovine testicular cell produced C-strain vaccine were 104CID/dose and 7.0×103~8.0×103RID/dose.The potency test results of the alternative strategy CID were at certain extent corresponding to that of RID test,and it could reflect the concentration of infectious virus particles in vaccine.The alternative strategy CID is of potentiality to replace the RID test.

