蜡蚧轮枝菌孢子萌发条件研究
王庆菊
(长春汉高表面技术有限公司,吉林 长春 130012)
0 引 言
螺旋粉虱是全球的经济性作物害虫(Lauofo[1],1982),1965年在美国佛罗里达州被Russell首次报道并记述为新种,属同翅目(Homoptera),粉虱科(Aleyrodidae)。螺旋粉虱具有寄主种类多、传播方式多样且繁殖速度快等特点,最初产于中、南美洲和加勒比海的新热带地区[2],至今几乎遍布整个热带地区。2006年海南首次报道螺旋粉虱,调查发现其在海南的寄主达到49科97属115种(变种)[3]。
目前,防治螺旋粉虱主要使用化学农药,化学农药凸显出诸多问题,既伤害了天敌,又污染了环境,蔬菜和经济作物中农药的残留会影响人类的健康,故人们不断探索新型药剂以控制螺旋粉虱为害[4]。生物源农药就是其中一类,其对环境友好,人畜安全是当前的研究热点。
蜡蚧轮枝菌(Verticillium lecanii)是蚜虫、蚧类及粉虱等同翅目害虫的重要病原真菌之一。普遍分布在温带、热带和亚热带,寄主范围很广,亦可寄生鳞翅目、等翅目、鞘翅目等昆虫以及植物病原菌[5-7]。蜡蚧轮枝菌在欧洲有两个品系已经商品化,用于控制温室蔬菜害虫白粉虱(Mycotol)和蚜虫(Vertalec)[8]。我国也有利用蜡蚧轮枝菌防治白粉虱、烟粉虱、温室白粉虱等温室害虫的报道[9],但是应用蜡蚧轮枝菌防治螺旋粉虱及其螺旋粉虱感病后病理学变化在国内未见报道。
目前,我国主要研究螺旋粉虱的生物学特性、种群动态及化学防治等,如2010年,石艳华[10]等应用石蜡切片技术分别研究螺旋粉虱成虫复眼、雌雄触角感器以及消化系统的形态和组织结构。在前人研究的基础上,文中主要对蚧轮枝菌孢子萌发条件和感染螺旋粉虱后的组织病理学进行研究,孢子萌发是成功侵染螺旋粉虱的先决条件,为成功开发生防菌株奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种来源
从番石榴叶片上感病的螺旋粉虱虫体上分离,采用单孢分离法分离纯化,根据常规形态学和分子生物学技术初步鉴定该菌株属于蜡蚧轮枝菌(Verticillium lecanii.sp)。
1.1.2 供试昆虫
从野外摘取带有螺旋粉虱成虫的番石榴叶片,将螺旋粉虱成虫接种于番石榴苗上,48h后将番石榴苗移到养虫室中,待螺旋粉虱若虫长至适合龄期时,供生物测定使用。
1.1.3 试剂配置
配 制100mL 10×PBS(pH值7.2):137mmol/L NaCl;2.7mmol/L KCl;4.3mmol/L Na2HPO4·12H2O;1.4mmol/L KH2PO4;用DEPC处理水配制,pH调至7.2。
1.1.4 接种孢子悬浮液的制备
将复壮后的菌株接种到PDA培养基上,置28℃恒温培养箱中培养7d,前3d黑暗培养有利于孢子萌发和菌丝生长,后4d(L∶D=14∶10)光照培养促进分生孢子的形成。用含有0.1%吐温-80的无菌水收集蜡蚧轮枝菌分生孢子,过滤后,用血球计数板计数法分别配置2×105,2×106,2×107,2×108,2×109个·mL-1的孢子悬浮液各50mL备用,另用含0.1%吐温-80的无菌水作对照。
1.2 方法
1.2.1 分生孢子萌发条件研究
1.2.1.1 温度对分生孢子萌发的影响
采用琼脂玻片法测定,取培养10d的蜡蚧轮枝菌分生孢子,配制成2×107个·mL-1的孢子水悬浮液(含0.1%吐温-80)。摇匀后取20μL涂布于含沙氏培养基的载玻片上,分别放置于设定为15,20,25,30,35℃的恒温培养箱内保湿培养,每4h观察一次孢子萌发率,每个处理观察的孢子数不少于300个,每个温度设置3次重复。
1.2.1.2 营养对分生孢子萌发的影响
采用琼脂玻片法测定,取培养10d的蜡蚧轮枝菌分生孢子,分别用无菌水、1%葡萄糖液、1%麦芽糖液、萨氏培养液和沙氏培养液配制2×107个·mL-1的孢子悬浮液(含0.1%吐温-80)。摇匀后取20μL涂布于含水琼脂载玻片上,30℃恒温培养箱保湿培养,每4h观察一次孢子萌发率,每个处理观察的孢子数不少于300个,每个处理设置3次重复。
1.2.1.3 湿度对分生孢子萌发的影响
参照方仲达[11]的饱和盐控制湿度法,不同饱和盐控制的相对湿度见表1。
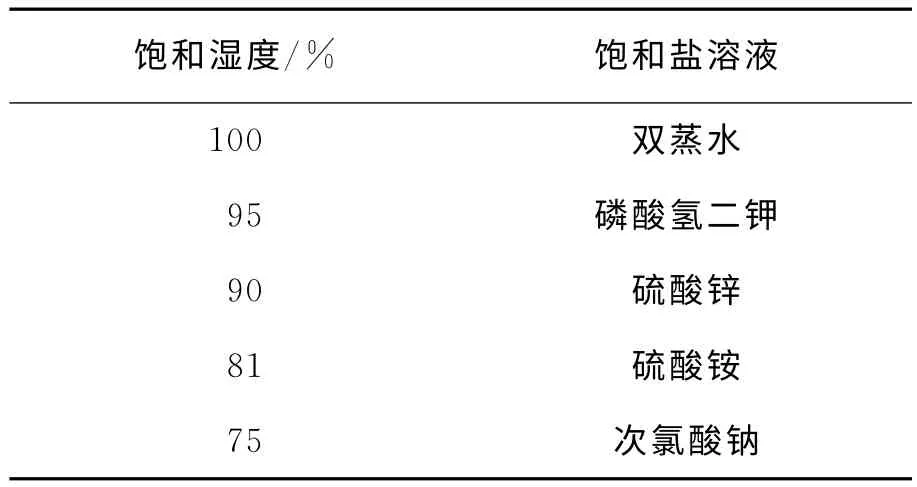
表1 不同饱和盐控制的相对湿度表
配置2×107个·mL-1蜡蚧轮枝菌孢子悬浮液(含0.1%吐温-80),摇匀后取20μL涂布于含沙氏培养基的载玻片上,利用30℃恒温培养箱培养。每个湿度分别设置3个重复,每4h观察一次孢子萌发率,每次观察的孢子数不少于300个,每个处理设置3次重复。
1.2.2 不同浓度孢子悬浮液对螺旋粉虱若虫的侵染力
生物测定参照张仙红[12]喷雾法,将系列梯度浓度的孢子悬浮液用猴头喷雾器喷于3龄若虫整齐的新鲜石榴叶片上,至叶片表面湿润,将叶片保湿后放入30℃恒温气候箱中。培养48h后,每隔24h检查1次感病症状和侵染数量,直至第7天为止,每个处理300头虫,每个处理3个重复,记录螺旋粉虱虫体长出白色菌丝或表面有灰色颗粒状的虫数。
2 结果与分析
2.1 分生孢子萌发条件结果
2.1.1 温度对分生孢子萌发的影响温度对孢子萌发的影响见表2。
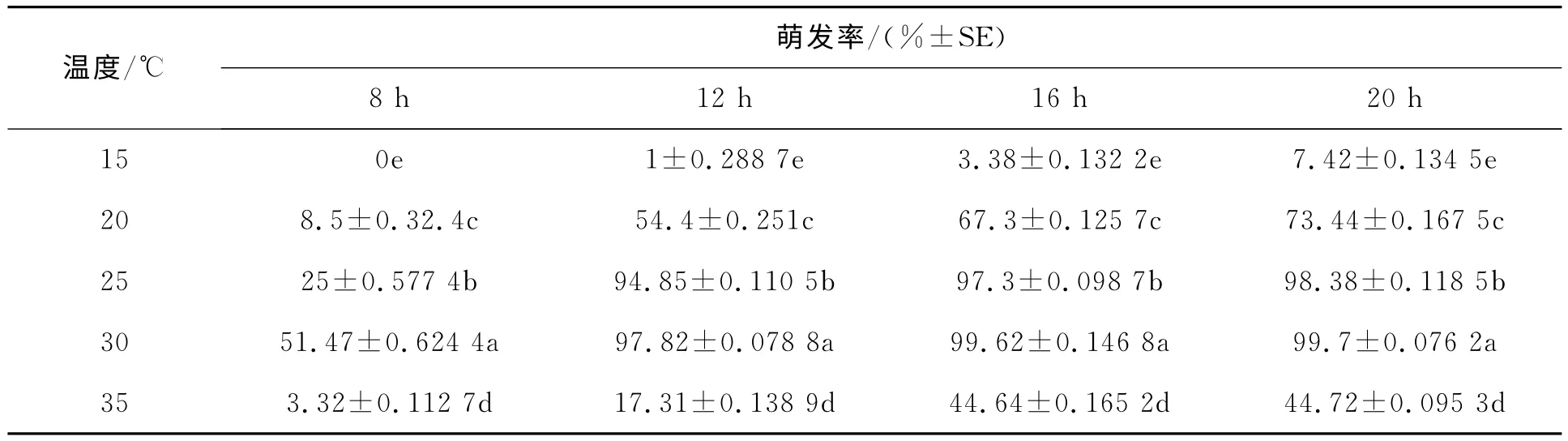
表2 温度对孢子萌发的影响
结果表明,在相同湿度和营养的条件下,15~35℃之间孢子均能萌发,萌发率大小如下:30℃>25℃>20℃>35℃>15℃,且各温度梯度差异显著。在25~30℃之间,12h时孢子萌发率均达到了94%以上,孢子萌发速率快且整齐。综上所述,适宜孢子萌发温度为25~30℃,最适温度为30℃。
2.1.2 营养对分生孢子萌发的影响
不同营养对分生孢子萌发的影响见表3。

表3 营养物质对孢子萌发的影响
结果表明,不同的营养物质对孢子萌发影响较大,随着培养时间的延长,孢子萌发率逐渐递增。16h时,4种营养液中沙氏培养基孢子萌发率最高达到99.63%,20h时,无菌水孢子萌发率达到70.63%,1%葡萄糖萌发率仅达到58.38%。因此,最适宜孢子萌发的营养物质为沙氏培养基,葡萄糖对孢子萌发有一定的抑制作用。
2.1.3 湿度对分生孢子萌发的影响
湿度对分生孢子萌发的影响见表4。
结果表明,在相同温度和营养条件下,相对湿度对孢子萌发的影响较大,孢子萌发率随着湿度的下降而降低。饱和湿度下,16h孢子萌发率达到99.4%,而且孢子萌发快速且整齐。相对湿度在85%以上时,孢子萌发率均在85%以上;当相对湿度为53%时,20h孢子萌发率仅为7.33%。随着湿度的降低,延长了孢子的萌发时间,降低了孢子萌发率。
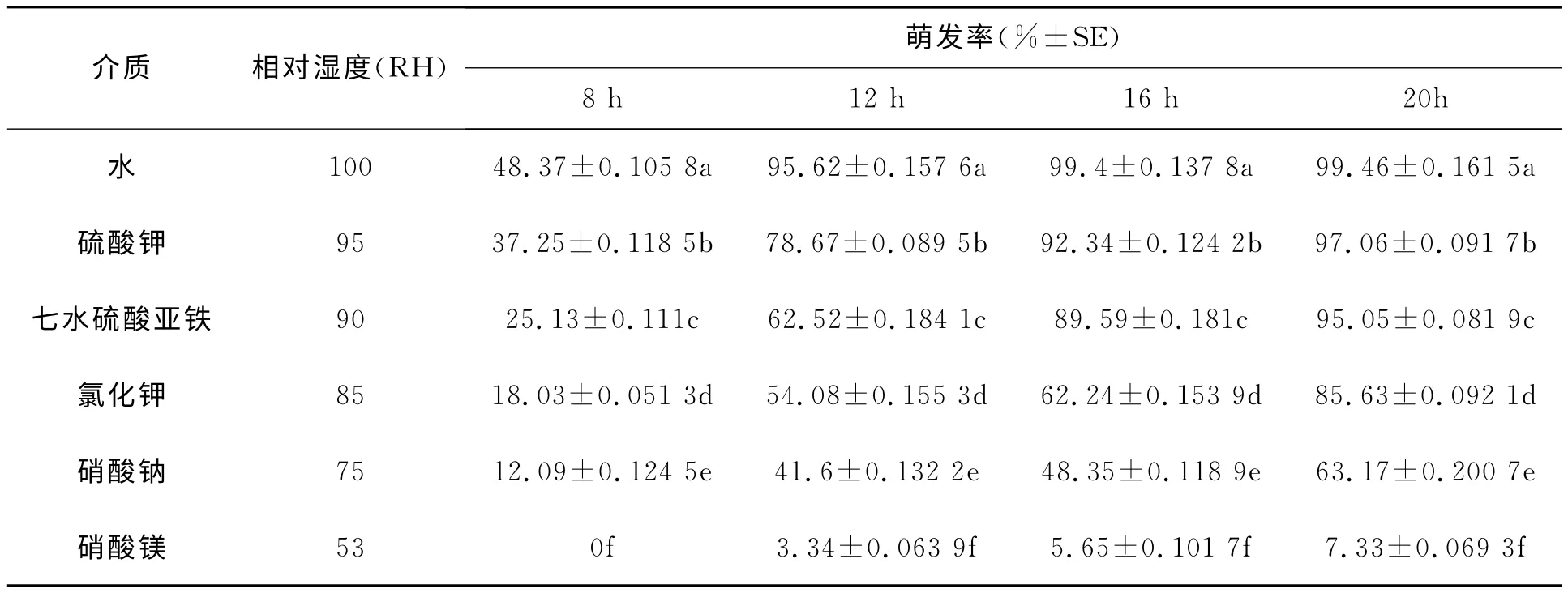
表4 湿度对孢子萌发的影响
2.2 不同浓度孢子悬浮液对螺旋粉虱若虫的侵染力
蜡蚧轮枝菌对螺旋粉虱的致病力如图1所示。
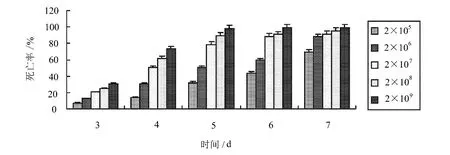
图1 蜡蚧轮枝菌对螺旋粉虱的致病力
由图1可以看出,接种5d后,2×109孢子·mL-1对螺旋粉虱3龄虫致死率达到98.18%,其它4个浓度的孢子悬浮液致死率均在90%以下;7d时,除2×105孢子·mL-1的致病性低于70%以外,其它浓度的致病性均达到85%以上,其中2×109孢子·mL-1螺旋粉虱的死亡率达到99.39%。因此,不同浓度孢子悬浮液对螺旋粉虱的致病性随着有效侵染时间的延长逐渐增强。
3 结论与讨论
蜡蚧轮枝菌分生孢子的萌发率决定菌株的致病性,只有透彻研究孢子萌发条件才能提高该菌株侵染的机率[13-14]。蜡蚧轮枝菌孢子萌发适宜温度为25~30℃,与昆明菌株KM9803的适宜产孢温度基本一致[15-16],在适宜的温度范围内孢子萌发快速而集中,为以后的实际应用奠定了理论基础。湿度是影响蜡蚧轮枝菌毒力的关键因子之一,直接影响孢子在昆虫体表萌发和侵染时间,从而影响蜡蚧轮枝菌致病性。当湿度逐渐增大时,孢子萌发率随着时间的延长而显著递增。冯明光[17]等研究发现,将蜡蚧轮枝菌分生孢子在高湿条件下保存后转移到70%湿度下保存,孢子萌发率显著降低。综上所述,高温高湿有利于提高蜡蚧轮枝菌孢子萌发率和致病性[18]。
蜡蚧轮枝菌分生孢子液对螺旋粉虱若虫有很好的杀虫效果,2×107~2×109孢子·mL-1有很好的速效性,2×105和2×106孢子·mL-1有很好的持效性,与蜡蚧轮枝菌对桃蚜的侵染力结果一致[19]。蜡蚧轮枝菌分生孢子浓度为3×107孢子·mL-1时,对温室白粉虱的防治效果在58%~60%,对螺旋粉虱的防治效果可以达到69%~85%,该菌株防治螺旋粉虱的效果明显高于对温室白粉虱的防治效果[20]。实验中发现蜡蚧轮枝菌可以侵染刚羽化的螺旋粉虱成虫,说明蜡蚧轮枝菌不仅对螺旋粉虱若虫有致病性,对成虫也有致病性,但是对成虫的致病性没有进行详细的研究,有待进一步完善。
蜡蚧轮枝菌对寄主的易感性可能与寄主昆虫表皮的结构和成分有关。表皮的成分对蜡蚧轮枝菌的致病性有很大的影响,如几丁质、长链脂肪酸、N-乙酰氨基酸葡萄糖、淀粉等可以促进孢子的萌发,但是癸酸和辛酸等物质可以抑制孢子的萌发。昆虫不同的发育阶段影响蜡蚧轮枝菌的致病性,随着昆虫虫龄的不断提高,表皮的骨化程度逐渐增强,蜡蚧轮枝菌的侵入速度也会逐渐减慢,从而降低了寄主昆虫对蜡蚧轮枝菌的易感性[21-25]。
文中没有研究紫外线对孢子萌发的影响,在田间使用时可能会影响对螺旋粉虱的防治效果,将在以后的试验中进一步补充;蜡蚧轮枝菌对螺旋粉虱若虫的致病性很高,对螺旋粉虱卵和蛹的致病性没有做深入的研究,设计蜡蚧轮枝菌分生孢子侵染力的试验时,没有研究表面活性剂对致病性的增效作用,蜡蚧轮枝菌应用时的施菌方式、施用时间、剂型及菌药联用的效果等均需进一步研究。
[1] 徐岩.警惕螺旋粉虱传入中国[J].植物检疫,1999(4):41-45.
[2] Russell L M.A new species of aleurodicus douglas and two close relatives(Homoptera:Aleyrodidae)[J].Fla Entmol.,1965,48:47-55.
[3] 李国寅,艾怡雯,王伟,等.海南岛螺旋粉虱寄主植物新记录种调查[J].热带作物学报,2010(4):655-660.
[4] 王克勤,刘春来,于振民,等.蜡蚧轮枝菌防治温室白粉虱应用研究[J].黑龙江农业科学,1999(5):9-11.
[5] Ghewande M P.Biological control of groundnut rust in India[J].Tropical Pest Management,1990(1):17-20.
[6] HallR A.Control of aphids by the fungus,Verticillium lecanii:effeet of spore concentration[J].Entomologica Experimentaet Applicata,1980(27):1-5.
[7] Williams M E D,Edmondson R N,Gill G.The potential of some adjuvants in promoting infection with verricillium lecanii:laboratory bioassays with myzus persicae[J].Annals of Applied Biology,2000,137(3):337-345.
[8] 缪森.蜡蚧轮枝菌对温室白粉虱和桃蚜的致病性的初步研究[D].北京:中国农业大学,2004.
[9] 罗小刚.一种重要的昆虫病原真菌一蜡蚧轮枝孢V.lecanii[J].贵州农业科学,1988(1):57-64.
[10] 石艳华,吴伟坚,符悦冠.螺旋粉虱成虫复眼形态及其内部结构[J].环境昆虫学报,2010,32(1):41-46.
[11] 方仲达.致病研究方法[M].3版.北京:中国农业出版社,1998:343-344.
[12] 张仙红,贺运春,王建明,等.蜡蚧轮枝菌对害虫致病性的初步研究[J].植物保护,2001,27(1):44-46.
[13] Chouvenc T,Su N Y,Robert A.Cellular encapsulation in the eastern subterranean termite,Reticulitermes flavipes(Isoptera),against infection by the entomopathogenic fungus Metarhizium anisopliae[J].J.Invertebr.Pathol.,2009,101(3):234-241.
[14] Khaehatourians G G.Bioehemistry and molecular biology of entomopathoogenic fungi[J].In The MycotaV1.(ED.Miler,J.D.).SPringe-Verlag:Berlin Heidelberg,1996:331-363.
[15] 张亚平,周天雄,杨美林.湿度对蜡蚊轮枝菌KM9803菌株芽生孢子及分生孢子萌发的影响[J].云南农业大学学报,2006,21(2):243-245.
[16] 刘召,雷仲仁,花保祯,等.烟粉虱感染白僵菌后的组织病理变化[J].植物保护,2006,32(3):52-54.
[17] 冯明光,李增智.轮枝孢及其应用有害生物的微生物防治原理与技术[M].武汉:湖北科学技术出版社,1995:256-263.
[18] 孟艳琼.蜡蚧轮枝孢的生物学特性及防治温室桃蚜的研究[D].合肥:安徽农业大学,2003:35-45.
[19] 李国霞,郭友中,茅洪新,等.应用蜡蚧轮枝菌对大棚蔬菜蚜虫防治效果的研究[J].中国病毒学,2000,15:262.
[20] 洪华珠,武觑文.致病病理学.昆虫真菌学[M].合肥:安徽科学技术出版社,1996:93-110.
[21] 张爱文,邓春生,农向群,等.亚洲玉米螟感染白僵菌后组织病理学研究[J].生物防治通报,1994,10(4):151-156.
[22] 宋玉梅,王云滨,李瑞军,等.甜菜夜蛾感染白僵菌、绿僵菌后的病症及组织病理学变化[J].华北农学报,2006,21(B11):171-174.
[23] 张艳梅,谢映平,薛皎亮,等.油松毛虫受白僵菌感染的组织病理学变化[J].昆虫学报,2011,54(5):531-539.
[24] 王音,雷仲仁,张青文,等.小菜蛾感染绿僵菌后的病征及组织病理变化[J].中国生物防治,2004,20(3):156-160.
[25] 郑丽霞,吴伟坚,符悦冠.螺旋粉虱成虫触角的感器[J].昆虫知识,2012,47(3):525-528.

