1,1,2,3,3,3-六氟丙基氢氟醚制备研究进展
张勇耀 徐卫国 赵卫娟
(浙江省化工研究院有限公司,浙江 杭州 310023)
1,1,2,3,3,3-六氟丙基氢氟醚制备研究进展
张勇耀 徐卫国 赵卫娟
(浙江省化工研究院有限公司,浙江 杭州 310023)
对1,1,2,3,3,3-六氟丙基氢氟醚的制备研究进行了综述,反应选择性和产物后处理是研究的重点。
六氟丙基氢氟醚;选择性;催化剂;后处理
0 前言
1,1,2,3,3,3-六氟丙基氢氟醚是一大类含氟精细化学品,其中比较有代表性的化合物有CF3CHFCF2OCH3、CF3CHFCF2OCH2CH3、CF3CHFCF2-OCH2CF3等脂肪族氢氟醚和以虱螨脲、多氟脲为代表的芳香族氢氟醚。其中脂肪族六氟丙基氢氟醚(以下简称六氟丙基氢氟醚)可以作为清洗剂[1]、溶剂[2]、发泡剂[3]、热交换介质[4]等,尤其是近年来随着电动汽车的普及和锂电池技术的发展,该类六氟丙基氢氟醚更被视作高容量锂电池的优良电解质溶剂[5-7],因此,六氟丙基氢氟醚具有广阔的市场前景。
1 六氟丙基氢氟醚的合成
六氟丙基氢氟醚的主要合成方法有以下几种:1)氟气或金属氟化物对醚类化合物的氟化;2)醚化合物的电化学氟化;3)醇在碱存在条件下,与卤代烃反应得到氢氟醚;4)醇与六氟丙烯在催化剂作用下进行加成反应。
方法1)生产过程中产生HF,腐蚀性大,对反应设备要求苛刻。方法2)能耗高,并且收率低。方法3)虽然可以采用,但大多数反应时间长,反应温度高,收率低,产生三废量大。唯有方法4)工艺简单,收率较高,原子经济性好,它是工业化的较为理想的方法,也是目前普遍采用的方法。在此方法的基础上,前人对六氟丙基氢氟醚合成已经有了较多的研究,目前研究使用的催化剂主要有强碱、碱金属氟化物、碱金属盐与离子液体的复配物和零价钯膦配体类化合物。但是到目前为止,工业化生产的选择性问题仍然没有得到较好的解决,在合成六氟丙基氢氟醚的同时,总是有五氟丙烯基醚产生。
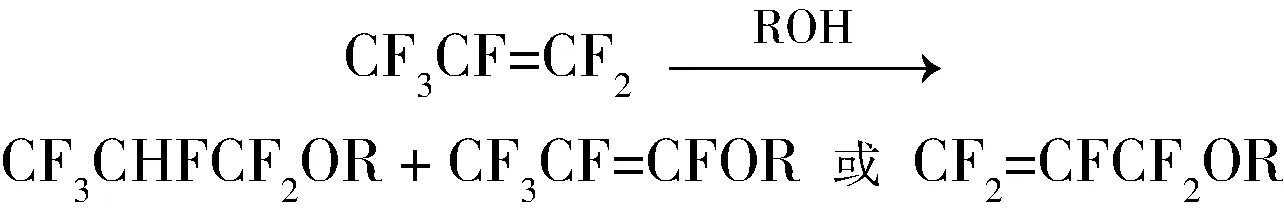
1.1 以强碱为催化剂
1.1.1 以碱金属氢氧化物为催化剂
早期合成六氟丙基氢氟醚使用的主要催化剂是碱金属氢氧化物,反应以RO-模式进行。
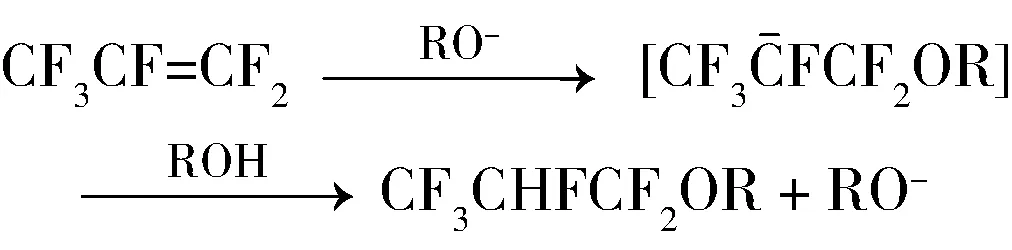
1953年,前苏联Knunyants等[8]报道了六氟丙烯在高压釜中、在氢氧化钾的作用下于50~60 ℃加热,与各类醇反应,制备系列1,1,2,3,3,3-六氟丙基氢氟醚,其中1,1,2,3,3,3-六氟丙基甲基醚的收率为83.0%,1,1,2,3,3,3-六氟丙基乙基醚的收率为79.3%,同时,研究发现有五氟丙烯基醚产生。另外,通过比较发现,随着醇的位阻增加,醚的收率逐渐下降。1976年,上海有机所报道[9]在温度为-40~-30 ℃的条件下,六氟丙烯与KOH-CH3OH体系反应可以得到几乎等当量的1,1,2,3,3,3-六氟丙基甲基醚。
2002年,Murata等[10]认为增加质子性溶剂的量有利于提高反应的选择性,所以他们向体系中加入水。反应如下:将0.1 mol三氟乙醇、0.1 mol氢氧化钾、50 mL水加入到高压釜中,氮气置换气体,室温下通入0.75 mol六氟丙烯进行反应,压力≤0.5 MPa,氢氟醚收率(以三氟乙醇计)可达96%,选择性≥97%。研究者还在等当量的氢氧化钾水溶液中验证了系列氢氟醚的稳定性,结果认为氢氟醚在氢氧化钾水溶液中是稳定的,因此判断不饱和的五氟丙烯基醚在反应中以下式中的途径2方式产生的,而不是在KOH作用下氢氟醚再脱HF产生的。

在使用氢氧化钾或者氢氧化钠作为催化剂的基础上,中国研究人员对反应溶剂进行了研究。滕刚等[11]报道使用强极性的N,N-二甲基甲酰胺或二甲基砜作溶剂,2,2,2-三氟乙基-1,1,2,3,3,3-六氟丙基醚的收率达到94.2%。王军等[12]报道选用二氯甲烷、氯仿、N,N-二甲基甲酰胺、二甲基砜、乙腈、丙腈作溶剂,其关键在于选择合适的溶剂量,最优的溶剂与底物的量比为六氟丙烯∶ 醇∶ 溶剂=1∶ 1∶ 9.7~10.2,溶剂量过大或者过小均对反应不利。兰喜平等[13]报道使用相对较小极性、沸点适中的丙酮、四氢呋喃、甲基四氢呋喃和吡啶作为溶剂,该法收率高,溶剂回收容易。
另外,魏宣等[14]报道还有研究人员对反应温度进行了选择,以强碱为催化剂,无溶剂,优选110~180 ℃的较高温度,其中得到的1,1,2,3,3,3-六氟丙基甲基醚收率(以六氟丙烯计)达99%,经过精馏后1,1,2,3,3,3-六氟丙基甲基醚纯度达99.9%以上。
1.1.2 以醇钠为催化剂
研究者还使用醇钠尝试催化反应。Bargamova等[15]报道将2.3 g钠溶于16 g甲醇中,通入23.5 g六氟丙烯,得到1,1,2,3,3,3-六氟丙基甲基醚的收率为56%,另外,有2,3,3,3-四氟丙酸甲酯和1,3-或者1,1-二甲氧基取代的2-氢氟代丙烷副产物生成。
Nguyen Thoai等[16]在由六氟丙烯制备α-氟代丙烯酸酯的中间体2,3,3-三氟烯丙醇中叙述了以乙醇钠为催化剂通过六氟丙烯与乙醇反应制备1,1,2,3,3,3-六氟丙基乙基醚。如在反应器中加入40 mL无水乙醇,2 g乙醇钠(87 mmol),将反应器冷却到-70 ℃,加入18 g(120 mmol)六氟丙烯,温度逐渐上升到20 ℃反应1 h,产物加入到150 mL冷水中,分离蒸馏得到23 g产品。
1.2 以碱金属氟化物为催化剂
在氢氟醚的制备过程中,有研究者认为醇在以强碱作催化剂条件下生成的RO-对水较为敏感,不利于转化率提高。所以提出用碱金属氟化物来催化本反应,这样无须使醇转化为RO-来反应,且催化剂易于分离。
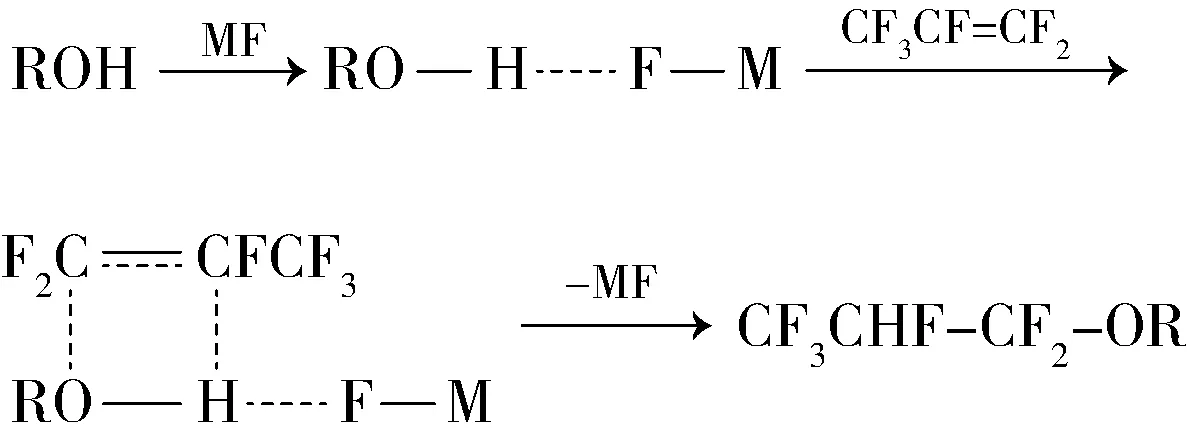
John D. Watson[17]以碱金属氟化物为催化剂制备氢氟醚,使用一定量的碱金属氟化物,在常温常压下即可催化反应,且反应可以使用水溶液。如300 mL(237 g)乙醇、2 g KF(溶于25 mL水中)置于1 L反应瓶中,间歇加入150 g六氟丙烯,最后水洗分离得到1,1,2,3,3,3-六氟丙基乙基醚130 g,六氟丙烯的转化率为71.5%。采用相同方法合成1,1,2,3,3,3-六氟丙基甲基醚,则转化率为83%。
2008年,Natalia等[18]研究了2,2,2-三氟乙基-1,1,2,3,3,3-六氟丙基醚的合成,以KF为催化剂,在乙腈溶液中n(三氟乙醇) ∶n(六氟丙烯)为1∶2,室温下反应1 h,转化率为85.3%,选择性高达97.2%。他们还深入研究了碱金属氟化物催化该反应的机理,提出:1)通过比较认为,碱金属氟化物在溶液中的解离度或者碱金属氟化物阳离子大小是决定反应选择性的关键(一般情况下碱金属氟化物阳离子越大,在有机溶剂中碱金属氟化物的溶解度和解离度越大),应该选择中等大小阳离子或者解离度的碱金属氟化物。KF是合成2,2,2-三氟乙基-1,1,2,3,3,3-六氟丙基醚转化率和选择性最佳的碱金属氟化物,LiF、NaF不能催化反应,RbF、CsF则导致产生大量烯烃副产物;2)溶剂对反应转化率影响较大,溶剂极性大则碱金属氟化物在溶剂中溶解度大,则反应转化率高,但是选择性低;溶剂极性小则碱金属氟化物在溶剂中溶解度小,则反应转化率低,选择性升高;3)六氟丙烯在碱金属氟化物作用下可以加成HF产生HFC-227,而且由于此反应仍可以部分RO-模式进行从而导致烯醚的产生,但是可以通过控制碱金属阳离子浓度来减少此副反应。
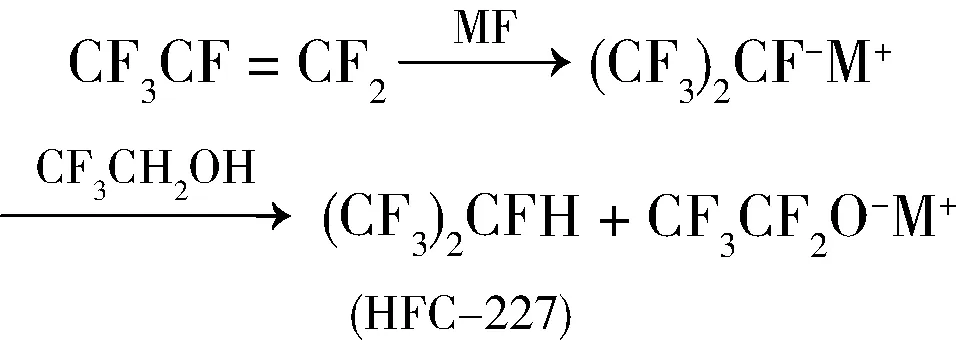
1.3 以碱金属盐与离子液体的复配物为催化反应体系
近年来,研究者尝试用离子液体来催化本反应。日本Matsukawa[19]报道三氟乙醇和六氟丙烯在1-乙基-3-甲基咪唑鎓四氟硼酸盐中于65 ℃反应13 h,得到收率为61%的目标产物,延长反应时间可以提高收率,但是长达7天的反应,收率也只能提高到84%。
2009年,韩国团队Kang等[20]又报道了钾盐和1-丁基-3-甲基咪唑鎓氯化盐([BMIm]Cl)混合物对合成2,2,2-三氟乙基-1,1,2,3,3,3-六氟丙基醚的影响,其中单一的[BMIm]Cl并不能有效地催化反应,而钾盐中具有碱性的盐(如K3PO4、K2HPO4、n-BuOK)可以催化反应但是选择性较差。选用碱性的K3PO4和[BMIm]Cl进行复配,结果在[BMIm]Cl的作用下,氢烷基化反应副产物烯烃的产生大大减少,同时,研究还认为钾离子是产生烯烃的重要原因。反应机理如下:
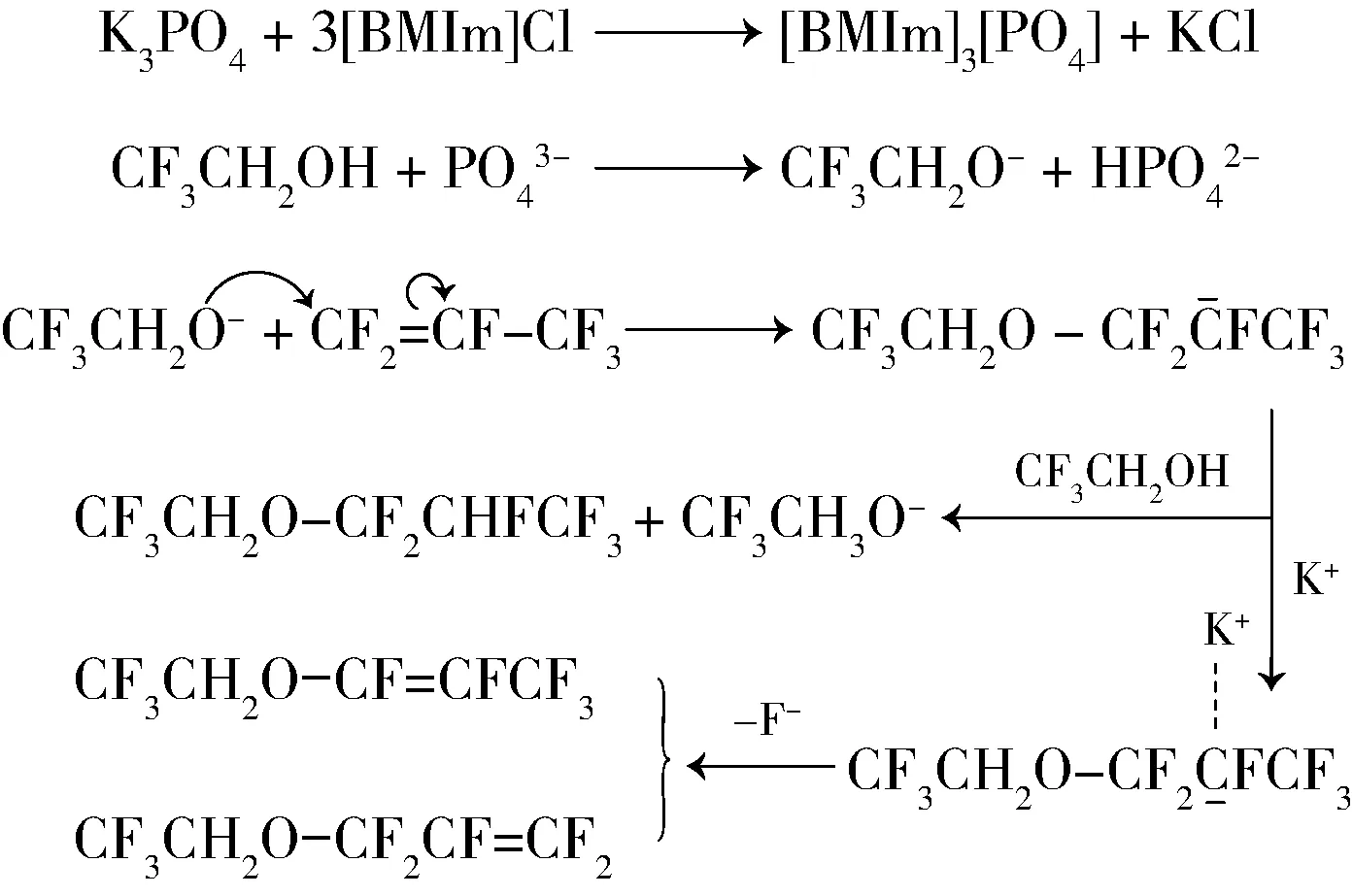
Lee等[21]公布的专利中,在碱金属磷酸盐和卤化胺盐存在条件下合成氢氟醚,其中10 g三氟乙醇、0.21 g K3PO4、0.35 g 1-甲基-3-丁基咪唑鎓氯化盐溶于10 mL N, N-二甲基乙酰胺中,通入7.5 g六氟丙烯,25 ℃下搅拌反应30 min,经气相色谱分析,2,2,2-三氟乙基-1,1,2,3,3,3-六氟丙基醚的收率达98%。
而在另一项研究中,Kim[22]报道了不同取代基的咪唑离子液体对于反应的影响,实验发现以取代咪唑醋酸盐的催化效果最为理想,且不用加入碱金属盐即可在温和条件下催化反应。当咪唑环上取代基为给电子基团时,咪唑环电子云密度升高,与醋酸根负离子电荷作用减弱,使醋酸根负离子更容易从ROH获得氢离子,从而使ROH转变为RO-,进一步与六氟丙烯反应生成CF3CF-CF2-OR。另外,咪唑环电子云密度升高,使咪唑环更加不容易从CF3CF-CF2-OR夺取F-,因此,反应转化率和选择性均得到提高。但是,使用本类催化剂存在很大的不足,就是需要远高于醇的用量(物质的量)的催化剂才能获得较好的结果。
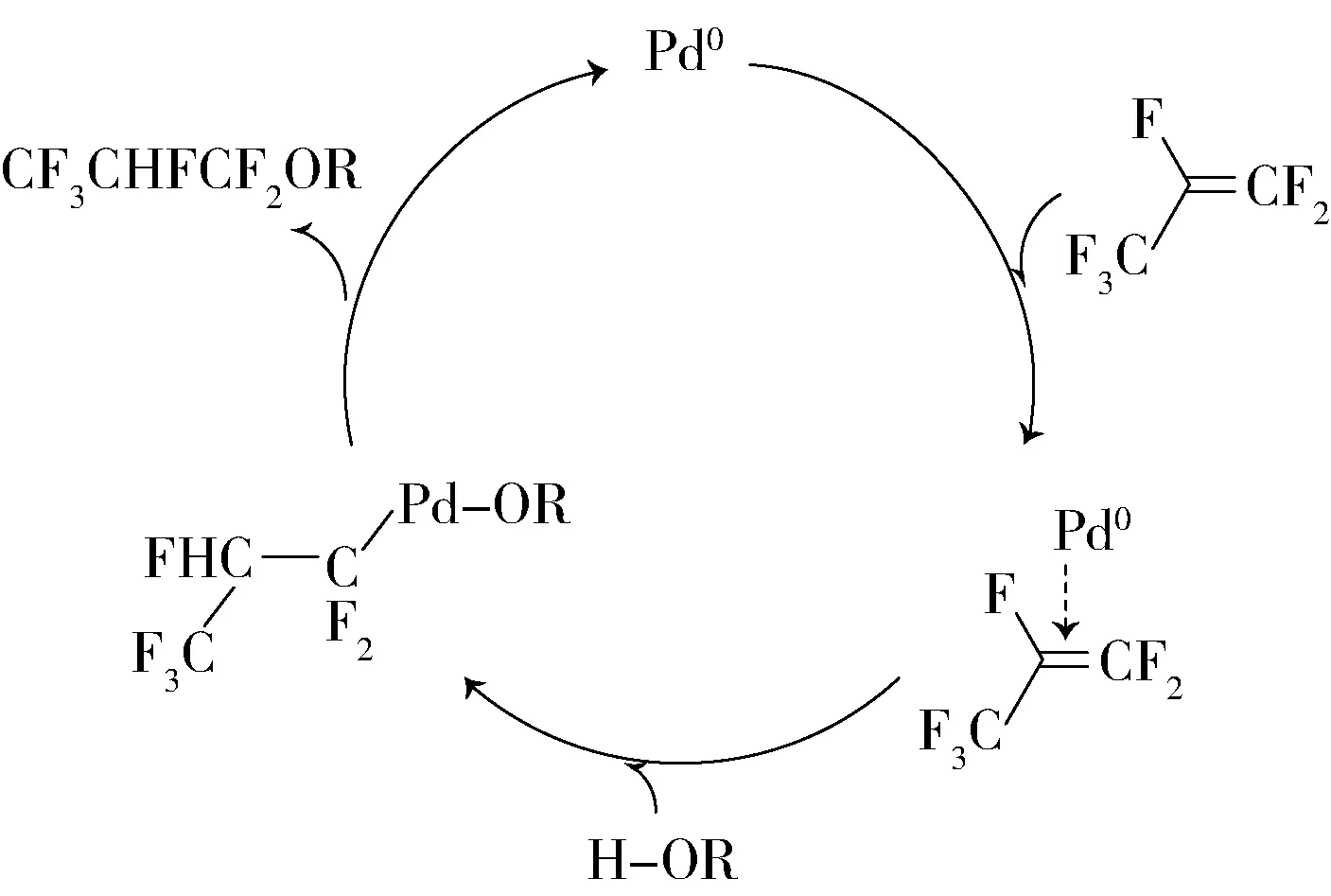
1.4 以零价钯膦配体类化合物为催化剂
鉴于强碱和碱金属氟化物选择性不佳的情况,Matsukawa等[23]探索以Pd0膦配体为催化剂,在中性条件下催化六氟丙烯与醇反应,反应不形成烯醚副产物,其中Pd(PPh3)4为最佳催化剂。反应在一般情况下酸性醇的收率较高,而弱酸性醇收率中等,但是用1,4-双(二苯基膦)丁烷(dppb)作为助催化剂可以提高弱酸性醇反应的收率。如在物质的量分数为5%的Pd(PPh3)4和10%的dppb催化下,于室温下,15 mL乙腈中2 mmol乙醇与过量的六氟丙烯反应得到1,1,1,2,3,3-六氟丙基乙基醚,收率为78%。
2 反应产物后处理研究
鉴于六氟丙基氢氟醚不理想的选择性,为了获得高纯度的六氟丙基氢氟醚,研究人员对于其反应粗品的后处理也进行了研究。
合成六氟丙基氢氟醚的产物中,主要的杂质有低沸点的CF3CFCF3(HFC-227)、CF3CHF=CF-OR或者CF2=CFCF2-OR和高沸点的C3HF5(OR)2等,其中CF3CF=CF2-OR或者CF2=CFCF2-OR与产物沸点十分接近,因此,产品精馏时存在极大的分离难度。所以,产品精馏前需要特殊处理,才能除去该杂质。
1953年,Knunyants等[24]报道了精馏前用溴处理粗品,其中烯醚杂质转化为CF3CFBrCFBrOR(CF2BrCFBrCF2-OR)高沸物。
显然,用溴处理粗品成本是比较高的,所以日本Okamoto等[25]采取氯气处理粗品的方式。液相除杂质时,在高压汞灯照射下,通入氯气,水洗处理后,精馏粗品。GC(气相色谱)分析精品中无烯醚杂质存在,产品纯度可达99.9%。气相除杂质时,在装有活性炭催化剂的反应管中,通入粗品和氯气的混合气体,150 ℃反应,冷却收集粗品,水洗处理后,精馏。GC分析精品中无烯醚杂质存在,产品纯度可达99.9%。
2010年,韩国Lee等[26]公布了一种制备高纯氢氟醚的方法,其中包括除去粗品中大约9.9%的烯醚的方法:粗品用正己胺处理,精馏后氢氟醚精品中不含杂质烯醚,该方法可以替代使用溴处理粗品的方法。
3 结语
从文献来看,在1,1,2,3,3,3-六氟丙基氢氟醚选择性问题中,通过离子液体或者零价钯膦配体催化是降低反应产生难分离烯醚含量的有效途径,但是离子液体投料量大、难回收,而贵金属钯价格昂贵且使用条件苛刻,不利于工业化生产。
而用强碱或者碱金属氟化物催化的方法,虽然经过多年来的不断优化,但是结果依然不甚理想。但是由于该催化剂价格低廉,对设备要求低,是工业化的较为理想的途径。
目前,采用强碱方式催化,需要解决的问题如下:1)降低烯醚的产生;2)依照Murata的理论,水有助于降低烯醚的产生,那么需要思考如何降低水对RO-活性的影响以及尽量避免产物与水进一步反应生成酯。
如果采用碱金属氟化物催化,则存在如下问题:1)六氟丙烯在碱金属氟化物作用下会加成HF,形成HFC-227杂质;2)碱金属氟化物依然不能避免少量以RO-途径形成的CF3CF-CF2-OR碳负离子,因此,也有可能形成少量烯醚;3)若以Natalia等所述选用KF为催化剂,如Kang等所述K+离子是形成烯醚的主要原因,需要将游离的K+离子控制在较低的含量,但是反应液中较低水平的碱金属氟化物浓度,必然导致反应时间延长,可能造成转化率偏低。
高选择性的反应能够有效降低反应粗品中烯醚的含量,为后续提纯降低不少难度。但是强碱或者碱金属氟化物催化的方法无论如何都难以避免产生与氢氟醚难以分离的烯醚,对于可能应用于锂电池电解液方面的高纯氢氟醚来说,这是极其不利的。所以,高纯氢氟醚制备还需要解决的问题是探索采用尽量环保廉价的方式处理粗品,除去其中的烯醚。
在已有研究的基础上,进一步研究适合工业化的高选择性与高转化率的催化体系对制备1,1,2,3,3,3-六氟丙基氢氟醚依然是十分必要的。此外,环保、廉价地除去粗品中的烯醚也将为1,1,2,3,3,3-六氟丙基氢氟醚在锂电池领域的应用打开便捷之门。
[1]Hiaki T, Murata J J, Urata S, et al. Azeotropic composition containing fluorine ether and alcohol as cleaning solution for electronic, mechanical and plastic parts: JP, 2002180280[P]. 2002-06-26.
[2]Du L B, DeSimone J M, Roberts G W. Fluoropolymer Synthesis in carbon dioxide- expanded liquids: a practical approach to avoid the use of perfluorooctanoic acid[J]. ACS Symposium Series, 2009, 1006 (Gas-Expanded Liquids and Near-Critical Media): 259-273.
[3]Uenveren E, Marhold M, Eicher J M, et al. Methods of using a solvent or a foam blowing agent: WO, 2009019219[P]. 2009-02-12.
[4]Nishiguchi A, Okamoto S, Sakyu F. Heat- transfer media, and their usage for heat- transfer units and absorption- type heat pump system: JP, 2014005419[P]. 2014-01-16.
[5]Takase H. Separator for rechargeable lithium battery, and electrode structure and rechargeable lithium battery including the same: US, 20130040185 [P]. 2013-02-14.
[6]Iwaya M, Onozaki Y. Nonaqueous electrolyte solution for secondary batteries and lithium ion secondary battery: WO, 2013183719[P]. 2013-12-12.
[7]Yokotsuji H, Takase H. Electrolyte for rechargeable lithium battery and rechargeable lithium battery including the same: US, 20140154591[P]. 2014-06-05.
[8]Knunyants I L, German L S, Dyatkin B L. Addition reactions of perfluoro.ovrddot. olefins. VI. Reaction of perfluoroisobutylene and perfluoropropylene with ucleophilic reagents[J]. Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya, 1956: 1353-1360.
[9]Shanghai Institute of Organic Chemistry. Reactions of water, methanol, alkali and hydrogen peroxide with perfluoropropylene epoxide and with perfluoropropylene[J]. Huaxue Xuebao, 1976, 34(1): 53-58.
[10]Murata J J, Tamura M, Sekiya A. Selective synthesis of fluorinated ethers by addition reaction of alcohols to fluorinated olefins in water [J]. Green Chemistry, 2002, 4(1): 60-63.
[11]滕刚, 李同信, 刘菲, 等. 新型氢氟醚及其制备方法: 中国, 1651378[P]. 2005-08-10.
[12]王军, 马慧荣, 王汉利. 一种氢氟醚的制造方法: 中国, 103739450[P]. 2014-04-23.
[13]兰喜平, 周强, 胡正, 等. 一种氢氟醚的制备方法: 中国, 201310162297[P]. 2013-05-03.
[14]魏宣, 王铁彬, 杨华杰. 一种氢氟醚的合成方法: 中国, 102115428[P]. 2011-07-06.
[15]Bargamova M D, Cheburkov Y A, Dyatkin B L, et al. Interaction between perfluoropropylene and methanol at atmospheric pressure[P]. Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya, 1967, 3: 611-614.
[16]Nguyen T, Wakselman C. Conversion of hexafluoropropene into 2, 3, 3- trifluoroallyl alcohol as precursor of α- fluoroacrylates[J]. Journal of Fluorine Chemistry, 1995, 74(2): 273-277.
[17]Watson J D. Catalytic preparation of fluoroethers: US, 3291844[P]. 1966-12-13.
[18]Natalia D, Nguyen D Q, Oh J H,et al. Fluoride-catalyzed hydroalkoxylation of hexafluorop ropene with 2, 2, 2- trifluoroethanol[J]. Journal of Fluorine Chemistry, 2008, 129(6): 474-477.
[19]Matsukawa Y, Tamura M, Sekiya A. Preparation of fluoro ethers without strong base catalysts and volatile solvents: JP, 2006256967[P]. 2006-09-28.
[20]Kang J E, Lee J S, Kim D S, et al. Ionic liquid- assisted hydroalkoxylation of hexafluoropropene with 2, 2, 2- trifluoroethanol: A Mechanistic Consideration [J]. Journal of Catalysis, 2009, 262(1): 177-180.
[21]Lee H J, Lee S D, Yoo G S , et al. Method for the preparation of fluorine- containing ether: KR, 2009131049[P]. 2009-12-28.
[22]Kim J H, Kwak S J, Lee J S, et al. Ionic liquid- catalyzed selective production of hydrofluoroether: Synthesis of a third generation CFC alternative, CF3CH2OCHFCF2CF3[J]. Applied Catalysis, B. Environmental, 2009, 89(1-2): 137-141.
[23]Matsukawa Y, Mizukado J J, Quan H D, et al. Palladium(0) - catalyzed hydroalkoxylation of hexafluoropropene: Synthesis of hydrofluoroethers under neutral conditions [J]. Angewandte Chemie, International Edition, 2005, 44(7): 1128-1130.
[24]Knunyants I L, Shchekotikhin A I, Fokin A V. Addition reactions of fluoro.ovrddot.olefins. II. Addition of alcohols and thiols to perfluoropropylene[J]. Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya, 1953: 282-289.
[25]Okamoto H, Shimizu T. Method for processing fluorinated alkyl ether: WO, 2006123563[P]. 2006-11-23.
[26]Lee H J, Kim D S, Min B G, et al. Method for the preparation of fluorine- containing ether: KR, 2010138245[P]. 2010-12-31.
Research Progress in the Preparation of1,1,2,3,3,3-Hexafluoropropyl Ether
Zhang Yongyao, Xu Weiguo, Zhao Weijuan
(Zhejiang Chemical Industry Research Institute Co., Ltd., Hangzhou 310023, China )
Preparation of 1,1,2,3,3,3-hexafluoropropyl ether was reviewed. Selectivity and post-treatment were the focus of the research.
hexafluoropropyl ether; selectivity; catalyst; post-treatment
张勇耀(1985—),男,工程师,主要从事含氟精细化学品的研究开发工作。
专论与综述

