2,3-二氯-5-三氯甲基吡啶的合成及应用进展
张 迪 于万金 林胜达 王术成 王久菊 刘武灿 张建君
(浙江省化工研究院 国家ODS替代品工程技术研究中心 浙江省化工新材料重点实验室,浙江 杭州 310023)
2,3-二氯-5-三氯甲基吡啶的合成及应用进展
张 迪 于万金 林胜达 王术成 王久菊 刘武灿 张建君
(浙江省化工研究院 国家ODS替代品工程技术研究中心 浙江省化工新材料重点实验室,浙江 杭州 310023)
综述了国内外2,3-二氯-5-三氯甲基吡啶的合成技术及研究进展,并对各合成工艺进行了分析,认为吡啶衍生物氯代法具有原料廉价、操作简易、后处理便捷等优点,便于进行大规模工业化生产;介绍了2,3-二氯-5-三氯甲基吡啶在农药领域的应用。
2,3-二氯-5-三氯甲基吡啶;2-氯-5-氯甲基吡啶;氯化;农药中间体
0 前言
2,3-二氯-5-三氯甲基吡啶是一种重要的农药中间体,其下游产品2,3-二氯-5-三氟甲基吡啶是氟代氮杂环类农药中重要的中间体,可进一步合成吡氟禾草灵等除草剂,定虫隆等杀虫剂,氟啶胺等杀菌剂。相对于其他氯代吡啶衍生物,用2,3-二氯-5-三氯甲基吡啶制备的除草剂和杀虫剂的性能尤为突出,具有高效、低毒、对环境友好等显著特点,有着广泛的应用和广阔的市场前景。2,3-二氯-5-三氯甲基吡啶的研究与生产,必将伴随着上述农药的开发应用而兴起。
1 2,3-二氯-5-三氯甲基吡啶的性质
2,3-二氯-5-三氯甲基吡啶,英文名称2,3-dichloro-5-(trichloromethyl)pyridine,CAS号69045-83-6,分子式C6H2Cl5N,分子质量为265.35,分子结构式如下:
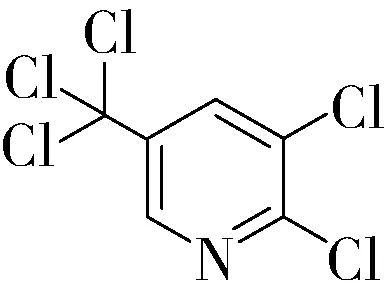
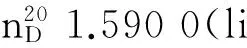
2 2,3-二氯-5-三氯甲基吡啶的合成方法
目前,制备2,3-二氯-5-三氯甲基吡啶和2,3-二氯-5-三氟甲基吡啶的工艺有以下几种。
2.1 2-氨基-5-甲基吡啶工艺
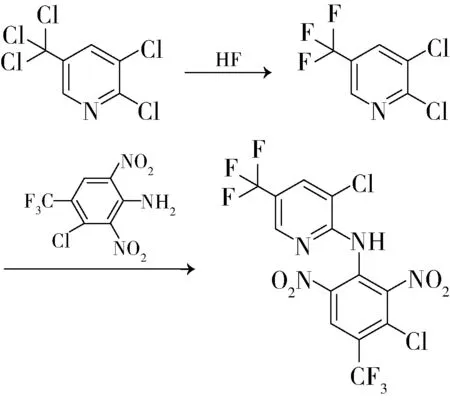
帝国化学工业公司专利US4324627[1]、US4508907[2]、US4555575[3]报道了多步法制备2,3-二氯-5-三氯甲基吡啶的方法:1)以2-氨基-5-甲基吡啶为原料,经过溴代反应合成2-氨基-3-溴-5-甲基吡啶;2)2-氨基-3-溴-5-甲基吡啶与NaNO2、HCl溶液反应,得到3-溴-2-氯-5-甲基吡啶;3)将得到的3-溴-2-氯-5- 甲基吡啶溶于四氯化碳中,在紫外灯照射下与氯气反应,得到目标产物2,3-二氯-5-三氯甲基吡啶。反应式如下:
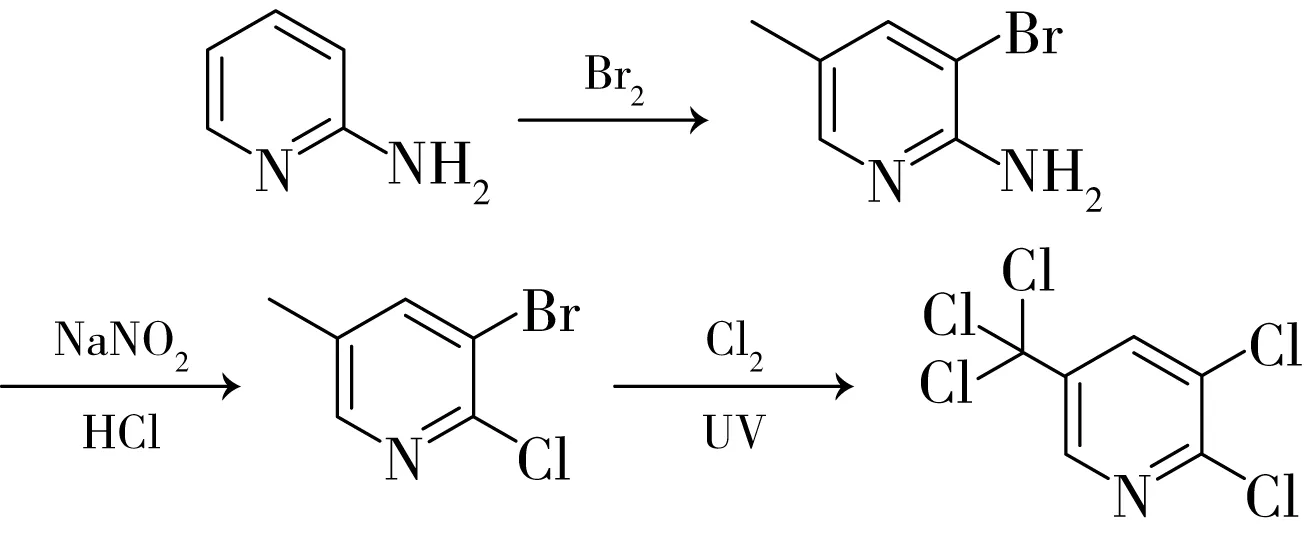
该合成方法最后一步氯化反应时使用了紫外线照射,加速了自由基取代速率。其不足之处在于原料成本高,反应后处理分离异构体困难,不宜进行工业化开发。
2.2 甲基吡啶工艺
以3-甲基吡啶为原料,先合成2-氯-5-三氯甲基吡啶,再合成2,3-二氯-5-三氯甲基吡啶。
焦素霞等[4]即以此法合成2,3-二氯-5-三氟甲基吡啶。
1) 中间体2-氯-5-三氯甲基吡啶的合成:在一个特制的反应器中,从一进口于1 h内慢慢通入22.4 g 3-甲基吡啶与212 mL四氯化碳的混合蒸气,在另一进口通入氯气,在350~400 ℃反应10 s,收集的产品用稀氨水洗涤后用无水硫酸钠干燥,脱除四氯化碳得油状粗品,收率为75.3%,经精馏后收率为50%,纯度大于90%。
2) 中间体2,3-二氯-5-三氯甲基吡啶的合成:取2-氯-5-三氯甲基吡啶46.2 g,加入催化剂后升温至150~160 ℃,缓慢通入干燥的氯气,反应6 h,加入苯稀释反应液,用水洗涤后干燥有机相,减压蒸除苯后,经精馏得油状产品50.3 g,收率90%,纯度为95%。

安徽国星生物化学专利CN102382048[5]报道了一种精盖草能的制备方法,其中2,3-二氯-5-三氯甲基吡啶作为中间体,在氮气和四氯化碳反应体系中通过3-甲基吡啶和氯气按物质的量比为1∶1反应得到,反应温度为350~450 ℃。
2.3 2-氯-5-甲基吡啶工艺
江苏扬农化工专利CN103058918[6]报道了以2-氯-5-甲基吡啶为原料,在自由基反应引发剂类催化剂与钼或钨化合物类催化剂作用下,进行氯化合成反应,一锅法合成2-氯-5-三氯甲基吡啶与2,3-二氯-5-三氯甲基吡啶两种产品的工艺。反应式如下:
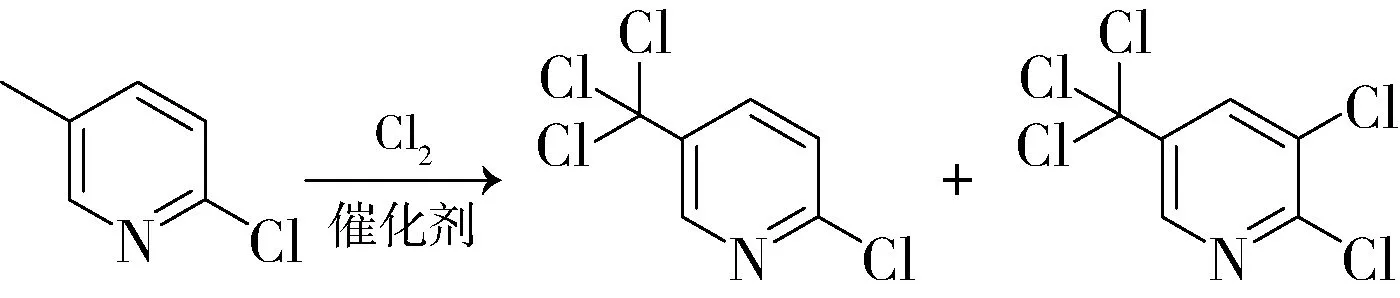
自由基反应引发剂类催化剂优选偶氮二异丁腈或过氧化苯甲酰,钼或钨化合物类催化剂优选五氯化钼或六氯化钨。通过催化剂组合比例的调整,可实现两种产品比例的任意调整。如投入2-氯-5-甲基吡啶100 g,升温140~150 ℃,加入催化剂偶氮二异丁腈0.100 g,然后通氯气反应,10 h后加入催化剂五氯化钼0.030 g,再继续反应5 h,中控,n(2-氯-5-三氯甲基吡啶)∶n(2,3-二氯-5-三氯甲基吡啶)为5∶5;其他条件不变,加入偶氮二异丁腈0.100 g,加入五氯化钼0.300 g,得到两种产品的比例约为1∶9。
由于吡啶结构的特殊性使得氯化过程不容易,大都涉及到高温,且氯化时间长,氯气利用率低。传统氯化工艺大都通过加入溶剂或催化剂来提高氯化效率及氯气利用率,这样无形中增加了成本。江苏扬农化工专利CN102942518[7]报道了一种用于2-氯-5-甲基吡啶氯化反应的反应器,该反应器在传统氯化反应器的基础上,置入了氯气分布装置和涡轮桨自吸式搅拌器,利于氯气与物料的充分接触,氯气的利用率最高可达到99.5%。
2.4 2-氯-5-氯甲基吡啶工艺
在现有技术中,以2-氯-5-氯甲基吡啶为原料,通常采用两步反应合成2,3-二氯-5-三氯甲基吡啶。
1)以2-氯-5-氯甲基吡啶为原料,在紫外光的作用下合成2-氯-5-三氯甲基吡啶。紫外光用于引发自由基反应,在氯气作用下将氯甲基转化为三氯甲基,最终合成2-氯-5-三氯甲基吡啶。
2)以2-氯-5-三氯甲基吡啶为原料,在无催化剂或路易斯酸的作用下合成产品2,3-二氯-5-三氯甲基吡啶。
陶氏化学公司专利US4309548[8]公开了以下方法:以2-氯-5-三氯甲基吡啶为原料,与N-甲基吡咯烷酮、N,N-二甲基甲酰胺或二甲亚砜等溶剂混合后,通入氯气,在55~120 ℃反应,转化率可达到91%。
该公司专利US4331811[9]、US4636565[10]报道了催化剂对2-氯-5-三氯甲基吡啶氯化合成2,3-二氯-5-三氯甲基吡啶的影响。采用钼、钨或钌的化合物作为催化剂,以2-氯-5-三氯甲基吡啶为原料,在催化剂和氯气的存在下,于150~200 ℃液相氯化反应合成2,3-二氯-5-三氯甲基吡啶,产物中2,3-二氯-5-三氯甲基吡啶的含量可达到95.6%,其他物质2-氯-5-三氯甲基吡啶、2,3,5,6-四氯吡啶、2,3,6-三氯-5-三氯甲基吡啶的含量分别为1.6%、1.6%、1.2%。
该公司专利EP0246349[11]报道了2-氯-5-三氯甲基吡啶与氯气在60~180 ℃、0.345 MPa及以上压力的条件下进行无催化氯化反应,反应转化率较低;使用FeCl3催化剂可提高反应转化率。例如起始原料2-氯-5-三氯甲基吡啶为956.6 g,通入氯气18.2 g/h,在125 ℃反应49 h,分析产物组成,未反应的2-氯-5-三氯甲基吡啶的含量为13.3 %,2,3-二氯-5-三氯甲基吡啶、2,3,6-三氯-5-三氯甲基吡啶的含量分别为83.7%、0.4%。
苏联专利SU1787156[12]报道了2,3-二氯-5-三氯甲基吡啶的合成方法。以2-氯-5-三氯甲基吡啶为原料,在温度100~175 ℃、压力1 480 kPa条件下连续加入HCl进行液相氯化反应,得到的产物为2,3-二氯-5-三氯甲基吡啶和2,6-二氯-5-三氯甲基吡啶,物质的量比为2.8 ∶1.0。
陶氏益农专利EP0544267[13]报道了气相合成2,3-二氯-5-三氯甲基吡啶的方法。在温度为250~400 ℃条件下通入氯气、溶解于四氯化碳的2-氯-5-三氯甲基吡啶,进行气相氯化反应,所用催化剂包括γ-Al2O3、ZnCl2/蒙脱土、ZnCl2/SiO2、NiCl2/SiO2等,其中5%ZnCl2/蒙脱土催化剂具有较高的Lewis酸性,对2,3-二氯-5-三氯甲基吡啶的选择性较好。例如,在反应器中装填28 g 5%ZnCl2/蒙脱土催化剂,通入96.3 mL/min氯气、8.7 mL/min 2-氯-5-三氯甲基吡啶、110 mL/min 四氯化碳,在385 ℃反应150 min,尾气中未反应的2-氯-5-三氯甲基吡啶含量为27.9%,2,3-二氯-5-三氯甲基吡啶、2,6-二氯-5-三氯甲基吡啶、2,3,6-三氯-5-三氯甲基吡啶的含量分别为21.0%、12.8%、13.8%。
杜汉权等[14]介绍了2,3-二氯-5-三氯甲基吡啶和2,3-二氯-5-三氟甲基吡啶的制备方法,其中2,3-二氯-5-三氯甲基吡啶的制备是以2-氯-5-三氯甲基吡啶溶液为起始原料,在70~250 ℃、常压或高压条件下(压力可达到1.378 MPa 或更高),通入氯气进行催化氯化反应,2,3-二氯-5-三氯甲基吡啶的收率可达到89.7%。所用的催化剂活性中心可以选择六氯化钨、五氯化钼、四氯氧钨、四氯氧钼或氯化钌等,载体可使用氧化铝、硅烷、硅铝、陶土或分子筛。一般情况下,当反应温度提高10~15 ℃时,反应速率会增加一倍,而提高催化剂浓度也能加快反应速率。
江苏省激素研究所专利CN103787961[15]报道了一种高效氟吡甲禾灵的合成方法,其中中间体2,3-二氯-5-三氯甲基吡啶通过2-氯-5-氯甲基吡啶与催化剂在130~145 ℃与氯气反应得到,所用催化剂为五氯化钼、三氯化铁或三氯化铝。

在两步反应中,由于氯甲基与三氯甲基对吡啶环的定位效应不同,氯甲基定位于吡啶环的4位与6位,三氯甲基定位于吡啶环的3位。先用紫外光在氯气作用下将氯甲基转化为三氯甲基,再用路易斯酸在氯气作用下反应,定位效应好,基本没有副产物生成。
上海康鹏化学专利CN101092392[16]介绍了一种一步法制备2,3-二氯-5-三氯甲基吡啶的工艺。通常认为,一步反应在氯甲基的定位效应下,定位效应差,会生成如2,4-二氯-5-三氯甲基吡啶、2,6-二氯-5-三氯甲基吡啶、2,3,4-三氯-5-三氯甲基吡啶、2,3,6-三氯-5-三氯甲基吡啶等副产物,影响收率。该公司专利采用MoO2、MoO3、MoCl5、MoCl2O2、WCl6或其组合作为催化剂,以2-氯-5-氯甲基吡啶为原料,在催化剂和氯气等存在下,反应温度为100~250 ℃,氯化合成2,3-二氯-5-三氯甲基吡啶,产率通常达到70%~90%,产品的纯度可达到99.5%以上。该反应过程中不需要使用任何有机溶剂,可减少后处理过程,且几乎无副反应发生,生产能力大,反应条件温和,成本低,易工业化生产。

扬州大学专利CN104529882A[17]公开了类似的一步法制备2,3-二氯-5-三氯甲基吡啶的方法。以2-氯-5-氯甲基吡啶为原料,在催化剂存在下,在温度70~280 ℃,压力0.101 3~1.013 MPa的反应条件下,2-氯-5-氯甲基吡啶与氯气进行氯化反应,然后进行过滤、蒸馏,制得2,3-二氯-5-三氯甲基吡啶,产率为76%~84%。所述催化剂选自三氯化铁、三氯化钌、二氯化钴、六羰基钼中的一种或几种的组合。该发明原料廉价,操作简易,后处理便捷,产品有较高的纯度和收率,可以进行大规模的工业生产。
2.5 烟酸工艺
芳基或杂芳基上的羧酸基团,在二氯二苯基膦和PCl3的作用下可转化为三氯甲基基团。陶氏化学专利US4419514[18]报道了以PCl5为氯化剂,以5-氯-6-羟基烟酸为原料合成2,3-二氯-5-三氯甲基吡啶的制备工艺。383 g的5-氯-6-羟基烟酸与1 000 g的PhP(O)Cl2和1 755 g的PCl5,在83~108 ℃反应,可获得567 g的2,3-二氯-5-三氯甲基吡啶。

凯末偌瓦公司专利WO2014198278[19]报道了以PCl3/PCl5为氯化剂,以烟酸为原料合成2,3-二氯-5-三氯甲基吡啶的制备工艺。反应温度为70~200 ℃,压力为0.2~3.0 MPa,2,3-二氯-5-三氯甲基吡啶的收率为63%~73%。

2.6 多卤代醛与不饱和腈环合工艺
以多卤代醛与不饱和腈为原料,经环合反应可以合成2,3-二氯-5-三氯甲基吡啶[20-21]。此法思路新颖,但工业化的困难在于原料多卤代醛合成和分离提纯存在一定难度。

3 2,3-二氯-5-三氯甲基吡啶的应用
2,3-二氯-5-三氯甲基吡啶是一种重要的农药、医药有机中间体,能够合成各类高效杀虫剂、杀菌剂和除草剂,具有低毒、高效、广谱的特点[22]。
3.1 合成吡氟氯禾灵[23]
吡氟氯禾灵,又称盖草能、氟吡甲禾灵、(RS)-2-(4-(3-氯-5-三氟甲基-2-吡啶氧基)苯氧基)丙酸甲酯,CAS号69806-34-4,分子式C15H11ClF3NO4。该产品是陶氏益农公司开发的一种苯氧羧酸类除草剂,1978年3月1日申请专利,1986年上市,2003年销售额为1.15亿美元,2005年为1.30亿美元,2007年为1.35亿美元,2009年为1.10亿美元。该产品是脂肪酸合成抑制剂,具有内吸传导作用,茎叶处理后很快被杂草吸收并传输到整个植株,水解成酸,抑制根和茎的分生组织生长,导致死亡。芽后施于阔叶作物田,可有效防除葡萄冰草、野燕麦、旱雀麦、狗牙根等。其合成工艺如下:

截止2014年11月,中国还没有公司登记吡氟甲禾灵。
3.2 合成定虫隆[24]
定虫隆,又称抑太保、氟啶脲、1-(3,5-二氯-4(3-氯-5-三氟甲基-2-吡啶氧基)苯基)-3-(2,6-二氟苯甲酰基)脲,CAS号71422-67-8,分子式C20H9Cl3F5N3O3。该产品是1982年由日本石原产业和先正达公司开发的一种苯甲酰脲类几丁质抑制剂,1978月4月28日申请专利,1989年上市,2003年销售额小于0.25亿美元,2005年为0.27亿美元,2007年销售额小于0.28亿美元,2009年为0.40亿美元。该产品以胃毒作用为主,兼有触杀作用,无内吸作用,具有很高的杀虫活性,是一种高效、低毒、与环境相容的农药品种,对有机磷、拟除虫菊脂类、氨基甲酸脂类等农药产生抗性的害虫有良好的防效,将成为替换当前使用高毒杀虫剂的主要品种之一。其合成工艺如下:
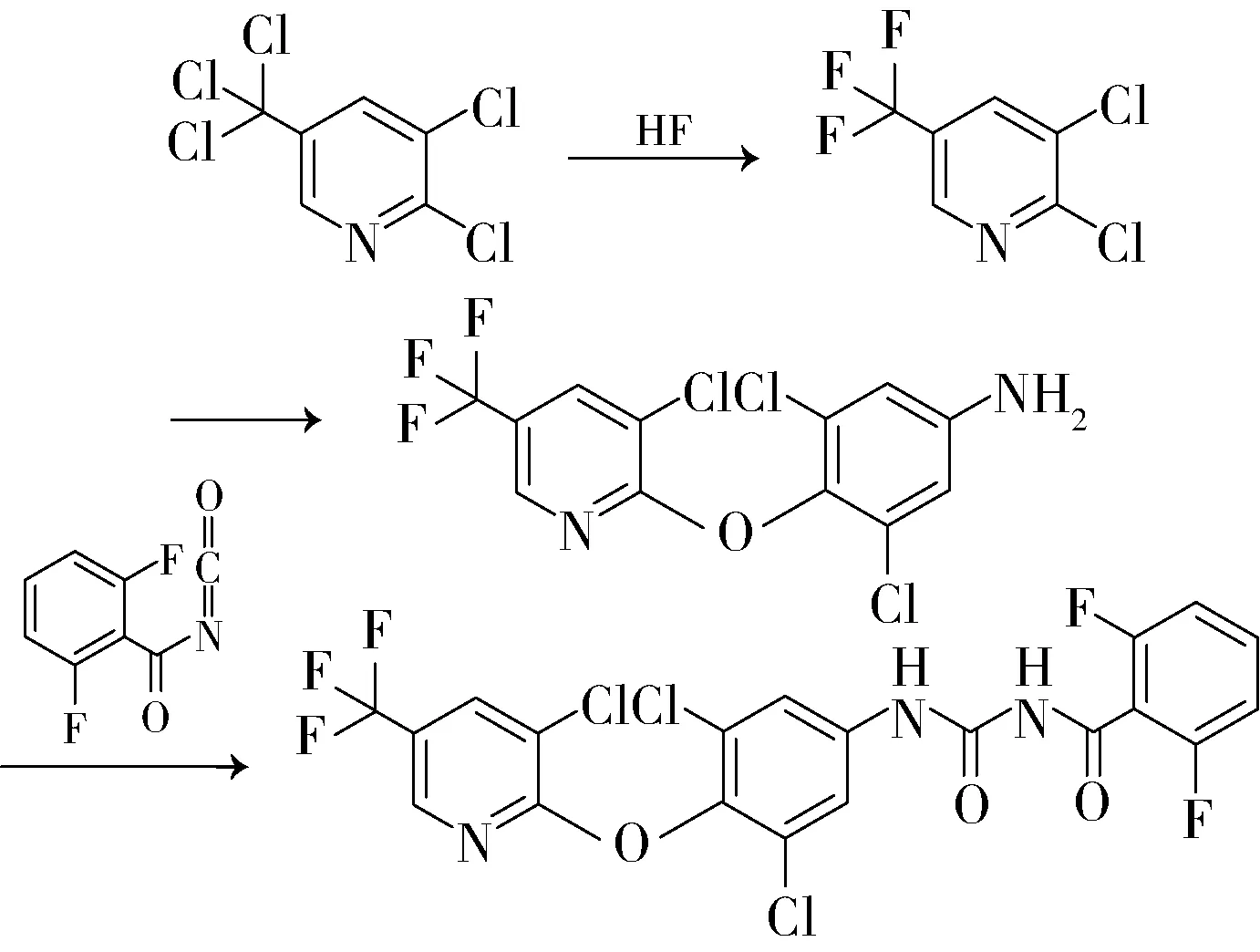
3.3 合成氟啶胺
氟啶胺,又称3-氯-N-(3-氯-5-三氟甲基-2-吡啶基)-A,A,A-三氟-2,6-二硝基-对甲苯胺,CAS号79622-59-6,分子式C13H4Cl2F6N4O4。该产品是由日本石原公司研制的一种保护性杀菌剂,1980年12月3日申请专利,1988年上市,2003年销售额为0.85亿美元,2005年为1.10亿美元,2007年为1.30亿美元,2009年为1.05亿美元。该产品不内吸,不具治疗作用,但极耐雨水冲刷、残效长,是一种很好的叶面喷洒剂,并能兼治叶螨,对交链孢霉、葡萄孢霉(特别是已对苯并咪唑,二羧酰亚胺类产生抗性的)、疫霉菌、单轴霉菌、核盘菌、黑星菌有效。国内江苏扬农化工股份有限公司有生产,其合成工艺如下:
4 结束语
2,3-二氯-5-三氯甲基吡啶在农药领域具有广泛的应用和良好的市场前景。在2,3-二氯-5-三氯甲基吡啶的各种合成工艺中,吡啶衍生物氯代法在国内外研究较多,合成方法比较成熟,同时3-甲基吡啶、2-氯-5-氯甲基吡啶等原料国内已有销售,因此该工艺具有一定的优势。但该工艺为取得较好的定位氯化效果,大都采用多步合成法,操作工艺较长。最近关于以2-氯-5-氯甲基吡啶为原料,一步法制备2,3-二氯-5-三氯甲基吡啶的相关研究开始兴起,该工艺操作简易,后处理便捷,可进行大规模工业化生产,其关键点在于选择合适的定位氯化催化剂。环合反应合成2,3-二氯-5-三氯甲基吡啶的方法,研究相对较少,存在原料生产成本较高、苄氯分离困难等缺点。
[1]Cartwright D. Process for preparing 2-chloro-5-trichloro-methylpyridine: US, 4324627[P]. 1982-04-13.
[2]Cartwright D. 2,3-Dichloro-5-trichloromethylpyridine: US, 4508907[P]. 1985-04-02.
[3]Cartwright D. Process for preparing 2,3-dichloro-5-trichloromethylpyridine: US, 4555575[P]. 1985-11-26.
[4]焦素霞, 周梁, 陈美玲. 2,3-二氯-5-三氟甲基吡啶的合成研究[J]. 河北化工, 2003(3): 24-25.
[5]顾福海, 李健, 钱前, 等. 精盖草能的制备方法: 中国, 102382048A[P]. 2012-03-21.
[6]周景梅, 贺书泽, 丁泽升, 等. 合成2-氯-5-三氯甲基吡啶与2,3-二氯-5-三氯甲基吡啶两种产品的方法: 中国, 103058918A[P]. 2013-04-24.
[7]周景梅, 贺书泽, 丁泽升, 等. 一种吡啶衍生物氯化合成方法: 中国, 102942518[P]. 2013-02-27.
[8]Wilson C A, Wener J A. Chlorination of 2-chloro-5-trichloromethylpyridine: US, 4309548[P]. 1982-01-05.
[9]Wener J A, Wilson C A, Mixan C E. Preparation of 2,3-dichloro-5-trichloromethylpyridine: US, 4331811[P]. 1982-05-25.
[10]Wener J A, Wilson C A, Mixan C E. Preparation of 2,3-dichloro-5-trichloromethylpyridine: US, 4636565[P]. 1987-01-13.
[11]Humphreys P L, Dietsche T J, Bixby J L. Method of selectively chlorinating 2-chloro-5-(trichloromethyl)pyridine in the 3-position: EP, 0246349A1[P]. 1987-11-25.
[12]Humphries P L, Ditsche T J, Bixby J L. Method of 2,3-dichloro-5-(trichloromethyl)pyridine synthesis: SU, 1787156A3[P]. 1993-01-07.
[13]Allphin C P, Desjardin M A, Harley A D. Selective gas phase chlorination of polychlorinated beta-picolines to produce 2,3,5,6-tetrachloropyridine and its precursors: EP, 0544267[P]. 1993-06-02.
[14]杜汉权, 唐彦秋, 张勇. 2,3-二氯-5-三氯(氟)甲基吡啶的制备[J]. 有机氟工业, 2010 (1): 15-18.
[15]孔繁蕾, 张旺庚, 丁武松. 一种高效氟吡甲禾灵的合成方法: 中国, 103787961A[P]. 2014-05-14.
[16]戴信培, 张京, 唐运宏. 一种2,3-二氯-5-三氯甲基吡啶的制备方法: 中国, 101092392[P]. 2007-12-26.
[17]金朝俊, 于梦轩, 袁宇. 一种2,3-二氯-5-三氯甲基吡啶的合成方法: 中国, 104529882A[P]. 2015-04-22.
[18]McKendry L H, Ricks M J, Rogers R B. Converting carboxylic acid groups to trichloromethylgroups: US, 4419514[P]. 1983-12-06.
[19]Andersen C S. Process for the preparation of 2,3-dichloro-5-(trichloromethyl)pyridine: WO, 2014198278[P]. 2014-12-18.
[20]Pews R G, Lysenko Z. Synthesis of halogenated pyridines via the CuCl-catalyzed addition of polyhaloacetonitriles to olefins[J]. J Org Chem, 1985, 50(25): 5115-5119.
[21]Steiner E. Process for the production of chloropyridines substituted by methyl, trichloromethyl or trifluoromethyl groups: US, 4469896[P]. 1983-12-04.
[22]申桂英, 王晨. 3-甲基吡啶氯代衍生物在农药上的应用[J]. 精细与专用化学品, 2014, 22(12): 23-30.
[23]唐庆红. 吡氟氯禾灵类除草剂的介绍[J]. 浙江化工, 2000, 31(3): 29-32.
[24]Hashi B, 张敏恒. 新型杀虫剂定虫隆[J]. 农药, 1989(4): 39.
书 讯
《有机氟工业》编辑部现有2004年~2015年合订本出售。每本定价人民币100元,
另加挂号邮费10元/本。请需要的读者与编辑部联系。
地址:上海市龙吴路4411号 邮政编码:200241
电话:021-64340430 021-64340154×3374 传真:021-64345915
Email:youjifugongye@126.com
Research Progress in the Synthesis and Application of2,3-Dichloro-5-(trichloromethyl)pyridine
Zhang Di, Yu Wanjin, Lin Shengda, Wang Shucheng, Wang Jiuju, Liu Wucan, Zhang Jianjun
(Zhejiang Chemical Industry Research Institute, The National ODS Substitutes Engineering & Technology Research Center, Zhejiang Provincial Key Laboratory of New Chemical Materials, Hangzhou 310023, China)
A variety of synthetic technology and research progress of 2,3-dichloro-5-(trichloromethyl)pyridine were introduced.Among the synthetic routes, chlorination of pyridine derivative, which has the advantage of low-price raw materials, easy control and simple reprocess,it is suitable for industrialized production.The application of 2,3-dichloro-5-(trichloromethyl)pyridine in the field of pesticide was also introduced.
2,3-dichloro-5-(trichloromethyl)pyridine; 2-chloro-5-chloromethylpyridine; chlorination; pesticide intermediate
浙江省博士后科研择优资助项目(BSH1402061)。
张迪(1985—),女,硕士,工程师,主要从事催化氟化技术、新型ODS替代品的开发与合成研究等工作。

