吡喹酮混悬注射液的质量标准研究
杨海峰,李勇军*,金礼琴,赵杉杉,孙爱荣,乔新月
(1.江苏农牧科技职业学院,江苏泰州225300;2.江苏倍康药业有限公司,江苏泰州225300)
血吸虫病是一种由血吸虫感染所引起的严重危害人类健康和社会经济发展的人畜共患寄生虫病,流行于全世界76个国家和地区[1]。在大规模彻底灭螺和血吸虫病疫苗临床应用实现之前,抗血吸虫药物仍是防治血吸虫病的主要手段。吡喹酮(praziquantel,PZQ)为广谱抗血吸虫和抗绦虫药,适用于各种血吸虫病、华支睾吸虫病、肺吸虫病、姜片吸虫病以及绦虫病和囊虫病[2-3]。吡喹酮是目前防治血吸虫病的首选药物,其作用机理主要是通过5-羟色胺样作用引起虫体活动兴奋,同时影响Ca2+的通透性引起虫体肌肉挛缩和皮层受损,继而导致虫体表面抗原决定簇暴露,宿主的免疫效应得以发挥,促使虫体死亡[4-5]。
家畜(特别是耕牛)作为主要的保虫宿主和传染源,在血吸虫病的流行过程中起着重要的传播作用。采用吡喹酮治疗病畜,最大限度消灭病畜体内的虫体,减少或杜绝病原对环境的污染是控制血吸虫病重要而有效的措施之一。目前,我国批准使用兽用吡喹酮制剂有片剂和粉剂两种剂型[6-7],但由于吡喹酮具有低溶解度、高渗透性、内服首过效应明显和生物利用度低的特点,影响了其临床效应的发挥[8]。因此,提高吡喹酮生物利用度和有效血药浓度维持时间的新制剂开发成为防治血吸虫病的研究热点[9-10]。近几年,国内外报道的吡喹酮新制剂有吡喹酮固 体 分 散 体[8]、注 射 剂[11-13]、透 皮 剂[14]、纳 米乳[15]和脂质体冻干剂[16]等。
针对吡喹酮的理化性质和药代动力学特点,课题组研制了30%吡喹酮混悬注射液,拟用于家畜血吸虫病的防治。为评价和控制吡喹酮混悬注射液的质量,确保临床用药的安全性和有效性,本试验依据2010年版《中国兽药典》一部[6]和农业部新兽药评审中心《兽药研究技术指导原则汇编》[17]的相关技术规范,建立了吡喹酮混悬注射液的质量标准。
1 材料与方法
1.1 材料
1.1.1 主要仪器 扁平式气流粉碎机,南京理工大学国家特种超细粉体工程技术研究中心;FJ-200型高速分散均质机,上海标本模型厂;BG 型半自动液体灌装机,江苏永和制药机械有限公司;KFJ-S40型封口盖机,南通市华中包装材料有限公司;UV-2250型紫外可见分光光度计,日本岛津公司;LC-10Avp型高效液相色谱仪,日本岛津公司;AS1201型自动进样器,大连依利特公司;BS224S型电子天平,北京赛多利斯公司。
1.1.2 主要试剂 吡喹酮混悬注射液,规格100 mL:30g,批号110419、110423、110427,江苏倍康药业有限公司制备;吡喹酮标准品,中国药品生物制品检定所提供;甲醇、乙腈,色谱纯,美国TEDEA 公司生产;206佐剂,赛彼科上海特殊化学品有限公司生产。
1.2 方法
1.2.1 外观性状 依据2010年版《中国兽药典》一部制剂通则要求,对3批样品进行外观性状考察。
1.2.2 鉴别
1.2.2.1 紫外-可见分光光度法 取摇匀后的吡喹酮混悬注射液适量,加乙醇制成每1m L 中含0.6 mg吡喹酮的溶液,按照紫外-可见分光光度法测定,检测其最大吸收波长是否与吡喹酮标准品一致。
1.2.2.2 高效液相色谱法 取吡喹酮混悬注射液样品,按含量测定项下操作,记录色谱图,观察供试品溶液主峰的保留时间与吡喹酮标准品溶液主峰的保留时间是否一致。
1.2.3 检查
1.2.3.1 粒度 采用显微镜法测定吡喹酮混悬注射液的粒度,《中国兽药典》制剂通则要求,混悬型注射液不得检出50μm 及以上粒子,15μm 以下的颗粒不得少于90%,15μm~20μm 的颗粒不得超过10%。
1.2.3.2 分散性 取3批次吡喹酮混悬注射液,强力振摇30s,分别将供试品转移置玻璃容器中检视,应分散均匀,无结块现象。
1.2.3.3 装量 采用最低装量检查法(容量法)检查吡喹酮混悬注射液装量,《中国兽药典》制剂通则要求,注射液的标示装量为50mL~500mL,每瓶的装量均不得少于其标示装量的97%。
1.2.3.4 无菌 取吡喹酮混悬注射液10瓶,充分混匀后取100mL,加入适量的二甲亚砜稀释液,溶解后,立即过滤,用含1g/L聚山梨酯80为冲洗液,采用薄膜过滤法进行无菌检查。
1.2.4 含量测定
1.2.4.1 色谱条件 色谱柱:Diamonsil C18柱(150 mm×4.6mm,5μm);柱温:25 ℃;流动相:乙腈-水(60∶40);流速:1.0mL/min;检测波长:210nm;进样量:20μL。
1.2.4.2 标准品工作液制备 取吡喹酮标准品60.37 mg,加无水乙醇定容至100 mL,得浓度为603.7μg/mL的标准品储备液,使用前用流动相稀释成系列浓度的标准品工作液。
1.2.4.3 供试品溶液制备 吡喹酮混悬注射液摇匀,用移液管精密量取2mL,置100mL 容量瓶中,用无水乙醇50mL,分5次洗涤移液管内壁,洗液并入容量瓶中,摇匀,置水浴中超声10min,加无水乙醇缓慢稀释至刻度,摇匀。精密量取1 mL,置100 mL容量瓶中,加无水乙醇稀释至刻度,摇匀,即得供试品溶液。
1.2.4.4 阴性对照液制备 按处方比例精密称取吡喹酮混悬注射液中除吡喹酮原料药外的其他成份,同吡喹酮混悬注射液工艺制备,再按供试品溶液的制备方法处理,即得阴性对照液。
1.2.4.5 系统适应性试验 分别取阴性对照液、标准品溶液和供试品溶液20μL,按“1.2.4.1项下”色谱条件进样测定,记录色谱图。
1.2.4.6 线性关系试验 精密量取标准品储备液适量加到流动相中,得浓度分别为6.037、12.074、30.185、60.37、90.555μg/mL 的标准品工作液,取20μL进样测定,以峰面积(A)对吡喹酮浓度(C)进行线性回归,计算线性回归方程。
1.2.4.7 精密度试验 取吡喹酮标准品工作液,连续重复进样6次,进样量20μL,依法测定峰面积,观察其峰面积测量值的相对标准偏差(RSD)。
1.2.4.8 稳定性试验 分别在供试品溶液制备0、4、8、12、24h后,精密量取20μL,依法测定峰面积,考察其稳定性。
1.2.4.9 加样回收率试验 精密取吡喹酮标准品和辅料适量,按处方制成吡喹酮射液的模拟样品,然后制备高、中、低3种浓度共9份样品溶液,测定吡喹酮浓度,与加入值进行比较,计算加样回收率。
1.2.4.10 含量测定 取3批吡喹酮混悬注射液样品,制备供试品溶液,进样测定,记录峰面积,计算样品含量(以标示量的百分含量表示)。
2 结果
2.1 性状
本品为吡喹酮与206佐剂、注射用水等配制而成的白色至类白色混悬注射液,久置分层,振摇后均匀。
2.2 鉴别结果
2.2.1 紫外-可见分光光度法 吡喹酮混悬注射液的紫外光谱扫描图见图1,其吸收峰特征明显,3批次样品最大吸收波长见表1,吡喹酮混悬注射液的最大吸收波长与吡喹酮标准品一致(兽药典规定测定误差可允许为±1nm),故将紫外吸收光谱法作为鉴别依据。
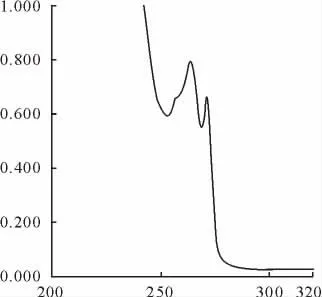
图1 吡喹酮混悬注射液的紫外光谱扫描图Fig.1 UV scanning pectrum of praziquantel suspension injection
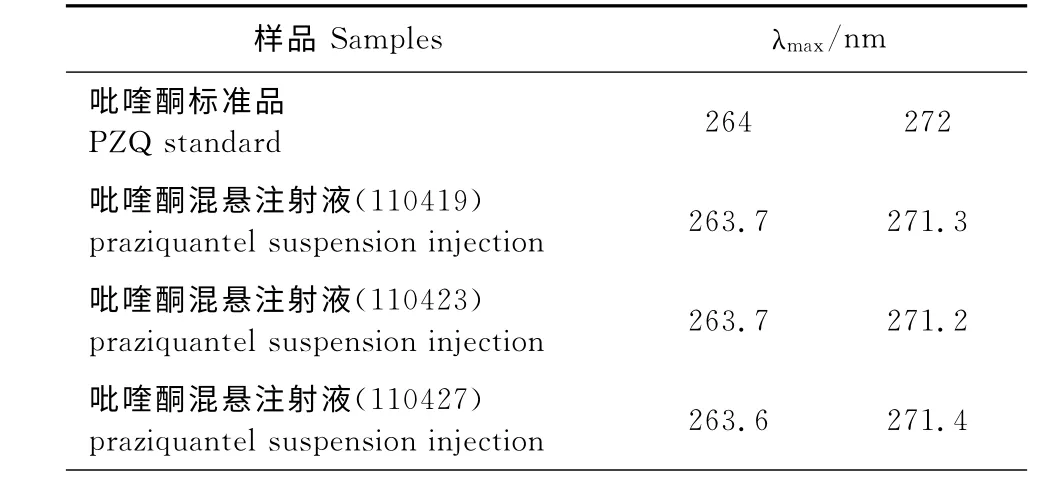
表1 紫外吸收光谱鉴别结果Table 1 Identification results of the UV absorption spectrum
2.2.2 高效液相色谱法 阴性对照液、吡喹酮标准品和吡喹酮混悬注射液的色谱图分别见图2~图4,可见供试品溶液主峰的保留时间与吡喹酮标准品溶液一致,阴性对照液在相应位置无吸收,故将高效液相色谱法作为鉴别依据。
2.3 检查结果
2.3.1 粒度检查结果 吡喹酮混悬注射液15μm以下的颗粒在90%以上,15μm~20μm 的颗粒不超过10%,粒度检查结果符合规定(表2)。
图2 阴性对照液色谱图Fig.2 Chromatogram of negative sample
图3 吡喹酮标准品色谱图Fig.3 Chromatogram of praziquantel standard
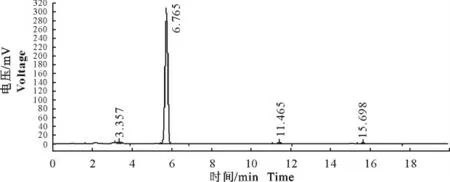
图4 吡喹酮混悬注射液色谱图Fig.4 Chromatogram of praziquantel suspension injection
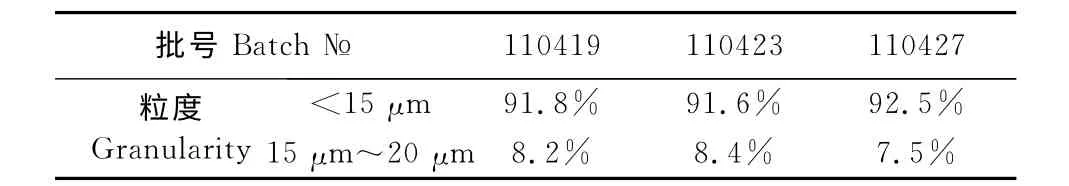
表2 粒度检查结果Table 2 Results of granularity inspection
2.3.2 分散性检查结果 吡喹酮混悬注射液分散均匀,无结块现象,分散性检查结果符合规定。
2.3.3 装量检查结果 装量检查结果见表3,3批吡喹酮混悬注射液的每瓶装量为100.8mL~102.2 mL(兽药典规定不少于标示装量的97%),平均装量分别为101.4、101.8、101.9mL(兽药典规定不少于标示装量),装量检查结果符合规定。
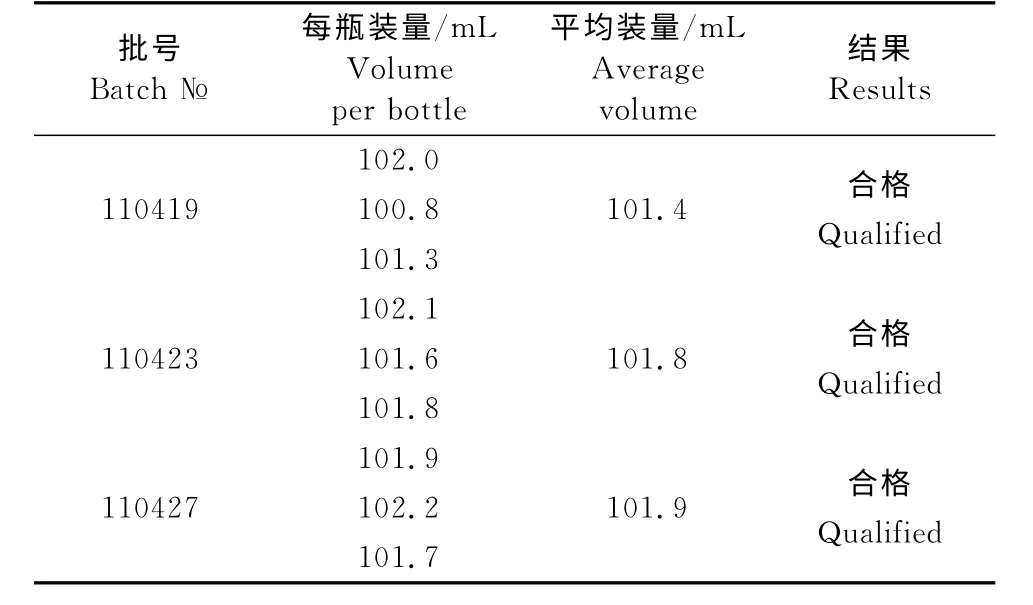
表3 装量检查结果Table 3 Results of volume check
2.3.4 无菌检查结果 阳性对照管24h~48h后生长良好,供试品管和阴性对照管14d 内无菌生长,吡喹酮混悬注射液无菌检查结果符合规定。
2.4 含量测定结果
2.4.1 系统适应性试验 供试品溶液主峰与其他杂质峰分离效果好,保留时间与标准品溶液一致,阴性对照液在相应位置无吸收,表明方法专属性好。
2.4.2 线性关系试验结果 以峰面积(A)对吡喹酮浓度(C)进行线性回归,得回归方程为A =93 729C+89 501(r=0.999 3),线性范围6.037 μg/mL~90.55μg/mL。
2.4.3 精密度试验结果 取吡喹酮标准品工作液重复进样测定,其峰面积的RSD 为0.15%(n=6),表明方法精密度符合要求。
2.4.4 稳定性试验结果 24h内不同时间点取供试品溶液进样测定,其峰面积的RSD 为0.13%,表明供试品溶液至少可以稳定24h。
2.4.5 加样回收率试验结果 加样回收率试验结果见表4,平均回收率为99.24%,RSD 为0.77%(n=9)。
2.4.6 含量测定结果 吡喹酮混悬注射液的含量测定结果见表5,3 批样品的平均含量为标示量的100.3%,综合考虑一般注射液含量限度要求、吡喹酮混悬注射液的规格、装量及及其混悬特点,规定本品含吡喹酮(C19H24N2O2)应为标示量的93%~107%。
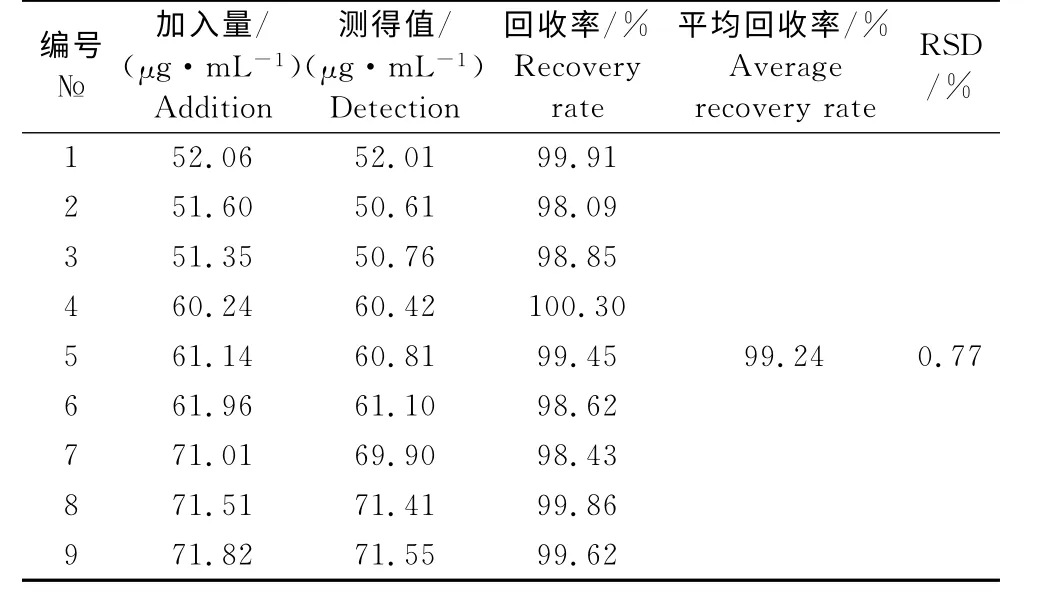
表4 回收率试验结果Table 4 Results of recovery test(n=9)

表5 吡喹酮混悬注射液含量测定结果Table 5 Determination results of praziquantel suspension injection content
3 讨论
兽药研发过程中,需对其质量进行系统、深入的研究,以制定出科学、合理、可行的质量标准,并不断地进行修订和完善,从而控制兽药的质量,保证其在有效期内安全有效[17]。兽药的质量标准为了使用兽药安全有效而制订的控制兽药质量规格和检验方法的规定,是兽药生产、经营、销售和使用的质量依据,亦是检验和监督管理部门共同遵循的法定技术依据。
本试验在成功制备30%吡喹酮混悬注射液的基础上,从外观性状、鉴别、检查、含量测定等方面进行吡喹酮混悬注射液的质量研究,建立了质量标准草案。
吡喹酮混悬注射液为吡喹酮与206佐剂、注射用水等制成的混悬型注射剂,久置分层,振摇后成均匀的白色至类白色混悬液。在鉴别试验中,采用了各国兽药典普遍采用的,专属性强、重现性好的紫外-可见分光光度法和高效液相色谱法,其鉴别操作简单、特征明显,故将二者列入质量标准正文。对粒度、分散性、装量差异、无菌检查等检查项目进行方法验证和测定,检查结果均符合中国兽药典的规定。
在含量测定试验中,采用HPLC 法测定吡喹酮混悬注射液中吡喹酮含量。根据吡喹酮的紫外扫描吸收特征,起初选择263nm 作为检测波长。2010年版《中国兽药典》一部中,吡喹酮原料药的检测波长为210nm[6]。试验证实在该检测波长下HPLC检测方法的灵敏度有所提高,故最终将检测波长定为210nm。为避免吡喹酮和注射液中辅料色谱行为的相互干扰,筛选了甲醇-水、乙腈-水等流动相,并根据色谱分离效果调整流动相组分的体积比,最终确定流动相为乙腈-水(60∶40)。试验结果表明,采用HPLC法测定注射液中吡喹酮含量,吡喹酮主峰分离效果好、保留时间适宜,方法操作简便、专属性强、灵敏度和回收率高、测定结果稳定。吡喹酮混悬注射液的含量限度根据注射剂一般要求以及样品剂型、装量、规格等自身特点,定为标示量的93%~107%。综上所述,30%吡喹酮混悬注射液质量可靠,所建立的质量分析方法专属性强、重复性好,能准确的进行定性和定量检测,可用于吡喹酮混悬注射液的质量控制。
[1] 周晓农,林丹丹,汪天平,等.我国“十二五”期间血吸虫病防治策略与工作重点[J].中国血吸虫病防治杂志,2011,23(1):1-4.
[2] 中国兽药典委员会.中华人民共和国兽药典兽药使用指南(化学药品卷)[M].北京:中国农业出版社,2010:166-167.
[3] 陈杖榴.兽医药理学[M].3版.北京:中国农业出版社,2010:327-328.
[4] 杨振坤,汪 伟,梁幼生.吡喹酮抗血吸虫的免疫机制研究进展[J].中国热带医学,2013,13(2):240-244.
[5] 黄一心.吡喹酮抗血吸虫作用机理的奥秘[J].中国血吸虫病防治杂志,2010,22(2):101-104.
[6] 中国兽药典委员会.中国兽药典2010年版.一部[S].北京:中国农业出版社,2010.
[7] 农业部兽药评审中心.兽药国家标准汇编——兽药地方标准上升国家标准(第1册)[M].北京:中国农业出版社,2010:52.
[8] 王天梓,刘艳艳,董春柳,等.吡喹酮联合载体固体分散体的制备及其性质考察[J].中国兽医科学,2014,44(5):545-550.
[9] 吴德智,马 正,刘运锋,等.吡喹酮制剂的发展和应用[J].中国血吸虫病防治杂志,2013,25(2):194-196.
[10] 邹永华,丁劲松,马 宁.提高吡喹酮疗效的新制剂技术研究进展[J].中南药学,2011,9(1):42-45.
[11] Sun Y,Bu S J.Pharmacokinetics and relative bioavailability of praziquantel in healthy water buffalo after oral and intramuscular administration[J].J Vet Pharmacol Ther,2012,35(6):618-622.
[12] Sun Y,Bu S J.Simple,cheap and effective high-performance liquid chromatographic method for determination of praziquantel in bovine muscle[J].J Chromatogr B,2012,899:160-162.
[13] 张 磊,汪勇沛,平宪卿,等.吡喹酮注射剂早期治疗小鼠血吸虫病效果的初步研究[J].畜牧与兽医,2010,42(4):24-27.
[14] 李小红,张大治,杨 艺,等.吡喹酮透皮给药治疗日本血吸虫病的效果观察[J].中国人兽共患病学报,2012,28(1):91-94.
[15] 张晓燕,欧阳五庆.复方吡喹酮纳米乳的研制[J].动物医学进展,2013,34(9):36-39.
[16] 邓 昉,匡光伟,陈启友,等.吡喹酮脂质体冻干剂的制备及质量评估[J].中国兽药杂志,2012,46(6):38-41.
[17] 农业部兽药评审中心.兽药研究技术指导原则汇编[M].北京:化学工业出版社,2011:47-51.

