液相色谱-串联质谱法测定猪血浆和尿液中8种同化激素的残留
张 怡,李艳芹,赖丽虹,姬竹玲,任妙贤,方炳虎
(华南农业大学,广东广州510642)
同化激素(anabolic steroids)是一类具有环戊烷多氢菲结构的物质,常被作为蛋白同化剂滥用于畜牧生产中,以提高饲料转化率,促进动物生长[1]。该类化合物在畜禽体内残留,且在动物体内稳定,不易分解[2]。欧盟早在21世纪80年代规定禁止该类物质作为促生长剂用于动物生长,我国农业部第176号公告明确指出禁止动物饮水和饲料中添加炔诺酮等药物[3]。
国外已经对牛血浆、牛尿液、动物肌肉等基质中同化激素的检测方法进行了研究,已报道的分析方法主要有高效液相色谱法(HPLC)[4]、气相色谱-质谱法(GC-MS)[5-6]及液相色谱-串联质谱法(LC-MS/MS)[7-13]。目前,8种同化激素(睾酮、群勃龙、勃地龙、甲睾酮、炔诺酮、康力龙、丙酸睾酮、苯丙酸诺龙)在猪血浆和尿液中的多残留检测还未见报道。由于尿液采样方便,并能实现活体检测[13],本文采用LCMS/MS对常被非法滥用在畜牧生产中8种同化激素在猪血浆和尿液中的残留进行研究,以期能建立低成本、快速、有效检测方法,为研究可食性组织与血液、尿液的动态关系建立基础。
1 材料与方法
1.1 材料
Agilent 1200高效液相色谱系统为美国安捷伦公司产品;API 4000电喷雾-串联四级杆质谱仪,配Analyst 4.1.5软件为美国应用生物系统公司产品;旋转蒸发仪显瑞士BUCHI公司产品;Milli-Q 纯水机为美国Millipore公司产品;Agilent C18 固相萃取小柱(200mg,3mL)为美国安捷伦公司产品;β-葡萄糖醛苷酶为上海安普科学仪器有限公司产品;睾酮、群勃龙、勃地龙、甲睾酮、康力龙、丙酸睾酮、炔诺酮标准品均为德国Dr.Ehrenstorfer公司产品;苯丙酸诺龙标准品为美国IL公司产品;甲酸、乙腈、甲醇均为色谱纯为德国Merk公司产品;乙酸乙酯、正己烷、无水乙醇均为国产分析纯。
1.2 方法
1.2.1 标准溶液的配制 储备液配制:分别准确称取群勃龙、甲睾酮、苯丙酸诺龙,睾酮、丙酸睾酮、勃地龙、康力龙适量置于10mL 容量瓶中,甲醇定容,配制成1mg/mL标准储备液,置-20℃密闭保存。混合标准溶液配制:分别从各激素药物的储备液中吸取1mL置于10mL容量瓶中,用甲醇定容,配制100μg/mL 混合标准溶液,-20℃密闭保存。使用时用初始流动性稀释成适宜浓度的工作液,现配现用。
1.2.2 色谱-质谱条件
1.2.2.1 色 谱 条 件 色 谱 柱:ZORBAX SB-Aq(2.1 mm×150 mm,3.5 μm);流 动 相:A 相 为1mL/L甲酸水溶液,B 相为乙腈溶液;梯度洗脱程序:0~1min,30%~55%B;1min~3min,55%B;3min~6min,55%~98%B;6min~12min,98%B;12min~12.5min,98%~30%B;12.5min~18 min,30%B。柱温:25℃;进样体积:5μL。
1.2.2.2 质谱条件 电喷雾电离(ESI),正离子扫描,多反应监测模式(MRM);电喷雾电压(IS)5 500 V,雾化气压力(GS1)65psi,辅助器流速(GS2)60 L/min,气 帘 气 压 力(CUR)30 psi,离 子 源 温 度(TEM)550 ℃,碰撞室压力(CAD)8psi。锥孔电压、碰撞能量及定性离子对、定量离子对等参数参见表1。
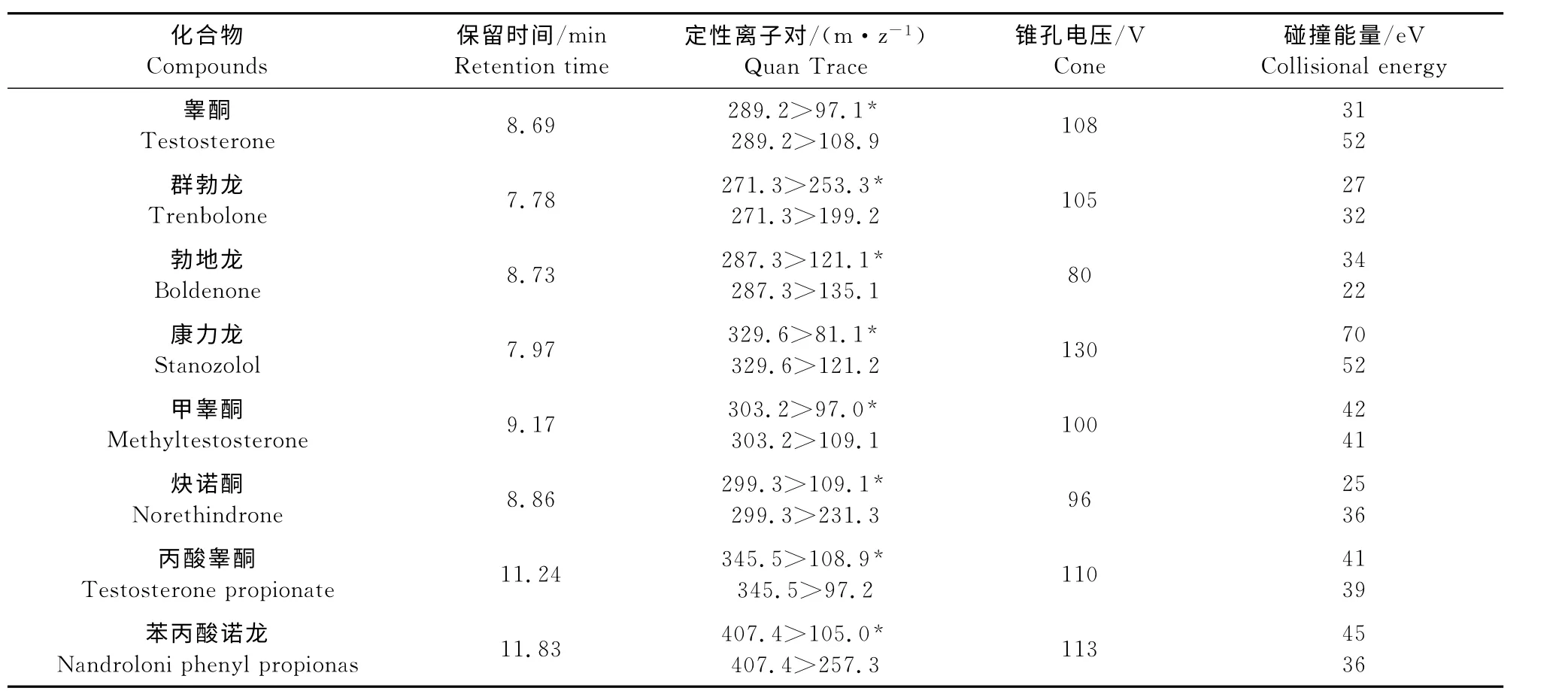
表1 8种同化激素的质谱参数Table 1 MRM parameters for eight anabolic steroids
1.2.3 样品前处理 取5mL(精确至0.1mL)试样于50 mL 离心管中,加入乙酸铵缓冲液(调节试样pH5.4)和β-葡萄糖醛苷酶100μL,37℃水浴12 h。冷却至室温,加入10 mL 乙酸乙酯,涡旋混匀,超声提取10min,以6 000r/min离心10min。将上清液转移梨形瓶中,重复提取1次。合并提取液,于37 ℃水浴旋转蒸发至近干。加1 mL 乙腈溶解残渣,再加水3mL 稀释,备用。备用液经C18固相萃 取 柱 净 化(3 mL 甲 醇、3 mL 水 活 化,3 mL 100 mL/L甲醇水淋洗),抽干后,加入3mL 乙腈洗脱,37 ℃水浴下氮气缓慢吹干。加入2mL 300mL/L乙腈水溶解残渣,取1mL加入等体积的正己烷,以15 000r/min离心10min,上清液过0.22μm 滤膜,待测。
1.2.4 标准曲线的制作 空白试样按照“1.2.3”中方法处理,取适量空白上清液加入不同量的混合标准工作液,涡旋混匀,配制成1.5、2、5、10、20、50、100μg/L的基质匹配标准工作液。以待测物色谱图的峰面积为纵坐标,相应待测物质量浓度为横坐标,进行回归计算,求得直线回归方程。
1.2.5 回收率与变异系数 在2、10、50μg/L每个浓度重复5次,连续做3个批次。按照上述方法处理,计算回收率和精密度。
1.2.6 检测限与定量限的测定 取适量的标准工作液,制 得0.1、0.15、0.2、0.3、0.5、1、1.5、2、5 μg/L添加水平样品,按照“1.2.3”方法处理,样品经上机检测后。按照信噪比S/N≥3 确定检测限(LOD),信噪比S/N≥10确定定量限(LOQ)。
2 结果
2.1 液相条件
试验中采用乙腈-1mL/L 甲酸水作为流动相,可实现对8种激素类药物的分离,并且药物的峰形对称,没有拖尾现象,图1为8种同化激素混合标准溶液MRM 离子流色谱图。
2.2 线性范围与检测限
在1.5μg/L~100μg/L浓度内,各个药物基质匹配标准曲线线性关系良好(r>0.99)。按照方法规定进行前处理,上机测定。在猪血浆和尿液中,睾酮、群勃龙、勃地龙、康力龙、甲睾酮的检测限为0.2 μg/L,丙酸睾酮、炔诺酮的检测限为0.3μg/L;除炔诺酮定量限为1.5μg/L,其他药物定量限均为1μg/L。
2.3 回收率和精密度
按照“1.2.3”方法,采用空白样品添加标准溶液进行检测,血浆中8种药物平均回收率为72.3%~92.3%,日内标准偏差(RSD)为2.2%~14.6%,日间RSD 为5.0%~12.2%。尿液中8 种药物平均回收率为71.5%~90.9%,日内RSD 为2.3%~13.7%,日间RSD 为3.2%~12.7%(表3)。

图1 8种同化激素药物的MRM 离子流图(5μg/L)Fig.1 Multiple reaction monitoring chromatograms of eight anabolic steriods(5μg/L)
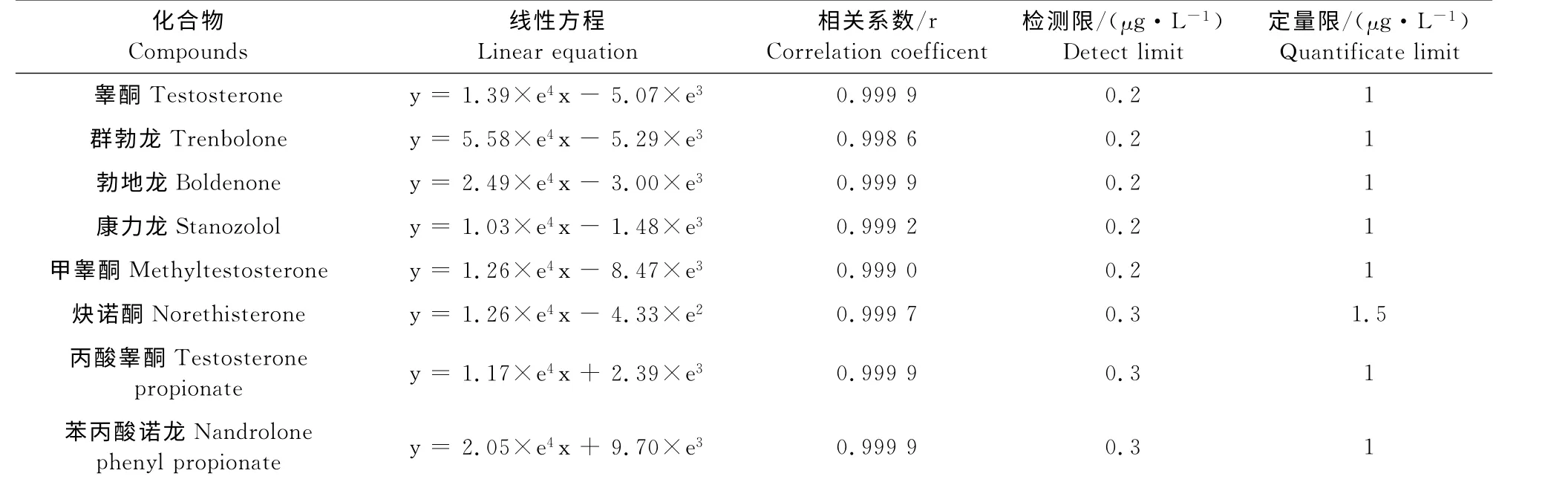
表2 8种同化激素的线性方程、检测限和定量限Table 2 Matrix calibration curves,LOD and LOQ for eight steroid hormones
2.4 抽样检测
应用建立的分析方法,对30 个养殖场随机采集的60份猪血浆和尿液进行测定,其中1份血浆和尿液样品检测出含有睾酮,血浆残留量为1.94μg/L,尿液为3.50μg/L,血浆和尿液中未检出其他同化激素。结果表明,该方法可用于监控实际生产中该类激素的非法添加和残留检测。
3 讨论
3.1 MS/MS特征离子的选择
本文采用电喷雾电离,用针泵连续直接进样,对8种物质的质谱条件进行优化。在正离子模式下,8种激素都可形成稳定的[M+H]+准分子离子,然后进行相应的子离子全扫描,以确定MRM 参数(表1)。
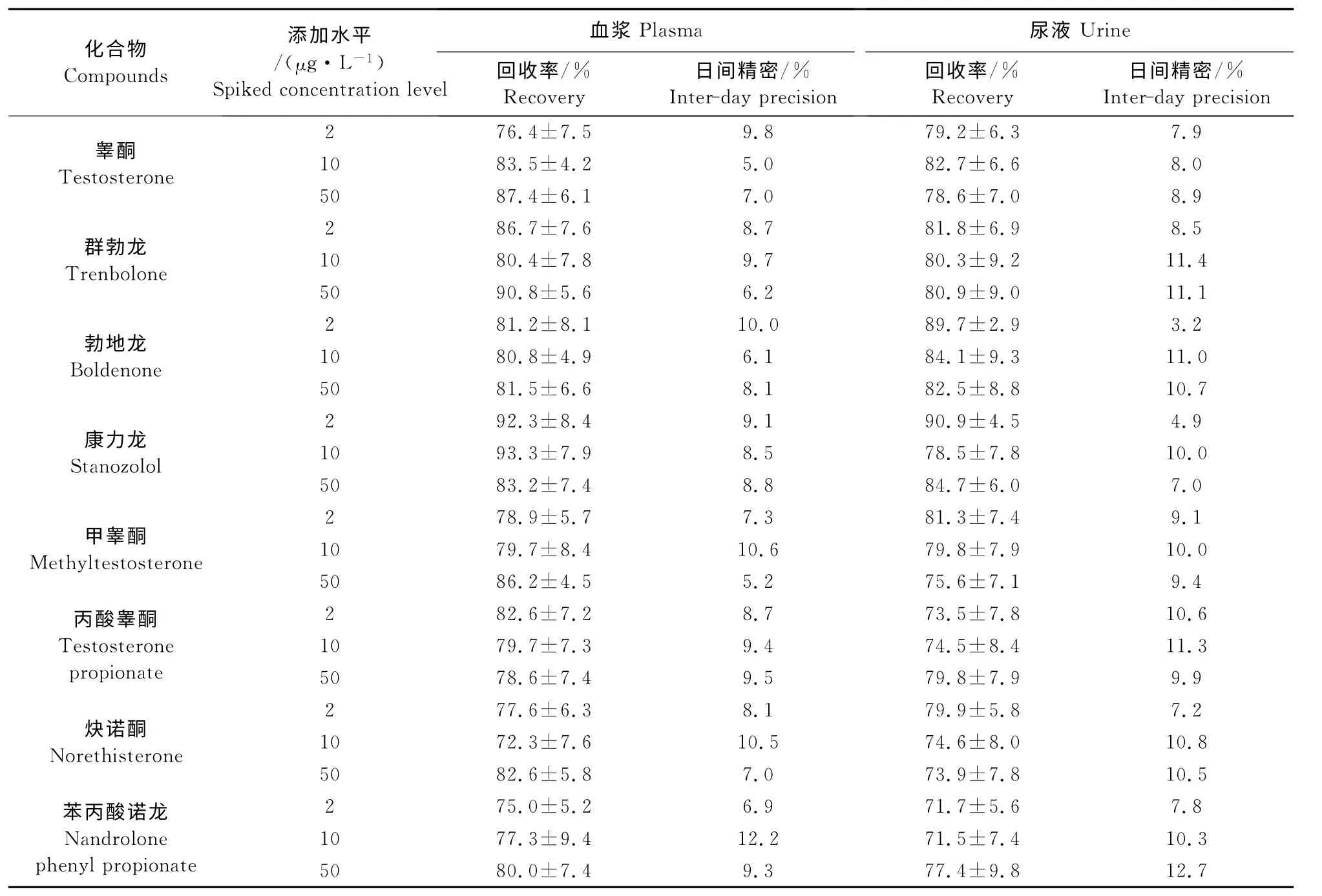
表3 猪血浆和尿液中8种同化激素的回收率及精密度(n=6)Table 3 Recoveries and precisions of eight steroids hormones in plasma and urine of swine(n=6)
3.2 样品前处理优化
3.2.1 酶解 外源性同化激素在动物体内的代谢情况比较复杂,目前没有文献明确指出8种激素动物体内代谢过程和代谢途径。黄冬梅等[7]报道蛋白同化激素多以葡萄糖醛酸结合形态存在,因此本试验选择酶解。
3.2.2 提取液的选择 试验对比了乙醚[8]、叔丁基甲醚[9]、乙酸乙酯[10]等溶剂或混合溶液[7]的提取效果,发现用甲醇提取样品杂质较多,基质干扰较为严重;叔丁基甲醚提取时,群勃龙、炔诺酮、苯丙酸诺龙的回收率低于50%。乙酸乙酯提取时各个药物的回收率较高,且易于浓缩,最终选择乙酸乙酯作为提取液。
3.2.3 固相萃取柱的选择 考虑到尿液酶解后产物相对较多,本试验采用目前最常用的净化方式SPE净化[7-13]。由于该类物质为中等极性或者弱极性,多数文献采用HLB 和C18固相萃取小柱。Wozniak B等[11]将尿液直接通过C18固相萃取小柱和NH2固相萃取小柱富集、净化,以减少基质干扰。王旭峰等[12]将尿液直接冷冻、复溶后经MCX 小柱净化,上机检测。
本试验对比了8 种同化激素在HLB 和C18两种固相萃取小柱上吸附效果,发现各个药物在C18固相萃取柱上回收率均较高,同时考虑其成本相对较低,最终选择C18柱。
3.3 基质效应的消除
利用ESI离子源对目标物进行分析时会产生较强的基质效应,试验中采用在空白提取液中加入不同浓度的混合标准溶液,按照已定的色谱、质谱条件进行检测,与相应流动相(纯溶剂)中待测物的离子强度进行比较。结果发现8种同化激素在血浆和尿液中的响应值均比标准溶液低,存在基质抑制效应。为消除或减少基质效应,本试验采用空白基质匹配标准校正定量[13-14]。
3.4 实际样品检测
应用建立的分析方法,对30 个养殖场随机采集的60份猪血浆和尿液进行测定,其中1份血浆和尿液样品睾酮结果为阳性,血浆和尿液中未检出其他同化激素。说明该方法对监控实际生产中该类激素的非法添加有重要的意义。
本试验建立了猪血浆和尿液中睾酮、群勃龙、勃地龙、康力龙、甲睾酮、炔诺酮、丙酸睾酮及苯丙酸诺龙8种同化激素的LC-MS/MS检测方法,该方法前处理简单、方便,为监控猪生产中该类物质的非法添加使用提供一定的技术支持。
[1] Chang C,Saltzman A,Yeh S,et al.Androgen receptor:An overview[J].Critical Reviews in Eukaryotic Gene Expression,1995,5(2):97-125.
[2] 左晓磊,付新城.畜禽产品中的兽药品残留[J].动物医学进展,2010(S1):237-240.
[3] 农业部.中华人民共和国农业部公告第176号公告:禁止在饲料和动物饮用水中使用的药物品种目录.[S/OL].[2002-02-09].http://www.doc88.com/p-8139044830166.html
[4] 许婷婷.动物肌肉中同化激素类药物残留的HPLC 分析[D].江苏无锡:江南大学,2009.
[5] Zeng D,Lin C,Zeng Z,et al.Multi-residue determination of eight anabolic steroids by GC-MS in muscle tissues from pigs[J].Agri Sci China,2010,9(2):306-312.
[6] Hansen M,Jacobsen N W,Nielsen F K,et al.Determination of steroid hormones in blood by GC-MS/MS[J].Anal Bioanal Chem,2011,400(10):3409-3417.
[7] 黄冬梅,惠芸华,沈晓盛,等.HPLC-M/SMS测定河蟹中蛋白同化激素残留量[J].中国卫生检验杂志,2011(1):48-49.
[8] Vanhaecke L,Vanden B J,Wille K,et al.Ultra-high performance liquid chromatography-tandem mass spectrometry in high-throughput confirmation and quantification of 34anabolic steroids in bovine muscle[J].Anal Chim Acta,2011,700(1-2):70-77.
[9] Zeng Z,Liu R,Zhang J,et al.Determination of seven free anabolic steroid residues in eggs by high-performance liquid chromatography-tandem mass spectrometry[J].J Chromatogr Sci,2013,51(3):229-236.
[10] You Y,Uboh C E,Soma L R,et al.Simultaneous determination of testosterone and testosterone enanthate in equine plasma by UHPLC-MS-MS[J].Chromatographia,2010,72(11):1097-1106.
[11] Wozniak B,Matraszek-Zuchowska I,Zmudzki J.LC-MS/MS fast analysis of androgenic steroids in urine[J].Anal Bioanal Chem,2012,403(10):2965-2972.
[12] 王旭峰,赵 丽,张高奎,等.液相色谱-串联质谱法同时测定猪尿中23种违禁药物[J].分析化学,2013(8):1254-1258.
[13] 邱增枝,郑增忍,赵思俊,等.UPLC-MS/MS法测定猪尿中β_2-受体激动剂的基质效应研究[J].动物医学进展,2013,34(9):66-70.
[14] 王立琦,贺利民,曾振灵,等.液相色谱-串联质谱检测兽药残留中的基质效应研究进展[J].质谱学报,2011,32(6):321-332.

