硫酸盐还原菌制备纳米硫化镉的研究*
高 艳,白红娟**,贡 俊,宋霄敏
(1.中北大学 环境与安全工程系,山西 太原 030051;2.山西财经大学 环境经济系,山西 太原 030006)
由于纳米CdS微粒在光、电、磁、催化等方面有巨大的应用潜能(如发光二极管、传感器、光催化等领域)[1],因而引起人们的高度重视。
制备CdS纳米晶的方法有水热法[2]、溶剂热法[3]、模板法[4]、气相沉积法[5],微乳液法[6]等。但以上方法往往要在高温高压无氧等苛刻的条件下进行,或者需要利用毒性较大的原料及有机溶剂。
一些研究者开始转向微生物法合成纳米材料,如2004年Sweeney等人的研究则表明大肠杆菌(E.coli)在含有CdCl2和Na2S的培养基中在细胞内形成了纤锌矿结构的纳米CdS晶体,并且E.coli在生长的稳定期形成纳米晶体的速度是对数增长期的20倍[7]。此外中北大学的白红娟教授在2009年利用固定化光合细菌合成了纳米硫化镉,并对其影响因素和光致发光特性进行了研究[8]。
作者利用硫酸盐还原菌合成了纳米硫化镉,该微生物法具有一些独特的优点,与传统的物理和化学纳米合成技术相比,纳米生物合成技术清洁、无毒、环境友好和可持续发展,反应条件温和可控,不需添加任何还原剂,效率高等优点成为纳米合成领域研究热点[9]。
1 实验部分
1.1 实验材料
1.1.1 菌种
硫酸盐还原菌,由山西财经大学环境经济系惠赠。
1.1.2 试剂
采用的试剂有氯化镉(CdCl2)、氢氧化钠(NaOH):以上试剂均为分析纯,市售。
1.1.3 基础培养基
硫酸盐还原菌(sulfate reducing bacteria,SRB)基础培养基组成[10]:NH4Cl 1.0 g,MgSO4·7H2O 2.0 g,Na2SO41.0 g,乳酸钠(质量分数70%)3.5 mL,酵母膏1.0 g,CaCl2·2H2O 0.1 g,K2HPO40.5 g,抗坏血酸0.1 g,蒸馏水1 000 mL,pH调节为7.4。以上试剂均为国产市售分析纯。
1.1.4 仪器设备
JA2003型电子天平:上海佰栾仪器仪表有限公司;LDZX-50KBS型立式压力蒸汽灭菌锅:上海申安医疗器械厂;303-2电热恒温培养箱:上海跃进医疗器械厂;TD-3500型X射线衍射仪:上海沪峰化工有限公司;JSM-6700F型扫描电子显微镜(SEM):日本电子公司JEOL;牛津能谱仪:牛津仪器(上海)有限公司。
1.2 实验方法
1.2.1 SRB的富集培养
将一定量的硫酸盐还原菌(SRB)接种到装有基础培养基的透明瓶中,振荡混匀,封口,置于30 ℃黑暗恒温箱静止培养。每4~5 d将一定量上层液接入新鲜培养液中。随着转接次数增加,SRB 得以不断富集。经20 d 富集培养后,每5 d 取50 mL 上层液接入500 mL 新鲜培养液之中,作为SRB 的日常保存和培养液使用。
1.2.2 纳米硫化镉的制备
纳米硫化镉生成培养基组成:ρ(NH4Cl)= 1.0 g/L,ρ(MgSO4·7H2O)= 2.0 g/L,ρ(Na2SO4)=1.0 g/L,φ(乳酸钠)=3.5 mL/L(质量分数70%),ρ(酵母膏)=1.0 g/L,ρ(CaCl2·2H2O) =0.1 g/L,ρ(K2HPO4)=0.5 g/L,ρ(抗坏血酸)=0.1 g/L,将一定量CdCl2与上述培养基组分一同溶于蒸馏水中,使ρ(Cd2+)=170 mg/L,进行高温高压灭菌后,在无菌条件下,接种一定量的硫酸盐还原菌。分别考察不同pH值、温度和接种量对合成纳米硫化镉的影响。调节培养液pH值分别为5.0,6.0,7.0,8.0和9.0,考察pH值变化对纳米硫化镉生成的影响;将培养物分别置于15,25和35 ℃,考察培养温度变化对纳米硫化镉生成的影响;改变菌液接种量分别为5%、10% 和20%,考察接种量变化对纳米硫化镉生成的影响。规定条件为:厌氧黑暗培养(5 L三角瓶装满培养物,盖橡皮塞;黑暗,静置),pH=7.0,温度30 ℃,接种量为10%。反应7~10 d后,瓶底有大量黄色硫化物沉淀产生,并沉降下来。然后倾去上层清液,对所获得的沉淀底物进行离心并收集积累于瓶底的沉淀物(2 000 r/min,10 min),蒸馏水洗涤5次,100 ℃真空干燥获得固体粉末。
2 结果与讨论
2.1 硫酸盐还原菌制备纳米硫化镉的优化条件研究
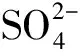
在温度30 ℃、接种量10%时,pH值变化对纳米硫化镉生成的影响见图1。
pH图1 pH值变化对纳米硫化镉生成的影响
由图1可见,在pH=7.0的中性条件下Cd2+表现出最大的转化率,过酸过碱Cd2+转化率都呈下降之势,酸性条件尤甚。从菌的生长情况来看,过酸过碱确实导致上层培养液的浊度降低,菌数减少。虽然SRB能够在pH=4.5~9.5生存,但其最适pH=6.5~7.5。在pH值中性条件下,SRB菌活性最强,Cd2+转化率也最高。
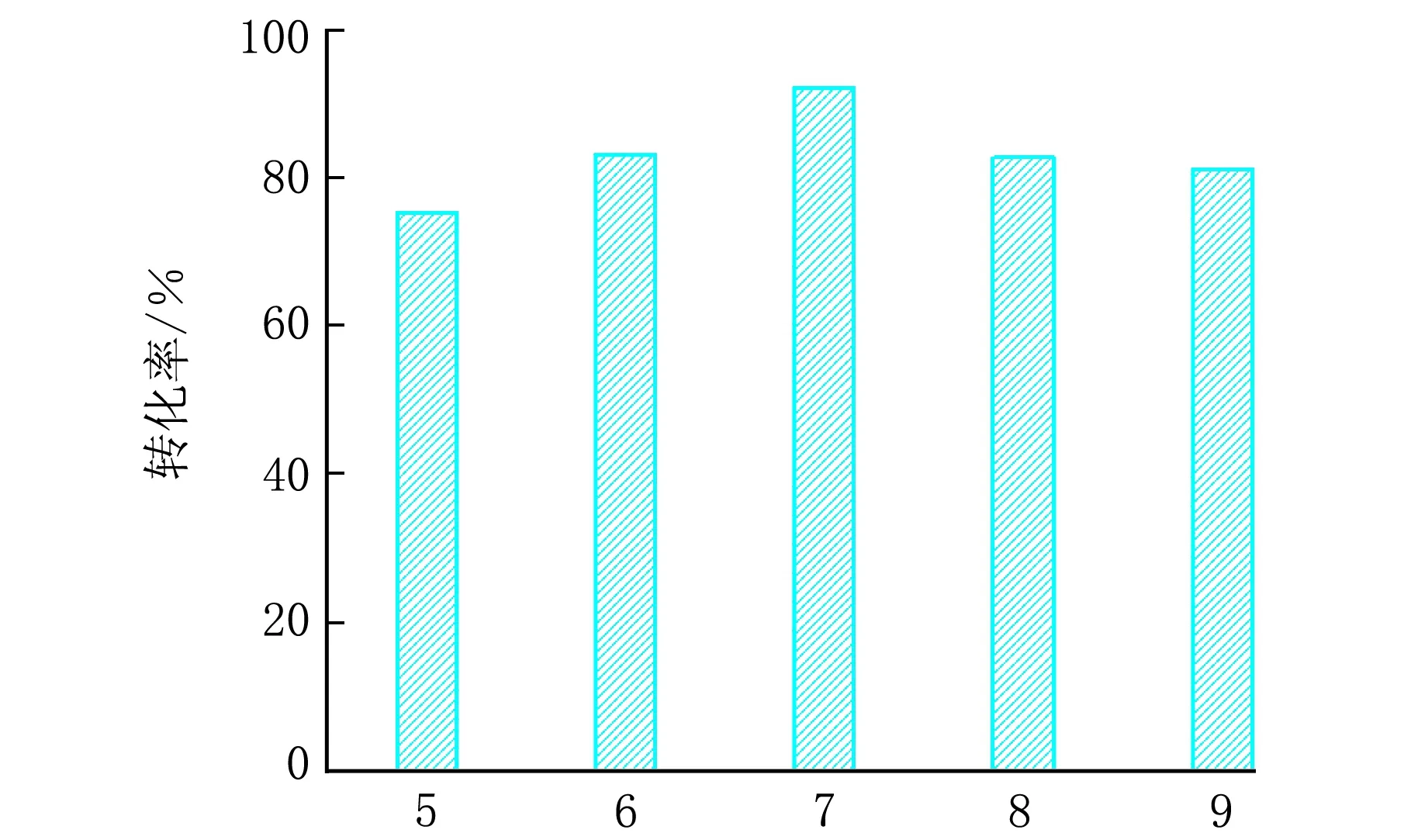
在pH=7、接种量10%时,不同温度下Cd2+的转化率见图2。
t/℃图2 培养温度变化对纳米硫化镉生成的影响
由图2可见,30 ℃培养温度下Cd2+具有最大转化率;温度过低导致Cd2+的转化率下降。这是由于SRB 菌的最适生长温度为30~37 ℃,在此温度下SRB 菌的活性最大,故Cd2+的转化效率最高。
在pH=7、温度30 ℃时,不同接种量条件下Cd2+的转化率见图3。

接种量/%图3 接种量变化对纳米硫化镉生成的影响
由图3可知,Cd2+的转化率随接种量的增加而增大。接种量小,菌数减少,对有机底物的利用力有限,致使Cd2+的转化率降低。
2.2 硫酸盐还原菌生成纳米硫化镉的物相、形貌和组成分析
2.2.1 X射线衍射分析
30 ℃时硫酸盐还原菌合成产物的XRD 图见图4。
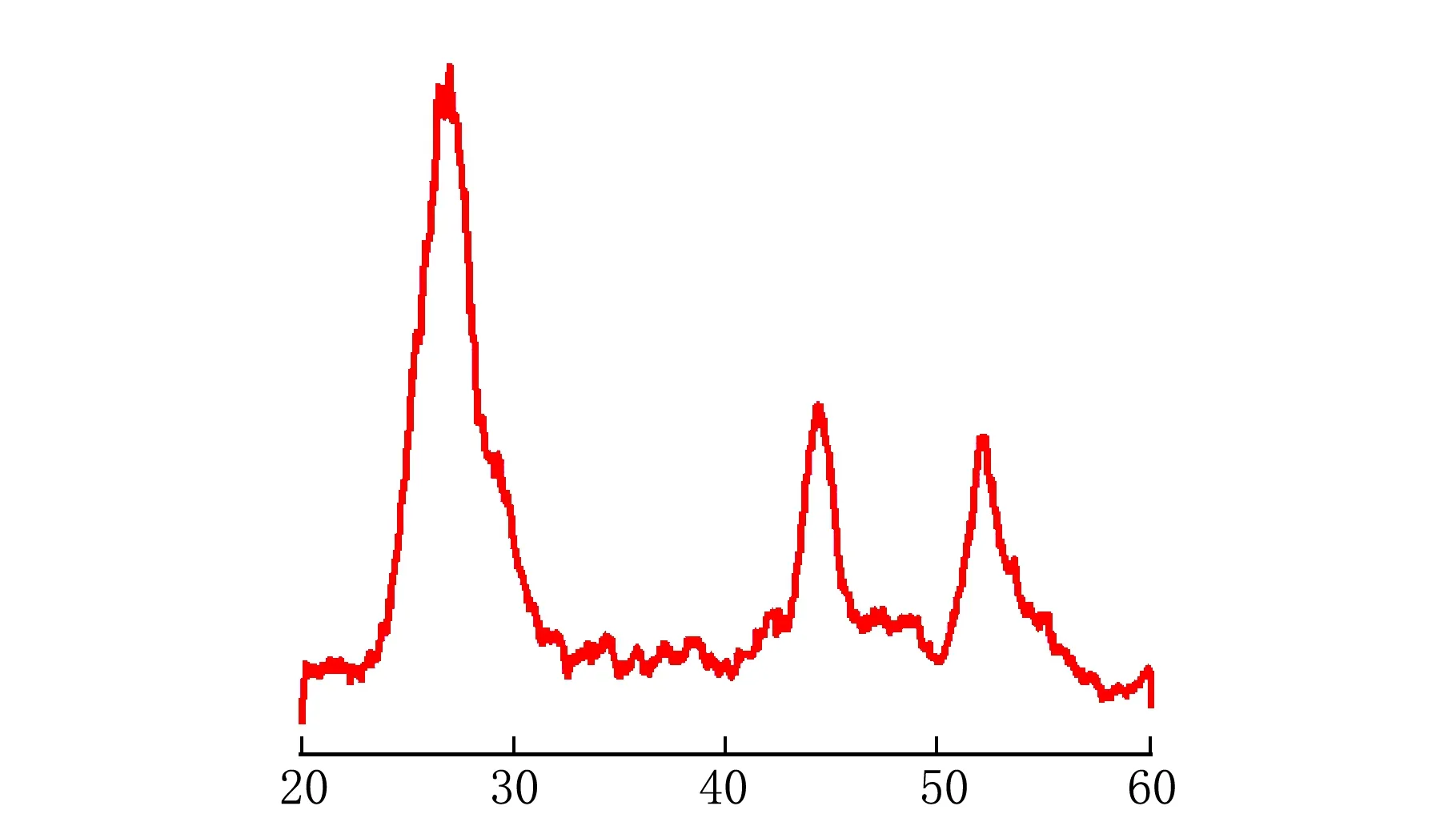
2θ/(°)图4 最佳条件下制备的纳米CdS颗粒XRD图
图4中,该样品无明显的杂峰,在2θ=26.6°,44.1°,52.1°附近出现了对应的特征峰,与XRD 标准PDF 卡片(42-1411)相符合,其晶面分别为(111),(220),(311)。样品的衍射峰尖锐,并且没有出现杂质峰,表明样品结晶性良好,晶型单一。
2.2.2 扫描电镜分析
对制得的纳米硫化镉颗粒进行扫描电镜分析,见图5。

图5 最佳条件下制备的纳米CdS颗粒的SEM图
由图5SEM图片可以看出:硫化镉微粒呈球形,粒径尺寸较小,微粒的平均粒径约为10 nm。
2.2.3 能谱定量分析
收获产物的EDS能谱见图6。

E/keV图6 最佳条件下纳米CdS颗粒的EDS谱图
由图6可见,沉淀物质由Cd和S 2种元素组成,而且Cd和S的原子数之比为1∶1,表明其化学组成为CdS,没有杂质,纯度高。能谱的测定需要在铜网碳膜上进行,故谱图中有Cu和C 2种元素。
3 结 论
(1) 利用硫酸盐还原菌建立了生物合成纳米CdS的途径,Cd2+可以直接和硫酸盐还原菌产生的硫化物反应生成纳米硫化镉颗粒,通过对转化率研究,合成纳米硫化镉的最佳条件:pH值为 7,温度为30 ℃,接种量为20%。
(2) 通过对最佳条件下合成的产物进行XRD、SEM和EDS表征,表明了所获得的产物为分布均匀的球形纳米硫化镉粒子,平均粒径约为10 nm。该方法具有较高的应用价值和研究前景。
[ 参 考 文 献 ]
[1] 孙景志,曹健,李寒莹.CdS 纳米棒/酞箐氧钛复合光导体的光电导性能[J].高等学校化学学报,2005,26(9):1722-1725.
[2] 臧会鑫,赵高凌,韩高荣.CdS纳米粒子的水热微乳法的制备[J].无机化学学报,2006,22(5):917-919.
[3] Jum S J,Upendra AJ,Jae SL.Solvothemal synthesis of CdS nanowires for photocatalytic hydrogen and electricity production[J].J Phys Chem C,2007,111(35):13280-13287.
[4] Johnson B J,wolf J H,Zalusky A S,et al.Template syntheses of polymer monoliths[J].Chem Mater,2004,16(15):2909-2917.
[5] Barrele C J,Wu Y,Bell D C,et a1.Synthesis of CdS and ZnS nanowires using single-source molecular precursors[J].J Am Chem Soc,2003,125(38):11498-11499.
[6] Wang F,Xu G,Zhang ZH,et al.Synthesis of monodisperse CdS nanospheres in an inverse rnicroemulsion system formed with a dendritic polyether copolymer[J].European Journal of Inorganic Chemistry,2006(1):109-114.
[7] Sweeney RY,Mao C,Gao X,et al.Bacterial biosynthesis of cadmium sulfide nanocrystals[J].Chem Biol,2004,11:1553-1559.
[8] Bai HJ,Zhang ZM,Guo Y,et al.Biological synthesis of size-controlled cadmium sulfide nanoparticles using immobilized rhodobacter sphaeroides[J].Nanoscale Research letters,2009,4(7):717-723.
[9] 张晓蓉.微生物应用于纳米生物合成技术研究进展[J].微生物学报,2011,51(3):297-304.
[10] Postgate,J R.The sulfate reducing bacteria[M].Cambridge:Cambridge University Press,1984:24.

