23例胃肠间质瘤的MSCT表现与病理分析
刘晓峰,韩军魁,马跃虎
(1.西安市临潼区人民医院放射影像科,陕西 西安 710600;2.南京医科大学附属南京医院放射影像科,江苏 南京 210006)
·经验与总结·
23例胃肠间质瘤的MSCT表现与病理分析
刘晓峰1,韩军魁1,马跃虎2
(1.西安市临潼区人民医院放射影像科,陕西 西安 710600;2.南京医科大学附属南京医院放射影像科,江苏 南京 210006)
目的:探讨胃肠间质瘤MSCT表现及与病理间的关系。方法:收集经病理确诊的胃肠间质瘤23例,对其临床资料及MSCT表现进行回顾性分析。结果:肿瘤位于胃13例,十二指肠1例,小肠5例,食管1例,胃肠道外3例。腔外型5例,壁间型3例,腔内型12例。肿瘤的密度及强化方式与病灶的大小有关,病灶较大者密度更趋于不均匀;肿瘤静脉期强化程度高于动脉期。按照NIH危险度分级标准:极低度1例,低度10例,中度5例,高度7例。结论:MSCT可准确显示胃肠间质瘤的位置、形态及大小,可以初步评估肿瘤的恶性危险度。
胃肠间质瘤;体层摄影技术;X线,电子计算机,断层扫描
2.Department of Radiology, Nanjing First Hospital, Nanjing Medical University, Jiangsu Nanjing, 210006,China)
胃肠间质瘤(gastrointestinal stromal tumor,GIST)源于胃肠道原始间充质细胞,为消化道最常见的间叶性肿瘤,可发生在消化道的任何一个部位,以胃和小肠多见。所有GIST均具有恶性潜能[1],多层螺旋CT(multi slice spiral computed tomography,MSCT)检查常常用于GIST的术前诊断及分期[2]。本文对23例经病理及免疫组织化学确诊的GIST资料及其影像表现进行分析,以提高对胃肠间质瘤的诊断和鉴别诊断能力。
1 资料与方法
1.1 一般资料 收集2012年3月至2013年12月经手术病理确诊为GIST的患者资料23例,其中:男11例,女12例;年龄19~82岁,平均62±1岁。临床表现主要有腹部不适、腹痛、便血、呕血、发现腹部肿块等。
1.2 仪器与方法 设备使用Siemens Sensation 16层CT和Philips Ingenity 128层CT。患者空腹8 h以上,检查前30 min内口服温水800~1 000 mL。扫描范围从膈顶至耻骨联合,行平扫加增强3期扫描。扫描参数:层厚5 mm,层距5 mm;电压120 kV,管电流300~350 mA。应用高压注射器经肘前静脉注射非离子型对比剂优维显100 mL,注射速度3~5 mL/s。采用自动示踪技术(CT阈值=120 Hu)行动脉期增强扫描,结束后延时20 s、80 s采集静脉期、平衡期数据。
1.3 图像分析 所有图像均转入PACS系统(MiStudio V5.12),由2名资深放射科医师分析图像并记录病灶的CT表现,包括记录病灶部位(分为胃底、胃体、胃窦、十二指肠、小肠、食管及胃肠道外),测量肿瘤最大直径,观察病灶的形态、病灶的密度是否均匀及强化方式,观察病灶与周围脏器分界情况、病灶的生长方式(分为腔外型、腔内型及同时向腔内外生长的壁间型)。
1.4 病理学诊断方法 所有患者均经病理组织学及免疫组化染色并确诊。病理危险度参照美国国立卫生研究院(National Institutes of Health,NIH)2008年标准分为极低度、低度、中度、高度4个危险程度。
2 结 果
2.1 肿瘤的部位及分型 位于胃底7例,胃体部5例,胃窦1例,十二指肠1例,小肠5例,食管1例,胃肠道外3例;肿瘤向胃肠道腔外生长(腔外型)5例,同时向腔内和腔外生长(壁间型)3例,向腔内生长(腔内型)12例。肿瘤最大直径为1.5~18 cm,平均5.3 cm。详见表1。
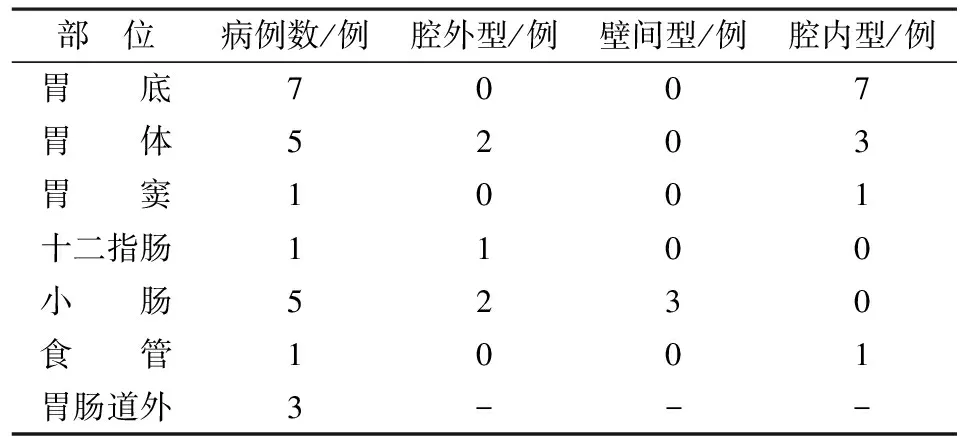
表1 GIST的部位及分型
2.2 肿瘤的CT表现 平扫肿瘤密度较均匀的7例,密度不均匀的16例,其中1例肿瘤内可见低密度气体影(见图1a)。增强扫描后肿瘤强化表现与病灶大小有关:直径<2 cm的肿瘤呈轻、中度均匀强化(见图1b);肿瘤大小在2~5 cm者强化表现不一,可均匀或不均匀强化;肿瘤较大者(>5 cm)表现为周边环形强化或不规则斑片状强化,肿瘤内可见低密度灶(见图1c)。动脉期大部分肿瘤无强化或仅轻度强化,仅有1例动脉期明显强化,多数肿瘤静脉期强化程度高于动脉期。少数肿瘤侵犯周围脏器表现为肿瘤与邻近脏器间的脂肪间隙消失(见图1d),所有病例均未见腹腔淋巴结增大表现。
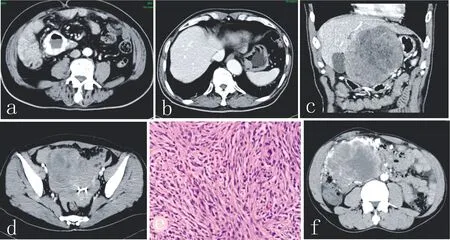
注:1)图1a:小肠腔外肿块,内见气液平,动脉期明显强化,术后病理低度危险度;2)图1b:胃底腔内软组织肿块,病灶最大径<2 cm,均匀强化,边界较清,术后病理中度危险度;3)图1c:冠状位重建图像,胃体腔外巨大软组织肿块,强化不均匀,病理高度危险度;4)图1d:小肠腔外软组织肿块,强化不均匀,与邻近子宫境界不清,病理高度危险度;5)图1e:为图1d患者病理图片,高倍镜下可见梭形细胞,核分裂>5/50;6)图1f:腹腔内形态不规则软组织肿块,强化不均匀,边界不清,边缘可见迂曲强化的血管影,术后病理高度危险度
图1 GIST的CT和病理检查图片
2.3 肿瘤的病理结果 病理组织学显示为梭形细胞、上皮样细胞为主(图1e),肿瘤较大内可见囊变及坏死,免疫组化示CD117阳性23例,CD34阳性22例。按照NIH危险度分级标准极低度1例,低度10例,中度5例,高度7例。
2.4 CT表现与病理关系 7例高度危险度病例:肿瘤均大于5 cm,其中3例大于10 cm;3例为胃肠道外病变(图1f),3例病灶位于小肠,仅1例病灶位于胃体;CT表现病灶密度不均匀,呈不均匀强化;病灶以腔外型为主(3例),壁间1例,病灶边界不清者4例。5例中度危险度及10例低度危险度病例:病灶大小在1.5~5 cm之间;3例位于小肠,其余12例均位于胃;病灶密度及强化方式与病灶的大小有关,病灶较大者更趋于不均匀,边界清楚或部分清楚;病灶多数位于胃(11例),小肠3例,食管1例,腔内型12例,壁间型2例,腔外型2例。1例极低危险度病例病灶2 cm大小,密度均匀,均匀轻度强化,病灶位于胃底腔内,边界清楚。
3 讨 论
GIST是起源于胃肠道壁肌层Cajal细胞及与Cajal细胞同源的间叶干细胞的肿瘤[3],约占全部胃肠道肿瘤的0.3%,也可发生于胃肠道外的腹腔其他部位,以往多诊断为平滑肌肿瘤或神经源性肿瘤,Mazur等于1983年根据肿瘤的分化特征提出命名。肿瘤由不同数量的梭形细胞和上皮样细胞组成[4],恶性GIST可经血行和种植转移至肝、腹膜和肺等部位,淋巴结转移少见。目前确诊GIST主要依靠病理免疫组化和电子显微镜检查。GIST的免疫组化检查表现为CD117和(或)CD34阳性。本组胃肠间质瘤CD117阳性23例(100%),CD34阳性22例(95.7%)。
根据瘤体与胃肠道管壁的关系可分为4型。(1)腔内型(又称黏膜下型):肿瘤从黏膜下生长向腔内突出,形成边缘光滑的肿块,可有分叶或切迹,亦可有囊变、坏死或钙化,本组有12例;(2)壁间型:肿瘤同时向腔内外生长突出,呈哑铃状骑跨生长,对周围组织或器官有不同程度推挤或压迫,本组有3例;(3)腔外型:肿瘤向胃肠道腔外生长,形成与胃肠道关系紧密的软组织肿块,本组有5例;(4)此外还有少数位于胃肠道外,肿瘤起源于胃肠道外的腹内其他部位,可为肠系膜、大网膜内的软组织肿块,或位于其它脏器内,本组3例胃肠道外型分别位于肠系膜内、肝内及卵巢。
GIST在MSCT上多呈圆形或类椭圆形软组织密度肿块,体积较大者可有分叶,多数边界清楚,病灶密度及强化方式与肿瘤大小有关,肿瘤较小多较均匀,病灶较大者密度多不均匀,强化也不均匀,尤其病灶大于5 cm者,与肿瘤内部的出血、囊变、坏死有关。肿瘤的强化多呈轻中度均匀或不均匀强化,静脉期持续强化并且高于动脉期。本组仅有1例动脉期明显强化,静脉期强化也高于动脉期。有研究表明,肿瘤恶性危险程度与CT表现之间存在一定相关性。本组病例中恶性危险度高者病灶直径均大于5 cm,边界可不清楚,易侵犯邻近器官,病灶密度不均匀,中央可见坏死,病灶内出现钙化少见。有文献报道,恶性危险度高者可见散在斑点状钙化灶[5]。本组病例中病理危险度低的病灶CT表现为病灶较小,一般不超过2 cm,边界清楚,密度均匀,呈较均匀的轻度强化。由此,我们认为,GIST病灶在MSCT上表现为较大病灶、有侵袭性表现时其病理危险度高,而病灶较小、呈良性病变表现的病理危险度低。此外,根据NIH危险度分级标准,病灶同样大小、胃肠道外GIST恶性危险度高于胃肠道的GIST,本组3例胃肠道外GIST均为高度危险度。
在MSCT表现上GIST与胃肠道壁相连部位以外的管壁结构层次正常,可以同胃癌、胃肠道浸润型淋巴瘤等鉴别,但与平滑肌肉瘤、平滑肌瘤、神经内分泌肿瘤、神经鞘瘤等常见间叶源性肿瘤仅凭影像诊断难以鉴别,需要通过免疫组化分析鉴别。CD117和CD34在GIST中的阳性表达率很高[6],而在胃肠道平滑肌肿瘤及神经源性肿瘤中均不表达。
通过对本组病例资料的分析显示,MSCT检查对于GIST的定位、形态大小判断较准确,分析CT表现可以初步评估肿瘤的恶性危险度,为临床设计治疗计划和评估预后提供重要的参考信息。
[1]Lasota J, Miettinen M. Clinical significance of oncogenic KIT and PDGFRA mutations in gastrointestinal stromal tumours[J]. Histopathology, 2008, 53(3): 245-266.
[2]祁义军,孟翔凌,赵文娣,等.胃肠间质瘤161例临床病理特征和预后相关因素分析[J].安徽医科大学学报,2012,47(8):963-965.
[3]杨其昌,季晓华,沈屹,等.74例胃肠道间质瘤临床病理与生物学行为评价[J].中华病理学杂志,2005,34(1):6-10.
[4]延宏,单裕清,赵记明,等.螺旋CT扫描对胃肠道间质肿瘤的诊断及其病理分析[J].中国CT和MRI杂志,2006,4(3):28-29.
[5]王冬青,曾蒙苏,饶圣祥,等.CT在胃肠道间质瘤诊断及随访中的价值[J].实用放射学杂志,2006,22(6):695-697.
[6]柳娟,刘宇虎.胃肠道间质瘤CD117、CD34、SMA、S-100蛋白、Vim、结蛋白的表达及临床意义[J].南方医科大学学报,2008,28(3):438-440.
Analysis of MSCT Features and Clinical Pathology in Patients with Gastrointestinal Stromal Tumors
LIU Xiaofeng1,HAN Junkui1,MA Yuehu2
(1.Department of Radiology, Lintong District People’s Hospital of Xi'an city, Shaanxi Xi’an, 710600,China;
Objective:To explore the relationship between MSCT performance of the stromal tumors and gastrointestinal pathology.Methods:A retrospective analysis was performed on the pathological diagnosis,clinical data and MSCT performance in 23 cases of gastrointestinal stromal tumors.Results:There were 13 cases of gastric tumor and 1 case of duodenal tumor,5 cases of small intestine tumor,1 case of esophagus tumour; and parenteral 3 cases.Outside cavity 5 cases,intramural type 3 cases,intracavity 12 cases were founded.Tumor density and enhancement pattern were related to the size of the lesion,the larger lesions tended to be more uneven. The degree of enhancement of tumor in venous phase was higher than that in arterial phase.Risk classification on NIH criteria:the lowest degree 1 case,low 10 cases, moderate 5 cases,the height 7 cases were founded.Conclusion:MSCT can accurately show the location,shape and size of GIST,and can initially assess the risk of malignant tumors.
Gastrointestinal stromal tumors; Tomography; X-ray computed
马跃虎,mayuehu1976@163.com
R735;R814
A
10.11851/j.issn.1673-1557.2015.01.013
http://www.cnki.net/kcms/detail/51.1688.R.20141218.1633.004.html
2014-04-08)

