苯磺贝他斯汀片微生物限度检查方法的验证
朱庆丽,王 威,凌 真,钱 斐
(扬州市食品药品检验检测中心,杨州 225009)
苯磺贝他斯汀片微生物限度检查方法的验证
朱庆丽,王 威,凌 真,钱 斐
(扬州市食品药品检验检测中心,杨州 225009)
目的:建立苯磺贝他斯汀片的微生物限度检查法,并对其进行验证。方法:按2015版《中国药典》(四部)相关内容,以试验菌回收率在0.5~2为要求,细菌、霉菌及酵母菌采用常规平皿法;大肠埃希菌采用常规法。结果:采用常规法,白色念珠菌的回收率小于50%,其余试验菌的回收率均在0.5~2之间。通过增加稀释液法,可消除供试品对白色念珠菌的抑制作用,其回收率在0.5~2之间;控制菌采用常规法即可检出。结论:细菌计数采用常规平皿法,霉菌及酵母菌计数采用培养基稀释法,控制菌按常规法,可作为苯磺贝他斯汀片微生物限度检查方法。
苯磺贝他斯汀片,微生物限度方法适用性试验,集落计数,验证
苯磺贝他斯汀片为口服片剂,是一种常见的抗过敏药,临床运用于荨麻疹、过敏性鼻炎、皮肤疾病引起的瘙痒(湿疹、痒疹、皮肤瘙痒症)等,使用同时也存在尿量减少、呼吸困难、肢体麻木等不良反应。关于本品,检验标准研究还较少,在微生物限度检查方面鲜有研究。本实验以试验菌的回收率为依据,对该口服片剂的细菌、霉菌及酵母菌的计数以及控制菌进行验证,能有效反应该片剂在生产、运输、存储过程中的污染情况,有助于提高该制剂的质量控制水平。
1 仪器与试药
1.1 试验样品 苯磺贝他斯汀片(规格:10 mg,批号20130401、20130402、20130403,江苏联环药业股份有限公司)。
1.2 实验仪器及设备 电热恒温干燥箱(HKG-9220A型,广东环凯微生物科技有限公司),压力蒸汽灭菌器、生物显微镜、净化工作台、生化培养箱(SPX-250B-Z型,上海博迅实业有限公司医疗设备厂),霉菌培养箱(MJX-250B-Z型,上海博迅实业有限公司医疗设备厂),海尔冷柜,水浴振荡器,电子天平。
1.3 验证用菌种 铜绿假单胞菌[CMCC(B)10104]、白色念珠菌 [CMCC(F) 98001]、枯草芽孢杆菌 [CMCC(B) 63501]、金黄色葡萄球菌 [CMCC(B) 26003]、黑曲霉 [CMCC(F) 98003)]、大肠埃希菌[CMCC(B)44102],均来源于中国食品药品检定研究院。
1.4 验证用培养基及稀释剂 胰酪大豆胨琼脂培养基(颗粒,批号20150922)、麦康凯琼脂培养基(颗粒,批号20150819)、沙氏葡萄糖琼脂培养基(颗粒,批号20150923)、胰酪大豆胨液体培养基(批号20151105)、沙氏葡萄糖液体培养基(颗粒,批号20150722)、pH 7.0氯化钠蛋白胨缓冲液(批号20150108),均由青岛高科技工业园海博生物技术有限公司生产。
2 方法与结果
2.1 供试液的制备 选取两个相同包装的供试品,从最小包装单位中量取各5 g(共10 g)的样品,加pH 7.0无菌氯化钠蛋白胨缓冲液至100 ml,然后用匀浆仪充分混匀,并最终将其制成1∶10的供试液。
2.2 菌液的制备 取经30~35 ℃培养18~24 h的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌第三代培养物,用0.9%无菌氯化钠溶液稀释为不大于100 cfu/ml的菌悬液。取经20~25 ℃培养24~48 h的第二代白色念珠菌,用上述溶液稀释成不大于100 cfu/ml的菌悬液。取经20~25 ℃培养5~7 d的第三代黑曲霉,加适量含0.05%聚山梨脂80的0.9%无菌氯化钠溶液洗下孢子,并稀释成不大于100 cfu/ml的孢子悬液。
2.3 培养基的适用性检查
2.3.1 方法 取稀释后的铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌,分别注入到无菌平皿中,并立即倾注胰酪大豆胨琼脂培养基,每株试验菌平行制备 2 个平皿,混匀,凝固,放置 30~35 ℃培养 48 h,计数;取稀释后的白色念珠菌、黑曲霉,分别注入无菌平皿中,立即倾注沙氏葡萄糖琼脂培养基,平行制备 2 个平皿,混匀,凝固,置20~25 ℃培养 72 h,计数,同时,用相应的对照培养基替代被检培养基进行上述试验。
2.3.2 结果判定 通过观察和计数,被检培养基上的菌落平均数与对照培养基上的菌落平均数相比,明显大于对照培养基上的菌落平均数的50%,且菌落形态、大小与对其基本一致,可以判断培养基的适用性检查符合规定。
2.4 细菌、霉菌及酵母菌计数方法的验证 当建立产品的微生物限度检查法时,应对细菌、霉菌及酵母菌的计数方法进行验证,以确认该产品的细菌、霉菌及酵母菌可以采用该方法进行测定[1]。
2.4.1 试验组 取 1∶10的供试液和相应的试验菌悬液各 1 ml至无菌平皿中,然后注入胰酪大豆胨琼脂培养基或沙氏葡萄糖琼脂培养基,每株试验菌平行制备 2个平皿,混匀,冷却,凝固。分别制成含铜绿假单胞菌、白色念珠菌、枯草芽胞杆菌、金黄色葡萄球菌及黑曲霉的试验组,细菌在30~35 ℃培养箱中培养24~ 48 h,霉菌及酵母菌在20~25 ℃培养箱中培养48~ 72 h,按平皿法计数。
2.4.2 菌液组 用刻度吸管分别吸取各菌液 1 ml,加入相应的培养基,每株试验菌平行制备2个平皿,并且放置在规定的条件下进行培养,然后计数所加的试验菌集落。
2.4.3 供试品对照组 取规定量供试液,加入相应的培养基,按照菌落计数方法,测定该供试品的本底菌数。
2.4.4 回收率的计算 试验组菌回收率(%)=[(试验组平均菌落数-供试品对照组平均菌落数)/菌液组平均菌落数]×100%
2.4.5 实验结果 《中国药典》2015年版四部规定进行3次独立的平行试验,各试验菌株的回收率的比值应在0.5~2范围内。试验结果见表1和表2。
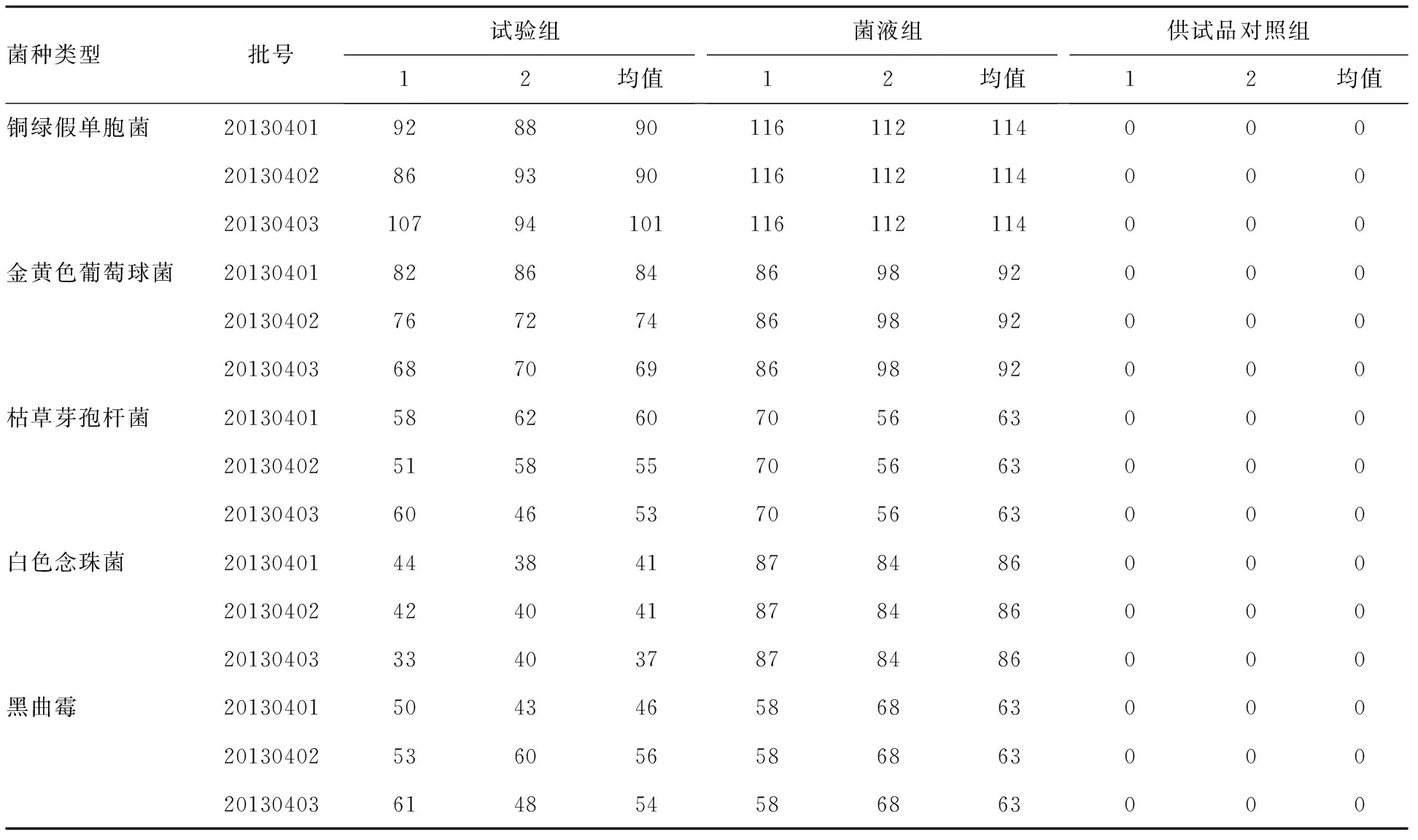
表1 各组菌落计数
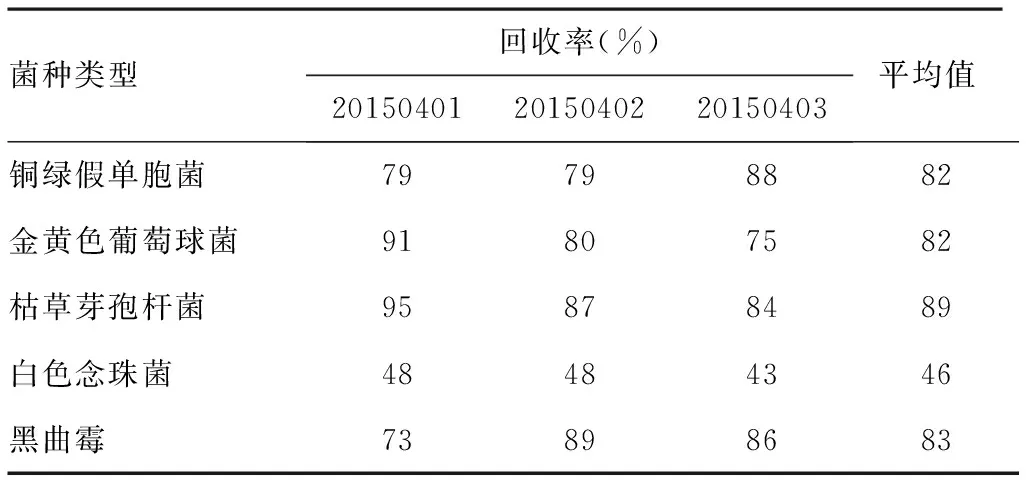
表2 试验组各菌株回收率
由表2可知:通过3次独立的平行试验,试验组的铜绿假单胞菌的平均回收率为82%,枯草芽孢杆菌的平均回收率为89%,金黄色葡萄球菌的平均回收率为82%,黑曲霉的平均回收率为83%,均高于50%,说明此样品对铜绿假单胞菌、枯草芽孢杆菌、金黄色葡萄球菌和黑曲霉均无抑菌作用,可以采用平皿法进行细菌数的测定。而白色念珠菌的试验组平均回收率为46%,低于50%,说明此样品对白色念珠菌有一定的抑菌作用,需要采用增加稀释液法等重新对其菌回收率进行验证。
根据《中国药典》2015版四部微生物计数法,若试验组菌落数减去供试品对照组菌落数的值小于菌液对照组菌落数值的50%,可采用增加稀释液或培养基体积等方法消除供试品的抑菌活性[2]。采用增加稀释液法(制成1∶20供试液)对白色念珠菌重新验证,结果见表3。由表3可知:通过3次独立的平行试验,试验组的白色念珠菌的回收率均大于50%,所以此样品可以采用增加稀释液法来进行霉菌及酵母菌的计数。
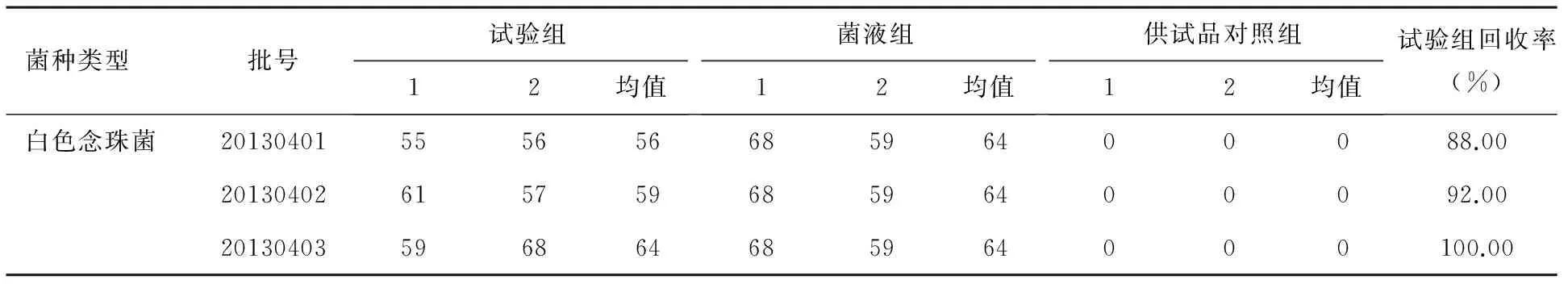
表3 各组白色念珠菌菌落计数及试验组回收率
2.5 控制菌检查方法的验证 苯磺贝他斯汀片为口服化学药,不含药材原粉及动物组织(包括其提取物),在此主要验证其大肠埃希菌。
2.5.1 试验组 取大肠埃希菌的菌悬液 1 ml和1∶10供试品溶液 10 ml,加入到100 ml的胰酪大豆胨液体培养基中,作为试验组。
2.5.2 阳性对照组 取大肠埃希菌的菌悬液 1 ml,加入到 100 ml胰酪大豆胨液体培养基中,作为阳性对照组。
2.5.3 阴性对照组 取pH 7.0无菌氯化钠蛋白胨缓冲液 10 ml,加入到 100 ml胰酪大豆胨液体培养基培养基中,作为阴性对照组。
2.5.4 选择和分离培养 取上述培养物1 ml接种至100 ml麦康凯液体培养基中,42~44 ℃培养24~48 h,取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35 ℃培养18~72 h。若有菌落生长,需分离纯化,确证是否为大肠埃希菌。若没有细菌生长,或虽有细菌生长但鉴定结果为阴性,判未检出大肠埃希菌。
2.5.5 验证结果 试验组和菌液组麦康凯琼脂培养基上有菌落生长,经确证为大肠埃希菌;供试品对照组麦康凯琼脂培养基上无菌落生长,未检出大肠埃希菌。
2.6 结果 经验证,用常规平皿法对细菌数进行测定,采用增加稀释液法对霉菌及酵母菌进行测定,其回收率均在0.5~2范围内。按常规法对大肠埃希菌进行检查,试验组检出阳性对照菌。
3 讨论
药品的微生物检查结果受到很多因素的影响,例如:样品中微生物可能分布不均匀、灭菌的彻底程度、培养基的配制、检验的条件、培养的条件等等[3]。同时,实验用的培养基、菌株的保存及菌液的制备应符合《中国药典》要求[4],实验室菌株的保存与处理也是微生物实验的一个重要环节,标准化、规范化的操作程序可以尽量减少菌种污染和生长特性的改变,以确保不影响实验结果。工作菌株的传代次数应严格控制,不得超过五代(从菌种保藏机构获得的标准菌株为第零代),以防止过度的传代增加菌种变异的风险[5]。再者,操作人员的不熟练对检验结果也会造成影响。比如将1 ml供试液加入到不大于100 cfu的菌悬液,此时还没有注入培养基,而浓度较高的供试液与菌悬液可能不能完全混合,如果该供试品抑菌作用较强,则会影响菌悬液中的活菌计数。因此,在加入供试液和菌悬液后,应立即将培养基注入,否则可能导致微生物迅速生长或死亡,从而影响试验结果。因此,在药品微生物检验的过程中,为使检查结果可靠、可信,必须从所有可能发生的角度去考虑问题,通过方法学验证,严格按照微生物实验室规范指导原则进行试验。
4 结论
苯磺贝他斯汀片的细菌计数采用常规平皿法进行检查,霉菌及酵母菌计数采用增加稀释液法,控制菌按常规法验证。该实验为本品的微生物限度检查提供了可靠的依据。
1 马仕洪,袁美琴,刘鹏,等.《中国药典》2010年版对照培养基的研制与应用[J].中国药事,2012,26(8):847-851
2 中国药典[S].四部.2015:140-144
3 李玉芹.浅谈目前无菌检查和微生物限度检查存在的问题[J].中国药事,2007,21(12):1011-1013
4 马绪荣,苏德模.药品微生物学检验手册[J].北京:科学出版社,2000:62-82
5 汪穗福.微生物检测验证技术[M].北京:中国医药科技出版社,2005:104-107
2015-06-21
R927.11
A
1006-5687(2015)06-0022-03

