双亲姜黄素衍生物减轻大鼠肝纤维化与抗炎抗氧化作用的研究
黄小华, 孙 永,沈 能,唐华东,任 红,彭明利
(1.重庆医科大学感染性疾病分子生物学教育部重点实验室,重庆 400010;2.重庆市肿瘤医院,重庆 400030;3.浙江工业大学,浙江 杭州 310014)
◇论 著◇
双亲姜黄素衍生物减轻大鼠肝纤维化与抗炎抗氧化作用的研究
黄小华1, 孙 永1,沈 能2,唐华东3,任 红1,彭明利1
(1.重庆医科大学感染性疾病分子生物学教育部重点实验室,重庆 400010;2.重庆市肿瘤医院,重庆 400030;3.浙江工业大学,浙江 杭州 310014)
目的 探讨新型双亲姜黄素衍生物(curc-OEG)对四氯化碳(CCl4)诱导大鼠肝纤维化的抗炎抗氧化作用。方法 大鼠分为正常组、模型组、姜黄素组和姜黄素衍生物组。除正常组外,其余各组给予CCl4混合液皮下注射,每周2次。造模4周后,正常组、模型组给与尾静脉注射生理盐水,姜黄素组给予姜黄素400 mg·kg-1·d-1灌胃治疗,姜黄素衍生物组给予姜黄素衍生物100 mg·kg-1·d-1尾静脉注射。治疗4周后分别取血清及肝组织标本。血清检测ALT、AST水平;肝组织做病理学检查,Real-time PCR法检测相关炎症因子的mRNA表达水平,试剂盒检测丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)水平。结果 正常组、模型组、姜黄素组和姜黄素衍生物组ALT水平分别为:(31.7±8.7) U·L-1、(383.0±75.6) U·L-1、(406.3±204.7) U·L-1、(107.0±73.7) U·L-1;AST水平分别为:(137.7±32.7) U·L-1、(585.3±36.7) U·L-1、(485.0±246.5) U·L-1、(202.7±56.0) U·L-1,姜黄素衍生物较姜黄素显示出更好的护肝降酶作用(P<0.05)。肝脏病理切片显示姜黄素衍生物较姜黄素具有更明显的延缓肝脏脂肪变性、减轻炎症细胞浸润及抗肝纤维化的作用。与姜黄素比较,姜黄素衍生物明显下调炎症相关因子NF-κB、IL-1β、IL-6、TNF-α、COX-2mRNA及蛋白表达水平(P<0.05);明显降低肝组织中MDA水平,提高GSH 、SOD表达水平,增强抗氧化能力。结论 姜黄素衍生物较传统姜黄素具有更好的抗炎、抗氧化作用,能够有效地延缓四氯化碳诱导的肝纤维化进程。
姜黄素;灌胃治疗;衍生物;静脉注射;纤维化;抗炎;抗氧化
肝纤维化是对慢性肝损伤(病毒性感染、酗酒、胆汁淤积等)的一种创伤修复反应,是过多的细胞外基质(ECM)产生和沉积的病理过程[1]。慢性肝损伤导致大量炎症细胞的聚集,释放炎症因子和生长因子,如TNF-α、TGF-β1,从而激活肝星状细胞(HSC), 而活化的HSC是ECM(特别是胶原纤维)生成的主要来源[2]。姜黄素是一种天然的多酚类化合物,具有抗炎、抗氧化药理作用,能够抑制脂肪氧合酶和环氧化酶-2(COX-2)的活性,抑制脂质过氧化,减少花生四烯酸的释放,特别是通过抑制NF-kB信号通路减少炎症因子IL-1β、IL-6、TNF-α的生成[3]。但姜黄素(curcumin)水溶性差,在酸性条件下几乎不溶于水,在中性和碱性条件下迅速降解,故其难以直接制作成静脉注射剂型[4]。围绕姜黄素为先导化合物,进行结构修饰和剂型改变,提高姜黄素生物利用度是突破姜黄素临床应用受限的瓶颈。
本课题组通过β-巯基丙酸酯键将姜黄素与两条短链PEG连接起来,形成具有典型双亲分子结构的姜黄素衍生物(Curc-OEG),该衍生物水溶性>50 g·L-1。研究表明,给大鼠200 mg·kg-1灌胃治疗,最高血药浓度0.7 mg·L-1,姜黄素物利用率只有4.13%[5]。但是给予小鼠静脉注射Curc-OEG 2 mg·kg-1(相当于姜黄素6.25 mg·kg-1),最高血药浓度达到6.8mg·L-1,血药浓度是普通姜黄素灌胃、静脉注射和腹腔注射的50~500倍,组织分布也显示姜黄素在肝脏、脾脏及肿瘤组织中含量较高[6]。我们前期的实验表明,姜黄素衍生物能够明显延缓CCl4诱导的大鼠肝纤维化进程,减少I胶原蛋白(collagen Ⅰ)的合成[7]。但姜黄素衍生物发挥抗纤维化作用是否与其抗炎、抗氧化作用相关,本课题旨在回答这个问题。
1 材料与方法
1.1 材料
1.1.1 动物60只SD ♂大鼠,SPF级,体质量190~220 g,第三军医大学大坪医院野战所实验动物中心提供。
1.1.2 试剂、仪器 Curc-OEG由浙江大学唐华东教授提供;Curcumin购自上海试剂三厂;高纯总RNA提取试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒购自北京白泰克生物技术有限公司;RNA逆转录、荧光定量PCR试剂盒购自日本TaKaRa公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)测试盒购自南京建成生物工程研究所; NF-κB 、TNF-α多克隆一抗和多克隆二抗购自Abcam公司;COX-2多克隆一抗购自Santa Cruz公司。β-actin多克隆第一抗体购自北京四正柏生生物科技有限公司;引物由上海生工生物工程公司合成;RM2235石蜡切片机购自德国莱卡公司;SpectraMax M2多功能酶标仪产自美国。
1.2 方法
1.2.1 造模、分组及给药 大鼠随机分为4 组: 正常组(Normal)、模型组(Model)、姜黄素组(Curcumin)、姜黄素衍生物组(Curc-OEG),每组15 只 。用CCl4诱导大鼠形成肝纤维化模型。除正常组,给予CCl4混合液( CCl4∶橄榄油= 2 ∶3) 皮下注射,每周2次,共8周。第5周开始,正常组和模型组尾静脉注射生理盐水0.2 ml·d-1; 姜黄素组给予Curcumin 400 mg·kg-1·d-1灌胃;姜黄素衍生物组尾静脉注射Curc-OEG 100 mg·kg-1·d-1。
1.2.2 标本采集 8周后,采心脏血,分离血清,20 ℃保存;取肝右叶同一部位组织,一部分用4%甲醛溶液固定做常规组织病理学观察,另一部分用锡箔纸包裹储存于液氮灌中,用于做定量PCR、MDA、SOD、GSH检测。
1.2.3 指标检测 应用全自动生化仪器检测血清ALT、AST含量。各组肝组织用0.9%的生理盐水制备成10%的匀浆组织,根据试剂盒说明书检测MDA、SOD、GSH水平。
1.2.4 肝组织病理学检查 取肝右叶同一组织部位组织用4%甲醛溶液固定,HE及天狼星红染色制片[8],镜下观察肝细胞变性、炎症浸润、胶原纤维增生程度等组织形态学变化,用Ishak法对肝脏胶原及纤维化程度进行分级[9]。
1.2.5 Real-time PCR法检测肝组织中相关炎症因子的表达 百泰克试剂盒提取肝组织总RNA。按照TaKaRa RNA PCR试剂盒(AMV)Vcr 3.0说明书逆转录合成cDNA。以cDNA为模板,按照SYBR Premix EX Taq(Perfect Real Time)说明书在ABI7300上进行扩增,检测NF-κB、IL-1β、IL-6、TNF-α、COX-2四种基因的转录水平,以GAPDH作为内参照。使用的引物序列如下:GAPDH上游: 5′GGCAAATTCAACGGCACAGT-3′,下游:5′-AGATGG TGATGGGCTTCCC-3′。NF-κB上游:5′-TCTGTTTCC CCTCATCTTTCCC-3′,下游:5′-GTCTTAGTGGTTCTG TGCTTCTC- 3′。 IL-1β上游:5′-GTGGTATTCTCCAT GAGCTTTGTA-3′,下游:5′- CCATCTTCTTCTTTGGG TATTGTT- 3′。 IL-6上游 :5′-AACGAAAGTCAACTC CATCTGCC - 3′,下游5′- GGTCTGTTGTGGGTGG TATCCTC- 3′。TNF-α上游:5′-CGCTCTTCTGTC TACTGAACTTC - 3′,下游: 5′- CTGCTTGGTGGTTT GCTACG- 3′。 COX-2上游:5′-CATTCTTTGCCCAGC ACTTCACT- 3′,下游:5′- GATACACCTCTCCACC GATGACC- 3′。
1.2.6 Western blot分析 取各组肝组织100 mg加入1 ml RIPA裂解液中提取总蛋白,BCA法检测蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,电转至PVDF膜。5%BSA封闭,加入NF-κB(1 ∶2 000) 、TNF-α(1 ∶1 000),COX-2(1 ∶200)多克隆第一抗体及β-actin(1 ∶3 000)第一抗体,4℃孵育过夜。相应HRP标记的第二抗体(1 ∶3 000)室温孵育1 h,DAB显影。Quantity One 4.0软件进行条带灰度分析,以β-actin作为内参照。

2 结果
2.1 Curc-OEG对大鼠肝纤维化模型血清ALT、AST的影响从Tab1中可见,与正常组比较,CCl4造成明显的肝损伤,模型组ALT、AST明显升高(P<0.05);姜黄素衍生物可以明显减轻CCl4引起的肝损(P<0.05),较姜黄素组、姜黄素衍生物组ALT、AST降低明显(P<0.05),姜黄素衍生物较姜黄素有更好的护肝降酶作用。

Tab 1 Effect of Curc-OEG on serum ALT,AST in rat hepatic fibrosis model( n=10)
*P<0.05vscontrol;#P<0.05vsmodel;△P<0.05vscurcumin
2.2 Curc-OEG对大鼠肝纤维化模型肝脏组织结构及胶原纤维的影响正常组肝组织肝细胞大小正常,肝索绕中央静脉呈放射状排列,肝小叶结构完整(Fig 1A),仅在汇管区和血管壁有少量胶原纤维存在,肝内未见纤维组织增生(Fig 2A);经8周造模后,模型组HE染色显示肝索排列紊乱,可见大片的肝脂肪变性,大量炎性细胞浸润其中(Fig 1B),天狼星红染色可见明显的红色CollagenⅠ桥接存在于汇管区间、汇管区与中央静脉间,多见假小叶形成(Fig 2B);经姜黄素治疗4周后,姜黄素组肝小叶结构较完整,可见明显的细胞脂肪变以及炎性细胞浸润,CollagenⅠ沿汇管延伸,形成汇管间桥接,可见汇管与中央静脉桥接(Fig 1C、Fig 2C);姜黄素衍生物组显示少量的细胞脂肪变以及炎性细胞浸润(Fig 1D),少许CollagenⅠ沿汇管区延伸,偶见汇管间的桥接,较姜黄素组治疗效果更佳(Fig 2D)。肝纤维化按Ishak评分显示模型组主要分布在F5-F6级,姜黄素组分布在F3-F4级,姜黄素衍生物组分布在F2-F3级。
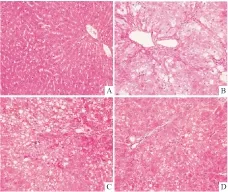
Fig 1 Effect of Curc-OEG on liver structure in rat hepatic fibrosis model( HE staining,×200)
A: Normal; B:Model; C:Curcumin; D:Curc-OEG
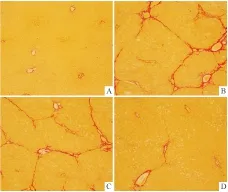
Fig 2 Effect of Curc-OEG on liver collagen in rat hepatic fibrosis model (Sirius red staining of collagens, ×100)
A: Normal; B:Model; C:Curcumin; D: Curc-OEG
2.3 Curc-OEG对大鼠肝纤维化模型肝脏各炎症因子mRNA表达的影响姜黄素及其衍生物对肝组织炎症相关因子的调控结果见Fig 3,与正常组相比,模型组NF-κB、IL-1β、IL-6、TNF-α、COX-2mRNA水平明显升高,其中以COX-2最明显,上调高达240倍,慢性CCl4损伤引起肝脏明显的炎症反应(P<0.05);与模型组对比,经姜黄素及衍生物治疗4周后, 均明显抑制肝组织中NF-κB、IL-1β、IL-6、TNF-α、COX-2mRNA表达,其中对COX-2 mRNA表达调控尤为突出,分别下调13.2倍和23.5倍(P<0.05);与姜黄素相比,姜黄素衍生物下调NF-κB、IL-1β、IL-6、TNF-α、COX-2mRNA分别为1.6倍、1.7倍、2.1倍、2.6倍、1.8倍,姜黄素衍生物较姜黄素有更好的抗炎作用。
2.4 Curc-OEG对大鼠肝纤维化模型肝脏NF-κB、TNF-α、COX-2蛋白表达的影响从Fig 4中可见,与正常组比较,模型组NF-κB、TNF-α、COX-2蛋白表达升高(P<0.05);较模型组和姜黄素组,衍生物组 NF-κB、TNF-α、COX-2蛋白表达明显降低(P<0.05)。该结果进一步表明,姜黄素衍生物较姜黄素有更好的抗炎作用。
2.5 Curc-OEG对大鼠肝纤维化模型肝脏MDA、SOD、GSH的影响姜黄素被广泛认为通过清除活性氧自由基发挥抗过氧化作用,改善肝细胞氧化还原状态[10],在此我们考察了姜黄素及衍生物对肝脏MDA、GSH和SOD水平的影响,结果见Fig 5,模型组较正常组MDA水平升高、GSH水平降低、SOD活性降低(P<0.05);经姜黄素及衍生物治疗后MDA水平降低、GSH水平升高、SOD活性升高(P<0.05);姜黄素衍生物组较姜黄素组改变更为明显(P<0.05),因而显示姜黄素衍生物具有更好的抗氧化作用。
3 讨论
目前抗肝纤维化的治疗主要是通过抗病因治疗,尚无特效的药物治疗。近年来,传统中药治疗对肝纤维化及肝硬化取得一些进展,临床上常用的中药有丹参颗粒、扶正化瘀方、鳖甲软肝片等,但其作用机制至今不明[11],因此对新型抗纤维化药物的寻找至今未曾停下。在肝纤维化形成和进展的过程中,HSC是产生ECM的主要来源,各类炎症因子、趋化因子及氧化应激都可以激活HSC,它们在肝纤维化的形成中起着重要作用[12-13]。在Fu等[14]的研究中运用CCl4诱导的大鼠肝纤维化为模型,给予姜黄素治疗4周后大鼠血清中ALT、AST、ALP、TNF-α、IL-6和IFN-γ的水平明显降低,同时肝脏中GSH的水平也升高,明显延缓大鼠的肝纤维化进程。Chen等[15]的研究证明,姜黄素可能通过降低TLR4的表达和抑制ERK活化从而抑制NF-κB的活化,进而减少活化HSC中结缔组织生长因子(CTGF)的表达。这表明姜黄素可以通过抗炎作用发挥抗纤维化作用,因为大量证据也表明CTGF是HSC活化过程中的中心环节。此外还有研究表明,姜黄素可以明显减少活化HSC细胞内氧化应激产物ROS的生成,这与它通过促进谷氨酸-半胱氨酸连接酶的活性和促进GSH的合成有关,而且细胞内GSH合成增多可以明显抑制HSC的活化[16]。这些发现对于表明姜黄素通过抗氧化作用发挥抗纤维化作用有着重大意义。

Fig 3 Effect of Curc-OEG on liver cytokines mRNA expression in rat hepatic fibrosis model
*P<0.05vsnormal;#P<0.05vsmodel;△P<0.05vscurcumin

Fig 4 Effect of Curc-OEG on liver NF-κB,TNF-α, COX-2 protein expression in rat hepatic fibrosis model
A: Normal; B:Model; C:Curcumin; D: Curc-OEG
但是姜黄素始终受到低生物利用度的限制,目前提高姜黄素生物利用度是国内外学者研究的热点。将姜黄素包裹在各种纳米粒、脂质体、微球中的剂型改变也取得很大进展,如聚乙二醇单丙烯酸脂和姜黄素聚合形成纳米姜黄素(Nano Curc TM)被证实较姜黄素有更高的水溶性,可以通过减少炎症因子(TNF-α、IL-6等)的释放和抑制HSC的活化,从而延缓CCl4诱导的小鼠肝纤维化进程[17],但是该纳米姜黄素的负载物稳定性较差,药物负载率有待考量、药物负载物与负载物之间也有可能各不相同[6]。

Fig 5 Effect of Curc-OEG on liver MDA,SOD,GSH in rat hepatic fibrosis model
*P<0.05vsnormal;#P<0.05vsmodel;△P<0.05vscurcumin
本研究比较了姜黄素和新型双亲Curc-OEG在CCl4诱导的大鼠肝纤维化模型中的抗纤维化效果,发现Curc-OEG具有更好的保肝降酶作用,可能与姜黄素衍生物能更好的提高GSH的水平有关。肝脏病理学显示,Curc-OEG比姜黄素能更有效地减轻肝脂肪变和炎症反应,减少CollagenⅠ(其是ECM 沉积中的重要成分)的生成,进而延缓肝纤维化的进程。我们还发现Curc-OEG较姜黄素明显减少脂质氧化产物MDA的产生,通过提高GSH水平和SOD活性有效地降低氧化应激损伤产生的氧自由基等物质,控制机体对氧化应激的损伤程度。同时Curc-OEG较姜黄素明显下调各炎症因子 mRNA及蛋白的表达,特别是对COX-2 mRNA的调控尤为明显,这可能与姜黄素衍生物发挥抗纤维化作用密切相关。因为有报道显示,静止的HSC并不表达COX-2,但是活化的HSC却表达,COX-2-前列腺素信号路径参与肝纤维化的形成[18]。因此,我们拟将进一步在体内外实验中探讨Curc-OEG是否是通过抗炎及抗氧化作用,抑制HSC活化进而发挥其抗纤维化作用以及其可能的机制。
[1] Friedman S L. Liver fibrosis-from bench to bedside[J].Hepatol, 2003,38 (Suppl 1):S38-53.
[2] Pablo M. NF-κB in liver diseases: a target for drug therapy[J]. Appl. Toxicol, 2009,29(2): 91-100.
[3] Lin J K. Molecular targets of curcumin[M].AdvExpMedBiol,2007, 595:227-43.
[4] Wang Y J, Pan M H, Cheng A L, et al. Stability of curcumin in buffer solutions and characterization of its degradation products[J].JPharmBiomedAnal, 1997, 15(12):1867-76.
[5] 张立康,汪小珍,李婉姝,等. 姜黄素在大鼠体内药代动力学和生物利用度研究[J].中国药理学通报,2011,27( 10) : 1458-62.
[5] Zhang L K, Wang X Z, Li W S, et al. Pharmacokinetics and absolute bioavailability of curcumin in rats[J].ChinPharmacolBull, 2011, 27(10):1458-62.
[6] Tang H, Murphy C J, Zhang B, et al. Amphiphilic curcumin conjugate-forming nanoparticles as anticancer prodrug and drug carriers:invitroandinvivoeffects [J].Nanomedicine(Lond), 2010, 5(6):855-65.
[7] 邓艳红,沈 能,彭明利,等.姜黄素衍生物对四氯化碳诱导大鼠肝纤维化的治疗作用[J]. 中国临床药理学和治疗学, 2012,17(2):147-53.
[7] Deng Y H, Shen N,Peng M L,et al.Efficacy of the Curc-OEG on rats liver fibrosis induced carbon tetrachloride[J].ChinJClinPharmacolTher,2012,17(2):147-53.
[8] 高春芳, 陆伦根. 纤维化疾病的基础与临床[M]. 上海:上海科学技术出版社, 2004,B327-37.
[8] Gao C F, Lu L G. The foundation and clinic of fibrosis diseases.Shanghai:ShanghaiscienceandTechnologyPress[M], 2004, B327-37.
[9] Ishak,Baptista A,Bianchi L,et al.Histological grading and staging of chronic hepatitis[J].Heapatology,1955,22(6):696-9.
[10] Purusotam B T, Natasa S. Curcumin: An Anti-Inflammatory molecule from a curry spice on the path to cancer treatment[M].Molecules, 2011,16(6):4567-98.
[11] Liu P. Fuzheng Huayu Capsule in the treatment of liver fibrosis: Clinical evidence and mechanism of action[J].ChinJIntegrMed,2012, 18(5):398-400.
[12] Bachem M G, Riess U, Gressner A M .Liver fat storing cell proliferation is stimulated by epidermal growth factor/transforming growth factor alpha and inhibited by transforming growth factor beta[J].BiochemBiophysResCommun, 1989, 162(2):708-14.
[13] Greenwel P, Dominguez-Rosales J A, Mavi G, et al. Rojkind, M. Hydrogen peroxide: a link between acetaldehyde-elicited alpha1(I) collagen gene up-regulation and oxidative stress in mouse hepatic stellate cells[J].Hepatology, 2000, 31(1):109-16.
[14] Fu Y M, Zheng S Z, Lin J G,et al. Curcumin protects the rat liver from CCl4-caused injury and fibrogenesis by attenuating oxidative stress and suppressing inflammation [J].MolPharmacol, 2008,73(2):399-409.
[15] Chen A, Zheng S. Curcumin inhibits connective tissue growth factor gene expression in activated hepatic stellate cellsinvitroby blocking NF-κB and ERK signaling [J].BritishJPharmacol, 2008, 153(3):557-67.
[16] Zheng S, Chen A .de novo synthesis of glutathione is a prerequisite for curcumin to inhibit HSC activation [J].FreeRadicBiolMed, 2007, 43(3):444-53.
[17] Savita B, Mehtab A, Mena B, et al. A polymeric nanoparticle formulation of curcumin (NanoCurc) ameliorates CCl4-induced hepatic injury and fibrosis through reduction of pro-inflammatory cytokines and stellate cell activation [J].LabInvest,2011, 91(9):1383-95.
[18] Efsen E, Bonacchi A, Pastacaldi S, et al. Agonist-specific regulation of monocyte chemoattractant protein-1 expression by cyclooxygenase metabolites in hepatic stellate cells [J].Hepatology, 2001,33(3):713-21.
The amphiphilic curcumin derivative attenuates liver fibrosis by anti-inflammatory and antioxidant effect
HUANG Xiao-hua1, SUN Yong1, SHEN Neng2, TANG Hua-dong3, REN Hong1, PENG Ming-li1
(1.KeyLaboratoryofMolecularBiologyofInfectiousDisease,ChongqingUniversityofMedicalScience,Chongqing400010,China;2.ChongqingCancerInstitute,Chongqing400030,China; 3、ZhejiangUniversityofTechnology,Hangzhou310014,China)
Aim To investigate the effects of anti-in-flammation and antioxidation of an amphiphilic curcu-min derivative (Curc-OEG) on CCl4-induced hepatic fibrosis in rats. Methods Rats were randomly divided into four groups: control group,model group,curcumin and Curc-OEG treatment group. All rats except those in control group were given subcutaneous injection of CCl4and olive oil mixture, twice a week for 8 weeks. After 4 weeks, rats of control and model group were treated with normal saline intravenously, curcumin group were administered with curcumin 400 mg.kg-1.d-1by gavage and Curc-OEG group were treated with Curc-OEG 100 mg.kg-1.d-1intravenously respectively. After 4 weeks treatment, the serum levels of ALT and AST were tested. HE and Sirus staining were used to evaluate the extent of liver inflammation and fibrosis. The mRNA expression levels of proinflammatory cytokines of NF-kB, IL-1β, IL-6, TNF-α, COX-2 were observed with Real Time PCR. The level of MOD, SOD and GSH in liver of rats were quantified. Results The levels of ALT in control, model, curcumin and Curc-OEG group was (31.7±8.7) U·L-1, (383.0±75.6) U·L-1, (406.3±204.7) U·L-1, (107.0±73.7) U·L-1respectively; that of AST was (137.7±32.7) U·L-1, (585.3±36.7) U·L-1, (485.0±246.5) U·L-1, (202.7±56.0) U·L-1respectively, Curc-OEG possessed more hepatoprotective effects than that of curcumin. Liver pathology showed Curc-OEG treatment could significantly alleviate steatosis, reduce inflammation and apparently suppress hepatic fibrogenesis by reducing the thickness of bridging fibrotic septa. Compared with curcumin, Curc-OEG down-regulated mRNA and protein expression levels of NF-kB, IL-1β, IL-6, TNF-α, COX-2(P<0.05). Moreover, Curc-OEG reduced the level of MOD and increased the levels of SOD and GSH. Conclusion Curc-OEG could more significantly protect the rat liver from CCl4-caused fibrogenesis by anti-inflammatory and antioxidant effect than curcumin.
curcumin; intragastric administration;derivative; intravenous;fibrosis; anti-inflammatory; antioxidant
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.015.html
2014-12-05,
2015-01-15
国家自然科学基金资助项目(No 30771921)
黄小华(1987-),女,硕士生,研究方向:肝纤维化的药物研究,E-mail:huangxianiboy@163.com; 彭明利(1972-),女,副研究员,硕士生导师,研究方向:肝纤维化发病机制与药物开发,通讯作者,E-mail:pengmingli@cqmu.edu.cn
10.3969/j.issn.1001-1978.2015.04.007
A
1001-1978(2015)04-0470-06
R-332;R284.1;R322.47;R329.24;R452;R575.205.31

