中介素对缺氧/复氧大鼠肾小管上皮细胞增殖作用及细胞周期的影响及其机制
王艳红,田继华,苏晓乐,乔 晞,李荣山
(1.山西医科大学微生物学与免疫学教研室, 2.山西医科大学第二医院肾内科,3.山西省人民医院肾内科,山西省肾脏病研究所,山西 太原 030001)
中介素对缺氧/复氧大鼠肾小管上皮细胞增殖作用及细胞周期的影响及其机制
王艳红1,田继华1,苏晓乐2,乔 晞2,李荣山3
(1.山西医科大学微生物学与免疫学教研室, 2.山西医科大学第二医院肾内科,3.山西省人民医院肾内科,山西省肾脏病研究所,山西 太原 030001)
目的 探讨中介素(intermedin,IMD)对大鼠近端肾小管上皮细胞NRK-52E缺氧/复氧(H/R)后细胞增殖、细胞周期的影响。方法 NRK-52E细胞随机分为对照组,模型组:缺氧/复氧组(H/R)、H/R+空质粒组、H/R+IMD质粒组。MTT法检测细胞增殖,比色法检测培养基上清LDH含量,流式细胞术检测细胞周期,Real time-PCR法和Western blot法检测cyclin D1、CDK、p57 mRNA及蛋白表达,间接免疫荧光染色检测cyclin D1亚细胞定位。结果 ①与对照组相比,H/R组培养基中LDH含量升高了106%,同时细胞存活率明显下降,与H/R组比较,H/R+IMD组培养基中LDH含量下降了33.85%(P<0.01),而细胞存活率增高(79.15%±1.42%vs61.22%±1.63%,P<0.05),②细胞周期结果显示,与对照组相比,H/R组细胞G0/G1期比例增加,S期细胞比例降低(P<0.05);与H/R组比较,H/R+IMD组G0/G1期细胞比例明显降低,而S及G2期细胞比例增加(P<0.05)。③H/R可增加cyclin D1、CDK4及p57的表达也增加(与对照组比较,P<0.05);而IMD可进一步上调cyclin D1、CDK4的表达,同时下调p57的表达,与对照组及H/R组相比差异具有显著性(P<0.05)。④免疫荧光检测结果可见,cyclin D1呈红色荧光,在NRK-52E细胞内主要表达在细胞核中。结论 IMD可以上调cyclin D1、CDK4蛋白表达,下调p57的表达,促进细胞周期进展,从而加速肾组织IRI后细胞增殖和修复。
中介素;缺氧/复氧损伤;肾小管上皮细胞;细胞增殖;细胞周期;细胞周期蛋白
急性肾衰竭(acute renal failure,ARF)在临床上的发生率非常高,而肾脏缺血/再灌注损伤(ischemia reperfusion injury,IRI)是其主要原因[1],研究表明,缺血性ARF的预后不仅取决于损伤的严重程度,而且取决于损伤后肾脏修复和再生情况,减轻急性期损伤和促进肾组织再生的因素均能改善缺血性ARF的预后[2]。本研究组前期研究证实,中介素(Intermedin,IMD)主要通过抑制氧化应激进而明显减轻肾脏IRI急性期损伤[3]。但其是否可以促进肾脏IRI后的肾小管上皮细胞再生、修复及细胞周期的影响目前尚未见报道,本研究利用大鼠肾小管上皮细胞H/R模型,通过检测IMD对肾小管上皮细胞H/R后细胞增殖、细胞周期的影响以及对周期蛋白cyclin的调节,从而探讨IMD促进肾脏IRI后细胞修复和再生的机制,为IMD应用于肾脏IRI的治疗提供理论依据。
1. 材料与方法
1.1 材料大鼠肾小管上皮细胞NRK-52E(上海细胞库),稳定转染PIRES2-EGFP/IMD及PIRES2-EGFP空质粒的NRK-52E细胞(本室制备)[4],细胞周期检测试剂盒( 南京凯基),MTT( 北京索莱宝),LDH检测试剂盒( 南京建成),兔抗鼠cyclin D1、CDK、p57、β-actin多抗(美国Santa),羊抗兔IgG(美国Santa)。
1.2 细胞分组NRK-52E分为对照组及模型组。对照组细胞常规培养;模型组分为:缺氧/复氧组(H/R组)。空质粒组(H/R+PIRES2)、IMD质粒组(H/R+IMD)。NRK-52E 细胞H/R模型的制备参照文献[5]方法进行改良,将已传代2~3次融合度达80%的细胞换用无血清DMEM/F12培养基24 h后细胞进入静止期,预先将无氧液中持续通入高纯度N230 min,达到N2饱和。弃去细胞培养基,PBS洗2次后加入无氧液,将细胞置入培养条件为37℃,95%N2+5%CO2(V/V)的培养箱中,进行缺氧培养1h,取出细胞,PBS洗涤,加入完全DMEM/F12培养基,置入调整为37℃,95%空气+5% CO2的培养箱中进行复氧培养,复氧2 h后,收集细胞及培养液上清[4]。
1.3 实验方法
1.3.1 细胞增殖指标 比色法检测培养基上清中乳酸脱氢酶(LDH),流式细胞术检测细胞周期,MTT法检测细胞增殖,严格按试剂盒说明操作。
1.3.2 Realtime PCR检测cyclin D1、CDK4、p57 mRNA表达 收集细胞,TRIzol法提取总RNA,反转录成cDNA,引物序列见Tab 1,应用SYBR Green PCR matter mix,反应条件为95℃, 10 min,95℃, 15 s,60℃, 30 s,40个循环,分析溶解曲线并计算相对浓度。
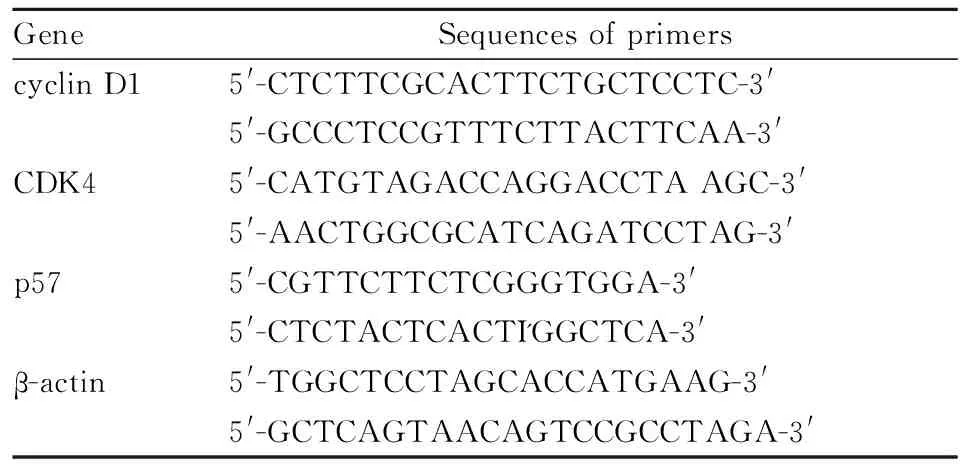
Tab 1 Sequences of primers and cycle parameter for real-time PCR
1.3.3 Western blot检测cyclin D1、CDK4、p57蛋白表达 收集细胞加入蛋白质抽提试剂提取蛋白质,12%的聚丙烯酰胺凝胶进行电泳,电泳结束后转印至NC膜上。用含有5%脱脂奶粉的TBST室温封闭1 h,加入一抗cyclin D1(1 ∶500)、CDK4(1 ∶500)、p57(1 ∶1 000),于4℃孵育过夜, TBST洗膜10 min×3次,二抗(1 ∶500)室温孵育1 h,TBST洗膜10 min×3次,用ECL化学发光法显色,以β-actin为内参,应用Quantity One分析系统对条带做吸光度定量,分析蛋白的相对表达量。
1.3.4 间接免疫荧光染色 取洁净的盖玻片置于24孔板中,NRK-52E以每孔5×105个细胞铺孔,细胞处理同前。4%多聚甲醛固定10 min,PBS震荡洗涤10 min×3次;含5%BSA的TBST室温封闭2 h,PBS震荡洗涤10 min×3;滴加cyclin D1一抗(1 ∶200)4℃孵育过夜,加入荧光标记二抗(1 ∶500),室温避光孵育60 min,PBS震荡洗涤10 min×3次;每孔加DAPI 50 μL,室温避光孵育10 min,PBS洗涤;加抗荧光淬灭剂封片,激光共聚焦显微镜下观察荧光表达。

2 结果
2.1 NRK-52E细胞增殖及培养液上清LDH的变化由Tab 2可见,与对照组相比,H/R组培养基中LDH含量明显上升(升高了106%),同时细胞存活率明显下降(P<0.01),而H/R+IMD质粒组与H/R组及空质粒组相比LDH含量分别降低了33.85%、33.46%,此外,细胞存活率提高[(79.15%±1.42%vs61.22%±1.63%,60.98%±2.62%,P<0.05)];H/R组与空质粒组差异无统计学意义。
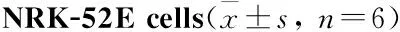

GroupCellproliferation/%LDH/U·L-1Control100.00505.24±32.15H/R61.22±1.63**1536.84±115.28**H/R+PIRES260.98±2.62**1522.33±93.57**H/R+IMD79.15±1.42*#699.81±65.28#
*P<0.05,**P<0.01vscontrol;#P<0.05vsH/R.
2.2 NRK-52E细胞周期的变化由Tab 3可见,与对照组相比,H/R 组细胞G0/G1期比例增加,S期细胞比例降低(P<0.05),说明H/R状态下NRK-52E细胞增殖受到抑制。与H/R组及空质粒组比较,H/R+IMD组表现为G0/G1期细胞比例明显降低,而S及G2期细胞比例增加(P<0.05),表明IMD可使细胞越过G0/G1期,进而促进NRK-52E细胞的增殖。

GroupG0/G1SG2Control57.93±1.2333.01±2.358.03±0.76H/R79.92±1.69*13.62±1.36*6.45±0.44H/R+PIRES276.98±1.63*16.19±1.18*6.82±0.36H/R+IMD46.16±2.75*#48.08±1.89*#7.12±0.30*#
*P<0.05vscontrol;#P<0.05vsH/R
2.3 NRK-52E细胞中cyclin D1、CDK4、p57的表达Western blot结果显示,H/R可增加cyclin D1、CDK 4的表达,这可能是一种损伤后修复启动的代偿机制,而IMD可明显上调cyclin D1、CDK 4的表达,与对照组及H/R组相比差异具有显著性(P<0.05);相似的是,Real time-PCR检测结果也显示IMD能明显增加cyclin D1、CDK 4的mRNA表达,提示IMD通过调控转录从而增加其表达(Fig 1)。与对照组相比,H/R组细胞p57 mRNA及蛋白的表达明显上调(P<0.05),而H/R+IMD组则明显低于H/R组及空质粒组(P<0.05)见Fig 2。
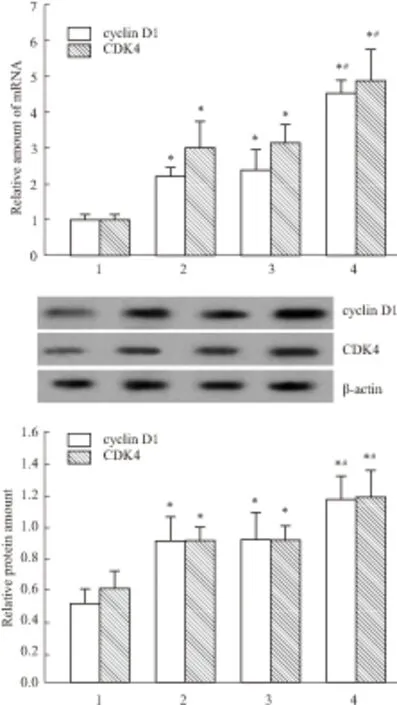
Fig 1 The mRNA and protein levels of cyclin D1 and CDK by
1:Control; 2: H/R; 3: H/R+PIRES2; 4: H/R+IMD,*P<0.05vscontrol;#P<0.05vsH/R.
2.4 免疫荧光检测cyclin D1在细胞内定位免疫荧光检测结果可见,cyclin D1呈红色荧光,在NRK-52E细胞内主要表达在细胞核中,DAPI呈现蓝色荧光,PIRES2-EGFP/IMD携带EGFP报告基因,呈现绿色荧光(Fig 3)。
3 讨论
缺血/再灌注损伤后肾小管上皮细胞的修复是肾功能恢复的基础。ARF 患者的临床预后取决于肾小管上皮细胞损伤与修复过程动态平衡的最终结果。在肾脏IRI后的修复需要肾小管上皮细胞再生取代受损的细胞,恢复肾小管的完整性,正常状态下休眠的细胞将发生去分化,DNA合成加强,之后细胞可以发生增殖分化,恢复肾单位的完整性。细胞的增生必须通过完成一个细胞周期才能得以实现,因而促进细胞周期的进展能加快组织的再生和修复[6-7]。
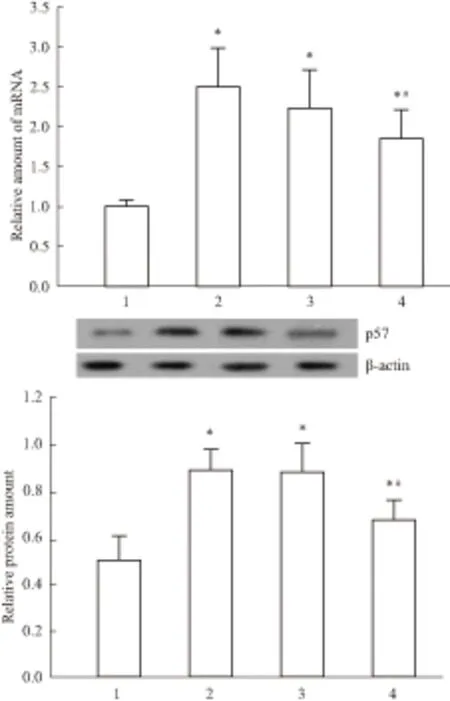
Fig 2 The mRNA and protein levels of p57 by western blot
1:Control; 2: H/R; 3: H/R+PIRES2; 4: H/R+IMD,*P<0.05vscontrol;#P<0.05vsH/R
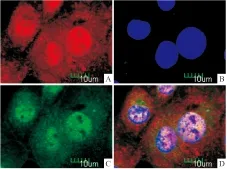
Fig 3 Immunolocalization of cyclin D1 in NRK-52E cells
A:cyclin D1; B:DAPI; C:EGFP; D:Merge
中介素(intermedin,IMD)又称肾上腺髓质素2(adrenomedullin 2,ADM2),是2004年由美国学者Roh和日本学者Takei同时发现的,是一种较肾上腺髓质素作用更强、更广泛的降钙素基因相关肽家族的新成员[8-9],是重要的心、肾、神经、内分泌调节肽,参与多种器官生理、病理过程[10-12],因此其生物学效应和功能越来越受到关注。大量的研究证实,IMD可以通过清除自由基、改善能量代谢、抑制细胞坏死和凋亡、抑制氧化应激等,从而减轻肾脏IRI急性期损伤[3, 13-18]。
近年来已有越来越多的证据提示,IRI后存在细胞周期的异常激活,肾小管上皮细胞在缺血性损伤后可快速进入细胞周期并增殖。本研究证实H/R组NRK-52E细胞存活率下降,培养液上清中的LDH活性升高,流式细胞术分析可见G0/G1细胞比例明显上调,而IMD转染后细胞存活率提高,同时细胞培养液上清中的LDH活性也明显下降,而IMD转染组G0/G1期细胞百分比明显减少, S、G2期细胞的百分比增加,这一结果提示IMD可促进H/R损伤后细胞的增殖,减轻细胞损伤。
cyclin是一类与真核细胞的细胞周期呈同步性、周期性升降的周期调节蛋白,通过与细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)结合形成cyclin-CDKs复合物共同控制着细胞周期[19-20]。cyclinD1、CDK4是 G1/S期关键的正性调节因子,二者通过结合成形成cyclinD1/CDK4复合物进入胞核,促使细胞通过G1/S调控点,启动细胞周期过程进而发挥作用[21-22]。p57是重要的细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitor,CKI)主要表达在肾小球上皮细胞,参与调控细胞在G1/S期的转变,抑制细胞增生[23]。本研究结果表明,H/R后cyclin D1、CDK4的表达均有所增加,这可能是损伤后机体的一种代偿机制;而H/R+IMD组这些周期调节蛋白的表达进一步上调。H/R可导致p57表达水平明显增加,而IMD则可降低p57的蛋白表达,同时我们还观察到,cyclin D1在NRK-52E细胞内主要定位于在细胞核中,而cyclin D1核聚集在增加细胞的增殖能力中发挥着至关重要的作用。这一结果提示IMD通过调控cyclin D1转录翻译,降低p57蛋白表达,进而增加cyclin D1/CDK4的活性,促进细胞周期由G0-G1期进入S期。这些结果与本课题组在动物实验中的结果相似[17]。
总之,肾小管上皮细胞修复过程的完成有赖于一系列的调节因子的作用[17],本研究在大鼠肾小管上皮NRK-52E细胞H/R模型中证实,IMD通过下调p57的表达,上调cyclinD1、CDK4的表达,从而促进细胞存活、增殖及细胞周期进展,这可能是IMD发挥肾脏缺血/再灌注保护的作用机制之一。本研究进一步证明了IMD促进肾脏IRI损伤后修复的重要作用,为IMD应用于肾脏IRI损伤的治疗提供了实验依据。
[1] Lameire N, Van Biesen W, Vanholder R. Acute renal failure[J].Lancet, 2005,365(9457):417-30.
[2] Jassem W, Heaton N D. The role of mitochondria in ischemia/reperfusion injury in organ transplantation[J].KidneyInt, 2004,66(2):514-7.
[3] Qiao X, Li R S, Li H, et al. Intermedin protects against renal ischemia-reperfusion injury by inhibition of oxidative stress[J].AmJPhysiolRenalPhysiol, 2013,304(1):F112-9.
[4] 周 芸,李荣山,乔 晞,等. 中介素对大鼠近端肾小管上皮细胞缺氧复氧模型的保护作用[J]. 中华肾脏病杂志,2010,26(5):388-9.
[4] Zhou Y, Li R S, Qiao X, et al. The protection of intermedin in rat renal tubular cell hypoxia-reoxygenation injury [J].ChinJNephrol, 2010,26(5):388-9.
[5] Basnakian A G, Ueda N, Hong X, et al. Ceramide synthase is essential for endonuclease-mediated death of renal tubular epithelial cells induced by hypoxia-reoxygenation[J].AmJPhysiolRenalPhysiol,2005,288(2):F308-14.
[6] Kim J, Jung K J, Park K M. Reactive oxygen species differently regulate renal tubular epithelial and interstitial cell proliferation after ischemia and reperfusion injury[J].AmJPhysiolRenalPhysiol, 2010,298:F1118-29.
[7] 王艳红. Intermedin对大鼠肾小管上皮细胞缺氧复氧损伤保护作用及机制的研究[D]. 山西:山西医科大学,2013.
[7] Wang Y H. Experimental study of the protection from intermedin in rat renal tubular cell hypoxia-reoxygenation injury[D]. Shanxi: Shanxi Medical University,2013.
[8] Roh J, Chang C L, Bhalla A, et al. Intermedin is a calcitonin/calcitonin gene-related peptide family peptide acting through the calcitonin receptor-like receptor/receptor activity-modifying protein receptor complexes[J].JBiolChem,2004,279(8):7264-74.
[9] Takei Y, Inoue K, Ogoshi M, et al. Identification of novel adrenomedullin in mammals: a potent cardiovascular and renal regulator[J].FEBSLett,2004,556(1-3):53-8.
[10]Takahashi K, Morimoto R, Hirose T, et al. Adrenomedullin 2/intermedin in the hypothalamo-pituitary-adrenal axis[J].JMolNeurosci,2011,43(2):182-92.
[11]Manuela C, Laura S, Benedetta S, et al. Adrenomedullin and intermedin gene transcription is increased in leukocytes of patients with chronic heart failure at different stages of the disease[J].Peptides,2014,55:13-6.
[12]王艳红,李荣山. 中介素/肾上腺髓质素2的生物学作用研究进展[J]. 国际移植与血液净化杂志,2013,11(1):13-7.
[12]Wang Y H, Li R S. The research progresses for the biology function of intermedin/ adrenomedullin-2[J].IntJTransplantHemopurificatio, 2013,11(1):13-7.
[13]Wang Y, Li R, Qiao X, et al. Intermedin/adrenomedullin 2 protects against tubular cell hypoxia-reoxygenation injuryinvitroby promoting cell proliferation and upregulating cyclin D1 expression[J].Nephrology(Carlton),2013,18(9):623-32.
[14]李 宏,李荣山,乔 晞,等. intermedin对大鼠肾脏缺血/再灌注损伤的保护作用及其机制[J]. 中华肾脏病杂志,2010,26(8):614-8.
[14]Li H, Li R S, Qiao X, et al. Protective effect of intermedin on renal ischemia reperfusion injury and its mechanism[J].ChinJNephrol, 2010,26(8):614-8.
[15]赵海红,李荣山,乔 晞,等. intermedin对肾脏缺血/再灌注损伤后血管再生相关因子表达的影响[J]. 中华肾脏病杂志,2011,27(12):912-6.
[15]Zhao H H, Li R S, Qiao X, et al. Effect of intermedin on the expressions of angiogenesis related genes induced by renal ischemia reperfusion injury[J].ChinJNephrol, 2011,27(12):912-6.
[16]赵 莉,李荣山,乔 晞,等. intermedin预处理对大鼠肾脏缺血/再灌注损伤的相关修复基因的影响[J]. 中华肾脏病杂志,2011,27(9):678-83.
[16]Zhao L, Li R S, Qiao X, et al. Effects of intermedin pretreatment on associated repairing genes in the kidney of rats with renal ischemia-reperfusion injury[J].ChinJNephrol, 2011,27(9):678-83.
[17]褚宇东,李荣山,乔 晞,等. Intermedin预处理对大鼠肾脏缺血/再灌注损伤修复过程中细胞周期蛋白表达的影响[J]. 中华风湿病学杂志,2011,15(8):541-5.
[17]Chu Y D, Li R S, Qiao X, et al. Effect of intermedin preconditioning on cyclin pression after renal ischemia reperfusion in rats [J].ChinJRheumatol, 2011,15(8):541-5.
[18]冯国徵,李荣山,乔 晞,等. intermedin预处理对大鼠肾脏缺血/再灌注损伤修复和再生过程的作用[J]. 中华肾脏病杂志,2011,27(12):917-22.
[18]Feng G Z, Li R S, Qiao X, et al. Effect of intermedin pretreatment on repair and regeneration process of renal ischemia reperfusion injury[J].ChinJNephrol, 2011,27(12):917-22.
[19]Barrera-Hernandez G, Park K S, Dace A, et al. Thyroid hormone-induced cell proliferation in GC cells is mediated by changes in G1 cyclin/cyclin-dependent kinase levels and activity[J].Endocrinology, 1999,140(11):5267-74.
[20]Bamberger A, Sudahl S, Bamberger C M, et al. Expression patterns of the cell-cycle inhibitor p27 and the cell-cycle promoter cyclin E in the human placenta throughout gestation: implications for the control of proliferation[J].Placenta,1999,20(5-6):401-6.
[21]胡 波,邱青朝,贺修培,等. 二烯丙基二硫下调cyclin D1和CDK4的表达诱导人鼻咽癌CNE2细胞G1期阻滞[J]. 中国药理学通报, 2010,26(9):1203-7.
[21]Hu Y, Qiu Q C, He X P, et al. Diallyl disulfide induced cell cycle arrest in G1 phase by downregulation of cyclin D1 and CDK4 in human nasopharyngeal carcinoma CNE2cells[J].ChinPharmacolBull, 2010,26(9):1203-7.
[22]张吉仲,万 谦,刘 圆. 白花丹醌对人肝癌细胞HepG2、SMMC-7721增殖及其BAX/Bcl-2、cyclin D1 mRNA表达的影响[J]. 中国药理学通报,2012,28(12):1729-32.
[22]Zhang J Z,Wang Q,Liu Y. The influence of plumbagin on proliferation of human hepatoma carcinoma cells HepG2 and mRNA expression of BAX/Bcl-2,cyclin D1[J].ChinPharmacolBull,2012,28(12):1729-32.
[23]赵 燕,曹 亚. 细胞周期蛋白依赖性蛋白激酶抑制剂p57的研究进展[J]. 生命的化学,2002,22(5):429-31.
[23]Zhao Y, Cao Y, The research progresses of cyclin-dependent kinase inhibitor p57[J].ChemLife, 2002,22(5):429-31.
Research of the effect in intermedin on cell proliferation repair of renal tubular cell hypoxia-reoxygenation injury
WANG Yan-hong1, TIAN Ji-hua1, SU Xiao-le2, QIAO Xi2, LI Rong-shan3
(1.DeptofMicrobiologyandImmunology,ShanxiMedicalUniversity,Taiyuan030001,China;2.DeptofNephrology,theSecondHospitalofShanxiMedicalUniversity,Taiyuan030001,China; 3.DeptofNephrology,ShanxiProvincialPeople′sHospital,ShanxiKidneyDiseaseInstitute,Taiyuan,Shanxi030001,China)
Aim To evaluate the effect of intermedin (IMD) on cell proliferation and regeneration in rat tubular epithelial cell line (NRK-52E) that was subjected to hypoxia-reoxygenation (H/R) injury. Methods The NRK-52E cells were divided into control group and three model groups (H/R,H/R+primitive vector, H/R+IMD vector) . The content of LDH was detected to observe the influence of IMD on H/R injury. The cell proliferation was detected by MTT.The cell cycle was detected by flow cytometry. Real-time PCR and western blotting were used to determine mRNA and protein levels. Results ① In comparison to the control, H/R treatment decreased the cell viability and increased LDH activity (P<0.01); in contrast, compared to H/R, IMD treatment ameliorated cell viability(79.15±1.421%vs61.22±1.63%,P<0.05) and decreased LDH activities by 33.85% (P<0.01). ② The proliferation of NRK-52E cells was significantly inhibited by H/R treatment. In comparison to the control, H/R treatment of NRK-52E cells increased the proportion of cells in the G0/G1phase but decreased the proportion of cells in the S and G2/M phases.Moreover, the over-expression of IMD resulted in S and G2/M phase redistribution and the accumulation of G2/M-phase cells. The real-time PCR and western blotting results indicated that the mRNA and protein expression levels of cyclin D1, CDK4 and p57 were increased in H/R-treated cells. IMD further stimulated this up-regulated expression of cyclin D1, CDK4 and decreased the expression of p57 in NRK-52E cells. ④Cyclin D1 had a predominantly nuclear localization in NRK-52E cells, although cytoplasmic localization was also observed. Conclusion The study shows that the over-expression of IMD may promote renal cell proliferation and regeneration after renal tubular cell H/R injury via the up-regulation of cyclin D1,CDK and the down-regulation of p57.
intermedin; hypoxia-reoxygenation injury; renal tubular epithelial cells; cell proliferation; cell cycle; cyclin
时间:2015-3-16 15:41 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150316.1541.017.html
2014-10-15,
2015-02-10
国家自然科学基金资助项目(No 30971380);山西医科大学博士启动基金(No 03201302);山西医科大学基础医学院331基金(No 201406);山西医科大学科技创新基金(No 01201403)
王艳红(1979-),女,博士,讲师,研究方向:肾功能不全的基础与临床,E-mail:wangyanhongmail@126.com; 李荣山(1963-),男,博士,教授,博士生导师,研究方向:肾功能不全的基础与临床,通迅作者,E-mail:rongshanli13@163.com
10.3969/j.issn.1001-1978.2015.04.009
A
1001-1978(2015)04-0482-06
R-332;R322.61;R329.24;R329.28

