十二井穴刺络放血联合亚低温治疗对颅脑创伤急性期大鼠脑水肿的影响*
苗笑梅, 程世翔, 杨 震, 张 赛, 韩宛君, 涂 悦△, 孙洪涛△
(1. 天津中医药大学, 天津 300193; 2. 天津市神经创伤修复重点实验室、武警脑创伤与神经疾病研究所、武警后勤学院附属医院脑科医院, 天津 300162)
十二井穴刺络放血联合亚低温治疗对颅脑创伤急性期大鼠脑水肿的影响*
苗笑梅1,2, 程世翔1,2, 杨 震2, 张 赛2, 韩宛君2, 涂 悦2△, 孙洪涛2△
(1. 天津中医药大学, 天津 300193; 2. 天津市神经创伤修复重点实验室、武警脑创伤与神经疾病研究所、武警后勤学院附属医院脑科医院, 天津 300162)
目的:探讨十二井穴刺络放血联合亚低温对颅脑创伤(TBI)大鼠急性期脑水肿的影响。方法:将75只健康成年雄性SD大鼠随机分为5组(n=15):假手术组(Sham)、颅脑创伤组(TBI)、放血组(BL)、亚低温组(MIH)、放血联合亚低温组(BL+MIH)。采用电子脑皮质损伤撞击仪(eCCI)建立大鼠TBI模型,BL组于伤后即刻行十二井穴刺络放血,每日2次;MIH组在伤后即刻采用亚低温冰毯使体温降至32℃,持续干预6 h。伤后48 h分别采用核磁共振成像技术(MRI)观察脑水肿变化(n=3)、神经功能缺损评分(mNSS)观察行为学改变及干/湿重法测定脑含水量(n=8)、伊文思蓝染色(EB)检测血脑屏障通透性(BBB)(n=4)。结果:MRI显示,TBI组脑水肿及血肿明显,中线明显偏移;而干预组较TBI组水肿明显减轻,中线居中。与TBI组比较,各干预组mNSS评分均明显改善(P<0.05),而且BL+MIH组优于单独BL和MIH组(均P<0.01);各干预组脑含水量也有不同程度降低(P<0.05),尤以MIH组和BL+MIH组降低最为显著(P<0.01);各干预组血脑屏障通透性均有明显改善(均P<0.01),而且MIH组和BL+MIH组显著优于单独BL组(P<0.05,P<0.01)。结论:十二井穴刺络放血和亚低温均可以降低神经功能缺陷评分,减轻脑水肿,降低血脑屏障通透性,对创伤性大鼠脑组织有保护作用,且二者联合治疗效果更加明显。
十二井穴;亚低温;颅脑创伤;脑水肿;放血;大鼠
随着我国交通业和建筑业的飞速发展,由交通事故及高空坠落等意外事件导致的颅脑创伤(traumatic brain injury,TBI)事件频频发生,病情发展快,致残、致死率高,目前已成为严重威胁人类生命安全的疾病之一。而创伤性脑水肿则是TBI急性期最重要的继发性病理生理反应[1],由于过多水分聚集于神经细胞内外间隙,会导致颅内压升高以及脑体积增大,甚至引起脑疝,是TBI致残、致死的首要原因。
目前认为,刺络放血(bloodletting,BL)疗法是我国传统急救方法之一,起源较早并且疗效值得肯定,尤其是十二井穴刺络放血自古便应用于治疗尸厥昏迷,通过刺络放血能改善脑水肿状态[2,3]。亚低温(mild-induced hypothermia,MIH)作为TBI联合治疗的手段之一,是指用物理方法将患者体温降低到32℃~35℃温度范围内的低温治疗方法,能减轻TBI后一系列不良反应,降低颅内压、减轻创伤性脑水肿,发挥脑保护作用,并已在临床上形成了一定的规范和标准[4,5]。然而对于十二井穴刺络放血联合亚低温对TBI后脑水肿影响的研究鲜有报道。本研究在建立TBI大鼠模型基础上进行二者单独以及联合干预,探讨其对TBI后脑水肿的影响以及为今后TBI的临床治疗提供新的思路。
1 材料与方法
1.1 实验动物与分组
75只成年健康雄性SD大鼠(由军事医学科学院实验动物中心提供,体重为280~300 g),编号称重后按数字表随机分为5组(n=15):假手术组(Sham)、颅脑创伤组(TBI)、放血组(BL)、亚低温组(MIH)、放血联合亚低温组(BL+MIH)。
1.2 建立脑皮质撞击致TBI大鼠模型
实验前实验大鼠禁食12 h,不禁水。5%水合氯醛(0.6 ml/100 g)经腹腔注射麻醉后,取俯卧位置于立体定向头架,无菌条件下于中线切开头皮,剥离骨膜,暴露右顶骨。在前囟人字缝尖连线中点偏右2 mm,使用颅钻开直径为4.5 mm的圆形骨窗,暴露完整硬脑膜,待出现夹尾反射后开始打击。调整电子控制性脑皮质撞击仪(electric controlled cortical impactor,eCCI,美国Custom Design公司)打击臂与垂直方向角度20°,设定打击深度3 mm、打击速率4 m/s、打击最低点持续时间120 ms,使用直径为3 mm打击帽精确撞击大鼠脑皮质。致伤后即刻给予小动物呼吸机维持通气,徒手心外按压抢救,观察到自主呼吸恢复后缝合头皮切口。Sham组大鼠正常开骨窗但不行撞击。
1.3 十二井穴刺络放血及亚低温干预
(1)十二井穴刺络放血:用1 ml注射器针头于大鼠双侧前肢趾端的十二井穴点刺出血,出血量为每穴20 μl,每日2次,穴位定位方法采用比较解剖学,参考人体相应穴位解剖标志。(2)亚低温:应用亚低温治疗仪(CSZ 公司,美国)行大鼠亚低温处理,即采用冰毯体表降温,用HP-V26温度测定仪连续监测肛温使体温维持在(32.0±0.5)℃,持续6 h,之后用头灯在1 h内缓慢加热复温至(37.0±0.3)℃。(3)放血联合亚低温:进行井穴刺络放血和亚低温联合干预。各干预组均在伤后48 h取材。
1.4 磁共振成像
致伤48 h后,采用3.0 T磁共振成像(magnetic resonance imaging,MRI,德国西门子公司verio-3.0 T)监测大鼠伤后脑水肿的变化情况。将麻醉后的大鼠自嗅沟水平向尾侧作连续冠状位,获取T2加权图像。具体参数为:重复时间(repetition time,TR)=4 000 ms,有效回波时间(echo time,TE)=75 ms,矩阵 320×320。实验大鼠俯卧,冠状面扫描,各序列采集20层,层厚2 mm,间距0.1 mm。
1.5 神经功能缺损评分
实验大鼠在致伤48 h后,由不了解实验分组情况、经过专业培训的研究人员,应用神经功能缺损评分(modified neurological severity scores,mNSS)[6],对实验大鼠伤后的运动、感觉、提尾、平衡和反射等行为学损害程度进行评价。总得分最低为0分,提示大鼠完全正常,没有神经功能缺陷;最高是18分,提示大鼠意识丧失或死亡。
1.6 脑含水量
采用干/湿重法测定脑组织含水量[7]。于伤后48 h断头取脑,弃去小脑和双侧嗅球,滤纸吸干表面水分,称量大脑湿重后,置于110℃恒温箱中烘烤24 h至恒重,称量干重。脑含水量 =(湿重-干重)/湿重×100%。
1.7 血脑屏障通透性
采用伊文思蓝(Evans blue,EB)染色法检测血脑屏障通透性[8]。实验大鼠于处死前2 h经股静脉注射2% EB(3 ml/kg),出现眼结膜及口唇、四肢变蓝后断头取脑。取损伤灶周边皮质置于5 ml甲酰胺中,充分匀浆后置于37℃水浴箱中孵育24 h。12 000 r/min离心20 min后,收集上清液,用酶标仪(Thermo,λ = 620 nm)测定光密度(OD)值。用倍比稀释法制作标准曲线,计算脑组织EB含量(μg/g)。
1.8 统计学处理
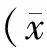
2 结果
2.1 大鼠MRI影像学表现
T2加权像显示致伤侧脑组织损伤改变,皮层的高信号区域提示损伤灶范围,损伤区出现部分极高信号考虑存在血肿形成。结果表明:Sham组MRI表现正常,未见异常信号影,中线结构居中。TBI组损伤处脑皮层有明显的挫伤,周围脑组织伴有水肿及血肿,中线明显偏移。BL组水肿范围缩小,中线轻微偏移。MIH组损伤范围变化不明显,水肿区较TBI组减小,中线基本无明显偏移。BL+MIH组水肿面积进一步减小,中线居中(图1)。

Fig. 1 T2-weighted images show TBI signal observation at different groups Sham:Sham-operation group; TBI: Traumatic brain injury group; BL: Bloodletting group; MIH: Mild-induced hypothermia group; BL+MIH: BL and MIH group
2.2 大鼠神经功能改变
大鼠TBI后神经功能受损,表现为平衡功能障碍,不能沿直线行走,感觉功能障碍,饮食摄水减少。与Sham组相比,差异显著(P<0.01)。与TBI组(13.25±0.67)相比,BL组(6.13±1.36)、MIH组(5.88±1.54)、BL+MIH组(2.38±0.99)mNSS评分均有明显下降(P<0.05),尤以BL+MIH组降低最为显著(P<0.01),其评分与Sham组(1.75±0.67)已无差异。此外,BL+MIH组mNSS评分较BL组、MIH组均有明显降低(P<0.05,图2)。
2.3 大鼠脑组织含水量改变
与Sham组(76.9±0.6)% 比较,大鼠致伤48 h后均出现不同程度的脑水肿:TBI组(79.9±1.1)%、BL组(78.8±0.8)%、MIH组(78.6±0.7)%、BL+MIH组(77.8±1.0)%(P<0.05,P<0.01),而BL组的脑含水量较TBI组降低(P<0.05),尤以MIH组和BL+MIH组下降最为显著(P<0.01,图3)。
2.4 大鼠血脑屏障通透性改变
与Sham组(2.5±0.6)μg/g比较,TBI组EB含量(5.5±0.4)μg/g明显上升(P<0.01),提示血脑屏障受损程度加重。而BL组(4.2±0.5)μg/g、MIH组(3.1±0.5)μg/g、BL+MIH组(2.9±0.6)μg/g。血脑屏障通透性均较TBI组明显下降(P<0.01),特别是MIH组、BL+MIH组已与Sham组无差异(图4)。

Fig. 2 Neurological severity scores of rats at 48 hours after injury Sham:Sham-operated group; TBI: Traumatic brain injury group; BL: Bloodletting group; MIH: Mild-induced hypothermia group; BL+MIH: BL and MIH group*P<0.05,**P<0.01vsshan group;#P<0.05,##P<0.01vsTBI group;△P<0.05vsBL group;▲P<0.05vsMIH group
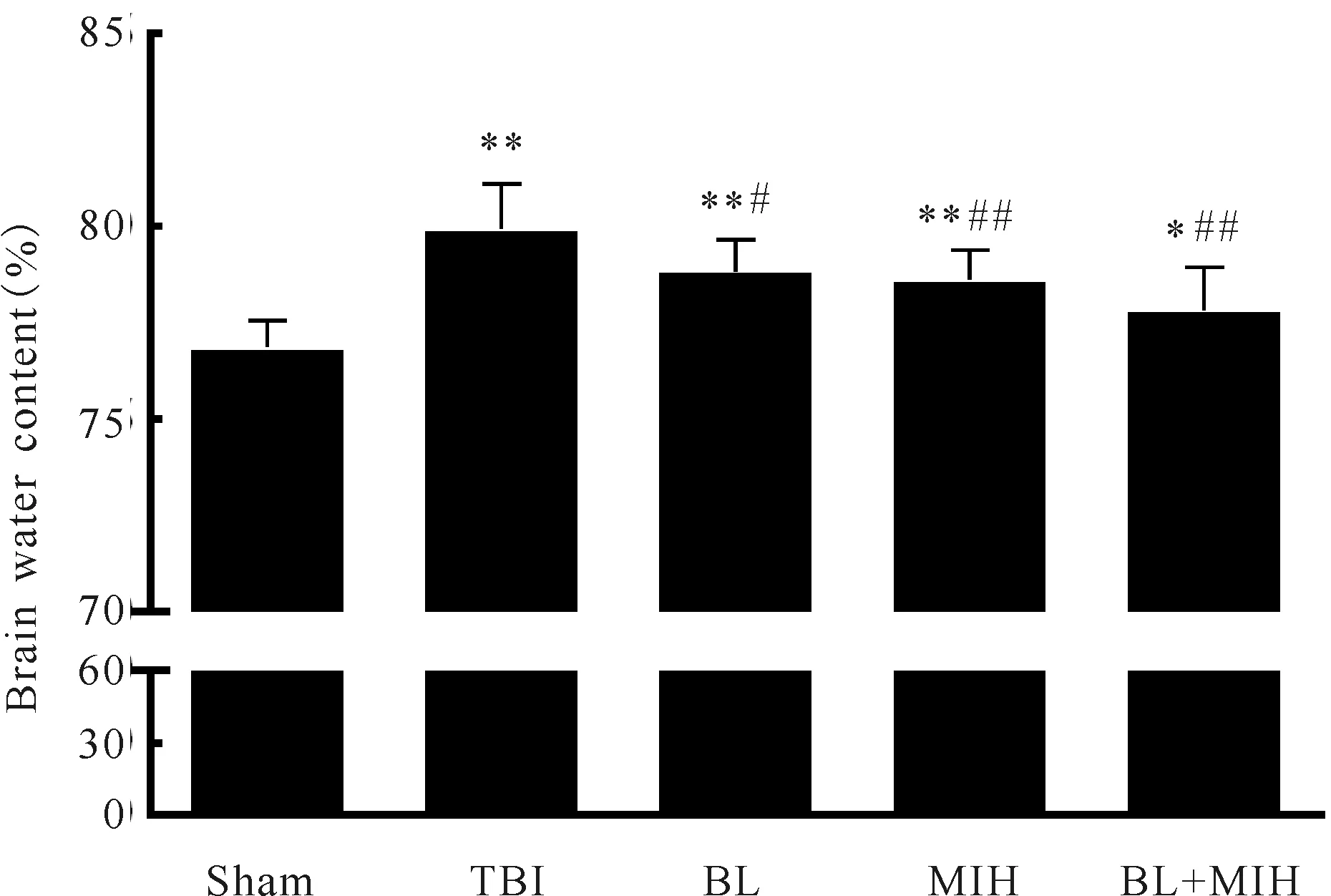
Fig. 3 Brain water content of rats at 48 hours after TBI(%) Sham: Sham-operation group; TBI: Traumatic brain injury group; BL: Bloodletting group; MIH: Mild-induced hypothermia group; BL+MIH: BL and MIH group*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsTBI group
3 讨 论
TBI是由机械性外力作用导致的脑组织局限性或弥散性的原发性损伤,而在致伤后的数分钟~数天内会出现诸如脑水肿、颅内压升高、脑血流量改变等继发性损伤,进而加重脑组织的原发性损害[9],尤其是创伤性脑水肿发展较快而且致残、致死率极高[10]。创伤性脑水肿主要有两种类型:血管源性脑水肿是由于TBI后血脑屏障内皮连接障碍,造成内皮细胞通透性增加,引起血管漏,这与脑挫伤和脑水肿有关;细胞毒性脑水肿是由于神经细胞膜机械性损伤,造成大量钾离子外流、钙离子内流,导致细胞肿胀,这与伤后脑组织的缺血、缺氧有关。在医学发展进程中,中医与西医对此疾病的研究都做出了卓越贡献。因此,寻找有效的中西医方法防控脑水肿可以降低TBI患者死亡率,提高生存质量。
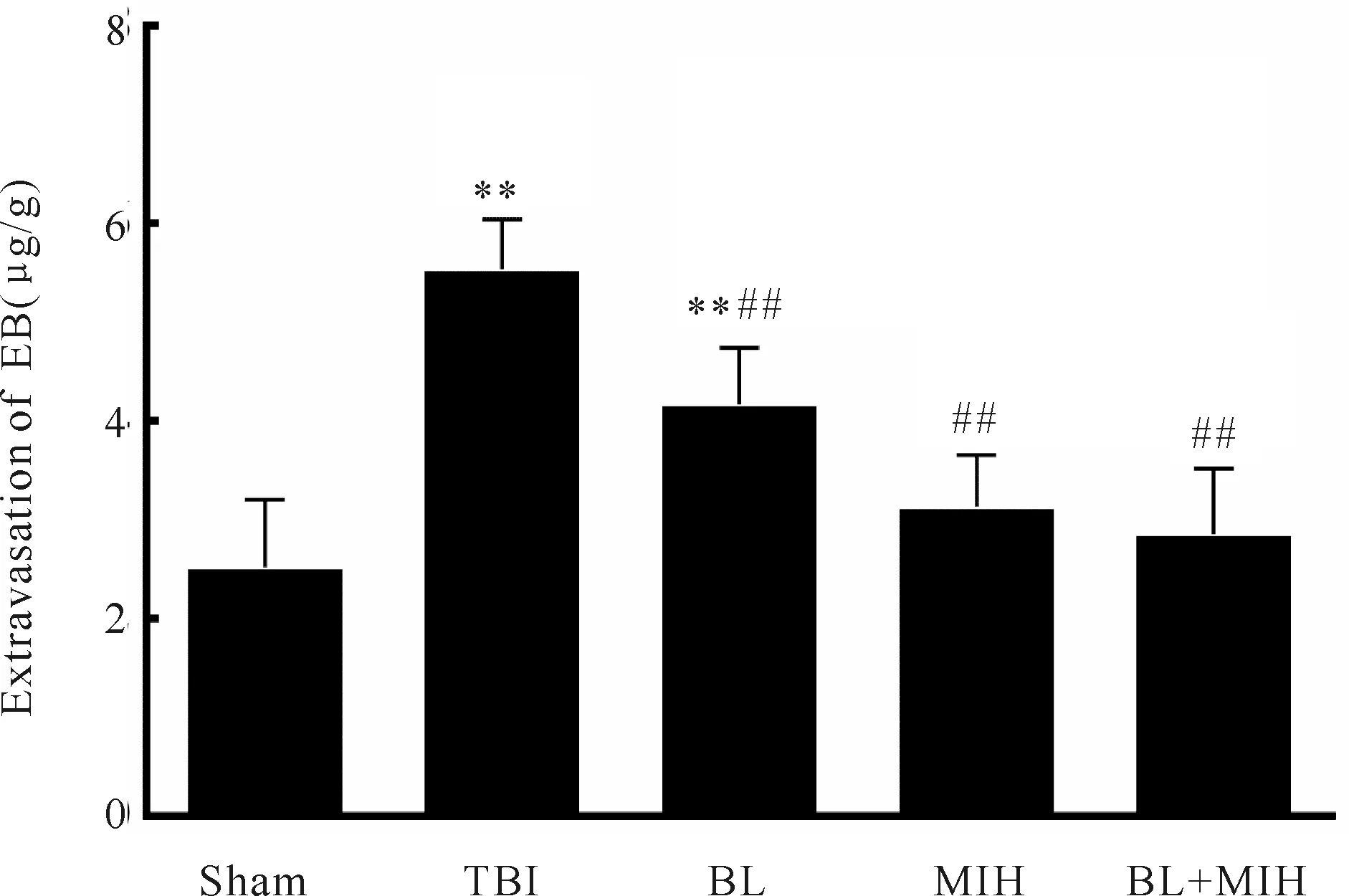
Fig. 4 Evan’s blue(EB) content in the damage zone at 48 h after injury Sham: Sham-operated group; TBI: Traumatic brain injury group; BL: Bloodletting group; MIH: Mild-induced hypothermia group; BL+MIH: BL and MIH group**P<0.01vssham group;##P<0.01vsTBI group
祖国传统医学是一个巨大的宝库,千百年来积累了大量的临床经验,其中井穴刺络放血作为中医传统的急救措施之一,疗效值得肯定。《医宗金鉴·刺灸心法要诀》中指出:“商阳主刺卒中风,暴仆昏沉痰涎壅,少商、中冲、关冲、少泽、商阳,使气血流行,乃起死回生救急之妙穴”。另外,《针灸大成》中也说:“凡初中风跌倒,卒暴昏沉……急以三棱针刺手十指十二井穴,当去恶血……乃起死回生妙诀”,可见十二井穴刺络放血是古代急救昏迷以促醒的重要方法,疗效确切。据报道,十二井穴刺络放血能抑制缺血区H+的堆积,调控K+、Na+浓度,阻止Ca2+内流,对离子浓度有重要的良性调节作用,且能调节脑血流速度,对维持细胞离子稳态、缓解细胞毒性水肿的发生和发展具有积极作用[11-13],而创伤性脑水肿和缺血性脑水肿在发病机理和病理过程方面有某些相似之处,因此可以考虑手十二井穴放血对缺血性脑水肿的起效机制可能同样作用于创伤性脑水肿。本实验也表明井穴放血能够降低脑含水量,促进脑水肿及血肿的吸收。
而在现代研究中也早已证实,亚低温对TBI性脑水肿有显著疗效,它能够通过减少血容量、抑制炎症以控制颅内压,进而缓解血脑屏障渗漏[14];也可通过调控紧密连接蛋白、肿瘤坏死因子α(TNF-α)、促炎细胞因子白细胞介素(IL-1β)而抑制血脑屏障的破坏[15];还可以抑制基质金属蛋白酶(MMPs)的释放及水通道蛋白质4(AQP-4)的过度表达以保护血脑屏障,降低内皮细胞通透性,减轻血管源性脑水肿[16-18]。此外,亚低温能够减少脑代谢,降低氧和葡萄糖的消耗,减少脑组织乳酸的堆积,使细胞的能量代谢维持在一个较低的水平,减少Ca2+内流,阻断钙离子对神经元的毒性,降低颅内压,抑制兴奋性氨基酸、乙酰胆碱、儿茶酚胺等内源性毒性产物对脑细胞的损害,减轻细胞毒性脑水肿,有利于神经功能的恢复[19-21]。通过此次实验也验证了亚低温可以降低血脑屏障通透性,加速水肿吸收,具有神经功能保护作用。
创伤性颅脑损伤病情严重[22, 23],病理过程复杂,它使细胞中大量内容物漏出,继发神经细胞坏死,炎性反应,水、电解质紊乱,脑含水量急剧增加,引发脑水肿及颅内压进行性增加等一系列病理损害[24]。单一的治疗方法很难达到预期效果,需要综合利用各种方法,多管齐下,以期获得满意疗效[25]。通过本实验可以发现,十二井穴刺络放血和亚低温对TBI后神经功能缺陷的改善有一定作用,且能降低脑水肿程度,稳定血脑屏障通透性,并且从核磁影像学也能观察到,干预组比模型组脑肿胀改善更明显。
[1] Maas AI, Stocchetti N, Bullock R. Moderate and severe traumatic brain injury in adults[J].LancetNeurol, 2008, 7(8): 728-741.
[2] 蒋丽元, 陈泽林, 祝 骥, 等. 井穴放血和薏苡仁干预实验性脑缺血性大鼠脑水肿的研究[J]. 针灸临床杂志, 2013, 29(4): 54-58.
[3] 高 靓, 杜元灏, 李中正, 等. 井穴放血结合薏苡仁对大脑中动脉栓塞大鼠脑水肿影响的实验研究[J]. 吉林中医药, 2012, 32(1): 65-67.
[4] Choi HA, Badjatia N, Mayer SA. Hypothermia for acute brain injury--mechanisms and practical aspects[J].NatRevNeurol, 2012, 8(4): 214-222.
[5] Brain Trauma Foundation, American Association of Neurological Surgeons; Congress of Neurological Surgeons,etal. Guidelines for the management of severe traumatic brain injury. III. Prophylactic hypothermia[J].JNeurotraum, 2007, 24 (Suppl 1): S21-25.
[6] Meng Y, Chopp M, Zhang Y,etal. Subacute intranasal administration of tissue plasminogen activator promotes neuroplasticity and improves functional recovery following traumatic brain injury in rats[J].PLoSOne, 2014, 9(9): e106238.
[7] Zhou L, Lin J, Lin J,etal. Neuroprotective effects of vagus nerve stimulation on traumatic brain injury[J].NeuralRegenRes, 2014, 9(17): 1585-1591.
[8] Si D, Li J, Liu J,etal. Progesterone protects blood-brain barrier function and improves neurological outcome following traumatic brain injury in rats[J].ExpTherMed, 2014, 8(3): 1010-1014.
[9] Morley EJ, Zehtabchi S. Evidence-based emergency medicine/ systematic review abstract. Mannitol for traumatic brain injury: searching for the evidence[J].AnnEmergMed, 2008, 52(3): 298-300.
[10]王 伟. 外伤性急性脑肿胀术后亚低温治疗疗效分析[J]. 浙江创伤外科, 2014, (3): 451-453.
[11]何树泉, 郭义赢, 马岩番, 等. 手十二井穴刺络放血对实验性脑缺血大鼠缺血区H+浓度影响的实验研究[J]. 针灸临床杂志, 2002, 18(2): 45-47.
[12]马惠芳, 严 洁, 任秀君, 等. 电针不同“井穴”对脑缺血大鼠脑组织活性钙调素的影响[J]. 北京中医药大学学报, 2002, 25(3): 73-74.
[13]方 颖, 张进科. 放血疗法治疗帕金森[J]. 中国民族民间医药, 2011, 20(3): 81-82.
[14]Jeon SB, Koh Y, Choi HA,etal. Critical care for patients with massive ischemic stroke[J].JStroke, 2014, 16(3): 146-160.
[15]Sun H, Tang Y, Guan X,etal. Effects of selective hypothermia on blood-brain barrier integrity and tight junction protein expression levels after intracerebral hemorrhage in rats[J].BiolChem, 2013, 394(10): 1317-1324.
[16]包 龙. 亚低温脑保护的基础研究进展[J]. 中国急救医学, 2013, 33(8): 762-766.
[17]Lee JE, Yoon YJ, Moseley ME,etal. Reduction in levels of matrix metalloproteinases and increased expression of tissue inhibitor of metalloproteinase-2 in response to mild hypothermia therapy in experimental stroke[J].JNeurosurg, 2005, 103(2): 289-297.
[18]代大伟, 王德生, 李克深, 等. 局部亚低温对大鼠脑出血后水通道蛋白4表达的影响[J]. 中华医学杂志, 2006, 86(13): 906-910.
[19]Farag E, Manno EM, Kurz A. Use of hypothermia for traumatic brain injury: point of view[J].MinervaAnestesiol, 2011, 77(3): 366-370.
[20]Liu J, Litt L, Segal MR,etal. Outcome-related metabolomic patterns from1H/31P NMR after mild hypothermia treatments of oxygen-glucose deprivation in a neonatal brain slice model of asphyxia[J].JCerebBloodFlowMetab, 2011, 31(2): 547-559.
[21]Darwazeh R, Yan Y. Mild hypothermia as a treatment for central nervous system injuries: Positive or negative effects[J].NeuralRegenRes, 2013, 8(28): 2677-2686.
[22]涂 悦, 杨细平, 商崇智. 醒脑静对颅脑创伤的保护作用[J]. 中国应用生理学杂志, 2014, 30(3): 230-232, 236.
[23]周建光, 方以群, 刘长云, 等. 高压氧对急性脑创伤后皮层一氧化氮合酶mRNA表达的影响[J]. 中国应用生理学杂志, 2012, 28(1): 38-41.
[24]Wilson M, Montgomery H. Impact of genetic factors on outcome from brain injury[J].BrJAnaesth, 2007, 99(1): 43-48.
[25]Margulies S, Hicks R. Combination therapies for traumatic brain injury: prospective considerations[J].JNeurotrauma, 2009, 26(6): 925-939.
Therapeutic bloodletting at Jing-well points combine hypothermia attenuated acute cerebral edema after traumatic brain injury in rats
MIAO Xiao-mei1, CHENG Shi-xiang1,2, YANG Zhen2, ZHANG Sai2, HAN Wan-jun2, TU Yue2△, SUN Hong-tao2△
(1. Tianjin University of Traditional Chinese Medicine, Tianjin 300193; 2. Tianjin Key Laboratory of Neurotrauma Repair, Institute of Traumatic Brain Injury and Neuroscience of China Armed Police Force; Neurology and Neurosurgery Hospital of China Armed Police Force, Tianjin 300162, China)
Objective: To investigate the influence of therapeutic bloodletting at Jing-well points and hypothermia on acute cerebral edema after traumatic brain injury (TBI) in rats. Methods: Seventy-five SD rats were randomly divided into sham-operation group (Sham), TBI group (TBI), bloodletting group (BL), mild-induced hypothermia group (MIH), and bloodletting plus MIH group (BL+MIH)(n=15). The model of TBI was established by electric controlled cortical impactor (eCCI). The rats of BL group were bloodletting at Jing-well points immediately after injury, twice daily. While the MIH group was settled on a hypothermia blanket promptly after TBI for 6 hours, so that the temperature dropped to 32 degrees. Each of measurement was performed after 48 hours. Magnetic resonance imaging (MRI) was used to evaluate the dynamic impairment of cerebral edema after TBI (n=3). In addition, mNSS score, measurements of wet and dry brain weight, and Evans Blue assay were performed to investigate the neurologic deficit, cerebral water content (n=8), and blood-brain barrier permeability(BBB), (n=4), respectively. Results: MRI analysis showed that the cerebral edema, hematoma and midline shifting of rats in TBI group was more serious than other treatment group. Meanwhile compared with TBI group, the mNSS scores of every treatment group were meaningfully lower (allP<0.05). Furthermore, treatment with BL+MIH group was superior to the separated BL and MIH group (allP<0.01). In addition, brain water content of each intervention group reduced to varying degrees (allP<0.05), especially that of MIH group and BL+MIH group (P<0.01). BBB permeability of each treatment group was also significantly improved (allP<0.01), and the improvement in MIH group and BL+MIH group was much better than the BL alone group (P<0.05,P<0.01). Conclusion: Our major finding is that bloodletting at Jing-well points and MIH can reduce cerebral edema and BBB dysfunction and exert neuroprotective effects after TBI. The results suggest that the combination of BL and MIH is more effective than other treatment being used alone.
jing-well points; mild-induced hypothermia; traumatic brain injury; brain edema; bloodletting; rat
天津市自然科学基金面上项目(12JCYBJC18500);武警部队后勤科研项目(WJHQ2012-20);武警后勤学院科研创新团队(WHTD201306)
2014-12-09
2015-03-02
R641
A
1000-6834(2015)03-249-05
10.13459/j.cnki.cjap.2015.03.015
△【通讯作者】Tel: 022-60577173,022-60577142; E-mail: ytumail@vip.126.com,chenmo333@163.com

