过氧化氢氧化纤维素的研究
黄小雷 刘 文 刘群华 陈雪峰
(1.中国制浆造纸研究院,北京,100102;2.制浆造纸国家工程实验室,北京,100102)
·氧化纤维素·
过氧化氢氧化纤维素的研究
黄小雷1,2刘 文1,2刘群华1,2陈雪峰1,2
(1.中国制浆造纸研究院,北京,100102;2.制浆造纸国家工程实验室,北京,100102)
对过氧化氢为氧化剂制备氧化纤维素进行了研究,探讨了pH值、氧化反应时间、过氧化氢用量、催化剂Fe2+用量对纤维素氧化程度和降解程度的影响。研究表明,在浆浓1%,不加催化剂时,pH值为3,反应时间6 h,过氧化氢用量50%时得到的醛基含量为0.24 mmol/g和羧基含量为0.20 mmol/g,纸浆的平均聚合度为969;控制上述其他工艺条件不变,考察催化剂FeSO4·7H2O用量对纤维素氧化程度和降解程度的影响。实验结果表明,添加该催化剂后纸浆聚合度显著降低,最低降至611;在催化剂用量0.1%时,羧基含量达到最大值0.29 mmol/g;在催化剂用量0.6%时,醛基含量达到最大值0.42 mmol/g。
过氧化氢;纤维素;催化剂;聚合度
(*E-mail: xiaoleicoolcool@126.com)
国内外关于氧化纤维素方面的研究较多,从近些年的研究可以看出,对纤维素仲羟基的选择性氧化主要以高碘酸盐体系为主,对纤维素伯羟基的选择性氧化主要以TEMPO媒介共氧化体系为主[1-9]。但高碘酸盐和TEMPO的市场价格均较贵。过氧化氢作为一种廉价、有效的氧化剂,已有研究者用过氧化氢开展制备氧化淀粉的实验,且反应条件温和,对分子质量的降低十分有限[7]。纸浆中纤维素与淀粉相似,都属于多糖类化合物,不同的是淀粉是由D-吡喃式葡萄糖基以α-1,4-苷键连接而成的。关于过氧化氢氧化纤维素的机理有许多争论,但目前普遍接受的是德国Peter Ney的观点[12]:过氧化氢分解生成的氢过氧自由基(HOO·)能将纤维素的还原性末端基氧化成羧基,而分解生成的氢氧自由基(HO·)既能氧化还原性末端基,也能氧化其他醇羟基。过氧化氢稳定性较差,易发生无效分解,影响氧化效果。根据已有研究者对过氧化氢的氧化反应特性研究可知,体系的pH值是影响过氧化氢分解的关键因素,其次是质量浓度,而体系温度的影响较小[13]。过氧化氢与Fe2+组合的体系,称为Fenton试剂,会不断产生羟基自由基(HO·),使得该体系具有强氧化性,现已广泛用于某些难治理的或对生物有毒性的工业废水的处理[14-17]。影响该体系的反应因素主要有溶液的pH值、反应温度、过氧化氢用量、催化剂用量等[14-17]。将Fenton试剂,即用Fe2+作为催化剂用于纤维素的氧化实验至今尚未见文献或专利报道。
由于纤维素氧化过程复杂,氧化反应通常会伴随着纤维素的降解反应,造成纤维素的强度损失。纤维素的氧化和降解程度受多种因素的影响,如氧化剂用量、pH值、反应时间等氧化反应条件,这些因素同样也决定着氧化产物中醛基和羧基的含量。因此,合理调节氧化条件,控制纤维素的氧化程度与降解程度是本研究的重点。此外,本研究将首次尝试开展Fenton试剂用于氧化纤维素的实验,以期探索出一种经济可行的氧化纤维素的制备方法。
1 实 验
1.1 主要原料
雄狮牌漂白针叶木硫酸盐浆(NBKP),产地加拿大,原树树种为英属哥伦比亚地区针叶木和西部雪松,α-纤维素含量为83.87%。
过氧化氢(H2O2),质量分数30%的水溶液,分析纯,北京有机化工厂;盐酸(HCl),分析纯,北京有机化工厂;七水合硫酸亚铁(FeSO4·7H2O),分析纯,北京有机化工厂。
1.2 主要仪器设备
D-8401W型电动搅拌机,天津市华兴科学仪器厂;03型标准纤维疏解机,瑞典L&W公司;PB-10型pH计,德国Sartorius公司;3173COND型电导率仪,上海任氏电子有限公司;IT-09A型磁力搅拌器,ITESTER公司;DHG-9145A型电热恒温鼓风干燥箱,上海一恒科技有限公司;MS204S分析天平,瑞士METTLER TOLEDO公司;毛细管黏度计,中国制浆造纸研究院自制;碱式滴定管。
1.3 过氧化氢氧化纤维素的实验方法
以疏解好的NBKP浆为原料,将相当于20 g绝干浆的NBKP分散在2 L水中,通过滴加1 mol/L的盐酸或氢氧化钠调节到要求的pH值,开启电动搅拌机,加入要求的过氧化氢量(用量均相对于绝干浆质量来计),如有必要,则可添加一定量的金属离子催化剂(本实验所用为FeSO4·7H2O),催化剂用量相对于绝干浆质量计。反应到规定时间后,多次洗涤浆料,滤除多余水分后备用。
1.4 氧化反应后纸浆主要指标的测定
(1)纸浆中羧基含量的测定
称取绝干质量约为0.3 g的氧化后浆料,加入55 mL去离子水和5 mL浓度0.01 mol/L的NaCl溶液,用磁力搅拌器混合均匀。然后用浓度0.1 mol/L的HCl溶液调节混合液的pH值为2.5~3.0,继续用磁力搅拌器搅拌20 min后,用浓度0.04 mol/L的NaOH溶液以0.2 ml/min的速度滴到pH值为11.0。用电导率仪测定溶液的电导率变化。作NaOH溶液消耗量对电导率的曲线图。图中电导率平稳阶段的NaOH消耗量即是氧化纤维素中羧基所消耗的量。由此可计算出氧化纤维素羧基的质量摩尔浓度(mmol/g绝干浆)。每个样品平行测定3次,取平均值作为该样品的羧基含量测定结果[18]。
(2)纸浆中醛基含量的测定
将氧化后的浆料用亚氯酸钠在pH值为4~5的条件下进一步氧化,由亚氯酸钠氧化增加的羧基数量。即认为是过氧化氢氧化后浆料中的醛基数量。测定结果以质量摩尔浓度计,单位是mmol/g绝干浆。
(3)纸浆平均聚合度的测定
根据国家标准GB/T 1548—2004计算出纸浆的黏度[η],再由式(1)计算出纸浆的平均聚合度。
DP0.905=0.75[η]
(1)
2 结果与讨论
2.1 pH值的影响
在反应温度为室温、反应时间为2 h、不加催化剂、过氧化氢用量为50%的条件下,考察pH值的变化对氧化纤维素羧基和醛基含量及平均聚合度的影响,实验结果见图1。
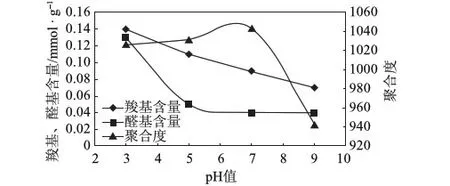
图1 pH值对过氧化氢氧化纤维素的影响
由图1可知,在实验pH值范围内纸浆的平均聚合度下降并不十分显著,均在900以上。pH值9时纸浆平均聚合度略低,这可能是碱性条件下纤维素发生轻微水解的原因。过氧化氢氧化纤维素在pH值较低时的氧化效果更好。分析认为这是由于体系的pH值与过氧化氢的分解(指发生无效分解,生成H2O和O2)速率密切相关,导致不同pH值条件下氧化效果不同。已有研究结果表明,pH值约为3时,过氧化氢最稳定,1 h内分解率不到1%;随着pH值增大,过氧化氢分解速率增大,尤其pH值为9时,最易导致其分解。这也解释了pH值为9时,醛基和羧基含量均很低的原因,相当一部分过氧化氢由于发生无效分解而显著降低了氧化效果。综合上述分析,后续过氧化氢氧化实验将pH值定为3。
2.2 反应时间的影响
在反应温度为室温、pH值为3、不加催化剂、过氧化氢用量为50%的条件下,考察反应时间的变化对氧化纤维素羧基和醛基含量及平均聚合度的影响,实验结果见图2。

图2 反应时间对过氧化氢氧化纤维素的影响
图2结果表明,在反应时间达到6 h之前,随着反应时间的增加,醛基和羧基含量随之快速增加。超过6 h后,继续延长反应时间,醛基和羧基含量增加的速度相对变缓慢。因此,过氧化氢适宜的氧化反应时间为6 h。
2.3 过氧化氢用量的影响
在反应温度为室温、pH值为3、不加催化剂、反应时间为6 h的条件下,考察过氧化氢的用量(以反应体系中过氧化氢的实际浓度计)对氧化纤维素羧基和醛基含量及平均聚合度的影响,实验结果见图3。
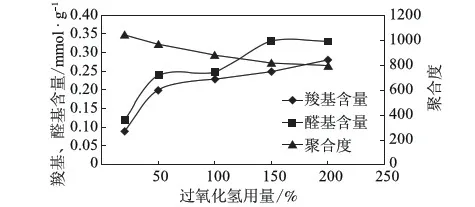
图3 过氧化氢用量对氧化纤维素的影响
图3结果表明,随着过氧化氢用量的增大,纸浆平均聚合度是逐渐降低的,羧基含量随之增加。过氧化氢用量由20%增大到50%时,羧基和醛基含量均增加迅速,之后继续增大过氧化氢用量,二者的增速均变缓,且醛基含量的增加速度略高于羧基含量。
2.4 催化剂用量的影响
在反应温度为室温、pH值为3、过氧化氢用量为50%、反应时间为6 h的条件下,考察催化剂FeSO4·7H2O的用量(相对于绝干浆的)对氧化纤维素羧基和醛基含量及平均聚合度的影响,实验结果见图4。
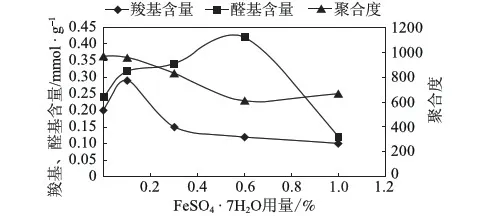
图4 催化剂用量对氧化纤维素的影响
过氧化氢和HO·的氧化选择性均较差,且在pH值为3时HO·的氧化电势(2.7 V)较过氧化氢(1.76 V)高,部分HO·将纤维素葡糖糖单元上的羟基氧化为醛基或进一步氧化成羧基,部分HO·直接进攻纤维素碳链的末端,导致纤维素降解,降低纸浆的聚合度。由图4结果可以看出,在H2O2量一定时,随着催化剂FeSO4·7H2O用量的增加,醛基和羧基含量整体都呈现先增大后降低的趋势。其中,醛基含量在FeSO4·7H2O用量为0.6%时达到最大值,羧基含量在FeSO4·7H2O用量为0.1%时达到最大值。分析认为这可能是由于催化剂用量较少时,产生的HO·都参与了氧化反应,使纤维素的羟基氧化成醛基或羧基,因此随着催化剂用量增加,醛基和羧基含量会增加,但由于一部分醛基还来不及被氧化成羧基,因此醛基含量增加幅度更大。但当催化剂用量过多时,如FeSO4·7H2O用量为1%时,会导致H2O2迅速分解,产生的HO·来不及与有机物发生反应就聚集并反应生成H2O和O2,造成HO·的损耗,极大削弱了氧化效果,醛基和羧基含量均显著降低,同时过量的Fe2+极易被氧化成Fe3+,造成纸浆呈明显黄色。由实验结果还可以看出,添加催化剂后,由于HO·的产生,氧化能力增强,导致纸浆聚合度出现了显著降低。
3 结 论
对过氧化氢作为氧化剂制备氧化纤维素进行了研究,探讨了制备条件对纤维素氧化程度和降解程度的影响。
3.1 在浆浓1%、不加催化剂的条件下,过氧化氢氧化纤维素反应的适宜pH值为3,反应时间6 h,过氧化氢用量50%时得到的醛基含量为0.24 mmol/g和羧基含量为0.20 mmol/g,对应纸浆的平均聚合度为969。
3.2 在浆浓1%、添加FeSO4·7H2O作为催化剂的条件下,随着催化剂用量的增加,醛基和羧基含量整体都呈现先增加后降低的趋势,且醛基含量增加的幅度要大于羧基。达到最大羧基含量(0.29 mmol/g)的氧化条件为:pH值为3,反应时间6 h,过氧化氢用量50%,催化剂FeSO4·7H2O用量0.1%;达到最大醛基含量(0.42 mmol/g)的氧化条件为:pH值为3,反应时间6 h,过氧化氢用量50%,催化剂FeSO4·7H2O用量0.6%。添加催化剂后,纸浆聚合度降低显著。
3.3 本实验条件下确定的适宜氧化反应时间为6 h,时间偏长,后续还应对氧化反应条件进一步优化,尽可能缩短反应时间,提高氧化纤维素的制备效率。
[1] TANG Ai-ming, HU Ting-ting, SU Xia.Preparation and Characterization of TEMPO Oxidized Cellulose/CdsNanocomposites[J].Transactions of China Pulp and Paper, 2012, 27(4): 7.唐爱民, 胡婷婷, 苏 霞.TEMPO氧化纤维素/CdS纳米复合材料的制备与表征[J].中国造纸学报, 2012, 27(4): 7.
[2] MAO Lian-shan, MA Pu, LIU Gui-nan.Study on TEMPO-mediated Selective Oxidation of TMP Long Fibers[J].China Pulp & Paper, 2009, 28(7): 7.毛连山, 马 朴, 刘桂南.机械浆长纤维的TEMPO选择性催化氧化[J].中国造纸, 2009, 28(7): 7.
[3] DONG Feng-xia, LIU Wen, CHEN Xue-feng.Preparation of Nanocellulose by Using 4-Acetamido-TEMPO Oxidizing System and Ultrasonic Treatment[J].China Pulp & Paper, 2013, 32(8): 33.董凤霞, 刘 文, 陈雪峰.4-乙酰氨基-TEMPO氧化制备纳米纤维[J].中国造纸, 2013, 32(8): 33.
[4] FENG Ya-qing, LIU Yan, ZHANG Xiao-dong, et al.Prepration of Diadehyde Cellulose and Its Absorption Property[J].Journal of Tianjin University, 2002, 35(6): 767.冯亚青, 刘 燕, 张晓东, 等.氧化纤维素的制备及吸附性能的研究[J].天津科技大学学报, 2002, 35(6): 767.
[5] LIU Wei, HOU Qing-xi, LIU Ze-hua.Study on the Cellulose Oxidized by Periodate and theApplication Progress[J].Journal of Cellulose Science and Technology, 2007, 15(4): 60.刘 苇, 侯庆喜, 刘泽华.高碘酸盐氧化纤维素的研究及应用进展[J].纤维素科学与技术, 2007, 15(4): 60.
[6] QIAN Rong-jing.TEMPO Selective Oxidation on Cellulose and the Application[D].Guangzhou: South China University of Technology, 2011.钱荣敬.TEMPO媒介氧化体系对纤维素的选择性氧化及应用研究[D].广州: 华南理工大学, 2011.
[7] TAN Zhong-yan.The Preparation of Cellulose Nanocrystals by TEMPO Oxidation with the Synergy of Ultrasonic[D].Nanjing: Nanjing Forestry University, 2011.覃忠严, 超声波协同TEMPO氧化法制备纳米纤维微晶的研究[D].南京: 南京林业大学, 2011.
[8] Tsuguyuki Saito, Akira Isogai.Introduction of aldehyde groups on surfaces of native cellulose fibers by TEMPO-mediated oxidation[J].Collids and Surfaces A: Physicochem.Eng.Aspects 289(2006): 219.
[9] TAO Fu-rong, WANG Dan-jun, SONG Huan-ling, et al.Oxidation of Microcrystalline Cellulose to Oxycellulose by Sodium Periodate[J].Journal of Molecular Catalysis, 2011, 25(2): 119.陶芙蓉, 王丹君, 宋焕玲, 等.高碘酸钠催化微晶纤维素的氧化[J].分子催化, 2011, 25(2): 119.
[10] Parovuori P, Hamunen A, Forssell P, et al.Oxidation of potato starch by hydrogen peroxide: Starch/Stärke1995, 47(1): 19.
[11] Shui-Dong Zhang, Yu-Rong Zhang, Xiu-li Wang, et al.High carbonyl content oxidized starch prepared by hydrogen peroxide and its thermoplastic application: Starch/Stärke2009, 61(11): 646.
[12] XIE Lai-su, ZHAN Huai-yu.Pulping Principle and Engineering[M].Beijing: China Light Industry Press, 2006.谢来苏, 詹怀宇.制浆原理与工程[M].北京: 中国轻工业出版社, 2006.
[13] LIU Zhong-xing, XIE Chuan-xin, SHI Ning, et al.Study on Decomposition Behavior of Hydrogen Peroxide Solution[J].Qilu Petrochemical Technology, 2009, 37(2): 99.刘中兴, 谢传欣, 石 宁, 等.过氧化氢溶液分解特性研究[J].齐鲁石油化工, 2009, 37(2): 99.
[14] YUAN Bao-ling, WANG Hong-jie.New Technology of wastewater treatment and its Application[M].Beijing: Chemical Industry Press, 2006.苑宝玲, 王洪杰.水处理新技术原理与应用[M].北京: 化学工业出版社, 2006.
[15] Li C W, CHEN Y M, CHI Y C, et al.Dye wastewater treated by Fenton process with ferrous ions electrolytically generated from iron-containing sluge[J].Journal of Hazardous Materials, 2007, 144(2): 95.
[16] LIU Jianyu, WANG Xiaojun.Advanced Treatment of Fine-chemicals Wastewater by Fenton[J].Environmental Science & Technology, 2009, 32(5): 141.刘剑玉, 汪晓军.Fenton化学氧化法深度处理精细化工废水[J].环境科学与技术, 2009, 32(5): 141.

(责任编辑:常 青)
Study on Oxidation of Cellulose by Hydrogen Peroxide
HUANG Xiao-lei1,2,*LIU Wen1,2LIU Qun-hua1,2CHEN Xue-feng1,2
(1.ChinaNationalPulpandPaperResearchInstitute,Beijing, 100102;2.NationalEngineeringLabforPulpandPaper,Beijing, 100102)
The oxidized cellulose was prepared by using hydrogen peroxide to treat the pulp, The effects of the pH value, oxidation time, dosages of hydrogen peroxide and catalyst (Fe2+) on the oxidation degradation degree of the cellulose were investigated.The results showed that under the conditions of pulp concentration 1%, pH=3, reaction time 6 h, and dosage of hydrogen peroxide 50% and without adding catalyst, aldehyde group content of the treated pulp was 0.24 mmol/g, carboxyl group was 0.20 mmol/g, and DP=969.The influence of FeSO4·7H2O on oxidation degradation degree was analyzed with fixd the conditions as mentioned above.The results showed that the DP of the pulp decreased obviously to the lowest value(611).The highest content of carboxyl group 0.29 mmol/g was achieved when the doage of FeSO4·7H2O was 0.1%.The highest content of aldehyde group 0.42 mmol/g was achieved when the doage of FeSO4·7H2O was 0.6%.
hydrogen peroxide; cellulose; catalyst; DP
黄小雷女士,工程师;主要从事特种纸与特种浆方面的研究开发工作。
2015-06-19(修改稿)
TS72
A
10.11980/j.issn.0254-508X.2015.11.004

