用HPLC法测定4种牡荆属植物中黄荆子素的含量
舒志恒,李华强,李 清,董睿方,郑承剑*,秦路平*
(1.宁夏医科大学药学院生药学教研室,银川 750004;2.第二军医大学药学院生药学教研室,上海 200433;3.上海师范大学生命与环境科学学院植物学教研室,上海 200234)
用HPLC法测定4种牡荆属植物中黄荆子素的含量
舒志恒1,2,李华强2,3,李 清2,董睿方2,3,郑承剑2*,秦路平2*
(1.宁夏医科大学药学院生药学教研室,银川 750004;2.第二军医大学药学院生药学教研室,上海 200433;3.上海师范大学生命与环境科学学院植物学教研室,上海 200234)
目的:建立HPLC法测定4种牡荆属植物(黄荆、牡荆、单叶蔓荆和蔓荆)果实中黄荆子素(VNL)的含量,比较黄荆子素的含量异同。方法:采用Zorbax Extend C18色谱柱(250mm×4.6mm,5μm),Extend-C18保护柱(12.5mm× 4.6mm,5μm);以乙腈-0.1%甲酸溶液为流动相,梯度洗脱,0~18min 14.4%乙腈,18~30min 14.4%~17%乙腈,30~45min 17%乙腈;流速1.0ml/min;检测波长254nm;柱温30℃。结果:黄荆子素在14.2~455.0μg/ml范围内呈良好的线性关系,平均加样回收率为96.99%。黄荆子素的含量在牡荆属4种植物中存在差异,其中以黄荆子和蔓荆子中含量较高。结论:该方法准确、快速,操作简便,精密度高,重复性好,可用于4种牡荆属植物中黄荆子素的含量测定。
牡荆属;黄荆子素;含量测定;色谱法,高效液相
[Pharm Care Res,2015,15(4):277-280]
牡荆属植物所含化学成分类型较丰富,主要含有二萜类、木脂素类和黄酮类化合物。其中木脂素类和黄酮类化合物被认为是该属植物的主要活性成分,具有抗氧化、抗肿瘤及抗炎镇痛等多种活性[1]。近年来,针对牡荆属中的木脂素类成分的研究十分活跃[2-6]。本课题组前期曾对该属植物黄荆的干燥成熟果实(黄荆子)的药理活性和化学成分进行了系统研究,获得了一系列苯代萘型木脂素[4-6]。其中6-羟基-4β-(4-羟基-3-甲氧基苯基)-3α-羟甲基-7-甲氧基-3,4-二氢-2-萘醛(简称为黄荆子素,VNL,化学结构见图1)的含量较高,且被证实有显著的抗肿瘤、抗炎镇痛和抗氧化等活性[3,7]。近期,通过LC-MS检测证实,VNL广泛存在于黄荆、牡荆、蔓荆、单叶蔓荆4种植物的果实中。本课题组曾采用HPLC法测定了黄荆子中VNL的含量[8],但牡荆属其他3种常用药用植物中VNL的含量测定方法及不同种间VNL含量异同未见报道。本研究建立了牡荆属4种常用药用植物中VNL的HPLC测定方法,为进一步建立以VNL为指标成分的牡荆属药材质量标准提供参考依据。

图1 黄荆子素(VNL)的化学结构Figure 1 Chemical structure of vitexdoin(VNL)
1 仪器和试药
1.1 仪器 Agilent 1200高效液相色谱仪(美国Agilent公司);Mettler AE分析天平[精度:0.01mg,梅特勒-托利多仪器(上海)有限公司];HWS-24型电热恒温水浴锅(上海一恒科技有限公司)。
1.2 药材和试剂 黄荆V.negundoL.于2014年9月采自四川省简阳市;牡荆V.negundoL.var.cannabifolia(Sieb.et Zucc.)Hand.-Mazz.于2014年9月采自第二军医大学药用植物园;蔓荆V.trifoliaL.、单叶蔓荆V.trifoliaL.var.simplicifoliaCham.于2014年9月采自福建省福州市,经第二军医大学药学院生药学教研室秦路平教授鉴定。VNL对照品(第二军医大学药学院生药学教研室自制,经HPLC检测纯度>98%)[4];95%乙醇、甲酸为分析纯,甲醇、乙腈为色谱纯(国药集团化学试剂有限公司);纯净水(杭州娃哈哈集团有限公司)。
2 方法和结果
2.1 色谱条件 采用反相高效液相色谱Zorbax Extend C18柱(250mm×4.6mm,5μm),Extend-C18保护柱(12.5mm×4.6mm,5μm);检测波长254nm;柱温30℃;进样量5μl,流速1.0ml/min;以乙腈-0.1%甲酸溶液为流动相,梯度洗脱,0~18min 14.4%乙腈,18~30min 14.4%~17%乙腈,30~45min 17%乙腈,对照品及样品的HPLC谱图见图2。
2.2 溶液的制备 (1)对照品储备液:精密称取VNL对照品4.55mg,用甲醇溶解,定容至10ml容量瓶中,即得455.0μg/ml的VNL对照品储备液,置4℃冰箱保存备用。(2)供试品溶液:精密称取2.00g已干燥至恒重的样品粉末(已过24目筛),加入25ml 50%乙醇,于75℃水浴恒温回流提取1h。提取液过滤,滤渣重复提取2次,用适量体积的溶剂洗涤残渣,收集滤液,60℃减压浓缩,用50%乙醇转移至50ml容量瓶中,定容,用0.45μm微孔滤膜过滤,取续滤液作为供试品溶液。
2.3 线性关系以及检测限和定量限的考察 精密吸取2.2(1)项下对照品储备液适量,用甲醇稀释成浓度为455.0、227.5、113.8、56.9、28.4、14.2μg/ml的系列对照品溶液,用0.45μm微孔滤膜过滤,按2.1项下色谱条件进行测定,以进样浓度(X)为横坐标,峰面积(Y)为纵坐标,进行线性回归,得回归方程:Y=9.264 1X+35.343,r=0.999 8(n=6)。结果表明VNL含量在14.2~455.0μg/ml范围内与峰面积线性关系良好。通过不断稀释对照品溶液浓度,得到VNL的检测限和定量限分别为0.055和0.182μg/ml。
2.4 精密度实验 精密吸取VNL对照品溶液5μl,连续进样6次,测得VNL含量的RSD为1.41%(n=6),结果表明仪器具有良好的精密度。
2.5 稳定性实验 精密吸取供试品溶液(黄荆子)5μl,分别于放置0、2、4、8、12、16、24h后进样,测得VNL含量的RSD为0.38%(n=7),结果表明供试品溶液在24h内稳定。
2.6 重复性实验 取同一批黄荆子样品,按2.2(2)项下方法制备6份供试品溶液,测得供试品溶液中VNL含量的RSD为0.82%(n=6),表明本方法具有良好的重复性。
2.7 加样回收率实验 精密称取已知含量的黄荆子样品(2.534mg/g)6份,每份1.00g,精密加入VNL对照品适量,按2.2(2)项下方法制备供试品溶液,测定含量并计算加样回收率,结果为(96.99± 1.71)%。
2.8 样品测定 精密称取单叶蔓荆子、蔓荆子、牡荆子和黄荆子样品2.00g,按2.2(2)项下方法制备供试品溶液后按照2.1项下色谱条件分别进样测定,根据标准曲线计算VNL含量,结果见表1。
3 讨 论
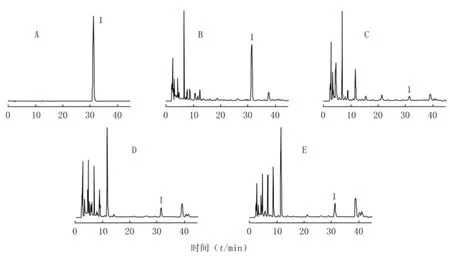
图2 4种牡荆属植物果实中黄荆子素的HPLC谱图Figure 2 HPLC photograms of vitexdoin in the fruits of the four Vitexspecies

表1 四种牡荆属植物果实中黄荆子素的含量Table 1 The contents of vitexdoin in the fruits of the four Vitex species
作者考察了30%、40%、50%、60%、70%、80%乙醇作为提取溶剂对VNL提取率的影响。结果发现,VNL的提取量随乙醇浓度的增大,先增加后有所下降,在乙醇浓度为50%时达到最大值,原因在于VNL为中等极性成分,溶剂极性过低会造成其溶解度的下降。同时还比较了不同的提取温度(55、65、75、85、95℃)对提取率的影响,发现VNL的提取率在75℃时达到最高,此后升高提取温度,提取率变化不明显。考虑到提取温度过高时,VNL含有多个酚羟基,受热不稳定,另外乙醇溶液的挥发也会造成有机溶剂的大量损失。因此选择75℃作为本研究中样品的提取温度。本研究在选择流动相组成和确立洗脱梯度时曾参考文献[8],按其方法测定4种牡荆属植物中VNL的含量,发现除黄荆外其他3种植物中目标物的分离效果并不理想。作者经过反复实验,最终确定梯度洗脱条件。此条件下4种牡荆属植物的供试品溶液基线平稳,目标物均得到良好分离,且重复性好。
样品测定结果表明,不同种间VNL含量存在较大差异,其中以黄荆子、蔓荆子含量较高,单叶蔓荆子次之,牡荆子中含量最低。有文献曾对黄荆子、蔓荆子、单叶蔓荆子、牡荆子的药理活性进行了比较,发现黄荆子的解热镇痛活性较强,而牡荆子效果最差[9]。本课题组前期一系列研究亦表明[4-7],牡荆属木脂素类成分具有良好的抗炎、镇痛和抗骨质疏松活性,结合本研究中4种植物的VNL含量测定结果,推测该属植物药理活性强弱与木脂素类成分的含量相关。
[1]周 燕,何蓉蓉,邱 峰,等.牡荆属植物的研究进展[J].中国实验方剂学杂志,2010,16(17):229-233.
Zhou Yan,He RongRong,Qiu Feng,et al. Research advances inVitexL. [J]. Chin J Exp Tradit Med Formuale,2010,16(17):229-233. In Chinese with English abstract.
[2]Xin Hong,Kong Ying,Wang Yong,et al. Lignans extracted fromVitex negundopossess cytotoxic activity by G2/M phase cell cycle arrest and apoptosis induction[J]. Phytomedicine,2013,20(7):640-647.
[3]Zhou YingJun,Liu Y E,Cao JianGuo,et al. Vitexins,nature-derived lignan compounds,induce apoptosis and suppress tumor growth[J]. Clin Cancer Res,2009,15(16):5161-5169.
[4]Zheng ChengJian,Huang BaoKang,Han Ting,et al. Nitric oxide scavenging lignans fromVitex negundoseeds[J]. J Nat Prod,2009,72(9):1627-1630.
[5]Zheng ChengJian,Tang WeiZong,Huang BaoKang,et al. Bioactivity-guided fractionation for analgesic properties and constituents ofVitex negundoL. seeds[J]. Phytomedicine,2009,16(6-7):560-567.
[6]Zheng ChengJian,Zhang XiangWang,Han Ting,et al. Antiinflammatory and anti-osteoporotic lignans fromVitex negundoseeds[J]. Fitoterapia,2014,93:31-38.
[7] 郑承剑.黄荆子的抗炎活性物质基础及其品质评价[D].上海:第二军医大学,2010.
Zheng ChengJian.Anti-inflammatory constituents and quality evaluation ofVitexnegundofruits[D].Shanghai:Second Military Medical University,2010.In Chinese with English abstract.
[8]Zheng ChengJian,Zhao XiangXiang,Ai HongWei,et al. Therapeutic effects of standardizedVitex negundoseeds extract on complete Freund’s adjuvant induced arthritis in rats[J]. Phytomedicine,2014,21(6):838-846.
[9]钟世同,邱光铎,刘元帛,等.单叶蔓荆子、蔓荆子、黄荆子和牡荆子的药理活性比较[J].中药药理与临床,1996,(1):37-39.
Zhong ShiTong,Qiu GuangDuo,Liu YuanBo,et al. Comparison of pharmacological activities of the fruits ofVitextrifoliaL. var.simplicifoliaCham. ,Vitex trifoliaL. ,Vitex negundoL. andVitex negundoL. var.cannabifolia(Sieb. et Zucc. )Hand. -Mazz. [J]. Pharmacol Clin Chin Mater Med,1996,(1):37-39. In Chinese.
Content determination of vitexdoin in the fruits of four Vitexspecies by HPLC method
SHU ZhiHeng1,2,LI HuaQiang2,3,LI Qing2,DONG RuiFang2,3,ZHENG ChengJian2*,QIN LuPing2*
(1.Department of Pharmacognosy,School of Pharmacy,Ningxia Medical University,Yinchuan 750004,China;2.Department of Pharmacognosy,School of Pharmacy,Second Military Medical University,Shanghai 200433,China;3.Department of Botany,College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
Objective:To establish a HPLC method for the determination and comparison of the content of vitexdoin(VNL)in the fruits of four relatedVitexspecies such asV.negundoL. ,V.negundoL. var.cannabifolia(Sieb. et Zucc. )Hand. -Mazz. ,V.trifoliaL. var.simplicifoliaCham. andV.trifoliaL. .Methods:Analyses were performed on Zorbax Extend C18analytical column(250mm×4. 6mm,5μm)and Extend-C18guard column(12. 5mm×4. 6mm,5μm). Mobile phase was composed of acetonitrile-0. 1%formic acid in gradient elution at a flow rate of 1. 0ml/min:0-18min 14. 4%acetonitrile,18-30min 14. 4%-17%acetonitrile,30-45min 17%acetonitrile. Detection wavelength was 254nm and column temperature was 30℃.Results:VNL displayed good linearity within the ranges of 14. 2-455. 0μg/ml and average additional recovery rate was 96. 99%. VNL content in the fruits of the four species varied considerably,with VNL contents inV.negundoL. andV.trifoliaL. being higher than those in the other two species.Conclusion:The HPLC method proves to be accurate,simple,rapid,precise and reproducible. It could be used for content determination of VNL in the fruits of the fourVitexspecies.
VitexL.;vitexdoin;content determination;chromatography,high performance liquid
R927.2 [
] A [
] 1671-2838(2015)04-0277-04
10.5428/pcar20150412
2015-03-27
] 2015-07-10
国家自然科学基金(81102773,81473328),上海市科委项目(14401902500,14R21411600),上海市卫生系统新优青计划(XYQ2013100)
舒志恒(男),硕士生.E-mail:13817760547@163.com
郑承剑,E-mail:zhengchengjian@smmu.edu.cn;秦路平,E-mail:qinluping@126.com
[
[本文编辑]阳凌燕

