用HPLC-MS/MS法测定大鼠血浆中硫辛酸的浓度及其毒代动力学研究
许晨昊,杨 光,林彤远,周霞,范国荣*
[1.安徽中医药大学药学院,合肥 230031;2.第二军医大学药学院药物分析学教研室,上海市药物(中药)代谢产物研究重点实验室,上海 200433;3.中国药科大学药学院药物分析学教研室,南京 210009]
用HPLC-MS/MS法测定大鼠血浆中硫辛酸的浓度及其毒代动力学研究
许晨昊1,杨 光2,林彤远1,周霞3,范国荣2*
[1.安徽中医药大学药学院,合肥 230031;2.第二军医大学药学院药物分析学教研室,上海市药物(中药)代谢产物研究重点实验室,上海 200433;3.中国药科大学药学院药物分析学教研室,南京 210009]
目的:建立测定SD大鼠血浆中硫辛酸的HPLC-MS/MS法,并将其应用于硫辛酸的毒代动力学研究。方法:采用XAqua C18色谱柱(150mm×4.6mm,5μm);流动相为甲醇(A):水(B),0~2min A:B=20:80,2~7min A:B=95:5,7~9min A:B=20:80,梯度洗脱9min;流速为1ml/min。采用负离子多反应监测模式(MRM)进行监测,离子对:硫辛酸m/z205→171,内标布洛芬m/z205→161,测定大鼠连续28d灌胃硫辛酸300mg/kg后的主要药动学参数。结果:硫辛酸线性范围为0.005~5μg/ml,最低定量限为0.005μg/ml;日内和日间精密度良好,RSD均<15%。大鼠初次和末次给药后的AUC0~24h分别为(23.16±2.45)和(21.27±2.62)μg·h·ml-1,AUC0~∞分别为(23.70±2.56)和(21.67±2.66)μg·h·ml-1,cmax分别为(24.34±2.50)和(22.23±2.61)μg/ml,t1/2分别为(5.22±0.57)和(4.96±0.23)h。硫辛酸在SD大鼠体内无明显的药物蓄积现象。结论:该方法灵敏度高、专属性强、操作简便,适用于生物样本中硫辛酸的测定及毒代动力学研究。
硫辛酸;毒代动力学;色谱法,高效液相;串联质谱法
[Pharm Care Res,2015,15(4):265-268]
研究发现,长期暴露在高强度的噪声下会给听力带来不可逆的损伤,其原因之一可能是噪声暴露破坏了耳蜗的抗氧化体系,导致耳内氧化和抗氧化体系失衡,耳蜗内积累了大量氧自由基。这些过量的自由基会破坏细胞膜脂质、DNA、蛋白质等结构,引起听力损伤,而且噪声暴露后期形成的活性氧又会进一步引起毛细胞损伤,造成永久性耳聋[1]。硫辛酸(lipoic acid)作为一种天然优质的抗氧化剂,是目前已知的唯一能在脂溶性和水溶性条件下均具有良好抗氧化作用的物质,易穿过细胞膜,对血脑屏障有良好的穿透性。已有研究表明,硫辛酸可以高效地清除自由基,对噪声性听力损伤具有保护作用[2,3]。
对硫辛酸的体内分析方法虽有文献报道[4-7],但检测方法的前处理繁琐,分析时间长,最低定量限高,且国内尚无其在SD大鼠体内毒代动力学研究的报道。本研究建立了一种灵敏且简便的检测方法,并对高剂量条件下硫辛酸在SD大鼠体内的毒代动力学进行了考察,为进一步研究奠定了基础。
1 材 料
1.1 仪器 XAqua C18色谱柱(150mm×4.6mm,5μm,华谱公司);高效液相色谱-质谱联用仪(包括Waters 2695液相色谱仪、Micromass Quattro Ultima质谱仪和Masslynx 4.1工作站,美国Waters公司);SCILOGEX MX-S涡旋混合器、Thermo Mircro 21R型低温离心机(美国Thermo Electron公司);Hi-Tech水纯化系统(18.2MΩ,上海和泰仪器有限公司);XS205Du十万分之一电子天平(瑞士Mettler Toledo集团公司)。
1.2 试药 硫辛酸供试品由第二军医大学药学院药物分析学教研室提供;硫辛酸对照品(规格20mg,纯度≥98%,批号12072905)由中国食品药品检定研究院提供;内标布洛芬对照品(纯度≥99.5%)由第二军医大学药学院药物分析学教研室提供;乙腈(色谱纯,美国Tedia公司);甲醇(色谱纯,美国Merck公司);氢氧化钠(江苏强盛功能化学股份有限公司);盐酸(分析纯,国药集团化学试剂有限公司);去离子水为Hi-Tech水纯化系统自制。
1.3 实验动物 SD大鼠,雌雄各半,体重180~220g,购自上海斯莱克实验动物有限责任公司,实验动物许可证号SCXK(沪)2013-0016。
2 方法和结果
2.1 色谱条件 流动相为甲醇(A):水(B),采用梯度洗脱方式(0~2min A:B=20:80,2~7min A:B=95:5,7~9min A:B=20:80),流速1ml/min,柱后1:2分流,进样量5μl,柱温25℃。
2.2 质谱条件 质谱采用电喷雾离子源,负离子模式扫描。锥孔电压为20V;毛细管电压为3.0kV;离子源温度为120℃;脱溶剂温度为350℃;脱溶剂气为氮气,流速为800L/h;碰撞气为氩气,0.25Pa;驻留时间0.5s。扫描模式为MRM模式,硫辛酸:m/z205→171,锥孔电压和碰撞能量分别为25V和8eV;内标布洛芬:m/z205→161,锥孔电压和碰撞能量分别为25V和9eV。两者的质谱图见图1。
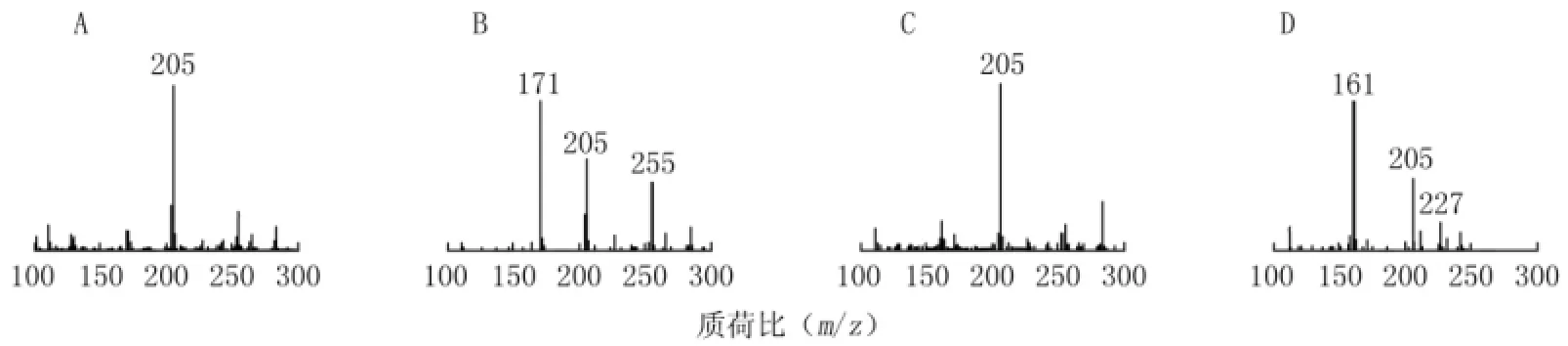
图1 硫辛酸和内标布洛芬的质谱图Figure 1 Mass spectrometry photograms of lipoic acid and internal standard ibuprofen
2.3 对照品溶液的配制 (1)硫辛酸对照品溶液:取硫辛酸对照品5mg,精密称定,置于5ml容量瓶中,用甲醇溶解并配制成浓度为1mg/ml的储备液,置于-20℃冰箱中备用。(2)布洛芬内标溶液:取布洛芬对照品5mg,按上述方法制得浓度为1mg/ml的储备液,用甲醇稀释后得浓度为0.5μg/ml的内标溶液,置于4℃冰箱中备用。
2.4 血浆样品的处理 血浆样品室温下解冻后,取100μl置于1.5ml Eppendorf塑料离心管中,加入10μl浓度为0.5μg/ml的内标布洛芬溶液,涡旋混合5s,加入300μl乙腈,涡旋振荡3min进行蛋白质沉淀,于1 600×g离心10min。吸取上清液150μl置于另一1.5ml Eppendorf塑料离心管中,于2 400×g离心3min。分取上清液100μl装瓶,置于进样器中自动进样5μl,进行HPLC-MS/MS分析。
2.5 动物分组、给药及血浆样品采集 16只SD大鼠,雌雄各半,按随机数字表法分成首日、末日给药组,每组8只。精密称取硫辛酸供试品适量,溶于适量1mol/L的氢氧化钠溶液中,待完全溶解后,用1mol/L盐酸调节pH至7.0左右。两组大鼠以300mg·kg-1·d-1剂量单次灌胃给予药液,末日给药组连续给药28d。在首次和末次给药前以及给药后0.25、0.5、1、2、4、8和24h,各组大鼠分别经眼眶采血约0.3ml,并立即置于肝素钠抗凝管中,1 000×g离心10min。吸取上层血浆,于-80℃低温冰箱中保存,备用。
2.6 方法学验证
2.6.1 专属性 硫辛酸和内标布洛芬的保留时间分别为5.5、5.9min,血浆样品均无干扰。空白血浆、空白血浆添加硫辛酸和内标布洛芬,及受试SD大鼠给药后血浆的典型图谱见图2。
2.6.2 基质效应 空白血浆按2.4项下方法处理后,加入硫辛酸对照品储备液制得低、中、高浓度为0.01、0.1、4μg/ml的血浆样品(每个浓度平行3份),测定的峰面积与相应浓度的硫辛酸对照品溶液的峰面积进行比较,即为血浆基质效应。结果表明本方法中基质效应不影响分析。
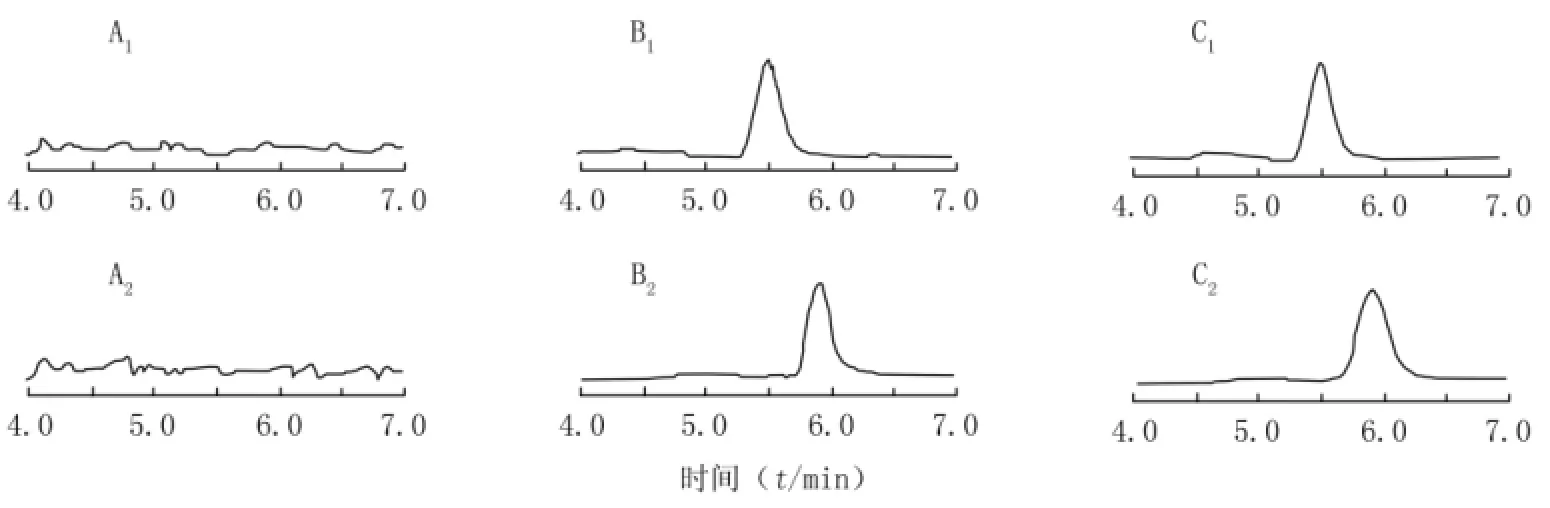
图2 SD大鼠血浆中硫辛酸和内标布洛芬的HPLC-MS/MS谱图Figure 2 HPLC-MS/MS photograms of lipoic acid and internal standard ibuprofen in plasma of SD rats
2.6.3 线性范围及定量下限 取适量硫辛酸对照品储备液,用甲醇逐级稀释后,加入到大鼠空白血浆中,制得浓度为0.005、0.01、0.05、0.1、0.5、1、5μg/ml的硫辛酸系列血浆样品,按2.4项下方法处理并进样,记录色谱图。以硫辛酸与内标的峰面积比值(y)为纵坐标,以血浆样品的浓度(c)为横坐标进行线性回归,权重为1/c2,得方程:y=9.930× 10-3c+1.778×10-2,r=0.997 7。线性范围0.005~5μg/ml,定量下限为0.005μg/ml。
2.6.4 准确度和精密度实验 配制浓度为0.01、0.1、4μg/ml的低、中、高浓度硫辛酸血浆样品各5份,按2.4项下方法处理,于1d内5个不同时间点测定,连续测3d。将待测物与内标峰面积的比值代入当天的随行标准曲线求得实测浓度,计算日内和日间精密度与准确度。结果日内与日间RSD均<15%(见表1)。准确度以方法回收率表示,同法制备低、中、高浓度对照品血浆各5份,按2.4项下方法处理,记录色谱峰面积,计算待测物峰面积与内标峰面积比值,代入标准曲线方程,计算实测浓度与加入浓度的比值即为方法回收率,结果见表1。
2.6.5 提取回收率 配制浓度为0.01、0.1、4μg/ml的硫辛酸血浆各5份,按2.4项下方法处理后进样,得峰面积作为Set 1;对照品溶液用甲醇稀释,使之与Set 1待测理论浓度一致,每个浓度平行制备5份,进样分析得峰面积Set 2。通过Set 1与 Set 2中硫辛酸峰面积均值的比值,求得其提取回收率(见表1)。
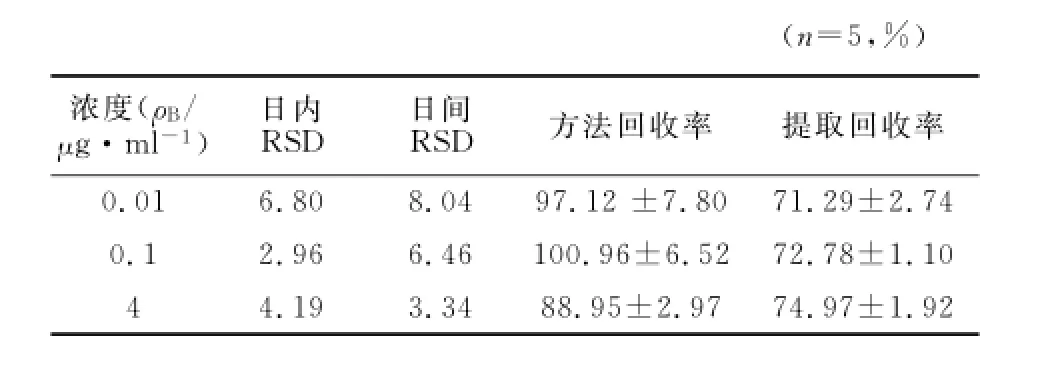
表1 精密度和回收率实验结果Table 1 Results of precision and recovery rate tests
2.6.6 稳定性实验 按2.4项下方法制备0.01、4μg/ml两个浓度的硫辛酸质控样品,分别置于-80℃冰箱中长期放置30d、经历3次冷冻-解冻循环、室温放置4h、提取后样品在自动进样器内放置24h,考察稳定性,结果表明血浆样品在上述条件下均稳定,RSD均<15%(n=3)。
2.6.7 稀释效应 对于实测样品中浓度超过线性范围的样品,需要进行稀释来考察稀释效应。同法配制8、20、40μg/ml的硫辛酸血浆样品,-80℃保存,分析时分别取8μg/ml血浆样品50μl加50μl空白血浆,取20μg/ml血浆样品20μl加80μl空白血浆,取40μg/ml血浆样品10μl加90μl空白血浆,以稀释到原浓度的1/2、1/5、1/10,按2.4项下方法处理后进样,测得浓度的准确度为(89.08± 2.98)%,RSD为3.35%(n=5)。
2.7 毒代动力学研究结果 用BAPP2.0软件处理SD大鼠不同时间点血药浓度,主要毒代动力学参数见表2。应用非房室模型方法比较SD大鼠给药后的平均血药浓度-时间曲线,结果见图3。SD大鼠灌胃给药后第1天和第28天AUC、MRT、t1/2及cmax均无明显变化,说明无药物蓄积现象。
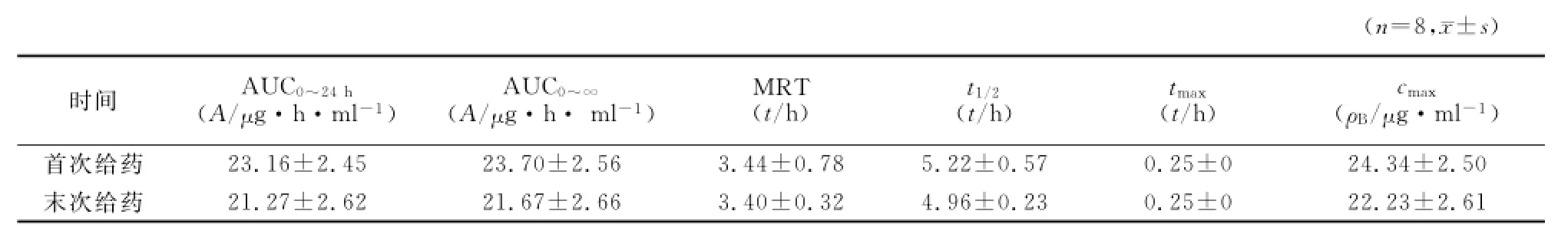
表2 SD大鼠首、末次给药后硫辛酸的药动学参数Table 2 Pharmacokinetic parameters of lipoic acid after the first and last administrations in SD rats
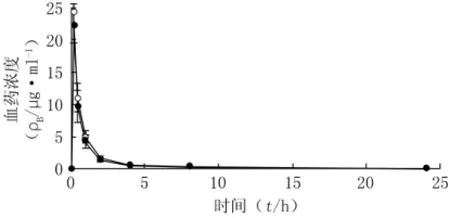
图3 大鼠首、末次给药后硫辛酸的平均血药浓度-时间曲线Figure 3 The mean plasma concentration-time curves of lipoic acid in SD rats plasma afterthe first and last administrations
3 讨 论
作者比较了蛋白质沉淀和液液萃取两种前处理方法,发现蛋白质沉淀法的提取效率明显高于液液萃取。研究报道可能是由于硫辛酸极性较大,导致其在非极性溶剂中分配较少[7]。作者也曾采用等度洗脱方式,发现基质效应严重,无法满足定量要求,从而采用了梯度洗脱的条件,发现基质效应得到明显改善,响应值更高。原因可能是血浆中的内源性物质与待测物得到有效分离,从而避免与待测物形成竞争,提高了离子化效率。与文献报道的方法[4-7]比较,采用本研究测定大鼠血浆中硫辛酸的方法,前处理方法更简单,取样量少,灵敏度较高,可以满足硫辛酸在SD大鼠体内的毒代动力学研究。
本研究发现,SD大鼠灌胃给药后,血浆中硫辛酸浓度15min即达峰值,24h时血药浓度低于cmax的5%,且半衰期较短,说明其在大鼠体内分布迅速,消除较快。其中末次给药与首次给药的AUC比值<1,可能与体内药物代谢酶活性升高有关。
[1]王希营,朱全刚,高 静,等.噪声性听力损伤药物防治的研究进展[J].药学服务与研究,2012,12(2):139-144.
Wang XiYing,Zhu QuanGang,Gao Jing,et al. Advances in research on drugs for prevention and treatment of noiseinduced hearing loss[J]. Pharm Care Res,2012,12(2):139-144. In Chinese with English abstract.
[2]何端军,郭万宏,唐建勇,等.硫辛酸对纯音听力损失前畸变产物耳声发射异常的作用及意义[J].中华耳科学杂志,2013,11(3):440-443.
He DuanJun,Guo WangHong,Tang JianYong,et al. Effects of lipoic acid on abnormal distortion product otoacoustic emissions without hearing lose following blast noise exposure[J]. Chin J Otol,2013,11(3):440-443. In Chinese with English abstract.
[3]王希营,朱全刚,高 静,等.灌胃α-硫辛酸对豚鼠噪声性听力损伤的防护作用研究[J].药学实践杂志,2012,30(2):103-106.
Wang XiYing,Zhu QuanGang,Gao Jing,et al. Protective effect ofα-lipoic acid on noise induced hearing loss in guinea pigs[J]. J Pharm Pract,2012,30(2):103-106. In Chinese with English abstract.
[4]孙 黎,姚晓东,苏克剑,等.2种硫辛酸制剂的人体药动学与生物等效性研究[J].中国临床药理学与治疗学,2009,14(8):924-927.
Sun Li,Yao XiaoDong,Su KeJian,et al. Pharmacokinetics and bioequivalence of twoα-lipoic acid preparations in Chinese healthy volunteers[J]. Chin J Clin Pharmacol Ther,2009,14(8):924-927. In Chinese with English abstract.
[5]赵恒利,曹若明,方增军,等.高效液相色谱串联质谱法测定人血浆中硫辛酸[J].药物分析杂志,2015,35(1):70-74.
Zhao HengLi,Cao RuoMing,Fang ZengJun,et al. LC-MS/MS determination of lipoic acid in human plasma[J]. Chin J Pharm Anal,2015,35(1):70-74. In Chinese with English abstract.
[6]Tsai ChiaJu,Lin YingChi,Chen YenLing,et al. Chemical derivatization combined with capillary LC or MALDI-TOF MS for trace determination of lipoic acid in cosmetics and integrated protein expression profiling in human keratinocytes[J]. Talanta,2014,130:347-355.
[7]Chng H T,New L S,Neo A H,et al. A sensitive LC/MS/MS bioanalysis assay of orally administered lipoic acid in rat blood and brain tissue[J]. J Pharm Biomed Anal,2010,51(3):754-757.
Concentration determination of lipoic acid in rat plasma by HPLC-MS/MS method and its toxicokinetic study
XU ChenHao1,YANG Guang2,LIN TongYuan1,ZHOU Xia3,FAN GuoRong2*
[1.Shool of Pharmacy,Anhui University of Traditional Chinese Medicine,Hefei 230031,China;2.Department of Pharmaceutical Analysis,School of Pharmacy,Second Military Medical University,Shanghai Key Laboratory for Pharmaceutical(Chinese Materia Medica)Metabolite Research,Shanghai 200433,China;3.Department of Pharmaceutical Analysis,School of Pharmacy,China Pharmaceutical University,Nanjing 210009,China]
Objective:To establish a HPLC-MS/MS method for concentration determination of lipoic acid in rat plasma and study its toxicokinetics.Methods:The analysis was performed on XAqua C18column(150mm×4. 6mm,5μm). The mobile phase was composed of methanol(A)-water(B)in gradient elution at a flow rate of 1ml/min,0-2min A:B=20:80,2-7min A:B=95:5,7-9min A:B=20:80. Negative ion multiple reaction monitoring(MRM)ofm/z205→171(lipoic acid)andm/z205→161(internal standard ibuprofen)was detected. Pharmacokinetic parameters of lipoic acid were calculated after gavage of 300mg/kg to the rats for 28d.Results:The calibration curve of lipoic acid had a good linearity within the range of 0. 005-5μg/ml and the limit of quantity was 0. 005μg/ml. The intra-day and inter-day RSD were<15%. The main pharmacokinetic parameters of the first and last administration were as follows:AUC0-24hwere(23. 16±2. 45)and(21. 27± 2. 62)μg·h·ml-1,AUC0-∞were(23. 70±2. 56)and(21. 67±2. 66)μg·h·ml-1,cmaxwere(24. 34±2. 50)and(22. 23± 2. 61)μg/ml,t1/2were(5. 22±0. 57)and(4. 96±0. 23)h,respectively. There was no significant drug accumulation in SD rats.Conclusion:The method is sensitive,specific,convenient and suitable for the determination of lipoic acid in biological samples as well as toxicokinetic study.
lipoic acid;toxicokinetics;chromatography,high performance liquid;tandem mass spectrometry
R927.2,R969 [
] A [
] 1671-2838(2015)04-0265-04
10.5428/pcar20150409
2015-04-16
] 2015-07-15
许晨昊(男),硕士生.
E-mail:xuchenhaomelody@126.com
范国荣,E-mail:guorfan@163.com
[
[本文编辑] 阳凌燕

