α-丙氨酸限域在扶椅型 SWBNNT(9,9)与水复合环境下的手性转变机制*
梅泽民,佟 华,夏立利,吕 洋,杨晓翠,王佐成,3
(1.白城师范学院化学学院,吉林白城137000;2.白城师范学院物理学院,吉林白城137000;3.吉林大学原子分子物理研究所,吉林长春130000)
α-丙氨酸是一种重要的手性氨基酸。其左旋体是在生命体内具有活性的优构体,对预防肾结石、协助葡萄糖的代谢等起着重要的作用,还有助于缓和低血糖。右旋体在制药业作为手性合成的手性源,食品行业利用其作为抑菌剂,又是保湿因子的主要成分,广泛用于化妆品。George等[1-2]的实验研究证实了生命体内存在着微量的α-丙氨酸右旋体,过量的右旋α-丙氨酸在体内会导致某些疾病或衰老。并猜测它可能一部分来源于左旋体,但左旋体向右旋体转变的反应机理尚不清楚。
由于光学纯的α-丙氨酸的重要性以及体内有微量右旋体存在等原因,人们对α-丙氨酸进行了广泛的研究。刘凤阁等[3]对α-Ala手性对映体的结构特性进行的理论研究,获得了α-Ala对映体最优构型的几何参数、能量、红外振动谱及VCD谱。Stepanian等[4]对α-Ala两种构象异构体进行了理论研究,用B3LYP/aug-cc-pVDZ方法得到了与实验数据非常吻合的α-Ala构象和振动频率。龚䶮等[5]对α-Ala对映体单晶变温偏振激光拉曼光谱进行了研究,发现α-Ala对映体的非偏振拉曼光谱图极其相似。王文清等[6]利用单晶的中子衍射研究了295和60 K时,α-Ala对映体的结构特征以及由D到L构型转变的可能性。以往的研究[7-10],获得了单体情况、水环境下以及限域在SWBNNT(9,9)(简写为A,下同)内α-Ala的手性转变机理。单体α-Ala的手性转变反应能垒很高,水环境以及纳米限域环境下,α-Ala手性转变过程中的H转移反应能垒被不同程度的降低,但顺利实现手性转变还有一定的困难。由于α-Ala在体内的存在环境及其在体内的输运环境,一定有水与纳米环境共存的情形,在纳米反应器内实现α-Ala手性转变的均相催化过程,都有水的存在。因此,研究限域在水与纳米管复合环境的α-Ala的手性转变具有重要的理论和实际意义。基于此,并考虑到氮化硼纳米管的耐高温抗氧化特性,α-Ala与水分子以氢键结合可能形成的水合分子的线度,以及扶手椅型A的尺寸。研究了α-Ala在A与水复合环境下的手性转变机理,得到A与水的复合环境,对α-Ala手性转变反应具有较好的活化作用。对进一步研究其它不同类型的纳米通道与水的复合环境对α-Ala手性转变的限域影响,揭示α-Ala在体内复杂的复合环境的手性转变机制,为实验上获得光学纯的α-丙氨酸都会起到积极的参考作用。
1 研究与计算方法
采用量子化学的ONIOM方法(our own n-layered integrated molecule orbit and molecule mechanics)[11],研究在 SWBNNT内 α-Ala的手性转变过程。将α-Ala与纳米管形成的包结物体系分为两层来处理:内层为 α-Ala,用基于密度泛函理论的B3LYP方法[12],基组选用 6-31+G(d,p);外层为硼氮纳米管,采用分子力学 UFF(universal force field)力场处理[13],优化反应过程的极小点和过渡态[14-15]。为得到相对高水平的体系能量,对内层采用6-311++G(3df,3pd)基组,计算各包结物的单点能。零点振动能校正后,绘制出反应过程的势能面。通过分析过渡态的虚频振动模式和对过渡态进行的内禀反应坐标(IRC)计算[16],确定过渡态的可靠性。α-Ala与A形成的包结物记为α-Ala@A,其余体系的表示法类似。所有计算采用Gaussian 09软件包完成[17]。
2 结果与讨论
2.1 单体S型α-Ala和中间体INT1与其限域在A与水复合环境下几何参数的比较
在B3LYP/6-31+G(d,p)水平,优化的单体S型α-Ala和R型α-Ala的几何构型;单体S型α-Ala向R型α-Ala转变过程中,H在羧基内转移形成的中间体INT1的几何构型[3],见图1。与羧基内H(12)从O(11)向O(10)转移及手性碳上的H(13)向羰基O(11)转移密切相关的键长、原子间距,见表1。
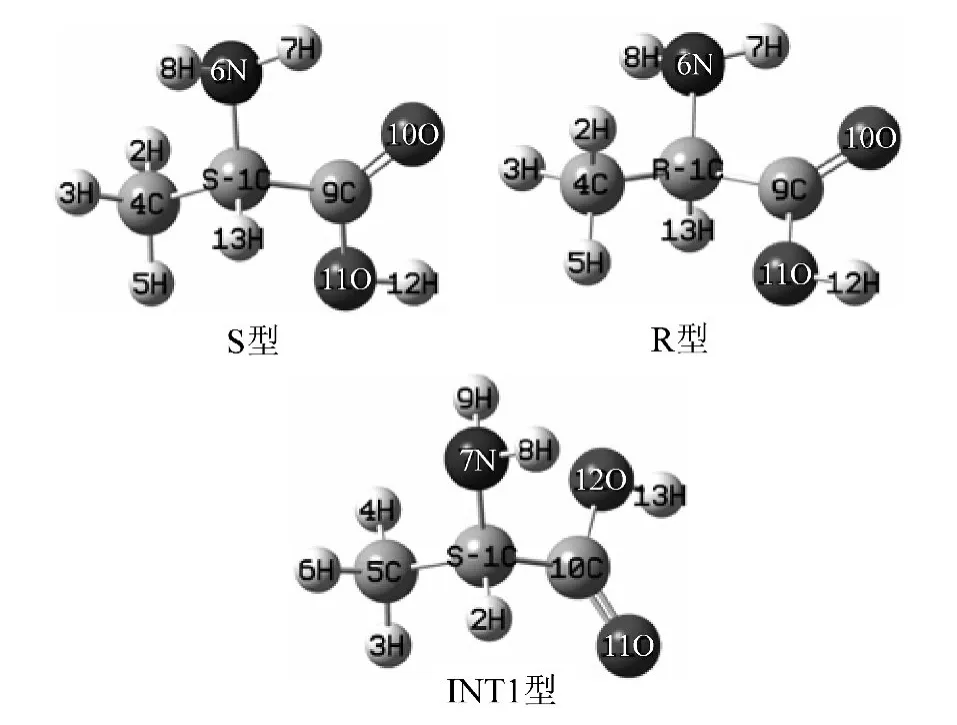
图1 在B3LYP/6-31+G(d,p)水平,单体S型α-Ala、R型α-Ala和中间体INT1的结构Fig.1 The geometry of S-type,R-type α-Ala molecule and the intermediate INT1 at the B3LYP/6-31+G(d,p)level
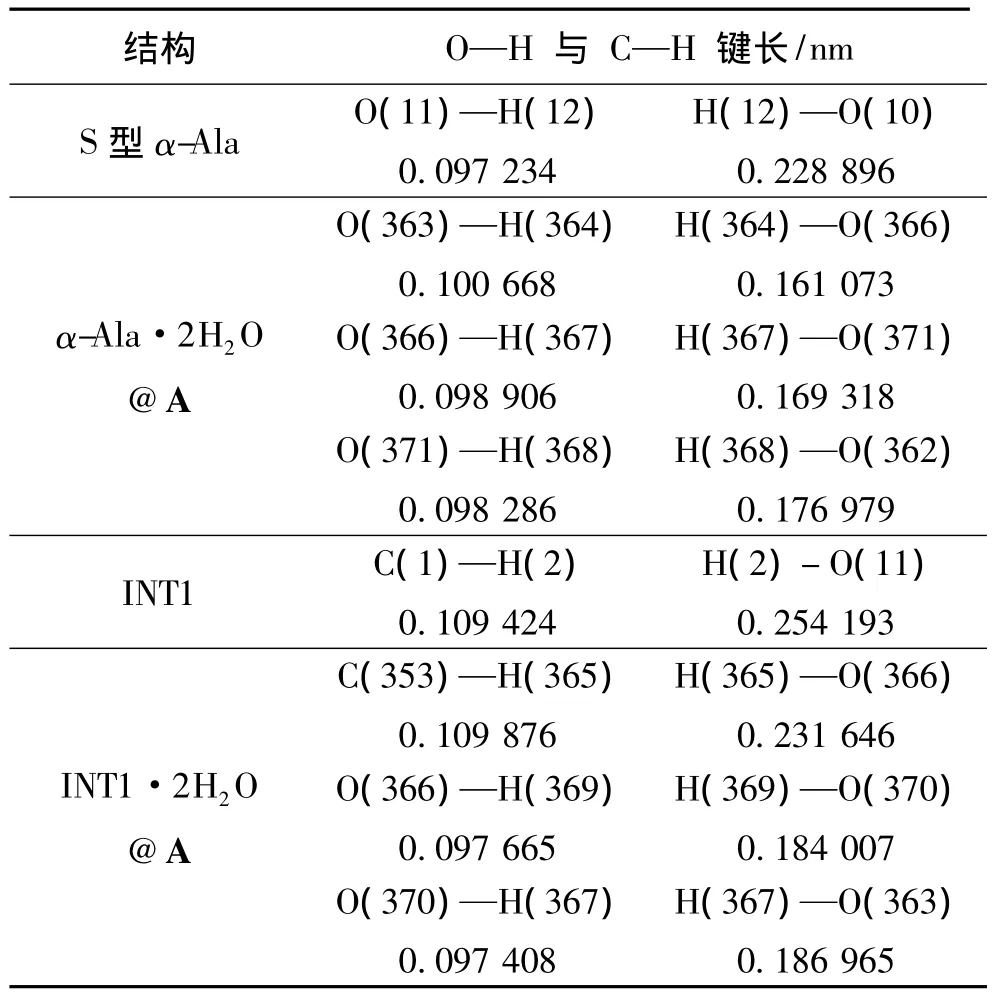
表1 α-Ala和INT1与它们分别限域在SWBNNT(9,9)与水复合环境下,包结物α-Ala·2H2O@A和INT1·2H2O@A的,与H转移相关的主要化学键的键长和主要原子间的距离Table 1 Monomeric α-Ala and intermediate INT1,confinement in SWBNNT(9,9)and water complex environment,respectively.The main atomic bond lengths and distances Inclusion α-Ala·2H2O@A and INT1·2H2O@A,and the H shift correlation between the major bond
研究发现:α-Ala限域在扶椅型A与水分子复合环境的手性转变过程中,在先羧基H转移然后手性碳上的H向羰基转移顺次进行的反应通道上,两个水分子构成的水链作为羧基H转移和手性碳上的H向羰基转移的媒介时,手性转变反应过程中的最高能垒被降的最低。为从反应过程反应物的分子结构说明这个结论,增加对这个结论的可信度,在 ONIOM(B3LYP/6-31+G(d,p):UFF)水平,优化了α-Ala与羧基旁边的两个水分子以氢键结合的复合分子被A包结,形成的包结物α-Ala·2H2O@A的几何构型;优化了中间体INT1与其手性碳上的H和羰基O旁边的两个水分子以氢键结合的复合分子被A包结,形成的包结物INT1@A的几何构型,见图2。与2H2O作为H转移桥梁,实现羧基内H(12)向O(10)转移反应以及手性碳上的H(13)向羰基O(11)转移密切相关的键长、原子间距,见表1。
从表1看出:S型α-Ala·2H2O@A与S型α-Ala相比较,S型α-Ala·2H2O@A的涉及到氢转移的 O—H 键长略长;H与 O的间距短很多。INT1·2H2O@A与INT1相比较,涉及到氢转移的C — H键长略长;H与O的距离变短,有的甚至短很多。这预示着2H2O构成的水链,对S型α-Ala向R型α-Ala手性转变反应过程中的H迁移反应能垒会有较好的降低作用。
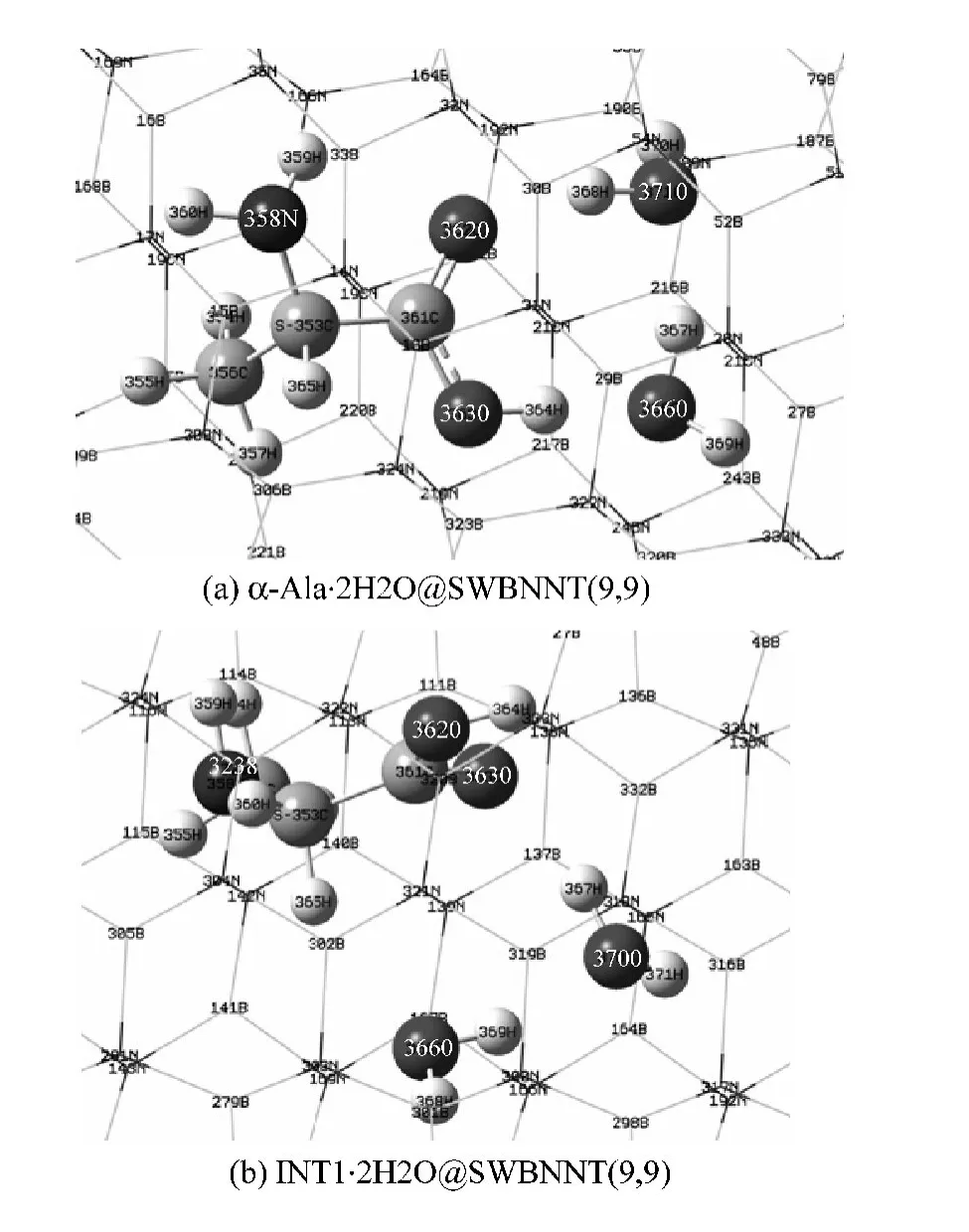
图2 α-Ala·2H2O@SWBNNT(9,9)(a)和INT1·2H2O@SWBNNT(9,9)(b)包结物结构Fig.2 Complex structure diagram of α-Ala·2H2O@SWBNNT(9,9)(a)and INT1·2H2O@SWBNNT(9,9)(b)
2.2 α-丙氨酸在SWBNNT(9,9)与水分子复合环境下的手性转变机制
研究发现,α-Ala在A与水分子复合环境下的手性转变有两个通道。第一通道是羧基内H转移后,手性碳上的H(13)再转移到羰基O(11)上,然后O(10)上的H在纸的里侧转移到手性碳的另一侧。此通道又分为路径 a和b,a是先经氨基在纸面里外摆的过渡态,实现氨基的两个H从纸面外进到纸面里的异构,然后是羧基内的H迁移和H从手性碳向羰基O迁移。b是先实现羧基内的H迁移和H从手性碳向羰基O迁移,然后经氨基在纸面里外摆动的过渡态,实现氨基的两个H进到纸面里的异构。第二通道是不经过羧基的H转移,手性碳上的H(13)直接转移到羰基O(10)上。此通道又分为两个路径c和d。c是先经氨基旋转的过渡态,实现氨基的两个H从纸面外到纸面里的异构,然后手性碳上的H(13)向羰基O(10)转移。d是首先手性碳上的H(13)向羰基O(10)转移,而后经氨基旋转的过渡态,实现氨基的两个H从纸面外到纸面里的异构。进一步研究发现,a和b以及c和d的过渡态中间体基本雷同,但a和c的最高能垒较小,分别为其所在通道内的优势路径,下面对这两个反应路径分别进行讨论。
2.2.1 限域在SWBNNT(9,9)与水分子复合环境下的α-Ala在a路径上的手性转变机理 α-Ala在A与水分子复合环境下,α-Ala可与多个水分子以氢键结合,并被A包结,形成复合包结物体系。研究发现,对于α-Ala手性转变过程中的H转移过程,可以有1个H2O和2个H2O构成的水分子链,分别作为H转移媒介两种情况。已有研究表明[18],对于没有断键的单分子某个基团的异构,水分子的参与对于反应能垒的影响可以忽略。因此,为简单起见,非断键的单分子异构过程可以不考虑水分子的存在。但为了得到尽可能连续的势能面的,又不增加问题的复杂性,氨基的异构过程考虑了水分子的存在。
研究发现,有1个H2O作为H转移媒介的α-Ala手性转变反应过程是:首先S型α-Ala和羧基旁的一个水分子以氢键结合,被纳米管包结的包结物S·H2O@A,经氨基的两个H在纸面里外摆动的过渡态TS1·1H2O@A,形成中间体INT1·H2O@A;INT1·H2O@A经过H在羧基内转移的过渡态TS2·1H2O@A,形成中间体包结物INT2m·1H2O@A;INT2和手性碳上H(13)与羰基O(11)附近的1H2O以氢键结合,被纳米管的包结物INT2n·1H2O@A,经过渡态TS3·1H2O@A,实现手性碳上的H(13)向羰基O(11)转移,形成中间体INT3m·1H2O@A;INT3和手性碳C(1)与羰基O(10)附近在纸面里的1H2O以氢键结合,被纳米管的包结物INT3n·1H2O@A,经过渡态纸面里的TS4·1H2O@A,实现O(10)上的H在纸面里向手性碳C(1)转移,形成对映体产物R·1H2O@A,完成手性对映体转变。2个H2O构成的水链作为H转移媒介时,反应过程雷同,不再敖述。
在ONIOM(B3LYP/6-31+g(d,p):UFF)水平,对α-Ala在A与水分子复合环境下,在a路径,1H2O和2H2O分别作为H转移媒介,手性转变反应过程的极小点与过渡态进行几何优化并计算频率。得到各个包结物体系的结构与过渡态虚频振动模式见图3,同时得到零点振动能。对各个过渡态的沿着虚频两个振动方向微调结构进行的优化,以及对过渡态进行的IRC计算,确定了过渡态的可靠性。反应过程的示意图见图3。
为获得高水平的能量,在ONIOM(B3LYP/6-311++G(3df,3pd):UFF)水平,计算了单点能;利用Etotal=Esp+ZPVE计算了体系的总能量,取S·1H2O@A、INT2n·1H2O@A、INT3n·1H2O@A、S·2H2O@A、INT2n·2H2O@A和INT3n·2 H2O@A的能量,为相应阶段反应过程的相对总能量的零点,计算了反应过程中各体系相对总能量,画出了α-Ala在A与水分子复合环境下,在手性转变反应路径a上,以1H2O和2H2O分别作为H转移媒介,手性对映体转变反应过程的势能面示意图,见图4。
由图4可以看出,α-Ala在A与水分子复合环境下,在手性转变反应路径a上的最高能垒,来自手性碳上的H(13)向羰基O(11)转移的过渡态,2H2O为 H转移媒介时此能垒值为153.8 kJ·mol-1,比1H2O 为 H 转移媒介时的176.6 kJ·mol-1低。因此,α-Ala在A与水分子复合环境下的手性转变反应,在a路径2H2O为H转移媒介时为优势路线。对于153.8 kJ·mol-1的能垒,在体内36℃以上的温度下,考虑到温度的涨落、分子之间的碰撞和体内某种酶催化作用的存在等多种因素,是可以有被越过的几率的。这说明,在生命体内的纳米生物通道与水的复合环境下,可以实现α-Ala从左旋体向右旋体的缓慢转变。同时在理论上说明,A与水的复合环境,对α-Ala手性转变过程中的氢转移过程具有极好的催化作用,可以作为比较理想的纳米反应器。
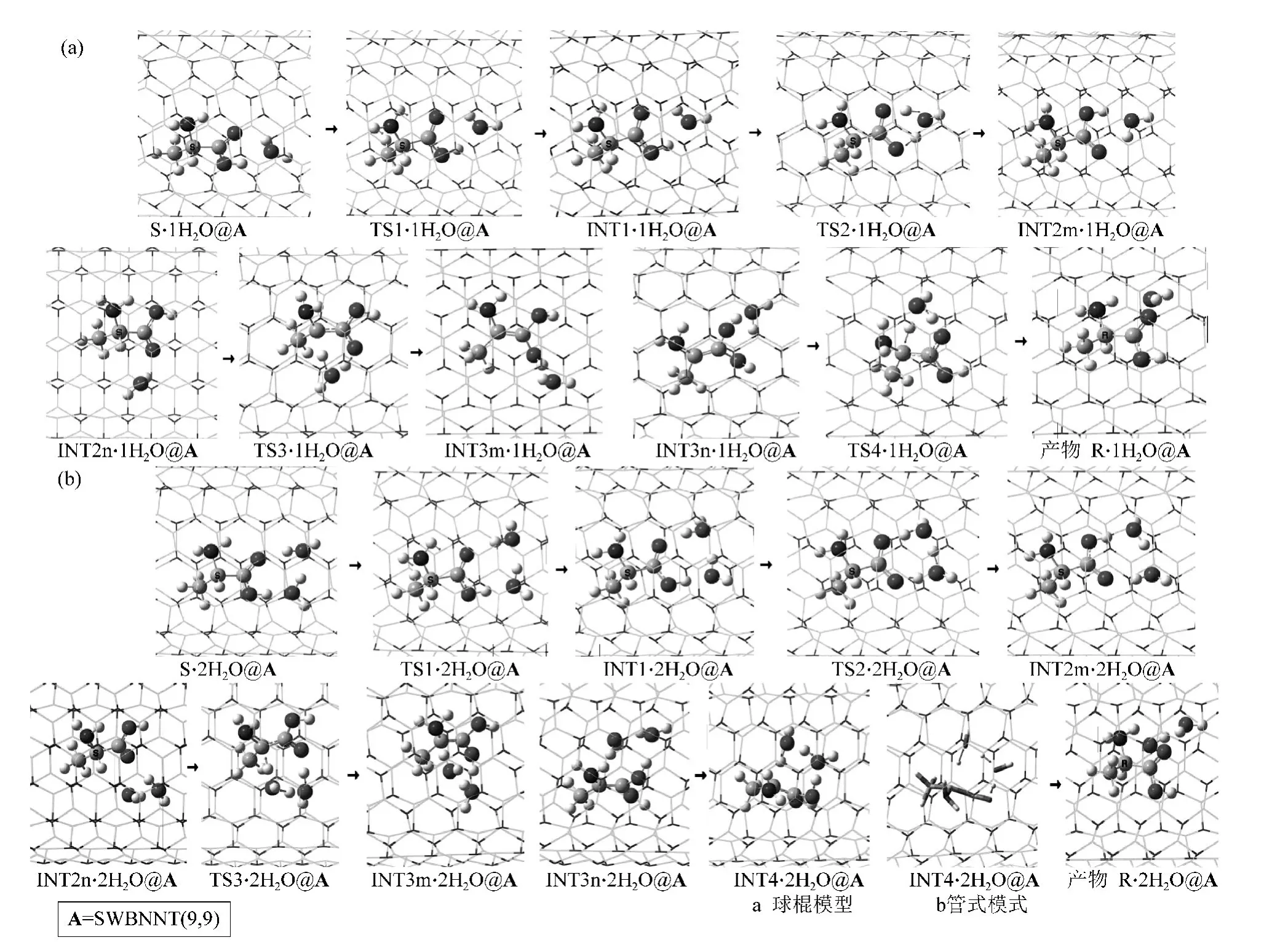
图3 α-Ala限域在SWBNNT(9,9)与水分子复合环境,在手性转变路径a上,以1H2O(a)和以2H2O(b)为H转移媒介时的极小点和过渡态的结构、过渡态的虚频振动模式及反应过程示意图Fig.3 The structures of mimimum points and transition states and the vibration modes of virtual frequencies of transition states on path a when α-Ala molecular confined in SWBNNT(9,9)
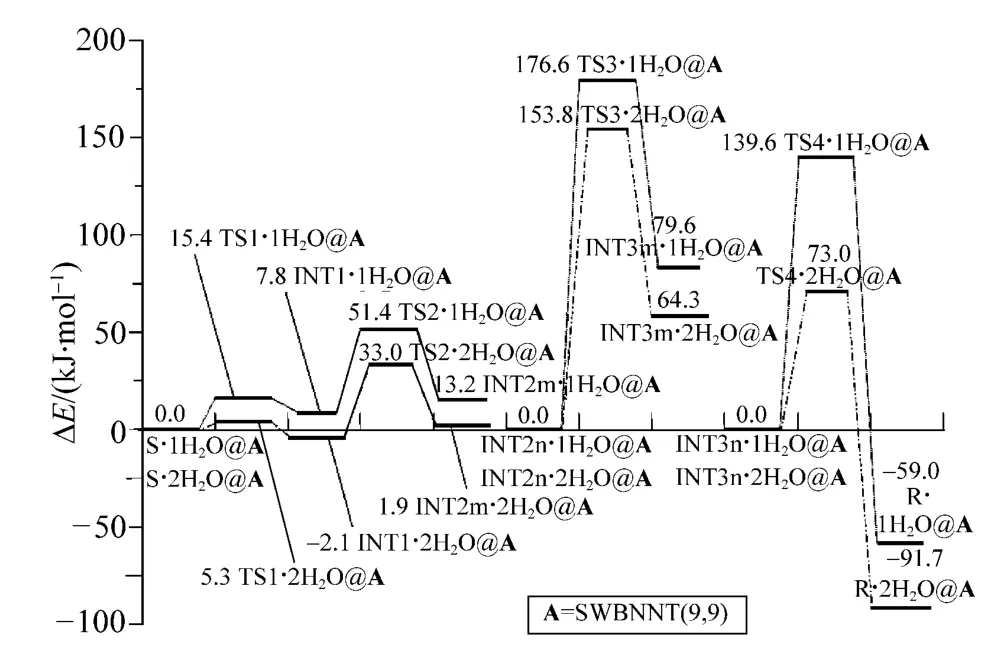
图4 在 ONIOM(B3LYP/6-311++G(3df,3pd):UFF)//ONIOM(B3LYP/6-31+g(d,p):UFF)水平,α-Ala在SWBNNT(9,9)与水分子复合环境下,在手性转变反应a路径上反应过程的势能面示意图Fig.4 The complete potential energy surfaces of chiral transition,when α-Ala molecular confined in SWBNNT(9,9)/water complex environment in the a reaction path at the ONIOM(B3LYP/6-311++G(3df,3pd):UFF)// ONIOM(B3LYP/6-31+G(d,p):UFF)
2.2.2 限域在SWBNNT(9,9)与水分子复合环境下的α-Ala在c路径上的手性转变机理 α-Ala在A与水分子复合环境下,在c路径的手性转变反应,同样有1H2O和2H2O作为H转移媒介两种情况。
有1H2O的反应是:S·H2O@A先经氨基旋转的过渡态TS1·1H2O@A,形成中间体INT1·1H2O@A;再经过渡态TS2·1H2O@A,手性碳上的H以1H2O为媒介转移到羰基氧O(10)上,形成中间体INT2m·H2O@A,而后INT2与在纸面里手性碳和O(11)上的H附近的1个H2O以氢键结合的水合物,被纳米管包结的包结物INT2n·H2O@A,经过渡态TS3·1H2O@A,实现羰基O(11)的H在纸面里向手性碳C(1)转移,形成中间体INT3m·1H2O@A,这时已经完成手性转变,见图5;INT3和其羧基旁边的1个H2O以氢键结合的水合物,被纳米管包结的包结物INT3n·1H2O@A经过渡态TS4·1H2O@A,实现H从O(10)向羰基氧O(11)的迁移,形成对映体产物R·1H2O@A,完成手性对映体转变。2个H2O构成的水链作为H转移媒介时,反应过程雷同,不再敖述。
在ONIOM(B3LYP/6-31+g(d,p):UFF)水平,对α-Ala在A与水分子复合环境下,在c路径上,1H2O和2H2O分别作为H转移媒介,所有极小点与过渡态进行几何优化并计算频率。得到各包结物体系的结构与过渡态虚频振动模式见图5,以及零点振动能。对过渡态振动频率的分析以及内禀反应坐标IRC计算,对诸过渡态进行了确认。

图5 α-Ala限域在SWBNNT(9,9)与水分子复合环境,在手性转变路径c上,以1H2O(a)和以2H2O(b)为H转移媒介时的极小点和过渡态的结构、过渡态的虚频振动模式及反应过程示意图Fig.5 The diagrams A and B,the structures of mimimum points and transition states and the vibration modes of virtual frequencies of transition states on path c when α-Ala molecular confined in SWBNNT(9,9)
为得到高水平的能量,在ONIOM(B3LYP/6-311++G(3df,3pd):UFF)水平,计算了单点能;利用Etotal=Esp+ZPVE计算体系的总能量,取S·1H2O@A、INT2n·1H2O@A、INT3n·1H2O@A、S·2H2O@A、INT2n·2H2O@A 和 INT2n·2H2O@A的能量,为相应反应过程包结物相对总能量的零点,计算了体系相对总能量,绘制了 α-Ala限域在A与水复合环境下,在手性转变路径c上反应过程的势能面示意图,见图6。
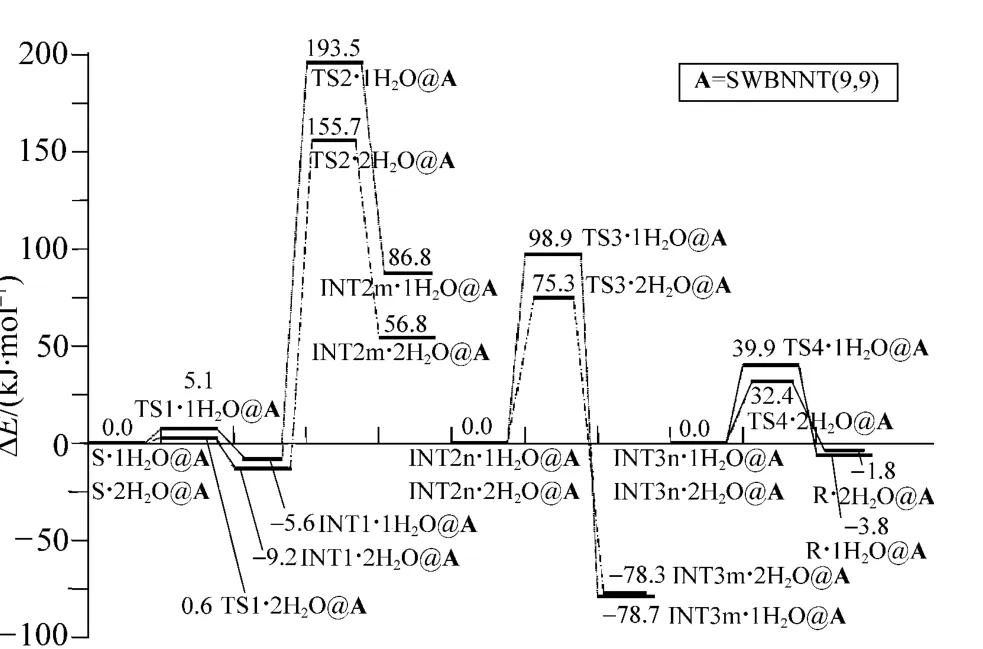
图6 在 ONIOM(B3LYP/6-311++G(3df,3pd):UFF)//ONIOM(B3LYP/6-31+g(d,p):UFF)水平,α-Ala在SWBNNT(9,9)与水分子复合环境下,在手性转变反应c路径上反应过程的势能面示意图Fig.6 The complete potential energy surfaces of chiral transition,when α-Ala molecular confined in SWBNNT(9,9)/water complex environment in the a reaction path at the ONIOM(B3LYP/6-311++G(3df,3pd):UFF)//ONIOM(B3LYP/6-31+G(d,p):UFF)
由图6可以看出,α-Ala在A与水分子复合环境下,在手性转变反应路径c上的最高能垒,来自手性碳上的H(13)向羰基O(10)转移的过渡态,2H2O为 H转移媒介时此能垒值为164.9 kJ·mol-1,比1H2O为 H转移媒介时的 199.1 kJ·mol-1低。因此,α-Ala在A与水分子复合环境下的手性转变反应,在c路径上也是以2个H2O构成的水链为H转移媒介时为优势路线。164.9 kJ·mol-1的能垒,在体内36℃以上的温度下,考虑到温度的涨落、分子之间的碰撞和体内某种酶催化作用的存在等多种因素,也是有被越过的几率。在生命体内的纳米生物通道与水的复合环境下,α-Ala可以以羰基O为桥梁,并以2个H2O为H转移媒介实现从左旋体向右旋体的转变。同时也说明,A与水的复合环境,对α-Ala手性转变过程中的氢转移过程具有不错的催化作用,可以作为比较理想的纳米反应器。
3 结论
分子结构计算表明:反应物S型α-Ala以及中间体INT1在A和水的复合环境里,与单体相比较,氢转移需要断的 O—H键和 C—H键的键长都略长,H与其要转移到的目标原子O的距离均短很多。从分子几何构型上说明了,2个H2O构成的水链对α-Ala手性转变反应过程中的H转移过程的反应能垒会有降低作用。
反应通道研究发现:α-Ala在A与水分子复合环境下的手性转变有两个通道。第一通道是先实现羧基内H转移,然后手性碳上的H再转移到羰基O(11)上。第二通道是先实现手性碳上的H向羰基O(10)转移。每个通道都有先实现H转移和先氨基异构两个路径,每个路径上的H转移过程的实现,都有1H2O和2H2O作为媒介两种情况。
势能面计算发现:手性转变反应的最高能垒均来自H从手性C向羰基O转移的过渡态,在第一通道氨基先异构接着羧基H转移和H从手性C向羰基O转移顺次实现的路径a,并以2H2O为氢转移媒介时最高能垒值被降到最小,最小能垒为153.8 kJ·mol-1。在第二通道氨基先异构接着H从手性C向羰基O(10)转移的路径c,并以2H2O为氢转移媒介时最高能垒值被降到最小,最小能垒为164.9 kJ·mol-1。均比只在 A 内的302.7 kJ·mol-1明显降低,比只在水环境的167.8 kJ·mol-1也有所降低。比较而言,a路径是最具优势的反应路径。
结果表明:考虑到温度的涨落、分子之间的碰撞以及体内某种酶催化作用等多种因素,α-Ala在体内类似于A的生物通道与水的复合环境下,可以实现从左旋体向右旋体的转变。同时,从理论上说明A与水的复合环境,可以作为比较理想的实现α-Ala手性转变的纳米反应器,为实验上获得光学纯的α-丙氨酸提供了一个新的途径。
[1]GEORGE H F,ANTIMO D'ANIELLO,AMEDEO V,et al.Free D-aspartate and D-alanine in normal and Alzheimer brain[J].Brain Research Bulletin,1991,26(6):983-985.
[2]ROBERT J T,ARCHIE BOUWER H G,DANIEL A P,et al.Pathogenicity and immunogenicity of a listeria monocytogenes strain that requires D-alanine for growth[J].Infection and Immunity,1998,66(8):3552-3561.
[3]刘凤阁,赵衍辉,钱研,等.孤立条件下手性α-丙氨酸分子结构特性的理论研究[J].吉林师范大学学报:自然科学版,2013,34(4):47-51.
[4]STEPANIAN S G,REVA I D,ADAMOWICZ L,et al.Conformational behavior of α-alanine matrix-isolation infrared and theoretical DFT and ab initio study[J].Physical Chemistry A,1998,102(24):4623-4629.
[5]龚䶮,易芳,王文清,等.丙氨酸对映体单晶的变温偏振激光拉曼光谱研究[J].光散色学报,2002,14(3):145-149.
[6]王文清,刘轶男,龚䶮,等.手性分子的宇称破缺:D和L丙氨酸的变温中子结构研究[J].物理化学学报,2004,20(11):1345-1351.
[7]王佐成,刘凤阁,吕洋,等.孤立条件下α-丙氨酸分子手性转变机制的DFT研究[J].吉林大学学报:理学版,2014,52(4):825-830.
[8]王佐成,佟华,梅泽民,等.水环境下α-丙氨酸分子手性转变机制的理论研究[J].吉林大学学报:理学版,2015,53(1):134-141.
[9]王佐成,赵衍辉,梅泽民,等.α-丙氨酸分子手性转变反应通道及水分子作用的理论研究[J].浙江大学学报:理学版,2015,42(2):196-204.
[10]王佐成,梅泽民,吕洋.α-丙氨酸分子在扶手椅型SWBNNT(9,9)内的手性转变机制[J].南京大学学报:自然科学版,2015,51(1):206-216.
[11]SVENSSON M,HUMBEL S,FROESE R D J,et al.ONIOM:A multilayered integrated MO+MM method for geometry optimizations and single point energy predictions.A test for Diels?Alder reactions and Pt(P(t-Bu)3)2 + H2oxidative addition[J].Physical Chemistry,1996,100(50):19357-19363.
[12]BECKE A D.Density-functional thermochemistry(Ⅲ)The role of exact exchange[J].Chem Phys,1993,98(7):5648-5652.
[13]RAPPE A K,CASEWIT C J,COLWELL K S,et al.UFF,a full periodic table force field for molecular mechanics and molecular dynamics simulations[J].Journal of the American Chemical Society,1992,114(25):10024-10053.
[14]GARRETT B C,TRUHLAR D G.Generalized transition state theory.Classical mechanical theory and applications to collinear reactions of hydrogen molecules[J].Journal of Physical Chemistry,1979,83(8):1052-1079.
[15]GARRETT B C,TRUHLAR D G.Criterion of minimum state density in the transition state theory of bimolecular reactions[J].The Journal of Chemical Physics,1979,70(4):1593-1598.
[16]ISHIDA K,MOROKUMA K,KOMORNICKI A.The intrinsic reaction coordinate.An ab initio calculation for HNC→HCN and H-+CH4→CH4+H-*[J].The Journal of Chemical Physics,1977,66(5):2153-2156.
[17]FRISCH M J,TRUCKS G W,SCHLEGEL H B,et al.Gaussian 09.Revision D.01[CP].Pittsburgh USA:Gaussian,Inc,Wallingford CT,2013.
[18]梅泽民,王佐成,赵衍辉,等.水环境下布洛芬分子的手性转变机理[J].吉林大学学报:理学版,2015,53(2):331-339.

