铁系纳米粒子的合成及其在生物医学中的应用
朱永吉,周治国,杨仕平
(上海师范大学生命与环境科学学院,上海 200234)
铁系纳米粒子的合成及其在生物医学中的应用
朱永吉,周治国,杨仕平
(上海师范大学生命与环境科学学院,上海 200234)
铁系纳米材料具有独特的磁学性质,在多个领域都有着广泛的应用.主要简要介绍了通过高温热解法制备的铁系纳米粒子及其在生物医学领域的应用.
铁系纳米材料;高温热解;生物医学
0 引 言
磁性纳米颗粒既拥有一般纳米材料的特质,且具有独特的物理化学性质,在诸多领域具有广泛应用,如磁流体、催化、生物科技、核磁共振成像、靶向载药、信息存储等.这些应用要求磁性纳米粒子具有优异的分散性、均一的尺寸,稳定的化学性质和良好的生物相容性,因此研究单分散磁性纳米粒子的制备、表面修饰及对生物药物分子的吸附组装具有十分重要的意义.在过渡金属元素中,Fe元素是最普遍的,并且在地壳含量中占第四位,也与日常生活息息相关.在铁磁元素中,室温下铁纳米粒子具有最高的饱和磁化强度,并且铁是软磁材料,较低的磁各向异性使其容易在磁场中转化,当粒径小于20 nm时表现出超顺磁性行为[1],在高磁场下可以稳定存在,铁纳米粒子以上优点使得其在生物医学、催化材料、光、磁方面得到广泛的应用.目前合成磁性纳米颗粒的方法主要包括物理法、生物法和化学共沉淀法(co-precipitation)、高温热解法(thermal decomposition)、微乳液法(microemulsion)和溶剂热法(solvothermalsynthesis).物理球磨法制备的纳米粒子的优点是便于操作,缺点是尺寸分布较宽、制备过程耗时长;生物法的最明显的优势是生物相容性比其他制备方法要好,缺点是细菌培养困难,粒子提取过程也较为复杂,同时所得到的粒子的粒径可控范围也容易受限制;化学共沉淀法的优点是操作简单,成本较低,但是部分氧化或部分还原反应不易控制,制备的粒径分布较宽;微乳液法可以合成多种性能可控的磁性纳米颗粒,缺点是形貌的变化较大,合成产物要大量的溶剂,产物收率较低;高温分解法在制备高质量的单分散铁纳米颗粒方面有显著优越性.
1 铁系纳米粒子的合成
1.1 氧化铁纳米材料的合成
高温热解法摒弃了铁离子参与的水解反应,转而采用金属铁有机化合物高温热解来实现磁性铁纳米晶的制备.高温热解法反应的特点是:采用高沸点的弱极性或者非极性有机溶剂作为反应的传热介质,通过分解铁前驱体的方式来制备磁性纳米铁.
1999年,美国伯克利大学的Alivisatos研究组[2]率先报道了采用热分解技术合成磁性氧化铁纳米晶.他们以高沸点的三正辛胺为溶剂溶解前驱体FeCuP3,把三辛胺加热到300℃,在剧烈搅拌下注入三正辛胺溶解的FeCuP3溶液,加热回流30 min,得到10 nm左右的Fe2O3纳米晶,如图1A所示.

图1 A:以FeCuP3为前驱体,高温热解法制备Fe2O3纳米晶体的TEM照片;B:以Fe(acac)3为前驱体,高温热解法制备Fe3O4纳米晶体的TEM照片;C:以油酸铁为前驱体制备的Fe3O4纳米晶体的TEM照片,C1,C2,C3为3种不同粒径的纳米晶体;D:以油酸铁为前驱体制备的Fe3O4纳米晶体的TEM照片
2002年,Sun小组[3]用Fe(acac)3为前驱体,油酸和油胺为稳定剂,1,2-十六二醇为还原剂,在苯醚中合成了4 nm球形Fe3O4纳米粒子.并以此为种子进一步采用晶种生长的方法,得到了8、12和16 nm的单分散的Fe3O4磁性纳米粒子.此后,Peng等人[4]报道了基于金属脂肪酸盐高温热解制备Fe3O4的方法,所制备的纳米颗粒在6~50 nm范围可调(图1C包括C1,C2,C3,).Hyeon等人[5]利用该方法发展了单分散性的磁性氧化铁纳米颗粒,如图1D所示.改变热解温度,可得到不同粒径的粒子.例如在274、287、317、330和365℃条件下分别合成了5、9、12、16及22 nm的氧化铁纳米颗粒.他们认为制备单分散性磁性氧化铁纳米颗粒的关键在于将成核与生长过程分开.这一大规模制备方法的建立,极大地鼓舞了人们进一步探索高质量铁磁性纳米晶体的应用.
1.2 Fe纳米粒子的合成
常温下铁纳米粒子具有最高的饱和磁化强度,并且铁是软磁材料,较低的磁各向异性使其可以容易地在磁场中转化,并且与氧化铁相比较在对核磁共振成像T2的弛豫时间上影响更短.当粒径小于20 nm时表现出超顺磁性行为,在高磁场下可以稳定存在,制备铁纳米材料成为科学工作者的研究热点.铁纳米粒子由于纳米尺寸效应,以及较高的比表面积与比表面能,使之在自然条件下很难存在,很容易被氧化成氧化铁,如何制备具有高的磁化强度的稳定的铁纳米粒子,成为科学工作者努力的一个方向.
Sun课题组[1]以Fe(CO)5为铁前驱体,以油胺为还原剂与表面活性剂,十八烯为溶剂,在180℃温度下,制备了核壳结构的Fe@Fe3O4纳米晶体,图2给出了材料核壳结构的TEM,用多巴胺修饰后可以运用到生物医学领域.2007年,Marzan课题组[6]采用了以油酸铁作为前驱体,在油酸钠、油酸的混合溶液中,以角鲨烯作为还原剂在320℃的温度下热解2 h,得到了含有30%的正方形的铁/铁氧化物核壳纳米粒子的产物,但是得到的产物饱和磁化率较低,只有40 emu/g;同年,Sabino团队[7]也是以Fe(CO)5为前驱体,合成了Fe/Fe2O3纳米颗粒合成T1/T2双模式造影剂,具有一定的双模式造影效果;2011年,Sun课题组[8]又在原来的方法上,将油胺与十八烯的混合液中加入了盐酸十六胺作为晶化剂,得到了13 nm左右的体心立方Fe/Fe3O4核壳纳米粒子,其饱和磁化率高达200 emu/g,为以后的T2核磁造影成像、磁靶向定位等应用提供了材料基础.2012年,Richard等[9]以有机金属铁夹心化合物Fe(C2H5)(C6H7)为前驱体,在油胺中110℃的条件下加热3 d,得到了(14.2±1.8)nm的Fe/Fe3O4核壳纳米材料,其饱和磁化率达到了120 emu/g,并与相同尺寸的Fe3O4纳米颗粒进行T2核磁成像能力的比较,其T2成像能力远高于同尺寸的Fe3O4纳米颗粒.同年,Tan等[10]以Fe/Fe3O4核壳纳米材料作为材料,外包磷脂大分子,进行了T2核磁造影成像的应用实验.

图2 A:核壳结构的Fe@Fe3O4的透射电镜照片;B:多巴胺的分子结构式;C:纳米粒子分散在PBS溶液中的透射电镜照片
2 Fe系纳米粒子在生物医学中的应用
纳米材料在生物医学领域的应用主要包含磁共振成像.靶向热疗、磁热疗、药物输送和生物传感器,下面对这几方面的应用做简单的介绍.
2.1 磁共振成像
磁共振成像能够对生物内脏器官进行快速无损检测,是目前肿瘤早期诊断最有效的方法之一.具有超顺磁性的纳米粒子可增强病变组织与正常组织图像之间的对比度,从而提高MRI的灵敏度和选择性.利用磁性纳米材料进行磁性共振成像具有多方面的优势[11].
氧化铁纳米粒子,应用于磁共振成像已有20多年的历史了.超顺磁性氧化铁(SPIO,粒径小于30 nm)纳米粒子被网状内皮组织吸收,在肝、脾、骨髓等组织和器官处富集,会大大缩短T2弛豫时间. SPIO作为T2造影剂的典型代表,已经临床多年,如Feridex IV、Resovist、Lumirem可以进行肝脏造影、追踪成像等[12].相同情况下,粒径越大的磁性纳米粒子的磁矩就越大,成像效果就越明显.为了增加造影剂的T2弛豫率,还可以通过自组装或有机物包覆等手段将多个SPIO装载到一个纳米粒子中.Monty等[13]将多个SPIO和药物载入介孔硅中,既提高了T2加权成像的灵敏性同时达到了药载的目的.Gao等人[14]利用双嵌段共聚物负载SPIO粒子,SPIO负载量越大,T2弛豫率越高(471 m·L·mol-1·S-1),MRI灵敏度也就越高.2013年Gao等[15]通过增大了SPIO纳米材料的有效半径,引起其形貌结构的变化,显著地增大了造影剂的r2.他们主要通过高温热解合成出八角形的SPIO纳米材料,不仅丰富了Fe系磁性纳米粒子的形貌,而且提高了SPIO的弛豫率(679.3 m·L·mol-1·S-1).图3详细比较了八角形结构的SPIO与球形结构的SPIO性质的不同.Richard团队[16]制备了具有核壳结构的Fe@Fe3O4纳米材料,这种核壳结构的纳米材料的弛豫率可以达到324 m·L·mol-1·S-1,图4为以此种纳米材料为T2造影剂的小鼠活体核磁共振成像效果图,从图4中可以得到,单一的Fe3O4与核壳结构的Fe@Fe3O4在注射后,相同的条件下,核壳结构的Fe@Fe3O4纳米材料具有更明显的造影效果.

图3 A:相同几何体积的八角形及球形结构的Fe3O4纳米粒子;B:不同形貌的Fe3O4磁滞回线;C:Fe3O4纳米材料的溶液T2加权成像示意图;D:弛豫率柱状图

图4 分为对照组与Fe3O4、Fe@Fe3O4注射到小鼠体内24 h后的T2磁共振成像
2.2 光热力学疗法
1866年有人报道了1例面部肉瘤患者,在感染丹毒后,经过持续数日的高温后,面部肿瘤逐渐缩小,2年后肿瘤完全消失,患者存活.自此以后,人们开始了热疗对肿瘤治疗的漫长研究,并取得了可观的效果.目前,热疗对肿瘤的治疗主要集中在浅表肿瘤方面,包括:乳腺癌、乳腺术后的胸壁侵犯、恶性黑色素瘤及部分软组织肉瘤等.Wu等[17]报道利用一种特殊的相控阵喷头设备进行局部热疗治疗乳腺癌,取得很好的疗效.Welz等[18]采用热疗结合放疗的方法治疗乳腺癌术后胸壁复发者50例,除4例因远处转移3年内死亡外,总生存率为89%(46/50),无复发生存率为68%(34/50),局部控制率为80%(40/50),且患者耐受性好.结果说明热疗结合放疗对提高高危乳腺癌患者尤其局部复发者的局部控制率和总体生存率是值得肯定的.
Fe系纳米粒子也具有较理想的近红外吸收性能以及高温快速离子传导性能等,因此也可以作为一种较理想的光热转换材料.图5为本课题组制备的Fe@Fe3O4光热治疗简图[19].首先,利用高温热解的方法合成出分散在正己烷中的油溶性纳米粒子(Fe@Fe3O4);然后利用连接了聚乙二醇单羧酸的盐酸多巴胺进行表面修饰,使其具有很好的稳定性和生物相容性,同时又因为其拥有的高饱和磁化率,使其对肿瘤细胞又有了磁靶向的效果,再外加808 nm的激光照射,达到治疗肿瘤的目的.

图5 磁靶向光热治疗试剂Fe@Fe3O4结构及应用示意图
台湾Ye课题组利用具有二十四面体结构的Fe3O4@Au@mSiO2-dsDNA/DOX纳米材料[20],通过尾静脉注射到小鼠体内,借助磁靶向作用,通过光热疗法以及DOX的药物化学治疗,成功地消灭了小鼠体内的肿瘤.图6给出了不同条件下的小鼠肿瘤体积变化及实物图.由图6中可以看到不同的对照组通过材料与磁场、激光和化疗的协同作用随着治疗时间的延长治疗效果很明显.
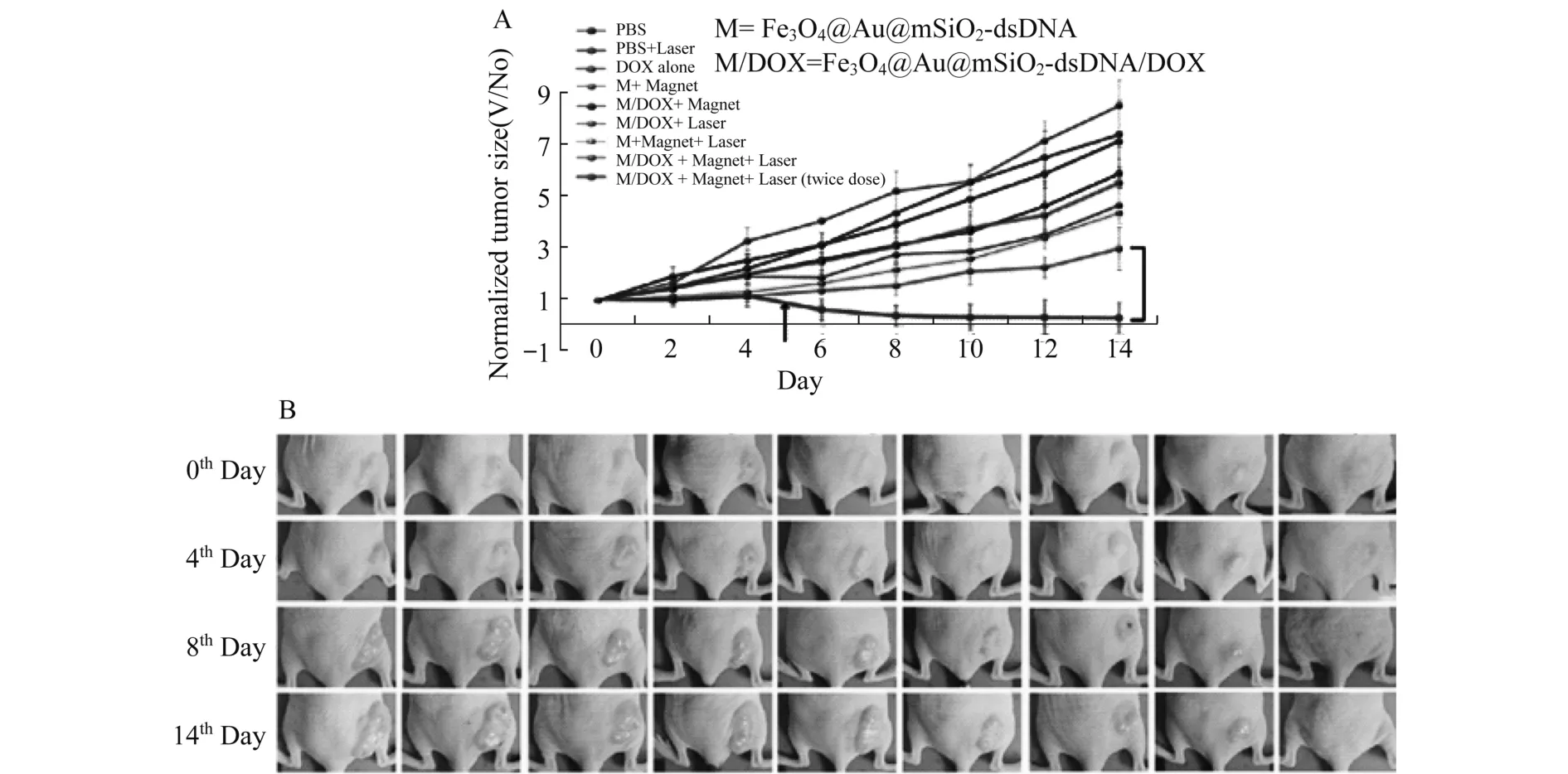
图6 A:不同对照组的肿瘤生长曲线;B:不同对照组在治疗后的图片
2.3 磁热力学疗法
肿瘤磁热疗(MTH)的原理是利用物理能量加热人体全身或局部,使肿瘤组织温度上升到有效治疗温度,并维持一定时间,利用正常组织和肿瘤细胞对温度耐受能力的差异(肿瘤细胞在38~40℃时活性受到抑制会趋向凋亡;在40~42℃时会严重受损,在短时间内死亡;43℃以上会快速破裂死亡),达到既能使肿瘤细胞凋亡,又不损伤正常组织的治疗目的.
目前用于肿瘤热疗磁性纳米粒子以磁流体形式居多,磁流体由磁性纳米粒子、表面活性剂和载液组成,是一种用表面活性剂处理后的磁性纳米粒子均匀分散在载液中的稳定胶体悬浮液.可用于制备磁流体的纳米粒子包括Fe、Co、Ni及铁氧体等.因具有在生物体内可降解与生物相容性良好,应用较广.由于人体液主要成分是水,故大多数磁热疗用磁性材料选用水做分散介质.
这种方法不仅适用于浅表肿瘤的治疗,也适用于深部肿瘤的治疗.当磁场频率>1 MHz,磁性粒子耗散射频波转换成热能,使温度升高,一般都可将器官或组织加热到40~46℃,这个温度范围足以杀死肿瘤细胞.2000年,Hilger等在癌病变区注入磁性氧化铁纳米粒子,外加磁场,在2~5 min内就使其达到58℃的高温,从而取得了磁靶向热消融(MTA)的目的.运用磁性纳米颗粒的磁流体热疗属于磁介质热疗的范畴,它主要利用磁性颗粒在外加交变磁场下基于颗粒布朗旋转、尼尔弛豫等效应而产热,从而对肿瘤组织进行局部加热的一种有效治疗手段.而具有核壳结构的铁酸盐纳米粒子把磁热疗法推向了新的高度,如Cheon等[21]把核壳结构的CoFe2O4@MnFe2O4纳米材料注射到小鼠体内放入磁场中,在交流电频率为500 KHz,磁场强度37.3 KAm-1下,10 min后取出,放置一段时间,材料组的小鼠肿瘤消失,对照组小鼠肿瘤仍然存在,如图7所示.
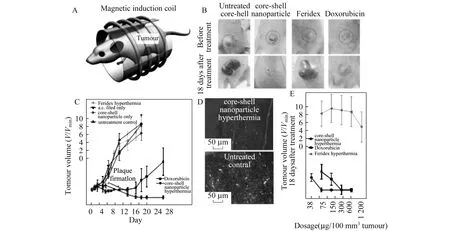
图7 A:磁性纳米粒子注入小鼠肿瘤组织中,并放在交变磁场下;B:治疗18 d后的肿瘤组织;C:肿瘤体积的变化;D:荧光标记肿瘤组织;E:抑制肿瘤生长所需要的剂量
2.4 药物传递
传统的抗癌药物通过血液循环分布于体内各器官,对癌细胞和正常细胞缺乏特异性,因此需要很大剂量才能达到预期的治疗效果,但是在治疗过程中,会杀死正常细胞,其毒副作用对患者身体影响很大.早在20世纪70年代末Widder、Senyei和他们的同事[22-23]就提出了使用Fe系磁性纳米材料用于载药系统.
磁性纳米材料作为一种新的靶向给药系统,将抗癌药和磁性纳米材料连接在一起,由于磁性纳米材料体积微小且可使药物输送智能化,所以靶向定位地将药物输送到病灶部位或专一性地作用于靶细胞.磁性纳米材料作为载体材料可以减少用药剂量、提高药物治疗指数和减低药物的毒副作用.
阿霉素作为一种常见的抗肿瘤药物,被广泛应用于癌症治疗中,阿霉素与DNA利用插入和抑制大分子的生物合成来相互作用.这个作用抑制了解开DNA超螺旋的拓扑异构酶II.在拓扑异构酶II为了复制而解开DNA链后,阿霉素会稳定拓扑异构酶II,防止DNA双股螺旋再结合在一起,从而停止复制过程.利用磁性纳米粒子负载阿霉素靶向定位到肿瘤组织,从而达到治疗的作用.
Yu[24]等人用热交联法用PEG对SPIONs改性,并使其表面带上羧基,利用电荷间的相互作用使阿霉素(DOX)与聚合物层结合形成载药粒子(合成示意图见图8),考察了该体系的释药行为,并且以小鼠为模型考察了该体系对肿瘤的抑制作用.将纯DOX和以超顺磁四氧化三铁(SPIO)为阿霉素的载体分别作用于肿瘤组织.利用活体荧光成像发现用SPIO做载体的DOX很快到达肿瘤组织,并在注入后12 h达到释药的最大时间.而纯DOX在注入老鼠体内后肿瘤组织荧光成像和正常组织间没有太大的区别.实验结果表明,磁性纳米材料作为药物的载体可以减少用药剂量、提高药物治疗指数,相应地减低药物的毒副作用.

图8 A:Dox-TCL-SPIO合成示意图;B:DOX的荧光光谱(从上到下NPs的浓度逐渐降低)
Chen[25]等制备了以聚N-异丙基丙烯酰胺PNIPAM为壳,四氧化三铁为核,并具有空腔的磁性复合胶束.其独特的空腔能够提高载体的载药率.在TEM下可以清晰识别其中空的核壳结构(图9A).在载药试验中考察了pH的影响,在低pH时,DOX溶解度很好,其载药率很低,碱性条件下包裹率较高,可达到50%.其载药的原理为DOX与高分子层之间形成的少量氢键,随着pH上升,DOX溶解性变差更容易吸附在高分子层.在释药试验中酸性条件比碱性条件的释放更快,这是由于DOX在酸性条件下的溶解性更好,如图9B.在考察温度变化对释药影响时发现得到20℃比40℃释药速率要慢,如图9C,因为40℃时胶囊的壳层疏水壳层缩紧,使DOX挤出,所以得到高的释药速率,但24 h后其释药率相同,这是因为释药率取决于DOX的溶解性,而DOX溶解性只与pH有关而与温度无关.结果表明以磁性纳米粒子为载体,负载药物进行化疗可以有效地治疗癌症,并且减少用药量降低药物的副作用.
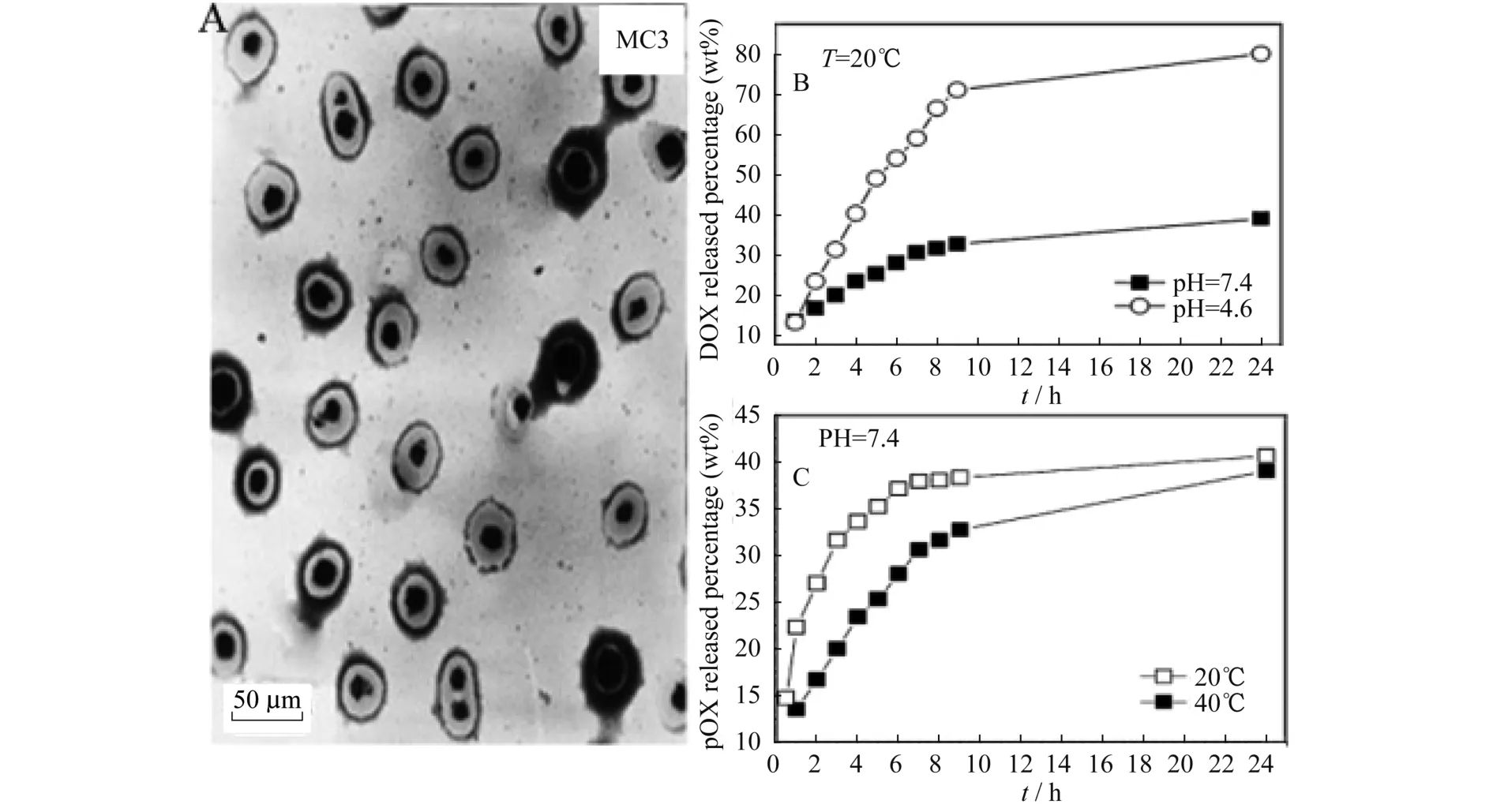
图9 A:中空核壳结构的磁性纳米胶束的TEM图;B:材料在不同pH值下的药物释放曲线;C:材料在不同温度下的药物释放曲线
3 总结与展望
铁系磁性纳米材料作为新型的功能材料近年来被广泛研究,其在生物医学领域已表现出独特的优势以及潜在的应用前景.但如何获得磁响应性较强、单分散和生物性良好的纳米粒子仍是亟待解决的问题.另外,随着铁系磁性纳米材料在生物应用方面的产业化和商业化的推进,大规模生产质量可靠稳定的磁性纳米材料,降低成本以期大规模临床应用也是后期要解决的问题.
[1] PENG S,WANG C,SUN SH.Synthesis and Stabilization of Monodisperse Fe Nanoparticles[J].JAm Chem Soc,2006,128(33):10676-10677.
[2] ROCKENBERGER J,SCHER E C,ALIVISATOS.A New Nonhydrolytic Single-Precursor Approach to Surfactant-Capped Nanocrystals of Transition Metal Oxides[J].JAm Chem Soc,1999,121(49):11595-11596.
[3] SUN SH,ZENG H.Size-Controlled Synthesis of Magnetite Nanoparticles[J].J Am Chem Soc,2002,124(28):8204 -8205.
[4] CHEN Y F,PENG X G.Size and shape controlledmagnetic(Cr,Mn,Fe,Co,Ni)oxide nanocrystals via a simple and general approach[J].Chem Mat,2004,16(20):3931-3935.
[5] PARK J,AN K,HYEON T.Ultra-large-scale syntheses of monodisperse nanocrystals[J].Nat Mater,2004,3(12):891 -895.
[6] SHAVEL A,GONZALEZ B R,SPASOVA M.Synthesis and Characterization of Iron/Iron Oxide Core/Shell Nanocubes[J].Adv Funct Mater,2007,17(18):3870-3876.
[7] MIGUEL O B,GOSSUIN Y,MROALESM.Comparative analysis of the1H-NMR relaxation enhancement produced by iron oxide and core-shell iron-iron oxide nanoparticles[J].Magn Reson Imaging,2007,25(10):1437-1441.
[8] LACROIX LM,HULSN F,SUN S H,et al.Stable Single-Crystalline Body Centered Cubic Fe Nanoparticles[J].Nano Lett,2011,11(4):1641-1645.
[9] CHEONG S,RICHARD P,HERMANS F,et al.Synthesis and stability of highly crystalline and stable Iron/Iron Oxide core/shell nanoparticles for biomedical applications[J].Chem Plus Chem,2012,77(2):135-140.
[10] CHEN T,TANW H.One-Step Facile Surface Engineering of Hydrophobic Nanocrystalswith Designer Molecular Recognition[J].JAm Chem Soc,2012,134(32):13160-13164.
[11] YANG H,ZHANG Y M,SUN Y,et al.Targeted dual-contrast T1-and T2-weighted magnetic resonance imaging of tumors usingmultifunctional gadolinium labeled superparamagnetic iron oxide nanoparticles[J].Biomaterials,2011,32(20):4584-4593.
[12] WANG Y X,HUSSAIN SM,KRESTIN G P.Superparamagnetic iron oxidecontrast agents:physicochemical characteristics and applications in MR imaging[J].Eur Radiol,2001,11(27):2319-2331.
[13] LIONGM,LU J,RUEHM SG.Multifunctional inorganic nanoparticles for imaging,targeting,and drug delivery[J].ACS Nano,2008,2(5):889-896.
[14] AIH,FLASK C,GAO JM,et al.Magnetite-loaded polymeric micelles as ultrasensitive magnetic-resonance probes[J]. Adv Mater,2005,17(16):1949-1952.
[15] ZHAO Z H,ZHOU Z J,GAO JH.Octapod iron oxide nanoparticles as high-performance T2contrast agents formagnetic resonance imaging[J].Nat Comm,2013,4(5):2266-2272.
[16] CHEONG S,FERGUSON P,TILLEY R,et al.Simple Synthesis and Functionalization of Iron Nanoparticles for Magnetic Resonance Imaging.Angew Chem,2011,50(18):4206-4209.
[17] WU L,MCGOUGH R J,ARABEO A.An RF phased array applicator designed for hyperthermia breast cancer treatments[J].Phys Med Biol,2006,51(1):1-20.
[18] WELZ S,HEHR T,LAMPRECHT U.Thermoradiotherapy of the chestwall in locally advanced or recurrent breast cancer with marginal resection[J].International Journal of Hyperthermia,2005,21(2):159-167.
[19] ZHOU ZG,SUN Y N,YANG SP.Iron/iron oxide core/shell nanoparticles formagnetic targeting MRI and near-infrared photothermal therapy[J].Biomaterials.2014,35(2):7470-7478.
[20] LIW P,SHENG C,YEH C S.Formation of Oligonucleotide-Gated Silica Shell-Coated Fe3O4-Au Core?Shell Nanotrisoctahedra for Magnetically Targeted and Near-Infrared Light-Responsive Theranostic Platform[J].JAm Chem Soc,2014,136(28):10062-10075.
[21] LI JH,CHEON JW.Exchange-coupled magnetic nanoparticles forefficient heat induction[J].ACSNANO,6:418-422.
[22] IDDER N,YEIS,LISR.In Magneticmicrospheres amodel system for site specific drug delivery in vivo[J].Royal Society of Medicine,1978(2):141-146.
[23] SEN Y,WIDDER K,CZERLINSKIG.Magnetic guidance of drug carryingmicrospheres[J].JAppl Phys,1978,49(3):3578-3583.
[24] YU M K,JEONG Y Y.Drug-loaded Superparamagnetic Iron Oxide Nanoparticles for Combined Cancer Imaging and Therapy In Vivo[J].Angew Chem,2008,47(29):5362-5365.
[25] CHEN L B,ZHANG F,WANG C C.Rational synthesis ofmagnetic thermosensitivemicrocontainers as targeting drug carriers[J].Small,2009,5(5):621-628.
Preparation of iron-containing nanoparticles and their application in biomedicine
ZHU Yongji,ZHOU Zhiguo,YANG Shiping
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai200234,China)
Iron-containing nanomaterials arewidely used inmany fields due to their uniquemagnetic properties.We provide here a mini review of the iron-containing nanomaterials obtained by high temperature thermal decomposition for the application of the biomedicine.
iron-containing nanomaterials;high temperature thermal decomposition;biomedicine
O 611.3
A
1000-5137(2015)05-0547-09
(责任编辑:郁 慧)
10.3969/J.ISSN.1000-5137.2015.05.016
2014-11-07
国家自然科学基金(20971086);教育部科学技术重点项目(210075)
周治国,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:zgzhou@shnu.edu.cn;杨仕平,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:shipingy@shnu.edu.cn

