金属铱配合物在光动力学治疗中的应用
石 敏,周治国,杨 红,杨仕平
(上海师范大学生命与环境科学学院,上海 200234)
金属铱配合物在光动力学治疗中的应用
石 敏,周治国,杨 红,杨仕平
(上海师范大学生命与环境科学学院,上海 200234)
光动力治疗主要通过光敏剂在特定波长光源的激发下发生光动力学反应,产生单线态氧而发挥其破坏肿瘤细胞的作用.金属铱配合物,由于金属铱的重原子效应,在被合适的光激发后经过系间窜越到达三重态,把能量传递给氧分子从而产生单线态氧用于光动力治疗.
铱配合物;光动力学治疗;化疗
0 光动力学治疗概述
光动力疗法(photodynamic therapy,PDT)是一种无创或微创性,非热性的,利用光化学反应靶向组织和靶向肿瘤细胞的治疗方法[1].PDT是一种冷光化学反应,其基本要素是氧、光敏剂和可见光(常用激光)[2].首先肿瘤组织选择性摄取光敏剂,随后选择适当波长的激光对局部照射,光敏剂被激活,激发态的光敏剂又把能量传递给周围的氧,生成活性很强的单线态氧.单线态氧和相邻的生物大分子发生氧化反应,产生细胞毒作用而导致细胞受损乃至死亡,如图1所示[3].
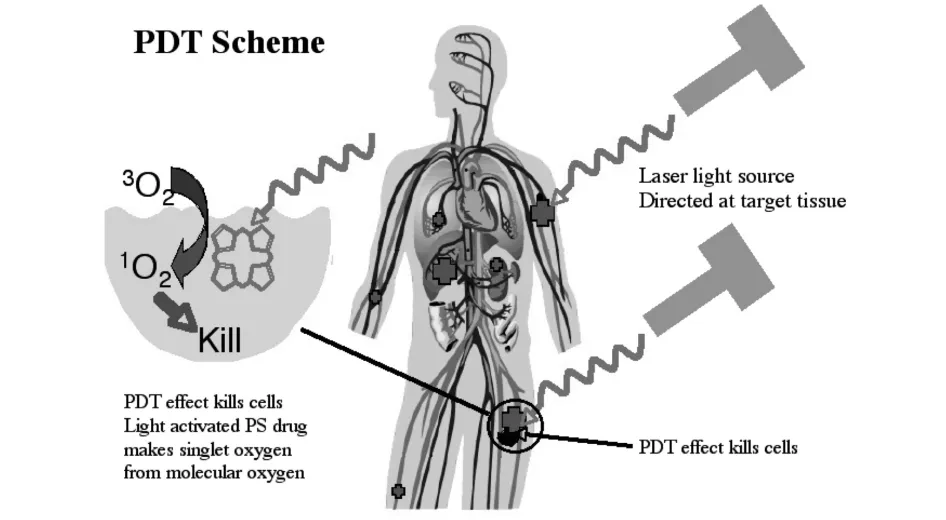
图1 光动力疗法示意图
近年来由于光敏剂、光激活装置以及导光系统的发展和进步,光动力学疗法已逐步成为肿瘤的基本治疗手段之一[4].迄今为止,已有一些商用的光敏剂应用于PDT中.常用的商用光敏剂例如:1966年,Lipson首先提出了血卟啉衍生物(hematoporphyrin deriva-tive,HPD)、二血卟啉醚(dihaematoporphyrin ether,DHE)和Por-fimer sodium(PhotofrinⅡ,即PHOTOFRINR)为第一代光敏剂,这三种光敏剂已获多国政府的药监部门批准应用于临床.临床应用光敏剂时,多为几种光敏剂的混合制剂,这使得光敏剂在体内的滞留时间长,避光时间需4周以上,其最大激发波长在630 nm,此波长穿透的组织深度有限(0.5 cm以下),由于穿透组织较浅,极大地限制了光动力学疗法在较大肿瘤上的应用[5-7].随着研究的进一步深入,又发现了第二代光敏剂,如5-ALA(5-氨基酮戊酸)、间-四羟基苯基二氢卟酚(meso-tetrahydroxyphenyl chlorin,m-TH-PC)、初卟啉锡(tin etiopurpurin,SnEtz)、亚甲基兰(methylene blue)和亚甲苯兰(toluidine blue)、苯卟啉(benzoporphyrin)衍生物以及lutelium texaphyrins(Lu-Tex)、苯并卟啉衍生物单酸(BPD-MA,vertoporfin)、酞青类(Phthalocyanines)、得克萨卟啉(Texaphyrins)、N-天门冬酰基二氢卟酚(N-aspartyl chlorin e6,Npe 6)、金丝桃素(hypercin)、血啉甲醚(Her-mimether,HMME).第二代光敏剂基本已进入临床研究阶段,尚未批准正式临床应用.第二代光敏剂部分地克服了第一代光敏剂的缺点,更加符合理想光敏剂的特点,表现为光敏期短,作用的光波波长较大,从而增加了穿透的深度,产生的单线态氧也较多,对肿瘤更有选择性[5,8].在第二代光敏剂的基础上,进一步交联上某些特殊的化学物质,更加提高了肿瘤组织的选择性.这些特殊的化学物质,如多聚体(Polymers)、脂质体(Liposomes)、肿瘤组织表达的抗原或受体的相应抗体和配体等,但目前尚处在动物研究阶段[9].本文作者介绍了铱配合物具有的优异性质,可作为理想的第三代光敏剂进行探讨研究.
金属铱配合物具有发光量子产率高、大的Stocks位移和发光寿命长、发射峰较窄等特点.可以通过对配体的修饰,调节铱配合物的发射波长、发光强度、发光量子产率.由于铱配合物的这些优点已经被广泛研究,有望作为新型高效的光敏剂,本文作者主要综述了基于金属铱配合物作为光敏剂在PDT领域的研究进展.
1 铱配合物的发光机理
铱配合物作为光敏剂用于光动力学治疗,即铱配合物在合适的光源照射下,吸收光源能量后激发,激发光将能量转移给周围的氧产生单线态氧,用于光动力学治疗.要了解铱配合物用于光动力学原理,首先要了解铱配合物发光机理.铱配合物在适当的激光照射下能发出荧光和磷光,荧光和磷光都是辐射跃迁过程.不同的是荧光的辐射跃迁始态是激发单重态,而磷光的辐射跃迁始态是三重态,但是终态都是基态.所以光敏剂发光可以细分为荧光和磷光.如图2所示,当处于基态(S0)的铱配合物受到光激发后,分子吸收能量(A)首先到达单重激发态(S1).由于铱原子存在重原子效应,大部分单重激发态(S1)所处的较低经振动能级与激发态较高振动能级重叠时,过系间窜越单重激发态到达三重激发态(S3),经过振动弛豫达到最低振动能级(T3),然后经过辐射跃迁回到基态(S0)从而发出磷光(P).部分单重激发态(S1)经过振动弛豫达到最低振动能级(T1),再经过辐射跃迁回到基态(S0),从而发出荧光(F).若再由三重激发态(S3)将能量转移到稀土(RE)中心上,中心离子发生跃迁至激发态,再回到基态并产生荧光,这就是铱配合物发光机理[10].
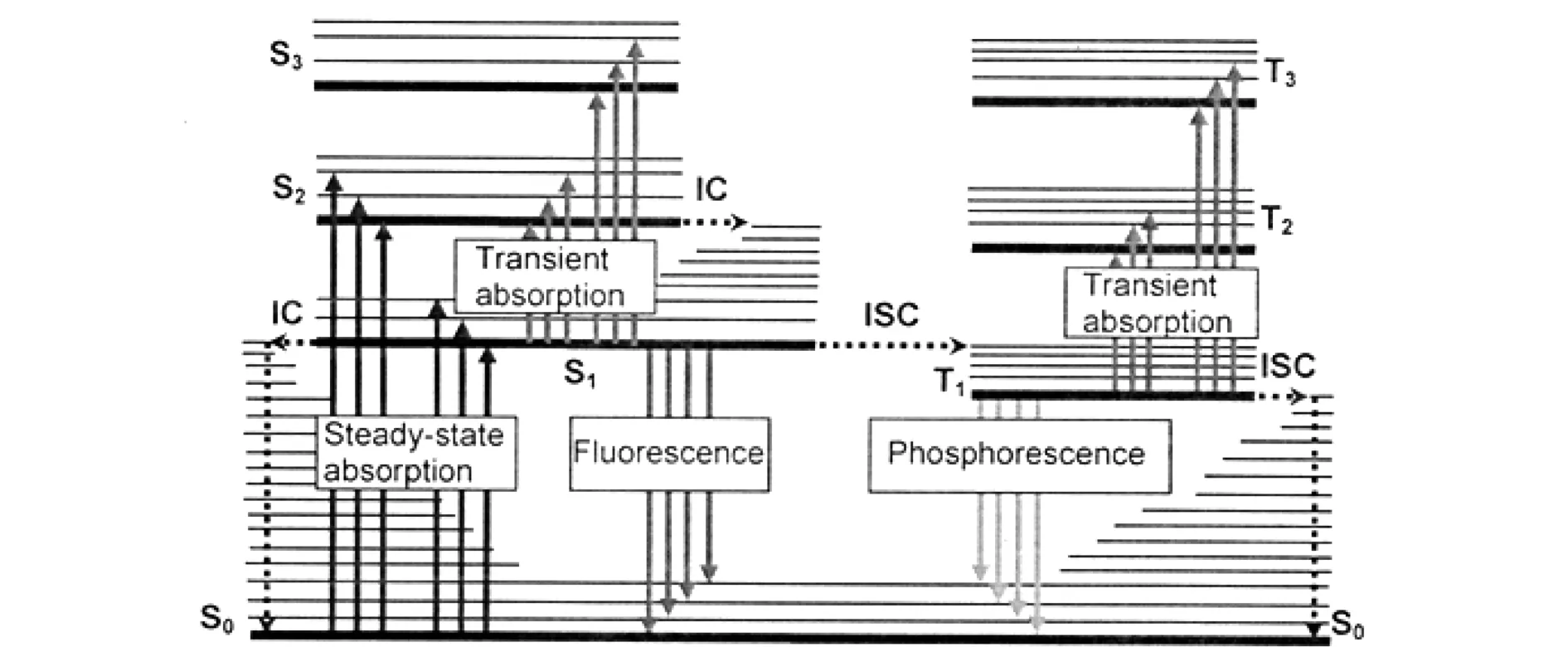
图2 铱配合物发光机理示意图
2 铱配合物的光动力学治疗研究
2006年Pi-Tai Chou课题组把铱配合物通过后修饰的方法连接到CdSe/ZnS纳米粒子表面得到了Ir-CdSe/ZnS量子点,在640 nm的激光照射下,能有效地产生单线态氧,可用于光动力学治疗[11-12].有关细胞以及动物光动力学治疗的研究当时未作报道.图3A为Ir-CdSe/ZnS量子点的合成路线,将铱配合物通过化学交联到CdSe/ZnS纳米粒子表面得到Ir-CdSe/ZnS量子点.图3B中嵌入了Ir-CdSe/ZnS量子点在充空气甲醇溶液中激发光谱.观察到在1 273 nm处有很强的发射,通过公式1Δg(0)→1∑g(0)1 273 nm计算,验证了单线态氧产生.进一步研究铱配合物在MeOH溶剂发射的衰减曲线.图3B为充空气和除氧两种条件下发射光谱的衰减历程,观察在除氧条件下,发射光谱的衰减时间明显加长.
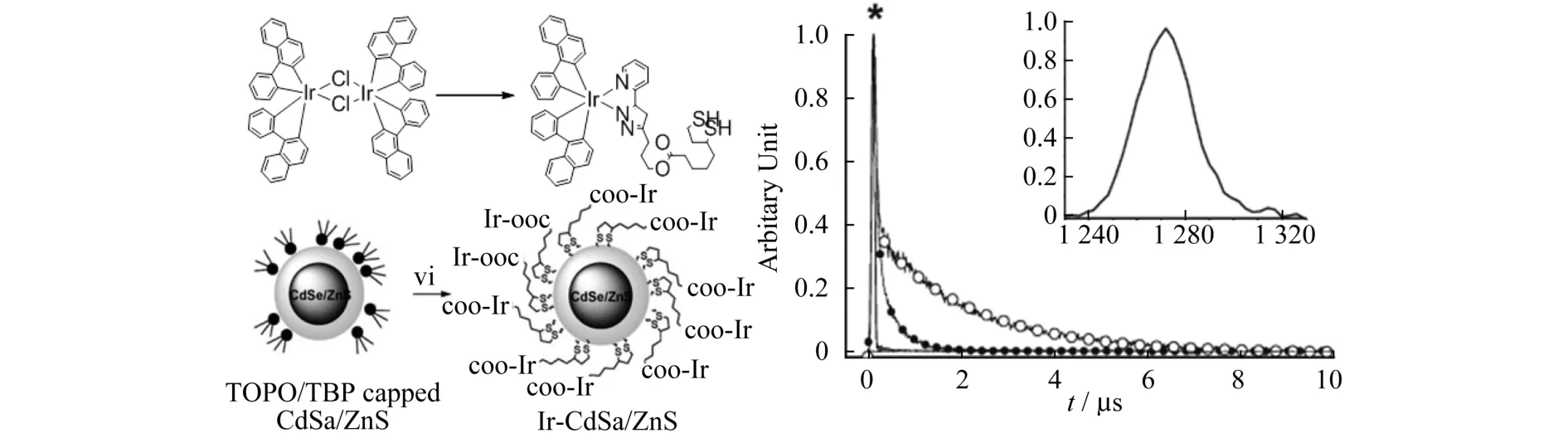
图3 A:Ir-CdSe/ZnS量子点的合成路线;B:Ir-CdSe/ZnS量子点在充空气(hollow circle)和除氧(solid circle)甲醇溶液发射光谱的衰减曲线(插图:1273nm处Ir-CdSe/ZnS量子点发射光谱)
2007年,Pi-Tai Chou课题组利用反胶束法制得Fe3O4/SiO2(Ir)纳米粒子.图4A为Fe3O4/SiO2(Ir)纳米粒子的合成路线,Fe3O4/SiO2(Ir)纳米粒子是由硅烷化的铱配合物在碱性条件下聚合到Fe3O4/SiO2纳米粒子表面制得.图4B为激光共聚焦显微镜观察100μg/mL Fe3O4/SiO2(Ir)纳米粒子孵育的HeLa细胞光动力学治疗图片.图4B中(a)为没有光照下0 min时的细胞形态,图4B中(b)为没有光照下480 min时的细胞形态.可以观察到光照对照组(a)、(b)细胞形态完好,没有死亡迹象.图4B中(c)~(f)是HeLa细胞在200 mW激光照射不同时间的激光共聚焦图片,光照时间分别为:(c)0 min,(d)90 min,(e)180 min,(f)210min,(g)390 min,(h)480min,观察到随着照射时间的加长,细胞中逐渐有气泡和胞浆碎片形成,细胞膜也逐渐变形、破损,最终死亡,从而达到治疗肿瘤的目的[13].
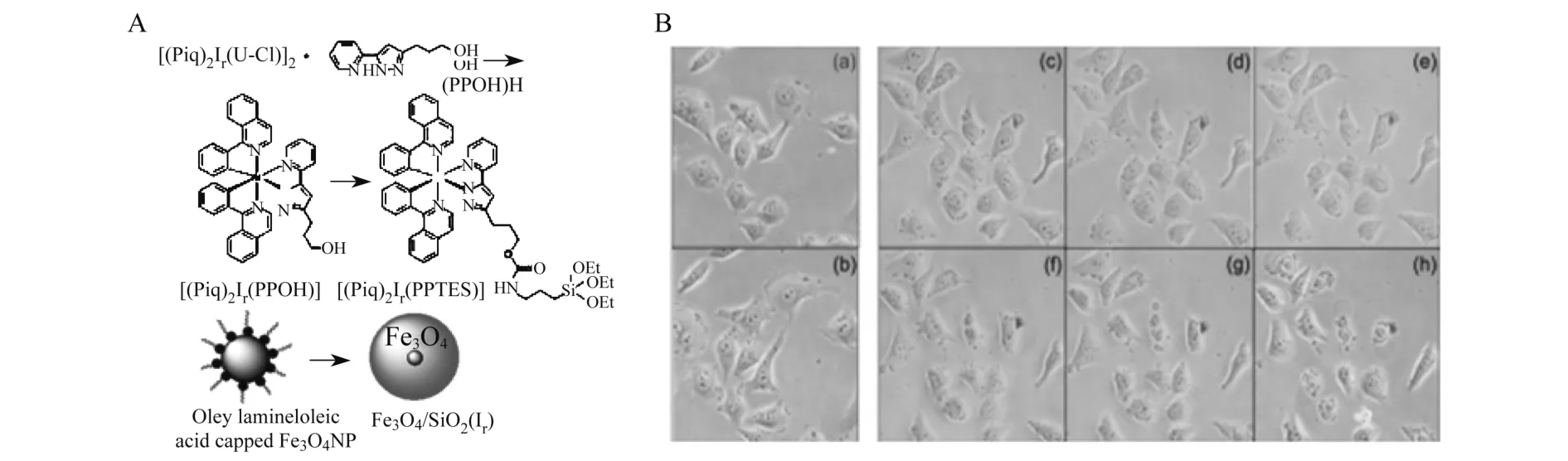
图4 A:Fe3O4/SiO2(Ir)纳米合成粒子路线;B:激光共聚焦观察100μg/mL Fe3O4/SiO2(Ir)纳米粒子孵育的HeLa细胞不同时间的光动力治疗图片
相比之前只是证明产生单线态氧,Fe3O4/SiO2(Ir)用于光动力学治疗的有了进一步的发展,进入了细胞层次,但治疗存在没有靶向性的缺点.在2008年,Pi-Tai Chou课题组报道了另一种具有靶向HeLa细胞的H-MnO@mSiO2(Ir)-FA纳米粒子,图5A为H-MnO@mSiO2(Ir)-FA纳米粒子合成路线,首先合成H-MnO@mSiO2(Ir)纳米粒子,然后在其表面利用离子交换的方法接上-NH2,得到H-MnO@mSiO2(Ir)-NH2纳米粒子,然后在EDC和NHS活化作用下与叶酸(FA)反应得到具有靶向功能的H-MnO@ mSiO2(Ir)-FA纳米粒子.H-MnO@mSiO2(Ir)-FA纳米粒子不仅大大降低了非靶向细胞的摄取量,减小对非靶向细胞的毒性,而且显著增强了HeLa细胞对纳米粒子的摄取量,治疗具有靶向性[14].图5B通过MTT法检测不同实验条件下HeLa细胞的光动力学治疗效果,(a)细胞中无H-MnO@mSiO2(Ir)-FA纳米粒子孵育,在100 mW卤素灯下照射10 min,无细胞死亡;(b)在黑暗的条件下,用50μg/mL H-MnO @mSiO2(Ir)纳米粒子孵育120 min,细胞成活率也在90%以上;(c)在黑暗的条件下,用50μg/mL H-MnO@mSiO2(Ir)-FA纳米粒子孵育120 min,细胞成活率在90%左右;(d)细胞用H-MnO@mSiO2(Ir)纳米粒子孵育120 min,在100 mW卤素灯下照射10 min,细胞成活率在90%左右;(e)细胞用HMnO@mSiO2(Ir)-FA纳米粒子孵育120min,在100mW卤素灯下照射10min,细胞成活率为60%,有大量细胞死亡,随着照射时间加长有更多的HeLa细胞死亡,通过对照说明H-MnO@mSiO2(Ir)-FA纳米粒子具有良好靶向光动力学治疗效果.

图5 A:H-MnO@mSiO2(Ir)-FA的合成路线;B:MTT法检测不同实验条件的光动力学治疗效果
2012年,Shinsuke Moromizato等人报道报道以2-(5′-N,N-二乙基氨基-4′-间甲苯基)吡啶(deatpy)配体为配体的新型铱配合物[Ir(deatpy)3].Ir(deatpy)3的发射具有很强的pH依赖性,在微酸性条件下(pH≈6.5~7),用377 nm或470 nm的激光照射,图6的水溶性照片可以清楚地看出pH在6.5和7下,Ir(deatpy)3被激发发光,将能量转移给周围的氧产生单线态氧,诱导细胞凋亡[15].而pH在7.4条件下没有激发,不会产生单线态氧,从而不会伤害正常细胞.体内正常环境为pH为7.4左右,而肿瘤细胞一般适合在偏酸性(pH≈6.5~7)环境生长,对于pH敏感的Ir(deatpy)3在肿瘤细胞生长的环境下,通过激光的照射,产生单线态氧能够诱导肿瘤细胞凋亡,Shinsuke等人成功报道具有pH靶向的光动力学治疗[16-17].

图6 pH敏感的Ir(deatpy)3光动力学治疗
2013年,Cao等人报道了新型金属铱配合物诱导的内质网应激反应,通过线粒体介导的癌细胞凋亡.Cao等人首次提出具有线粒体靶向作用的光动力学治疗,相对之前只是概述铱配合物进入细胞后激发产生单线态氧,破坏细胞机制,诱导细胞凋亡,有了进一步的突破[18].图7A通过核转录因子的同源蛋白(CHOP)的表达指示内质网应激反应,用10μmol/L铱配合物孵育的HeLa细胞分别在3、5、12 h的激光共聚焦图片,用β-微管蛋白(β-Tubulin)作为对照,观察到孵育12 h后,内质网产生了明显的应激反应.内质网应激反应导致了细胞对Ca2+过量吸收,聚集在细胞质中,引起线粒体的吸收,从而使线粒体被破坏,诱导细胞凋亡.图7B为激光共聚焦观察100μmol/L铱配合物孵育HeLa细胞的荧光强度随着时间推移不断增强.图7C为激光共聚焦显微镜的软件定量分析100μmol/L铱配合物处理后的HeLa细胞荧光强度随时间变化的曲线.图7D为激光共聚焦显微镜观察用10μmol/L铱配合物孵育的HeLa细胞在激光照射后,随着时间变化细胞出现核缩合,亮场图片显示HeLa细胞膜起泡,细胞逐渐凋亡,这是首次报道具有线粒体靶向的光动力学治疗.
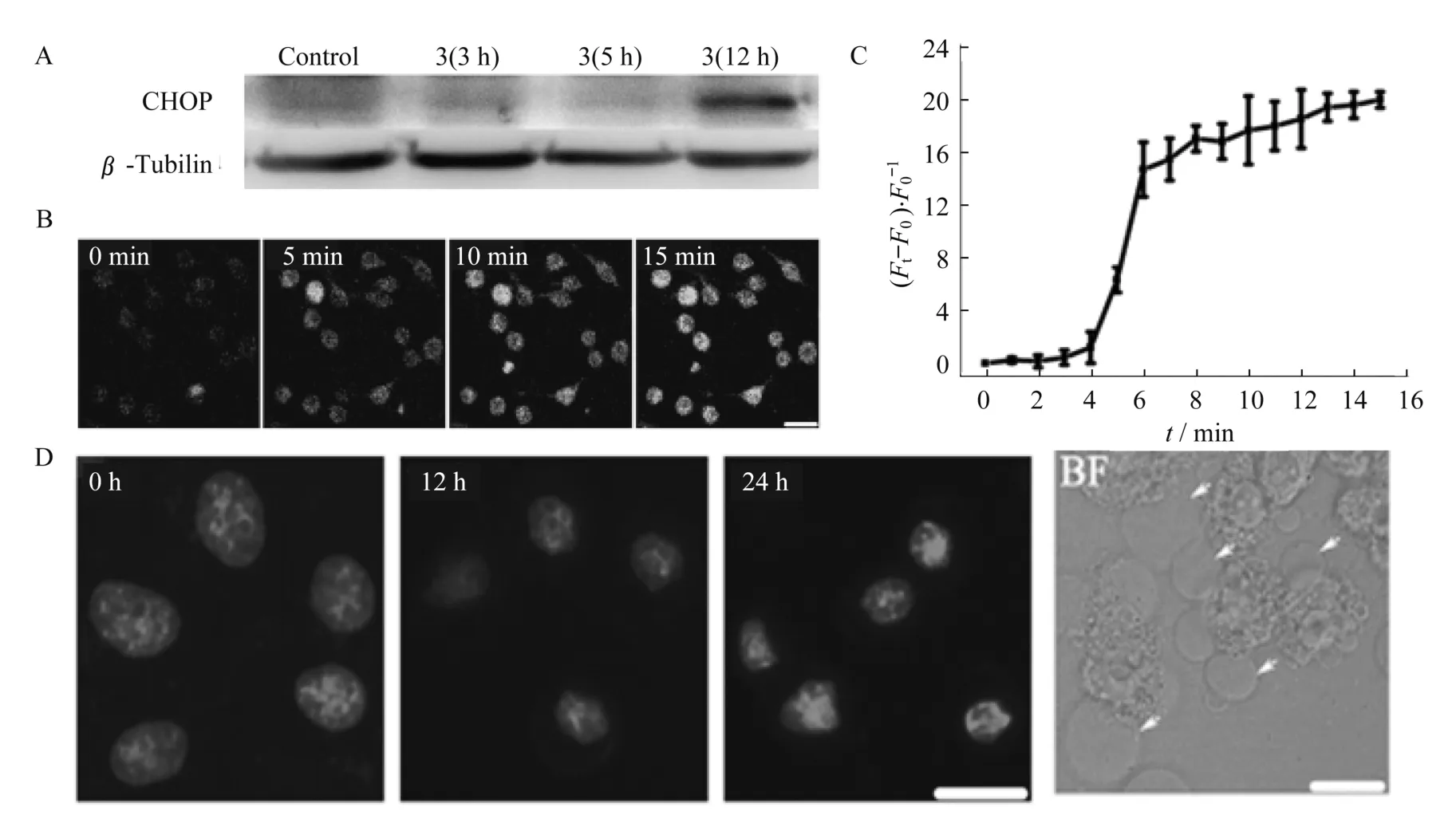
图7 A:10μmol/L铱配合物孵育的HeLa细胞分别在3 h、5 h、12 h内质网应激反应的免疫印迹;B:共聚焦观察随着时间推移100μmol/L铱配合物孵育的HeLa细胞荧光强度;C:利用共聚焦显微镜的软件定量分析100μmol/L铱配合物孵育的HeLa细胞荧光强度;D:共聚焦显微镜观察用10μmol/L铱配合物孵育的HeLa细胞明暗场图片
2013年,Li等人报道了线粒体靶向Ir complex-PEG复合物[20].通过配体来调节复合物的发光强度和发光寿命,创新点在于Li等人的研究解决了许多过渡金属常见的两个问题:一是对于真核细胞系高的细胞毒性,二是铱配合物在水溶液的溶解性差的问题.Li等人的解决方案是将铱配合物通过功能化接上聚乙二醇(PEG).铱配合物接上PEG极大地提高了复合物的生物相容性,保护了复合物与内细胞的DNA、蛋白质、其他细胞器之间的相互作用,从而减小了细胞毒性[21-22].并通过配体大π-π的共轭体系调整细胞对铱配合物的摄取效率.另外一大突破是研究进入到动物实验,选择与人类87%的DNA是相似的斑马鱼作为实验对象,治疗具有创新性[23-25].图8A为24倍显微镜观察不同浓度含有PEG的铱配合物(complex 3a)和不含有PEG的铱配合物(complex 3b)在相同条件下孵育20 h的斑马鱼胚胎图片,发现不含有PEG的complex 3b不能进入斑马鱼胚胎中,而含有PEG的complex 3a能被胚胎所摄取.图8B为72倍显微镜观察斑马鱼幼体的整体照片,同样可以看出含有PEG的complex 3a和空白对照组斑马鱼幼体形态都没有变化,complex 3a能够被胚胎很好摄取,而不含PEG的铱配合物complex 3b不能被胚胎摄取,在体内聚集肿胀,形态发生了变化,胚胎发育产生明显缺陷(已用箭头标注).如图9所示,complex 3a注射斑马鱼后沿血管分布,然后扩散到肌肉和其他组织,1h后进入脊索、脊髓和脑室.注射24 h后,加载的complex 3a聚集在头部周围和心腔的卵黄囊周围,斑马鱼接受治疗仍然正常活着,并且通过体循环逐渐代谢到膀胱,最后排出体外.这就意味着complex 3a有望成为体内光动力学治疗试剂.
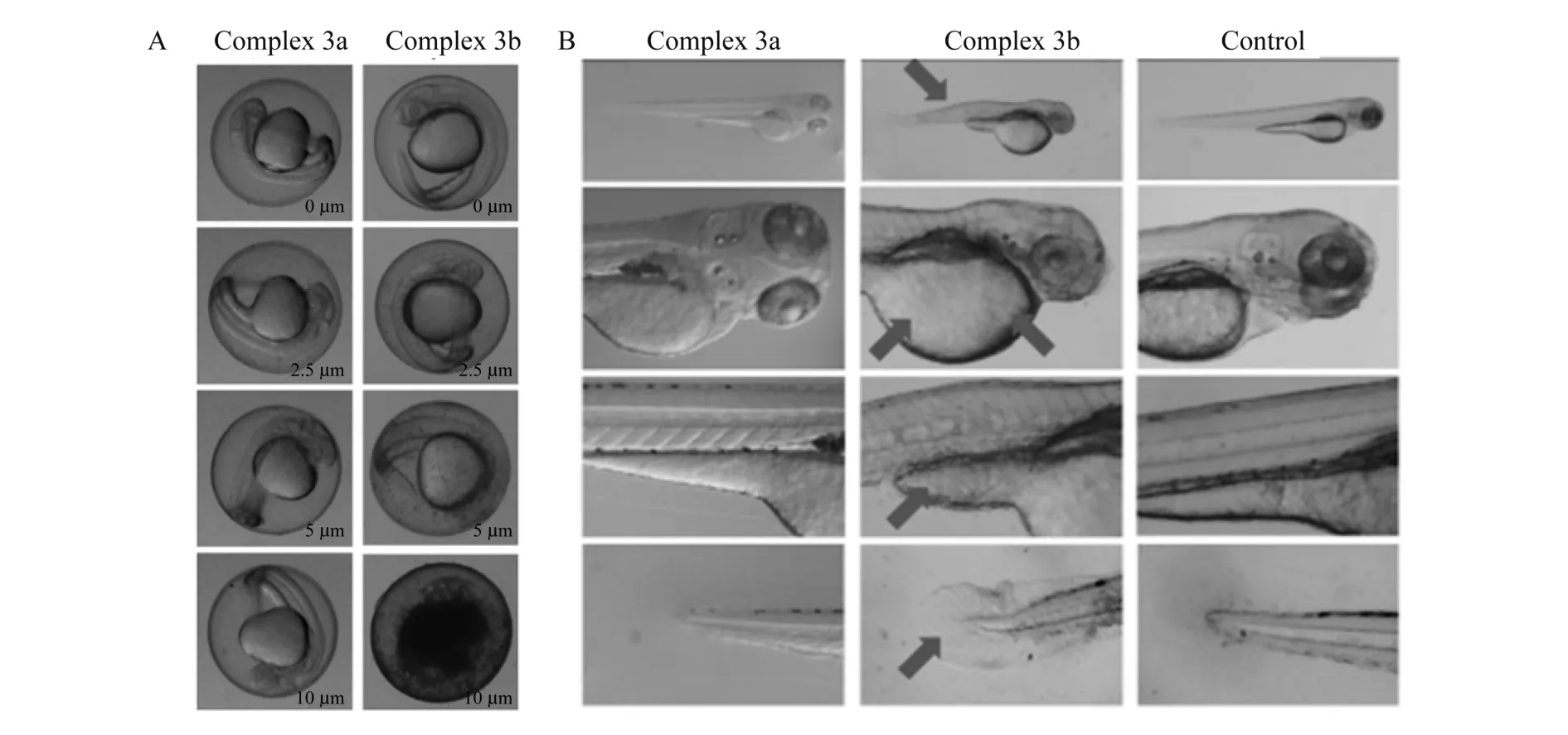
图8 A:24倍显微镜观察不同浓度complex 3a和complex 3b孵育20 h的斑马鱼图片;B:72倍显微镜观察complex 3a、complex 3b孵育24 h后斑马鱼幼体图片

图9 48倍显微镜观察不同时间段complex 3a在斑马鱼幼体内的生物分布
3 金属铱配合物光动力学疗法的局限性
金属铱配合物作为新型的光敏剂用于光动力学治疗的研究还不够全面,金属铱配合物光动力学疗法是一种局部治疗方法,对肿瘤的杀伤效果在很大程度上决定于病变区的照光剂量是否充分.由于现在报道的铱配合物用于光动力学治疗主要是在可见光部分有吸收,这就不可避免地对动物体产生一定的毒性,并且在黑暗条件下也有轻微的毒性,而且穿透深度较浅,光进入组织后会因组织的吸收和散射而衰减,所以无论采用哪种光照方式,一次照射的杀伤深度和范围都是有限的[26],至今还没有用于临床治疗.但金属铱配合物具有高发光量子产率、大的Stocks位移、长发光寿命和发射峰较窄等优点,希望通过进一步深入研究获得有近红外区吸收、低光毒性、高穿透深度的金属铱配合物,能够成为理想的新一代光敏剂用于光动力学治疗.
[1] LIU Z,ROBINSON J,TABAKMANM,etal.Dougherty TPhotodynamic therapy of neoplastic disease[J].Photochem Photobiol,1993,58:895-900.
[2] DOUGHERTY T J,GOMER C J,HENDERSON BW,et al.Photodynamic therapy[J].JNatl Cancer Inst,1998,90(1):889-905.
[3] KORBELIK M.Induction of tumor immunity by photodynamic therapy[J].Clin Laser Med surg,1996,14(1):329-334.
[4] SIBATA C H,COLUSSIV C,HYEON T,et al.Photodynamic therapy in oncology[J].Chem Soc Rev Expert Opin Pharmacother,2001,2(2):917-927.
[5] SELVASEKAR C R,BIRBECK N.Photodynamic therapy and the alimentary tract[J].Aliment Pharmacol Ther,2001,15:899-915.
[6] MOORE JV,WESTCM,WHITEHURST C.The biology of photodynamic therapy[J].Phys Med Biol,1997,42(2):913 -935.
[7] SCHRODER T,CHEN IW,SPERLINGM,etal.Hematoporphyrin derivative uptake and photodynamic therapy in pancreatic carcinoma[J].Surg On-col,1998,38(1):4-9.
[8] SHARMANW M,ALLEN CM.Photodynamic the rapeutics:basic principles and clinical applications[J].Carbon,1999,4:507-517.
[9] MOOR JV,GOTTLIEB L.Red light that stops cancer[J].Fortune,1995,131(5):171-176.
[10] FLAMIGNIL,BARBIERIA,SABATINIC,et al.Photochemistry and Photophysics of Coordination Compounds:Iridium[J].Top Curr Chem,2007,281:143-203.
[11] DENG H,PENG Q,WANG X,et al.Graphene oxide as a chemically tunable platform for optical applications[J].Angew,Chem,2005,117(1):2842-2845.
[12] MORRISK,AZIZUDDIN M.The rise of graphene[J].NatMater,2007,6(1):183-191.
[13] WANG H L,LIANG Y Y,MIRFAKHRAIT,et al.Advanced asymmetrical supercapacitors based on graphene hybrid materials[J].Nano Res,2011,4(8):729-736.
[14] HSIEH JM,WU PW,CHOU P T,et al.Iridium-Complex-Functionalized Fe3O4/SiO2Core/Shell Nanoparticles:A Facile Three-in-One System in Magnetic Resonance Imaging,Luminescence Imaging,and Photodynamic Therapy[J].Chem Commun,2006,4(2):615-617.
[15] SHINSUKEM,YOSUKE H,TOSHIHIRO K,et al.Design and Synthesis of a Luminescent Cyclometalated Iridium(III)Complex Having N,N-Diethylamino Group that Stains Acidic Intracellular Organelles and Induces Cell Death by Photoirradiation[J].Inorg Chem,2012,51(3):12697-12706.
[16] HUMMERSW,OFFEMAN R.For review and foresight of photochemical devices and their applications[J].JAm Chem Soc,2012,134:8289-8292.
[17] HOWERTON B S,HEIDARY D K.the structurally-strained ruthenium complexes as potent light-activated anticancer agents[J].JAm Chem Soc,2012,134(1):8324-8327.
[18] CAO H,JIA J L,ZHOU M,et al.Membrane Localized Iridium(III)Complex Induces Endoplasmic Reticulum Stress and Mitochondria-Mediated Apoptosis in Human Cancer Cells[J].JMed Chem,2013,56:3636-3644.
[19] KRYSKO D,VANEDN B T,VANEDNABEELE P,et al.Graphene/AuNPs/chitosan nanocomposites film for glucose biosensing[J].Methods,2008,44(1):205-221.
[20] STEVE Y L,LOUIE M W,CHENG SH,et al.Mitochondria-targeting cyclometalated iridium(III)-PEG complexes with tunable photodynamic activity[J].Biomaterials,2013,34(1):7519-7532.
[21] LEUNG SK,KWORK K Y,ZHANG K Y,et al.Design of luminescentbiotinylation reagents derive from cyclometalated iridium(III)and rhodium(III)bis(pyridylbenzaldehyde)complexes[J].Inorg Chem,2010,49:49849-49855
[22] ADARSH N,AVIRAH R R,RAMAIAHD.Tuning photosensitized singlet oxygen generation efficiency of novel aza-BODIPY dyes[J].Org Lett,2010,12(1):5720-5723.
[23] PADILLA PA,ROTH M B.Oxygen deprivation causes suspended animation in the zebrafish embryo[J].Proc Natl Acad Sci USA,2001,98:7331-7335.
[24] CELLIJP,RIZVI I,EBANSC L,et al.Imaging and photodynaic therapy:mechanisms,monitoring,and optimization[J]. Chem Rev,2010,110:2795-2838.
[25] SADOVOY A,TEH C,KORZH V,et al.Microencapsulated biomarkers for assessment of stress conditions in aquatic organismsin vivo[J].Laser Phys Lett,2012,9:542-546.
[26] SELVASEKA C R,BIRBECK N,MCMILLAN T,et al.Photodynamic therapy and the alimentary track[J].Aliment Pharmacol Ther,2001,15:899-915.
Iridium com plexes for the app lication of photodynam ic therapy
SHIMin,ZHOU Zhiguo,YANG Hong,YANG Shiping
(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai200234,China)
Photodynamic therapy can destruct tumor cells by singletoxygen which is generated via a photodynamic reaction of the photosensitizer under a specfic excitation wavelength.Due to the heavy atom effect ofmetal iridium,iridiumcomplexes are excited by suitable lightand then reach their excited triple state through intersystem crossing.The excited iridium complexes transfer energy to oxygen molecules to produce singlet oxygen for photodynamic therapy.
iridium complexes;photodynamic therapy;chemical therapy
O 657.1
A
1000-5137(2015)05-0563-08
(责任编辑:郁 慧)
10.3969/J.ISSN.1000-5137.2015.05.018
2014-11-07
上海市自然科学基金项目(12ZP1421800)
杨 红,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:yanghong@shnu.edu.cn

