基于光谱技术的食品中常见真菌毒素的快速检测研究进展
袁 景,郭小玉,杨天溪,王 卉,傅书悦,李川川,孙传文
(上海师范大学生命与环境科学学院,上海 200234)
基于光谱技术的食品中常见真菌毒素的快速检测研究进展
袁 景,郭小玉,杨天溪,王 卉,傅书悦,李川川,孙传文
(上海师范大学生命与环境科学学院,上海 200234)
真菌毒素广泛存在于食品中,特别是谷物和谷物制品,严重危害着人类和动物的安全和健康.随着色谱技术、免疫化学以及光、电、声等领域的不断发展,检测真菌毒素的方法出现多样化,各种方法的优缺点共存,如何快速、灵敏、准确、方便地进行检测成为目前形势发展下的要求.介绍了几种真菌毒素的性质、限量和检测现状,并综述了基于拉曼光谱的真菌毒素检测技术,及其在不同真菌毒素检测实验中的应用.
食品;真菌毒素;检测;拉曼光谱技术
0 引 言
真菌毒素是指由真菌产生,对人和动物有毒的次级代谢产物.通常真菌感染正在生长或储存的农作物及其制品,导致真菌毒素的产生.2013年,据联合国粮食及农业组织(FAO)估计,全球每年大约有25%的粮食作物受到真菌毒素的污染[1].如果摄入,真菌毒素可以引起急性或慢性疾病发作,如致癌、致突变、致畸、生殖系统毒性、神经系统毒性、出血性毒性、肾毒性、肝毒性和免疫抑制毒性等[2].不同的真菌可以产生多种真菌毒素,相同的真菌毒素也可以由不同的真菌产生.目前已知的真菌毒素有200多种,至少有100个国家已经对粮食/饲料中真菌毒素的限量进行了规定.粮食中主要真菌毒素有黄曲霉毒素(Aflatoxin,AFT)、赭曲霉毒素A(Ochratoxin,OTA)、桔霉素(Citrinin,CIT)、脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)、伏马毒素(fumonisin,FUM)等.关于真菌毒素的检测方法多种多样,各种方法优缺点并存,比较常用的真菌毒素检测方法主要有:
0.1 基于色谱与质谱的方法
色谱技术是利用试样中各组份在气相和固定液液相间的分配系数及吸附或溶解能力的不同,按顺序由色谱柱进入检测器,在记录器上描绘出各组份的色谱峰.质谱技术是通过对样品离子质合比的分析来实现对样品进行定性定量检测的方法.例如,气相色谱法(GC)、高效液相色谱法(HPLC)和各种质谱联用技术如气质联用(GC-MS)等多种方法,上述几种基于色谱和质谱检测技术的比较如表1所示[3].
0.2 基于免疫化学基础的免疫分析方法
免疫学检测方法是基于抗体与抗原或半抗原之间的选择性反应而建立起来的一种生物化学分析法.通常具有高的选择性和很低的检出限,在粮食及其制品真菌毒素检测中应用较广的主要是酶联免疫吸附法(ELISA)、胶体金免疫层析法等.

表1 基于色谱与质谱技术的GC、HPLC、GC/MS的比较
0.2.1 免疫胶体金技术
免疫胶体金技术主要利用了金颗粒具有高电子密度的特性,在金标蛋白结合处,显微镜下可见黑褐色颗粒.当这些标记物在相应的配体处大量聚集时,肉眼可以见红色或粉红色斑点,从而用于定性或半定量的快速免疫检测方法[4].2004年,美国农业部粮食检验、肉类加工和活畜市场管理局(GIPSA)采用两种快速定量试剂盒分别用于检测伏马毒素和呕吐毒素,结果表明伏马毒素试剂盒测试效果理想,而呕吐毒素试剂盒没有达到预期要求.同时进行的还有黄曲霉毒素试剂盒,不过当时仍处于数据验证阶段[5].2012年,赖卫华等人利用免疫胶体金技术检测到了酱油中黄曲霉素 B1,并且达到国家限量标准[6].
0.2.2 酶联免疫吸附法(ELISA)
酶联免疫法(ELISA)是一种用过氧化物酶标记抗体,再与抗原结合,然后根据酶与底物反应产生溶性的有色物质,借助光学或电子显微机观察细胞或亚细胞结构中抗原物质的方法.分为直接法和间接法[7].目前ELISA法已经广泛应用于食品中真菌毒素的检测,例如,2012年,廖妍俨等[8]成功利用ELISA法检测了牛奶中黄曲霉毒素M1.2006年,陈玲等[9]利用ELISA法检测了饲料中的黄曲霉毒素.
0.3 生物传感器技术
生物传感器是将生物技术和电子技术相结合,以生物学组件作为主要功能性元件,能够感受规定的被检测物质的量,并按照一定规律将其转换成可识别信号的器件或装置.该技术在黄曲霉素、伏马毒素和杂色曲霉素的检测中发挥了很好的作用[10].2005~2006年,Ngundi等人[11-12]先后利用生物传感器成功地检测了谷物中的赭曲毒素和呕吐毒素,并取得了良好效果.
0.4 近红外技术
近红外光是指介于可见光和中红外光之间的电磁波,波长范围是700~2 500 nm,一般有机物在该区的近红外光谱吸收主要是含氢基团(OH,NH2,SH)等的倍频和合频吸收[13].2012年,Dall′Asta等人[14]借助近红外光谱,研究了玉米样品的各成分比例,由于受到高污染的样品亚油酸成分较高,成功检测到了玉米样品中伏马霉素的存在.上述几种测技术的比较如表2[3]所示.

表2 免疫胶体金技术、酶联免疫吸附法、生物传感器技术、近红外光谱技术的比较
拉曼光谱相关技术是基于化学键的极化率,较其他技术对分子非极性基团中共价键的对称振动更为敏感,操作简单、无损、快速、便携、重复性、灵敏度高、不受水分子等干扰、很少有重叠带,可以为定性和定量检测真菌毒素的化学官能团及其衍生物提供更多有价值的信息.本文作者主要介绍基于拉曼光谱的几种真菌毒素的检测技术.
常规的拉曼光谱有时存在局限性,即灵敏度低,信号较荧光显微镜要弱很多.因此,常规的拉曼光谱技术通过将被检测的物质吸附在粗糙的纳米金属表面,通常是金、银、铜或者一些不常用的碱金属(锂、钠)[15],从而增强108数量级的信号强度,常认为表面等离子共振产生的表面电磁场增强和电荷转移引起的化学增强是导致拉曼散射信号极大增强的两种主要原因,这种方法称为表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS).与拉曼技术相关的混合动力系统光谱还有很多类型,例如:表面增强共振拉曼光谱(surface-enhanced resonance Raman spectroscopy,SERRS),傅里叶近红外表面增强拉曼光谱(FT near-IR-SERS),表面增强拉曼散射—扫面近场光学显微镜(SERS-SNOM),针尖增强拉曼光谱(tip-enhanced Raman spectroscopy,TERS)等[16].
1 黄曲霉毒素(AFT)
黄曲霉毒素是最强的化学致癌物之一,主要存在于玉米、花生等粮食中,它能使人体或动物的免疫功能丧失,诱导畸形、癌症的发生.黄曲霉毒素的毒性主要是对肝脏的损害,导致肝癌,还可以诱发骨癌、肾癌、直肠癌、乳腺癌、卵巢癌等,对人类、家畜和家禽的健康产生了严重的危害,其“三致”(致突变、致癌、致畸性)危害性已引起了世界的关注.1993年国际癌症研究所将黄曲霉毒素确定为一级人类致癌物,现已有60多个国家制订了食品和饲料中黄曲霉毒素限量标准和法规[17].我国对食品中黄曲霉毒素B1的最高允许量为玉米、花生及其制品20μg/kg;大米、食用油类10μg/kg;其他粮食、豆类、发酵食品5μg/kg;并规定婴儿食品不得检出[18-19].国际食品法典规定食品中黄曲霉素最高允许量为15μg/kg[20].
在以往的文献中已有基于拉曼相关技术检测黄曲霉毒素的报道.2014年,Lee等人[21],利用从德克萨斯州取来的132个已经接种过黄曲霉毒素的玉米样品,每个样品4.5 kg,浓度范围分别在0~1 206μg/kg,通过样品打碎、干燥等一系列方法预处理,至于拉曼显微镜下,进行2 s 5次,200~3 500 cm范围内扫描,得出光谱数据取平均值.通过求导和计算,经对光谱数据作定性和定量分析后得出400~620 cm-1,750~ 1 200 cm-1,1 400~1 800 cm-1几个范围内的波峰与玉米样品中的黄曲霉毒素有密切关系.同年,Lee等人[22]又利用与上述相同条件下被污染的玉米样品,用甲醇萃取后,至于拉曼显微镜观察,得到了5个不同浓度的黄曲霉毒素拉曼光谱,从而验证了拉曼光谱检测黄曲霉素的可行性.2012年,Wu等人[23]利用电子束斜角沉积的方法制得银纳米棒作为基底,通过拉曼显微镜,在激发波长为785 nm条件下,也检测出了甲醇溶液中不同浓度的黄曲霉毒素B1、B2、G1、G2,其中各黄曲霉毒素在甲醇溶液中的最低检出限为AFB1:5×10-5mol/L;AFB2:1×10-4mol/L;AFG1和AFG2:5×10-6mol/L.同时进行了密度泛函理论的计算,对各黄曲霉毒素的拉曼光谱进行了进一步的分析.2014年,Ivanova和Spiteller等人[24],分别用拉曼光谱和质谱检测了黄曲霉毒素B1、G1、M1、B2A、G2A、M2A.其中拉曼光谱的检出限为10.13μg/kg,定量限为33.76μg/kg.2012年,高思敏、王红艳等[25]采用密度泛函理论(DFT)的B3LYP方法和6-311g(d,p)(C,H,O)/LanL2DZ(Ag)基组,优化得到黄曲霉毒素分子AFB1与不同尺寸Ag小团簇形成的复合物AFB1-Ag n稳定结构,并计算了3种复合物的表面增强拉曼光谱(SERS)和预共振拉曼光谱(SERRS),与文献中实验结果相一致.
2 脱氧雪腐镰刀菌烯醇(DON)
脱氧雪腐镰刀菌烯醇又称为呕吐毒素、致呕毒素,一般在小麦、玉米中含量较高,在大米和黑麦中的含量相对较低.呕吐毒素的高细胞毒性及免疫抑制性质,已对人类及动物的健康构成了威胁.在实验动物模型中,急性中毒引起呕吐,而慢性低剂量暴露引起厌食、生长迟缓、免疫毒性以及生殖与发育障碍.在细胞水平上,可以破坏生物大分子合成、影响细胞信号转导、细胞分化和增殖以及凋亡[26].我国国家标准规定小麦、面粉、玉米及玉米粉中DON的限量为1 000μg/kg[27].国际上限量标准最高的为美国,规定人类食用磨粉小麦的最高限量为2 mg/kg;饲料用小麦及其制品最高允许量为4 mg/kg[17].
2009年,Liu等人[28]利用傅里叶拉曼显微镜对受到DON污染的大麦和小麦进行了探究.他们选用受到不同浓度DON污染的大麦、小麦各16组样品,首先打碎,一部分通过萃取,净化柱过滤,进行气相色谱-质谱分析;另一部分放置于傅里叶拉曼显微镜下进行受感染固体粉末拉曼光谱测量,并对所得光谱数据进行了取平均值和主成分分析,得到了被污染大麦和小麦在DON含量在0、5、10、31 mg/kg 4个条件下的拉曼光谱图(图2)和DON含量在0、6、10、33 mg/kg 4个条件下的拉曼光谱图(图1),并加以作图分析.

图1 浓度范围在0、6、10、33 mg/kg,受DON污染大麦的FT-拉曼图[28]
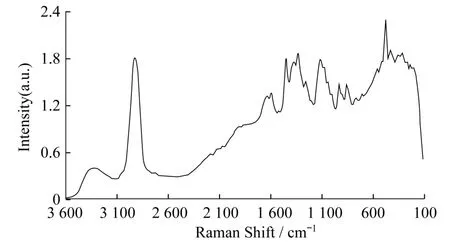
图2 浓度范围在0、5、10、31 mg/kg,受DON污染大麦的FT-拉曼图[28]
3 赭曲霉毒素A(OTA)
赭曲霉毒素包括赭曲霉毒素A、B、C、D,其中毒性最强的是赭曲霉毒素A(OTA),主要以肾脏毒性为主,另外还具有肝脏、神经系统、免疫系统、生殖系统毒性,以及致癌、致突变、致胎儿畸形的作用[29].赭曲霉毒素主要存在于粮食和谷物类、干果、葡萄及葡萄酒、咖啡、可可和巧克力、中草药、调味料、罐头食品、油、橄榄、豆制品、啤酒、茶叶等多种农作物和食品中,在动物饲料中OTA的污染也非常严重.我国规定人类粮食谷物、豆类及其制品中限量是5μg/kg[30].对实验动物的半数致死剂量(LD50)依给药途径、实验动物种类和品系不同而异,经口染毒OTA对猪的LD50为1 mg/kg、狗为0.2 mg/kg、鸡为3.3 mg/kg,大小鼠依品系不同而异[31].国际上具有最高允许量的国家为以色列,谷类、豆类的最高限量为0.05 mg/kg;饲料用谷物为0.3 mg/kg[23].
目前,基于赭曲霉毒素A的拉曼检测常与适配体技术结合.适配体又称适体,是一类25~80个碱基组成的寡聚DNA或RNA分子,是通过一种新型的组合化学技术:鄄指数富集配基的系统进化技术,经体外筛选得到的[32],其特殊而稳定的三维结构,可以通过空间构型互补高亲和力、高异特性与不同靶物质结合.目前已经筛选出针对赭曲霉毒素的适配体序列,并且对其5′端进行了修饰待实验使用[32]. 2014年,Ganbold等人分别从sigma和Bioneer公司买来OTA分子和相应被修饰的适配体序列,单纯地在带有该适配体的银基底上加入OTA分子,采用了与拉曼光谱技术结合的方式检测到了赭曲霉毒素A的存在,未结合OTA的适配体序列可以很容易吸附在银纳米粒子表面并且产生很强烈的SERS信号,当赭曲霉毒素A含量逐渐增加,由适配体产生的SERS信号就会下降约40%,这是因为适配体与OTA分子结合,构型发生了改变,从而不能和银纳米粒子表面结合.从未结合QTA的适配体到结合了靶分子OTA的适配体,可以从SERS光谱图出峰的改变观察到.通过这种间接方法成功的检测到了浓度范围在0.1~10 nmol/L内的OTA存在[33].2013年,Betty等人用适配体与拉曼结合检测了OTA的银基底上的存在,与之前不同的是,他们使用了嵌有金纳米粒子的微流通道,保证了待测溶液流动的准确和微量,并且适配体5′端被巯基标记,同样,没有结合OTA的适配体为卷曲构型,与金纳米粒子结合产生一定的SERS信号,当适配体与靶分子OTA赭曲毒素A结合后变成了四倍体鸟苷构型,从而SERS光谱发生了改变[34].
4 桔霉素(CIT)
桔霉素是一类具有荧光性的醌类甲基化合物,它是霉菌代谢产生的次级代谢产物,也可以由一些青霉、曲霉属真菌产生.桔霉素具有肝毒性、生殖毒性、诱导细胞畸变和凋亡[35].桔霉素也具有明显肾毒性,可引起实验动物的肾脏肿大、尿量增多、肾小管扩张和上皮细胞变性坏死等症状[36].桔霉素对植物及草也有毒性作用,从毒性上来说,桔霉素与黄曲霉毒素(如黄曲霉毒素B1在红曲米中的指标为5×10-6mol/L)可相提并论[37].目前在世界各地的多种农产品、食品、红曲制品、饲料中均已被检出.
Singh等人利用银纳米粒子作为SERS基地,通过标准加样法成功检测了桔霉素在各类基底上的.实验首先制得银纳米粒子,并且配制10-2mol/L的于乙醇中的桔霉素储存液,再将二者按照一定比例混合,稍加聚合,至于激光为633 nm的拉曼显微镜观察,曝光时间30 s,得出光谱数据,检出限测为10-6mol/L.之后又将桔霉素的密度泛函理论光谱、常规拉曼光谱、位于银板、位于聚四氟乙烯膜、10-5mol/L和10-6mol/L浓度位于银纳米粒子上的SERS光谱进行了总结比较[38].比较结果如图3所示.

图3 (a)对位甲基奎宁的DFT计算光谱;(b)桔霉素的普通拉曼光谱图;(c)桔霉素在银板上的拉曼光谱图;(d)桔霉素聚四氟乙烯薄膜上的拉曼光谱图;(e)10-5mol/L桔霉素于银纳米粒子上的拉曼光谱图;(f)10-6mol/L桔霉素于银纳米粒子上的拉曼光谱图;(g)银纳米粒子基底的拉曼光谱图[38]
5 伏马菌素(FUM)
伏马菌素是由串珠镰刀菌产生的水溶性代谢产物.目前发现种类已有FA1、FA2、FBl、FB2、FB3、FB4、FC1、FC2、FC3、FC4和FP1共11种,其中FB是其主要组分,占总量的70%,同时也是导致伏马菌素毒性作用的主要成分,伏马菌素能够广泛污染粮食及其制品,如玉米片、牛奶、茶、啤酒等,其中玉米及其制品最为严重,该毒素对某些家畜产生急性毒性并有潜在的致癌性,同时具有神经系统、免疫系统、肝脏,肾脏、肺毒性[39].对于伏马毒素的研究很多,但对其制定限量标准的很少.2001年6月美国食品与药物管理局(FDA)规定人类食用玉米中伏马毒素最高限量为2 mg/kg;同时,FDA的畜牧医学中心(CVM)也发布了动物饲料中伏马毒素的最高限量指导性公告,规定其限量范围为1~50 mg/kg.欧盟监管当局目前也正在讨论有关伏马菌素法规性限量的制定问题[23].
Lee等人[40]选用来自德克萨斯州试验田,已经受到浓度范围在2.0~99.0 mg/kg的伏马毒素污染的100组玉米样品为实验对象,经过打碎、干燥、控温等一系列样品处理方式,最终至于近红外激发波长为785 nm的拉曼显微镜下进行2 s 3次扫描测量,光谱范围设定为200~3 500 cm-1,得到光谱数据并加以求导和分析,从而评估了利用拉曼光谱技术检测伏马毒素的可行性,拉曼光谱如图4所示.图4为未经求导处理前5~25 mg/kg、25~50 mg/kg、50~100 mg/kg受FUM污染玉米的拉曼光谱图.
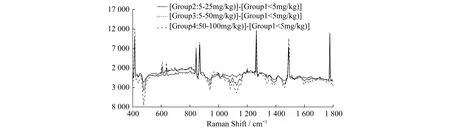
图4 5~25、25~50、50~100 mg/kg受伏马毒素污染的玉米常规拉曼光谱图
6 结论和展望
真菌毒素种类众多,在世界范围内普遍污染各种粮食、食品及饲料,其毒性可以严重危害人类和动物的健康和安全,造成食品的浪费.以往多种检测真菌毒素的方法,基于便携、简单、快速、准确、操作简单地检测食品中真菌毒素的多方面综合考虑,这些或多或少存在不足.如何快速、便携、准确、灵敏地进一步实时检测操作,已经成为人们在检测真菌毒素道路上的目的与追求.表面增强拉曼光谱技术在几种真菌毒素的检测中已经有涉及,并取得了良好的效果,但还没有普遍使用,是一个新兴的思路和探究方向,具有很高的研究价值,其可以无损、快捷,无污染、低干扰、快速准确地应用到实际生活的各类检测中,在食品中真菌毒素的检测领域有着鲜明的优势.研究者可以探索研制新型高效的表面增强拉曼光谱基底,或将拉曼光谱技术与其他技术材料配合使用,进一步提高检测准确度和灵敏度,推动基于拉曼光谱技术的真菌毒素检测技术在食品安全中发挥更显著的作用,另外,拉曼光谱技术在食品、生物、化学、环境、医药等方面也有很好的应用前景,值得进一步探索、实践和应用.
[1] SU F R,WANG SX,SUN H,et al.The state ofmycotoxin maximum limit of grain[J].Science and Technology of Cereals,Oils and Foods,2007,15(6):57-59.
[2] PEREIRA V L,FERNANDES JO,CUNHA SC.Mycotoxins in cereals and related foodstuffs:A review on occurrence and recentmethods of analysis[J].Trends in Food Science&Technology,2014,36:96-136.
[3] AMENDOLA VIA G.Detectionmethods formycotoxins in cereal grains and cereal products[J].Michelangelo N.Pascale,2009,117:15-25.
[4] XU Y L,BAO L,WU Z X,et al.Immune colloidal gold technique and its application in mycotoxin detection[J].China Brewing,2010,7:13-17.
[5] XIA C L.Research progress in the technology for rapid detection ofmycotoxins in grain and its products[J].Science and Technology of Cereals,Oils and Foods,2013,21(3):77-79.
[6] LAIW H,LIU D F,DENG SL.Study on aflatoxin B1 detecting in sauce by colloidal gold immunochromatographic assay[J].Food&Machinery,2012,28(1):70-72.
[7] CHEN A H,YANG J.The technology of enzyme-linked immunosorbentassay(ELISA)[J].China Food Additives,2004,4:109-111.
[8] LIAO Y Y,HUANG JL.The application of enzyme-linked immunosorbent assay on aflatoxin M1 in milk[J].Guizhou Chemical Industry,2012,37(4):33-39.
[9] CHEN L,CHEN L,FENG JW,et al.The detection of total aflatoxin in feed by ELISA[J].Feed Industry,2006,27(21):38-39.
[10] SUN Y M,CHEN JH,QIAN G L.Applicadon of biosensor technique in determination ofmycotxin.[J].Zhongguo Xumu ShouyiWenzhai(Shuoyi),2012,28(4):44-45.
[11] LISA C.SHRIVER-LAKE.Array Biosensor for Detection of Ochratoxin A in Cereals and Beverages[J].Anal Chem,2005,77:148-154.
[12] MIRIAM M N,SYEDA Q.Detection of deoxynivalenol in foods and indoor air using an array biosensor[J].Environ Sci Technol,2006,40:2352-2356.
[13] WANG D J,ZHOU X Y,JIN TM,et al.Application of near-infrared spectroscopy to agriculture and food analysis[J]. Spectroscopy and Spectral Analysis,2004,24(4):447-450.
[14] CHIARA D,CLAUDIA F,GIANNIG.Role ofmaize hybrids and their chemical composition in fusarium infection and fumonisin production[J].Journal of Agricultural and Food Chemistry,2012,60:3800-3808.
[15] REN B,TIAN ZQ.The progress in surface-enhanced Raman spectroscopy[J].Modern Instruments,2004,5:1-13.
[16] HALINA A,BEATA B P.Raman imaging in biochemical and biomedical applications.diagnosis and treatment of breast cancer[J].Chem Rev,2013,113:5766-5781.
[17] SU F R,WANG SX,SUN H,et al.The state ofmycotoxin maximum limit of grain[J].Science and Technology of Cereals,Oils and Foods,2007,15(6):57-59.
[18] GONG C B,JIANG L F,ZHANG Y C,etal.Hazards of aflatoxin in food and its removalmethods.[J].Food Research and Development,2004,52(1):120-123.
[19] LIU Y,HU JH,LIU C C.Toxicity and detection method of aflatoxin[J].Chinese Journal of Bioprocess Engineering,2013,11(3):83-88.
[20] ZHAO F,JIAO Y C,LIAN B,et al.Research progress in determination methods of aflatoxins[J].Guizhou Agricultural Sciences,2006,34(5):123-126.
[21] LEE K M,HERRMAN T J,BISRAT Y,et al.Feasibility of surface-Enhanced Raman Spectroscopy for Rapid Detection of Aflatoxins in Maize[J].JAgric Food Chem,2014,62:4466-4474.
[22] LEE K M,HERRMAN T J,YUN U.Application of Raman spectroscopy for qualitative and quantitative analysis of aflatoxins in ground maize samples[J].Journal of Cereal Science,2014,59:70-78.
[23] WU X M,GAO SM,WANG JS,et al.The surface-enhanced Raman spectra of aflatoxins:spectral analysis,density functional theory calculation,detection and differentiation[J].Analyst,2012,137:4226-4234.
[24] BOJIDARKA I,MICHAEL S.Raman spectroscopic and mass spectrometric determination of aflatoxins[J].Food Anal Methods,2014,7:242-256.
[25] GAO SM,WANG H Y,LIN Y X,et al.Surface-enhanced raman spectra of aflatoxin B1 adsorbed on silver clusters[J]. Acta Phys Chim Sin,2012,28(9):2044-2050.
[26] JAMES J.Deoxynivalenol:mechanisms of action,human exposure,and toxicological relevance[J].Arch Toxicol,2010,84:663-679.
[27] Ministry of Health of the People′s Republic of China.GB16329—1996 National Standard of the People′s Republic of China-Tolerance limits for deoxynivalenol in wheat,wheat flour,corn and corn flour[S].Beijing:Chinese Standards Press,1996.
[28] LIUA Y,DELWICHE SR,DONG Y.Feasibility of FT-Raman spectroscopy for rapid screening for DON toxin in ground wheat and barley[J].Food Additives and Contaminants,2009,26(10):1396-1401.
[29] YANG SY,QIU JF.Research progress of pollution condition and detectingmethods in mycotoxins in the food[J].Modern Preventive Medicine,2012,39(22):5897-5900.
[30] LIFQ,JIR.Ochratoxin A and human health[J].Journal of Hygiene Research,2003,32(2):172-175.
[31] GUO J,RUIY K,JIN Y H.Research on the detriment and the detection of ochratoxin A[J].Letters in Biotechnology,2006,17(5):823-825.
[32] ZHOU C L,XU H X.The application developmentof SELEX and Aptamer inmicromolecules[J].Chinese Frontier Health Quarantine,2011,34(4):276-288.
[33] YANG X H,KONGW J,YANG M H,et al.Application of aptamer identification technology in rapid analysis ofmycotoxins[J].Chinese Journal of Analytical Chemistry,2013,41(2):297-306.
[34] ERDENE-OCHIR GANBOLD,LEE CM,CHO EM,etal.Subnanomolar detection of ochratoxin A using aptamer-attached silver nanoparticles and surfaceenhanced Raman scattering[J].Anal Methods,2014,7(5):25-30.
[35] BETTY C GALARRETA,MOHAMMADALITABATABAEI,VALÉRIEGUIEU,etal.Microfluidic channelwith embedded SERS 2D platform for the aptamer detection of ochratoxin A[J].Anal Bioanal Chem,2013,405:1613-1621.
[36] WANG C N,MA M R.The citrinin ofmonascus[J].China Food Additives,2006,3:107-109.
[37] LIX L,CAO X L,LIAO Y H.Review on the analyticalmethods of citrinin[J].Analytical Instrumentation,2014,1:1-6.
[38] XU G R.Discussion on monascus citrinin[J].Liquor-Making Science&Technology,1999,3:20-22.
[39] DHEERAJK S,ERDENE-OCHIR G,CHO E M,et al.Detection of themycotoxin citrinin using silver substrates and Raman spectroscopy[J].Journal of Hazardous Materials,2014,265:89-95.
[40] PAN D C,LI JG,QIAN G L,et al.Effects of fumonisin and its toxicity[J].Shanghai Journal of Animal Husbandry and Veterinary Medicine,2012,5:56-57.
[41] LEE K M,TIMOTHY JH,CHRISTIAN N,etal.Application of Raman spectroscopy for qualitative and quantitative detection of fumonisins in ground maize samples[J].IJRS,2013,1(1):1-14.
Advances in rapid detection of common m ycotoxins in food based on spectral technology
YUAN Jing,GUO Xiaoyu,YANG Tianxi,WANG Hui,FU Shuyue,LIChuanchuan,SUN Chuanwen(College of Life and Environmental Sciences,Shanghai Normal University,Shanghai200234,China)
Mycotoxins are widely present in foods,espacially in cereals and cereal products.It does serious harms to the safety and health of humans and animals.With the development of chromatographic techniques,immunochemical,spectroscopy,electricity and other areas,themethods to detect the presence ofmycotoxins have been diversified.However,all thesemethods have both advantages and disadvantages under the current situation,as a result,how to detectmycotoxins fastly,sensitively,accurately and conveniently turns out to be highly desirable.This review introduces severalmycotoxins,as well as their limit standards and the present situations ofmycotoxin detection.An optical based technique named Raman and its applications in detecting differentmycotoxin have also been described.
food;mycotoxin;detection;Raman spectral technology
Q 331
A
1000-5137(2015)05-0571-08
(责任编辑:顾浩然)
10.3969/J.ISSN.1000-5137.2015.05.019
2014-08-16
上海师范大学创新团队发展计划(DXL123);主任基金(C-6101-10-038)
孙传文,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:willin@shnu.edu.cn

