蛋白质谷氨酰胺酶产生菌的分离筛选和鉴定
张艳芳,贾彩凤,何 灿,康 立,黄 迪,成 楠,宁显尚,黄 静,金明飞,鲁 伟,步国建,高红亮,*
(1.华东师范大学生命科学学院,上海 200241;2. 泰兴市东圣食品科技有限公司,江苏泰兴 225411)
蛋白质谷氨酰胺酶产生菌的分离筛选和鉴定
张艳芳1,贾彩凤1,何 灿1,康 立1,黄 迪1,成 楠1,宁显尚1,黄 静1,金明飞1,鲁 伟2,步国建2,高红亮1,*
(1.华东师范大学生命科学学院,上海 200241;2. 泰兴市东圣食品科技有限公司,江苏泰兴 225411)
[目的]筛选出能够产生蛋白质谷氨酰胺酶(Protein-glutaminase,PG)的菌株,并对筛选出的菌株分类和鉴定。[方法]以carboxybenzoxy(Cbz)-Gln-Gly为唯一氮源,从来自全国各地采集到的726份土样中富集筛选能够产生蛋白质谷氨酰胺酶的菌株,分别从形态学、生理学和分子生物学方面对所筛选的菌株进行分类鉴定,并测定发酵上清的脱酰胺活性。[结果]共筛选到9株产PG酶的细菌,经鉴定,其中7株为产吲哚金黄杆菌(Chryseobacteriumindologenes),一株为解朊金黄杆菌(Chryseobacteriumproteolyticum),另外一株为粘金黄杆菌(Chryseobacterium.gleum)。[结论]分别发酵测定9株菌的PG酶活性,产吲哚金黄杆菌ZYF120413-7发酵酶活最高,为0.7168U/mL。粘金黄杆菌D4-1-1的产酶能力最低,其酶活为0.1029U/mL。本课题的研究成果扩大了PG酶产生菌株的来源,为后续研究打下了基础。
蛋白质谷氨酰胺酶产生菌,分离筛选,金黄杆菌属,鉴定
天然蛋白质含有较多的谷氨酰胺和天冬酰胺残基,它们会以氢键的形式和其他氨基酸交联,导致蛋白质的溶解性降低,进而影响蛋白的工艺特性,如乳化性、起泡性、凝胶性等[1]。这限制着蛋白质在食品、饮料、保健品、医药领域的很多应用。脱酰胺是解决这一问题的重要途径,研究表明,脱酰胺作用能够改善蛋白质的溶解性和其他功能特性。蛋白质谷氨酰胺酶(Protein-glutaminase,PG),是近年来才被研究的一种新型水解酶,它能够脱去多种蛋白质、多肽或者短肽的氨基[2],将L-β-谷氨酰胺水解成L-谷氨酸和氨,且仅作用于蛋白质或肽的谷氨酰胺基团,而对天冬酰胺残基或游离谷氨酰胺没有影响,同时不会导致蛋白质的交联和水解[3],从而提高蛋白质的溶解度和乳化性等,且该酶在酸性条件下也能起作用,是食品行业中一种非常有前景的酶。2000年Shotaro Yamaguchi 等从解朊金黄杆菌(Chryseobacteriumproteolyticum)9670T中首次发现了PG酶[4],但由于生产菌株的稀少,目前为止,国内外对PG酶的研究主要集中在该酶的结构[5]和应用[6-8]上,而对能够产生PG酶的其他菌株研究甚少,这在一定程度上限制了PG酶的大量应用。因此,研究能够产生PG酶的其他菌种十分必要。
本文诣在筛选能够产生蛋白质谷氨酰胺酶的菌株,并对其进行分类鉴定,为以后提高菌株的产酶活性和在食品工业中的开发应用打下基础。
1 材料与方法
1.1 材料与仪器
实验菌株 9株产蛋白质谷氨酰胺酶的菌株,从采集自全国各地的726份新鲜土样中分离得到。
培养基:a.筛选培养基(1000mL):carboxybenzoxy(Cbz)-Gln-Gly 1g;Glucose 5g;KH2PO40.2g;MgSO4·7H2O 0.2g;NaCl 0.1g;CaCl20.02g;FeSO4·7H2O 0.002g;NaMO4·2H2O 0.005g;NaWO4·4H2O 0.005g;MnSO4·4H2O 0.005g;CuSO4·5H2O 0.1g;pH 8.0。b. PY培养基(1000mL):polypeptone 10g,Yeast Extract 2g,MgSO4·7H2O 1g。调pH至7.0。c. 发酵培养基(1000mL):lactose 5g;polypeptone 10g;Na2HPO4·H2O 1.7g;KH2PO40.25g;MgSO4·7H2O 0.25g;FeSO4·7H2O 0.05g。调节pH至7.2。d. LB培养基,配方略。
药品和试剂:酵母粉,胰蛋白胨 购自oxide;聚蛋白胨 购自Nihon Seiyaku;细菌生理生化鉴定管 购自青岛高科园海博生物技术有限公司(Qingdao Hope Bio-Technology Co.,Ltd);其他试剂均为国产分析纯。
电子天平,酸度计 赛多利斯科学仪器有限公司(北京);全自动高压蒸汽灭菌锅 上海博讯实业有限公司;BCN-1360型生物洁净工作台 北京东联哈尔仪器公司;电热恒温干燥箱,恒温水浴锅,GNP-9160型隔水式恒温培养箱 上海精宏;恒温摇床 上海聚辰科学仪器公司;高速冷冻离心机 Thermo;Hitech反渗透超纯水机 上海和泰仪器有公司;可见分光光度计 北京普析通用仪器有限责任公司。
1.2 土壤样品的采集与处理
土样按照随机、等量、多点混合的原则进行采集,选择五点取样法,用取土铲铲去2~5cm的表层土,每个点取样100g左右,然后将所取的5个点的土样压碎,充分混合均匀,依四分法弃去多余部分,拣去枯枝败叶、石砾等杂质,保留土样50g左右,存放于4℃的冷藏库,用于菌株的筛选来源。
1.3 平板法初步筛选产PG酶的菌株
称取土样10g加入到含有适量玻璃珠和90mL蒸馏水的锥形瓶中,混匀,制备成土壤悬液。取土壤悬液在超净台内静置10min后的上清液,以2%接种量接种于筛选培养基,220r/min 30℃,培养富集6d。之后取富集后的菌悬液在相同条件下再次富集培养3d。将二次富集后的培养液以10倍梯度稀释,涂布于LB固体平板,30℃恒温倒置培养1~2d。用3% KOH溶液喷洒在黄色或橘黄色菌落表面,若菌落变成红色,则再喷洒3% HCl溶液。若菌落又变回黄色或橘黄色,即为疑似菌株,并进行进一步筛选。挑取疑似菌株接种于LB平板,30℃恒温倒置培养1~2d。进行简单染色,观察菌落形态;并进行革兰氏染色和芽孢染色,选取革兰氏阴性,杆状,不产芽孢的菌株,以Cbz-Gln-Gly为底物,测定其发酵上清中的酶活,进行复筛。
1.4 产PG酶菌株的摇瓶复筛
将筛选到的疑似菌株挑取单菌落接种于试管斜面,30℃恒温培养1~2d。从试管斜面上刮下菌体,制备菌悬液,接种于PY培养基,30℃ 200r/min恒温培养12~14h,再以2%接种量接种于发酵培养基,30℃ 200r/min恒温培养10~15h,4℃,10000r/min离心,弃菌体,上清液中蛋白质谷氨酰胺酶活性的测定方法参考GRAS Notice No. GRN 000267(FDA,2008)并稍作改进。即将上清液稀释5倍,取0.1mL的上清稀释液加入到试管中,37℃温浴1min;然后向其中加入已预热的0.01mol/L Cbz-Gln-Gly溶液或1.0% 酪蛋白溶液 1mL,37±0.5℃温浴反应60min。然后加入1mL的三氯乙酸溶液,混合均匀,终止反应。苯酚法测定反应后溶液中氨的含量。A630测定吸光值A1。对照组为先加入三氯乙酸溶液后反应60min后再加入底物溶液。其余操作同实验组。测定A630为A2。规定每分钟产生1μmol氨所需的酶的量为一个酶活单位(1U)。发酵液中酶活计算公式如下:
酶活力(U/mL)=(A1-A2)×2.1/0.1×1/17.03×1/60×a×5
A1:实验组的吸光值;A2:对照组的吸光值;a:苯酚法测定的氨的标准曲线的斜率。
然后选取摇瓶法初筛得到的酶活性较高的菌株进行复筛,重复3次以上。选取酶活性较高且相对稳定的菌株进行形态学、生理学和分子生物学的鉴定。
1.5 菌株形态学鉴定
将筛选到的菌株于LB平板上画线法分离单菌落,观察各菌株的单菌落的状态;并进行革兰氏染色和芽孢染色[9]。
1.6 菌株的生理生化鉴定
取平板上分离的单菌落,参考说明书通过直接接种法或菌悬液法接种于制备好的生理生化管中,根据需要培养相应的时间,观察记录实验结果。
1.7 16S rDNA序列测定及分析
提取所筛选菌株的总基因组DNA,并以此为模版,扩增该菌株的16S rDNA序列,其引物序列为7f(5′-CAGAGTTTGATCCTGGCT-3′),1540r(5′-AGGAGGTGATCCAGCCGCA-3′)。PCR产物经1%琼脂糖凝胶电泳检测后,割胶回收,并送公司测序。测序工作由上海生工生物工程技术服务有限公司完成。将测得的16S rDNA序列提交到GenBank,并在RDP数据库中进行序列匹配,从中得到同源性较高的其他菌株的16S rDNA序列。下载并比对分析这些同源性较高的菌株的16S rDNA序列,连同目的序列在ClustalX1.83软件中进行比对,去除两端冗余序列,保存为.aln格式,然后在MEGA5.1中构建系统发育树,对菌种进行分类。构建系统发育树时选择neighbor-joining tree,设定Bootstrap replication为1000。
2 结果与分析
2.1 土样信息的统计和分析
按照土样的标准采集方法,我们从全国各地共采集到726份土样,这些样品覆盖了中国的25个省、直辖市,其分布情况见图1(A)。其中华东地区包括上海市、山东省、江苏省、安徽省、浙江省、福建省,共采集到275份土样,占全部样本的38%;西南地区(包括重庆市、四川省、贵州省、云南省、西藏自治区)和华中地区(湖北省、湖南省、河南省,江西省)分别采集到177份和108份,分别占样本的24%和15%。采样的地理条件和环境多种多样,如树林、草原、农田、山地、公路边、花园、果园、茶园等,具体分布情况见图1(B)。充足的样本量和各种各样的地理环境为不同微生物的生长和繁殖提供了可能性,为后续筛选产蛋白质谷氨酰胺酶的菌株提供了广泛而充足的来源。

图1 土样的地理分布(A)和采样环境情况(B)Fig.1 The geographical distribution(A) and the environment(B)of soil samples
2.2 产蛋白质谷氨酰胺酶菌株的筛选和分离
以Cbz-Gln-Gly为唯一氮源,经两次富集和平板筛选,我们从726份土样中筛选到168株疑似菌株。这些菌株经纯培养后,发酵测定上清液中的PG酶活性,每个菌株3个平行。其结果见图2(A)。由该图可知,大部分菌株的酶活性都比较低,没有利用价值。而酶活在0.6U/mL以上的菌株有24株,选取这些菌株进行摇瓶复筛,每个菌株3个平行,重复筛选3次。第三次摇瓶复筛的产酶情况见图2(B)。在进行摇瓶复筛时,发现很多菌的产酶能力都有所下降,有些菌株的产酶能力不稳定,而有的菌株退化很快,传到第三代时菌株的产酶能力几乎为零,进行分离纯化复壮之后,酶活力有所提高。我们从中挑选了7株产酶能力较高且相对稳定的菌株(ZYF120413-7、Y8-12-1、D4-19-1、Y6-17-1、CFL-4-40、HC-12、ZYF120111-1)和2株产酶能力不高但很稳定的菌株(ZYF120810-1和D4-1-1)进行鉴定。

图2 产PG酶菌株的摇瓶初筛和复筛Fig.2 The screening of strains producing protein-glutaminase with shake-flask cultureA:平板初筛得到的菌株首次进行摇瓶发酵的产酶情况; B:摇瓶法重复发酵三次后的产酶情况。
2.3 细菌的形态和生理生化特征
将9株筛选到的细菌平板划线法于LB固体培养基上分离单菌落,30℃培养48h,观察菌株在LB平板上的生长状况。这9株菌形成的菌落均呈圆形,边缘整齐,金黄色或橘黄色,不透明,菌落表面湿润光滑,有光泽。进行革兰氏染色和芽孢染色发现,菌株均呈杆状,革兰氏阴性,不产芽孢。其中Y8-12-1的革兰氏染色和芽孢染色结果如图3所示。然后用KOH溶液对菌株产生的色素再次进行鉴定。其中一株菌Y8-12-1的KOH变色反应如图4所示。由图可知,该菌株能够产生典型的黄色色素,且该色素能够与稀碱溶液KOH起反应,而变成橘红色或棕黄色。而用HCl溶液中和后,又变回原来的颜色。能够产生有此性质的不溶性黄色色素是金黄杆菌属细菌的典型特征之一,此外产黄色素的细菌还有假单孢菌属和类黄杆菌属。由此,可初步确定该菌株归属于金黄杆菌属或其相近属。而其他8株菌都有相同的颜色变化。
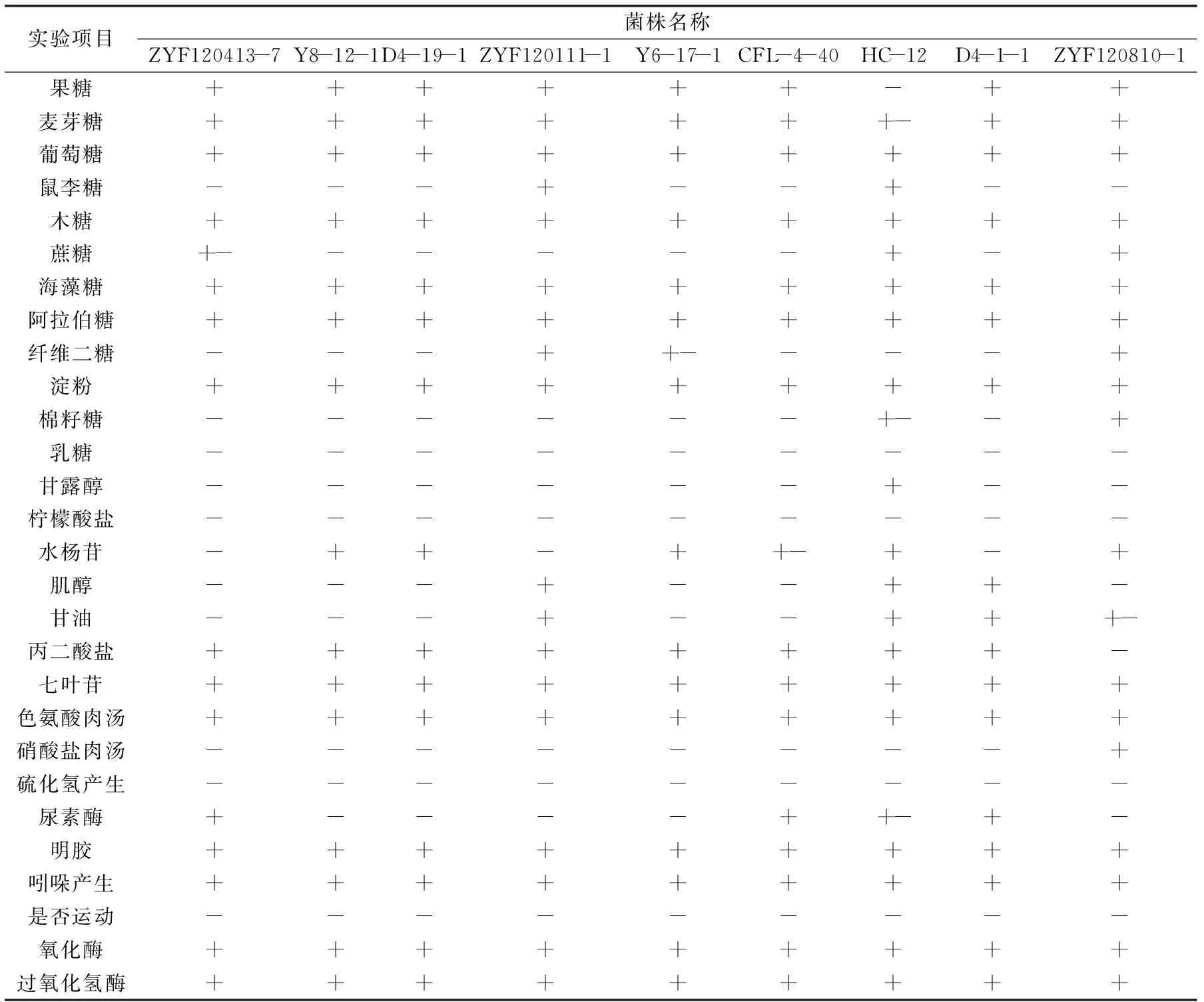
表1 所筛选菌株的生理生化实验结果和比较Table 1 The physiological test results of the isolates and their comparison

图3 Y8-12-1的革兰氏染色和芽孢染色观察Fig.3 The results of Gram’s staining and spore staining of the Y8-12-1A:革兰氏染色图;B:芽孢染色图。

图4 KOH溶液鉴定菌株产生的色素Fig.4 Change in color of ZYF120413-7 by 3% KOH and 3% HClA:KOH溶液作用前;B:KOH溶液作用后; C:HCl溶液中和后。
注:“+”,阳性;“+-”,弱阳性;“-”,阴性。
对所筛选到的菌株进行常规生理生化鉴定,结果如表1所示。所筛选到的菌株氧化酶、过氧化氢酶均呈阳性,可水解淀粉、明胶、七叶苷等,并能利用麦芽糖、葡萄糖、木糖、海藻糖、阿拉伯糖等产酸。其中D4-1-1和ZYF120810-1的生理生化特征和其他7株有较大差异。将菌株的菌落形态、生理生化特征与《常见细菌系统鉴定手册》[10]和《伯杰细菌鉴定手册》[11]中描述进行比对,并查阅相关参考文献,可初步认定所筛选的菌株归属于为金黄杆菌属。
2.4 系统发育树的构建和分析

图5 相邻交联法构建所筛选菌株的系统发育树Fig.5 Neighbour-joining tree of the isolates based on nearly completed 16SrDNA sequences, the scale bar indicates 0. 02 subtitutions per nucleotide position
分别将测序得到的各菌株的16S rDNA碱基全长序列在NCBI GenBank数据库中用Blast软件与已有细菌的16S rDNA序列进行相似性比对,发现ZYF120413-7、Y8-12-1、D4-19-1、Y6-17-1、CFL-4-40、HC-12、ZYF120111-1比对出的序列几乎相同,与之同源性较高的典型菌株为产吲哚金黄杆菌(Chryseobacteriumindologenes)LMG 8337(NR_042507.1)。而与D4-1-1同源性较高的菌株为粘金黄杆菌(Chryseobacteriumgleum)CCUG14555(NR_042506.1),与ZYF120810-1同源性较高的菌株为解朊金黄杆菌(Chryseobacteriumproteolyticum)9670T(AB039830)。然后提交目的序列到RDP数据库中并搜索和其亲缘关系最近的菌株,其数据集选择可培养的典型菌株,可知所筛选菌株的分类学地位均为:Bacteriadomain,Bacteroidetesphylum,Flavobacteriaclass,Flavobacterialesorder,Flavobacteriaceaefamily,Chryseobacteriumgenus。结果如图5。从图中可以看出,菌株ZYF0810-1与Chryseobacteriumproteolyticum的亲缘关系最近,且结点处的数值为100,这表明在1000次的bootstrap运算中,两者聚类到一起的几率为100%。结合菌落形态、生理生化特征和16S rRNA基因序列分析的结果,可以确定菌株ZYF0810-1是解朊金黄杆菌(Chryseobacteriumproteolyticum),命名为解朊金黄杆菌ZYF0810-1(ChryseobacteriumproteolyticumZYF0810-1)。同理,D4-1-1命名为黏金黄杆菌D4-1-1(ChryseobacteriumgleumD4-1-1),其余菌株为产吲哚金黄杆菌(Chryseobacteriumindologenes)。
2.5 所筛选菌株的产酶能力比较和分析
将所筛选到的9株细菌反复发酵,测定上清液中的PG酶对底物Cbz-Gln-Gly的活性,其结果如表2所示。Chryseobacteriumindologenes的产酶能力较高,最高为0.7168U/mL,最低为0.6348U/mL,其平均值为0.6759U/mL,是Shotaro Yamaguchi 在2000年筛选出的菌株Chryseobacteriumproteolyticum9670T的产生的酶活性的2.6倍[4]。而另外两株菌的酶活力较低。
3 结论与讨论
通常去酰基蛋白质因为带负电的基团增多而使等电点降低[12],从而使蛋白质在弱酸性环境下的溶解性增强。一般来说利用酸、碱或机械处理蛋白质可改善蛋白质的溶解性能,但副作用较大,会破坏蛋白质的其他功能[13-14]。所以现在多采用作用条件比较温和的酶来达到改善蛋白质功能的目的。研究表明,蛋白酶可用于蛋白质的脱酰胺作用,从而改善蛋白质的溶解性和其他功能特性,但是蛋白酶容易引起肽链水解,氨基酸消旋等,产生不良的风味[15]。谷氨酰胺转氨酶(transglutaminase,EC 2.3.2.13)是一种从哺乳类到微生物类分布很广泛的酶,该酶催化蛋白质中谷氨酰胺残基的酰基转移反应,许多有机氨类,包括蛋白质中的赖氨酸残基,可以作为酰基受体。当反应体系中没有有机氨时,水可以作为酰基受体,进而导致蛋白质的脱酰胺反应。但是TG酶容易引起蛋白质交联,从而使蛋白质不溶性增加。但若其过量使用,会对食物造成凝聚等现象。肽谷氨酰胺酶(peptidoglutaminase,EC 3.5.1.43/44)也可用于改善蛋白质的功能性质,只对分子量低于5000的多肽的谷氨酰胺酰残基起作用,对高分子量的多肽和蛋白不发挥作用,且脱酰胺程度不高[16]。
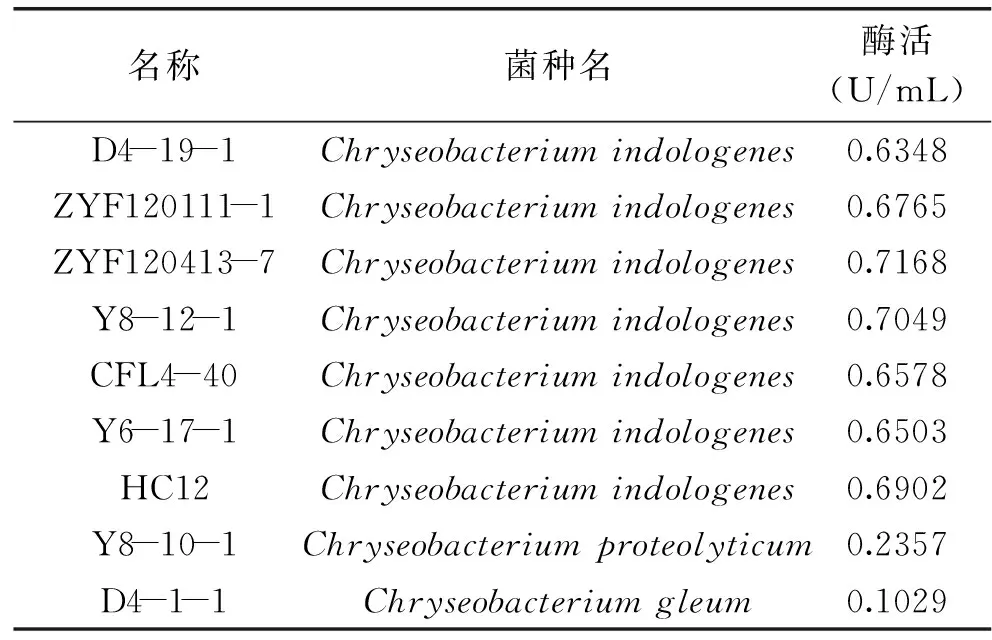
表2 所筛选菌株的产酶能力比较Table 2 The comparison of protein-glutaminase activity of the isolates
蛋白质谷氨酰胺酶(Protein-glutaminase,PG)的脱酰胺作用较好,具有十分广泛的工业应用前景。2000年Shotaro Yamaguchi 等从解朊金黄杆菌(Chryseobacteriumproteolyticum)9670T中首次发现了PG酶[4],随后公布了该酶的基因序列[17];2010年Kumeta H等揭示了PG酶高级结构和作用机理[5],随后各研究小组陆续报导了该酶对小麦蛋白[6]、米谷蛋白[7]、大豆蛋白[18]、玉米蛋白[19]、脱脂牛奶[8]等多种蛋白的影响。2012年汪正华[20]通过重叠延伸PCR法合成了PG酶的全长基因,并对其蛋白进行了重组表达。2013年Noriko Miwa研究了PG酶作用后的乳清分离蛋白构象的改变和它的凝胶性能之间的关系[21],Chun Cui研究了PG酶对小麦蛋白的结构影响[22],而Suppavorasatit则对PG酶处理后的豆浆中蛋白的溶解度和豆浆风味的影响进行了探究[23]。
虽然PG酶的脱酰胺作用较好,但目前国内外对PG酶的研究主要集中在该酶的结构和应用上,而对能够产生PG酶的其他菌株研究甚少,且目前用于工业生产的菌株9670T产酶能力较低,这在一定程度上限制了PG酶的大量应用。因此,研究能够产生PG酶的其他菌种十分必要。
土壤被认为是地球上微生物多样性最丰富的环境,据估算,每克土壤中约含数万个物种,100亿左右微生物,而其中有1%的物种可通过分离培养进行研究[24]。中国地域广阔,地形多样,自然环境复杂,土壤的物质组成、理化过程等更是丰富多样,这为微生物的生长和繁殖提供了各种各样的物理结构与化学营养,因此我国的微生物资源十分丰富。所以我们推测从我国的土壤中应该可以找到PG酶的高产菌株,然后对其进行改造,用于工业生产。
本研究从全国各地采集土样,以Cbz-Gln-Gly为唯一氮源进行富集和筛选能够产生PG酶的菌株。我们从中筛选到9株能够产生PG酶的细菌,并比较了它们形态学、生理学、分子生物学及产酶能力的差异。经鉴定,9株菌均为金黄杆菌属,这一方面与本文的筛选方法有关,但同时也说明金黄杆菌属中能够产生PG酶的菌株较多。9株菌中,其中一株菌Y8-10-1与目前用于工业生产的9670T是同一种,为解朊金黄杆菌(Chryseobacteriumproteolyticum),酶活性也与之相近,为0.2357U/mL。而产吲哚金黄杆菌的PG酶酶活最高为0.7168U/mL,显著高于9670T。
本课题的研究成果扩大了PG酶产生菌株的来源,并给我们一个提示,PG酶的产生菌株可能广泛存在于自然界中,我们可以寻找其他的筛选方法,以得到产酶能力更高,性能更加优良的菌株,为工业生产PG酶打下良好的基础。但是本课题还有很多地方需要深入研究,比如以上菌株产生的PG酶的基因序列,结构酶学性质是否有差异,酶的分离纯化条件还有待于研究,菌株的培养条件等还有待于优化。
[1]Fennema O R. 食品化学[Z]. 北京:中国轻工业出版社,2003316-317.
[2]Yamaguchi S,Jeenes D J,Archer D B. Protein-glutaminase fromChryseobacteriumproteolyticum,an enzyme that deamidates glutaminyl residues in proteins[J]. European Journal of Biochemistry,2001,268(5):1410-1421.
[3]Marcoa C,Rosell C M. Effect of different protein isolates and transglutaminase on rice flour properties[J]. Journal of Food Engineering,2008,84(1):132-139.
[4]Yamaguchi S,Yokoe M. A Novel Protein-Deamidating Enzyme fromChryseobacteriumproteolyticumsp. nov.,a Newly Isolated Bacterium from Soil[J]. Applied and Environmental Microbiology,2000,66(8):3337-3343.
[5]Kumeta H,Miwa N,Ogura K,etal. The NMR structure of protein-glutaminase fromChryseobacteriumproteolyticum[J]. Journal of biomolecular NMR,2010,46(3):251-255.
[6]Yong Y H,Yamaguchi S,Matsumura Y. Effects of enzymatic deamidation by protein-glutaminase on structure and functional properties of wheat gluten[J]. Journal of Agricultural and Food Chemistry,2006,54(16):6034-6040.
[7]Li X H,Zhou X L,Liu Y L,etal. Effects of Glutaminase on the Functional Properties of Rice Glutelin[J]. Food Science,2010,31(17):192-195.
[8]Miwa N,Yokoyama K,Wakabayashi H,etal. Effect of deamidation by protein-glutaminase on physicochemical and functional properties of skim milk[J]. International Dairy Journal,2010,20(6):393-399.
[9]吴坤,张世敏. 微生物学实验技术[M]. 北京:气象出版社,2004,20-25.
[10]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M][G]. 北京:科学出版社,2001:107-113.
[11]Holt J G K N R S. Bergy’s Manual of Deter minative Bacteriology(9th)[G]. London:William &Wilkins Press,1994:259-271.
[12]Hamada J S. Effects of heat and proteolysis on deamidation of food proteins using peptidoglutaminase[J]. Journal of Agricultural and Food Chemistry,1992,40(5):719-723.
[13]Shih F F. Deamidation studies on selected food proteins[J]. Journal of the American Oil Chemists’ Society,1990,67(10):675-677.
[14]Schwenke K D. Enzyme and chemical modification of proteins[J]. Food Science and Technology-New York-Marcel Dekkep-,1997:393-424.
[15]Tomotake H,Shimaoka I,Kayashita J,etal. Physicochemical and functional properties of buckwheat protein product[J]. Journal of Agricultural and Food Chemistry,2002,50(7):2125-2129.
[16]Kikuchi M,Hayashida H,Nakano E,etal. Peptidoglutaminase. Enzymes for selective deamidation of γ-amide of peptide-bound glutamine[J]. Biochemistry,1971,10(7):1222-1229.
[17]Yamaguchi S,Jeenes D J,Archer D B. Protein-glutaminase fromChryseobacteriumproteolyticum,an enzyme that deamidates glutaminyl residues in proteins[J]. European Journal of Biochemistry,2001,268(5):1410-1421.
[18]Li D,Zhao X. Limited Deamidation of Soybean Protein Isolates by Glutaminase and its Impacts on the Selected Properties[J]. International Journal of Food Properties,2012,15(3):638-655.
[19]Yong Y H,Yamaguchi S,Gu Y S,etal. Effects of enzymatic deamidation by protein-glutaminase on structure and functional properties of α-zein[J]. Journal of Agricultural and Food Chemistry,2004,52(23):7094-7100.
[20]汪正华,朱蓓霖,赵云,等. 蛋白质谷氨酰胺酶基因的合成表达及性质研究[J]. 中国生物工程杂志,2012,32(11):55-60.
[21]Miwa N,Yokoyama K,Nio N,etal. Effect of Enzymatic Deamidation on the Heat-induced Conformational Changes in Whey Protein Isolate and Its Relation to Gel Properties[J]. Journal of Agricultural and Food Chemistry,2013,61(9):2205-2212.
[22]Cui C,Hu Q,Ren J,etal. Effect of the structural features of hydrochloric acid-deamidated wheat gluten on its susceptibility to enzymatic hydrolysis[J]. Journal of Agricultural and Food Chemistry,2013,61(24):5706-5714.
[23]Suppavorasatit I,Lee S Y,Cadwallader K R. Effect of Enzymatic Protein Deamidation on Protein Solubility and Flavor Binding Properties of Soymilk[J]. Journal of Food Science,2013,78(1):C1-C7.
[24]宋长青,吴金水,陆雅海,等. 中国土壤微生物学研究 10 年回顾[J]. 地球科学进展,2013,28(10):1087-1105.
Isolation and identification of nine bacteria strains producing Protein-glutaminase
ZHANG Yan-fang1,JIA Cai-feng1,HE Can1,KANG Li1,HUANG Di1,CHENG Nan1,NING Xian-shang1,HUANG Jing1,JIN Ming-fei1,LU Wei2,BU Guo-jian2,GAO Hong-liang1,*
(1. College of Life Science,East China Normal University Shanghai 200241,China;2.Taixing Dongsheng Food Science and Technology co.,LTD,Taixing 225411,China)
[Objective]Isolating and screening the strains producing Protein-glutaminase and then making Identification of them.[Methods]726 soil samples from all over the country were collected,from which the strains producing Protein-glutaminase were enriched with Cbz-Gln-Gly as the sole nitrogen source by preliminary screening in plates. Then the isolates were identified in morphology,physiology and molecular biology. The enzyme activity of deamidation was also been detected.[Results]Totally 9 strains that could produce PG were isolated,of which 7 bacteria were identified asChryseobacteriumindologenes,one was identified asChryseobacteriumproteolyticumand another was identified asChryseobacterium.gleum.[Conclusions]The 9 strains were fermented in aerobic,and the PG activity in fermentation supernatant was tested. The results shown thatChryseobacteriumindologenesZYF120413-7 had the highest enzyme activity with 0.7168U/mL.Chryseobacterium.gleumcame the lowest with only 0.1029U/mL. This study enlarged the source of the PG producing strains,lying a good foundation for the following research.
strain of producing protein-glutaminase;screening and isolation;Chryseobacteriumgenus;identification
2014-03-05
张艳芳(1987-),女,硕士研究生,研究方向:食品微生物学及应用。
*通讯作者:高红亮(1973-),男,博士,副教授,研究方向:微生物谷氨酰胺转氨酶,蛋白质谷氨酰胺酶,丙酸杆菌细菌素和大豆多糖的工业化生产及应用等。
质检公益性行业科研专项项目(201310255)。
TS
A
1002-0306(2015)01-0170-07
10.13386/j.issn1002-0306.2015.01.027

