藏茜草不同溶剂提取物的抗氧化活性研究
景临林,马慧萍,范小飞,2,杨贝贝,彭晓霞,贾正平,*
(1.兰州军区兰州总医院药剂科,甘肃兰州 730050;2.兰州大学药学院,甘肃兰州 730000;3.甘肃中医学院,甘肃兰州 730000)
藏茜草不同溶剂提取物的抗氧化活性研究
景临林1,马慧萍1,范小飞1,2,杨贝贝3,彭晓霞3,贾正平1,*
(1.兰州军区兰州总医院药剂科,甘肃兰州 730050;2.兰州大学药学院,甘肃兰州 730000;3.甘肃中医学院,甘肃兰州 730000)
采用DPPH自由基清除法、ABTS自由基清除法、羟自由基清除法、超氧阴离子清除法、还原力测定法和螯合力测定法六种抗氧化模型对藏茜草95%乙醇提取物以及石油醚相,乙酸乙酯相,正丁醇相和水相等4个不同极性部位的抗氧化活性进行评价,同时分析抗氧化活性与总酚和总黄酮含量的关系。研究结果表明,除水提部位外,藏茜草其它4个极性部位提取物均表现出一定的抗氧化活性,其抗氧化活性与多酚和总黄酮含量呈显著相关。其中,乙酸乙酯部位总黄酮和总多酚含量最高,抗氧化活性也最强,其总黄酮和总多酚含量分别为(232.03±1.74)mg芦丁当量/g提取物和(173.53±1.75)mg 没食子酸当量/g 提取物,其清除DPPH自由基、超氧阴离子、羟自由基和ABTS自由基的EC50分别为0.06±0.01、0.17±0.01、(0.24±0.02)mg/mL和(1.75±0.23)μg/mL,对金属离子螯合力的EC50为(0.11±0.01)mg/mL。藏茜草的乙酸乙酯极性部位具有显著的抗氧化活性,是天然抗氧化活性化合物的良好来源。
藏茜草,抗氧化活性,总黄酮,总多酚
活性氧(ROS)是细胞有氧代谢过程中的产物,其在低浓度时参与机体的免疫过程,抵御外界刺激对机体的损害。但是过量ROS会诱导脂质过氧化,破坏核酸、蛋白质、DNA等生物大分子,导致细胞衰老或死亡[1]。研究表明:心脑血管疾病、神经退行性疾病、癌症和衰老的发生发展都有ROS代谢异常有关[2]。合理补充抗氧化剂能够保护机体免受ROS诱导的氧化应激损伤,延缓人体衰老,增强人体免疫能力,对多种疾病具有预防作用[3]。人工合成抗氧化剂,如丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)等,虽有一定抗氧化作用,但是可能会引起肝脏损伤,甚至诱导癌症的发生[4]。因此,从食用及药用植物中寻找广谱、低毒、安全、有效的天然抗氧化剂已成为抗氧化剂发展的必然趋势。
藏茜草是一种传统藏药,藏药名:佐,以茜草科植物西藏茜草(RubiatibeticaHook. F)的干燥根及根茎入药,具有清热凉血等功效,主治血病、扩散伤热、肺肾热邪和大小肠热[5]。藏茜草生长于海拔3600m处河滩砾石上,主要产自西藏阿里札达,通过千百万年的进化选择,适应了高原缺氧、寒冷干燥的气候环境,体内含有的特殊产物可能具有很好的抗氧化活性,但是关于藏茜草抗氧化研究未见报道。本文采用DPPH、ABTS、羟自由基、超氧阴离子、还原力和螯合力六种体外抗氧化模型对藏茜草95%乙醇提取物以及石油醚相,乙酸乙酯相,正丁醇相和水相等4个极性部位的抗氧化活性进行研究,并测定其总多酚和总黄酮含量,进行相关性分析,为藏茜草资源开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
藏茜草 购自青海西宁三江宝商贸有限公司,并经兰州大学药学院生药研究所杨永健教授鉴定为西藏茜草(RubiatibeticaHook. F)。
1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、菲啰嗪(Ferrozine) sigma公司;还原型辅酶I(NADH)、吩嗪硫酸甲酯(PMS)、抗坏血酸(VC)、钼酸铵、硫代巴比妥酸(TBA) 阿拉丁试剂公司;芦丁标准品、水杨酸标准品 中国食品药品检定研究院;钨酸钠、钼酸钠、亚硝酸钠、硝酸铝、氢氧化钠、过硫酸钾磷酸钠、磷酸二氢钠、磷酸氢二钠、三氯乙酸(TCA)、硫酸、盐酸等均为市售分析纯试剂。
DJ-04B小型中药粉碎机 上海鼎广机械设备有限公司;Spectramax i3多功能酶标仪 Molecular Devices公司;RE52CS型旋转蒸发仪 上海亚荣生化仪器厂;AE204型电子天平 梅特勒-托利多仪器有限公司;SK3300L超声清洗器 上海精密仪器仪表有限公司;UV2800SPC紫外可见分光光度计 上海舜宇恒平科学仪器有限公司。
1.2 实验方法
1.2.1 提取方法 藏茜草的提取按照文献方法[6]进行,具体步骤为:干药材用粉碎机粉碎,准确称量100g药材粉末,用500mL 95%乙醇浸泡12h,超声提取30min,再回流提取2h,重复提取两次,趁热过滤,合并滤液,减压浓缩得到浅棕色浸膏,为藏茜草95%醇提部位(15.61g)。提取物加5倍量的蒸馏水超声30min后得到悬浮液,将其移置500mL分液漏斗中,依次用等体积的石油醚、乙酸乙酯、正丁醇分别萃取3次,合并各自萃取液并保留水相,减压除去溶剂后,真空干燥至恒重,得到不同溶剂萃取物,分别为石油醚部位(0.77g),乙酸乙酯部位(4.18g),正丁醇部位(3.50g)和水提部位(3.16g)。
1.2.2 抗氧化活性的测定
1.2.2.1 DPPH自由基清除实验 不同质量浓度(0.1~0.4mg/mL)的样品和VC溶液125μL,分别加入125μL 0.1mmol/L DPPH 95%乙醇溶液中,暗处室温反应30min,以95%乙醇溶剂做空白对照,测量其在波长517nm 处的吸光度(Ai)。测定125μL DPPH 95%乙醇溶液与125μL 95%乙醇混合后在波长517nm 处的吸光度(A0);测定125μL 95%乙醇溶液与125μL样品溶液在波长517nm处的吸光度(Aj)[7]。按式(1)计算其清除率,并计算其EC50。
清除率(%)=(1-(Ai-Aj)/A0)×100
式(1)
1.2.2.2 ABTS+·清除实验 将等体积的7mmol/L ABTS 溶液与2.45mmol/L过硫酸钾混合使之反应并置于暗处12~16h,制备ABTS+·。用95%乙醇将ABTS+·溶液稀释至其在波长734nm处吸光度为0.70±0.02。将100μL不同质量浓度(0. 025~0.4mg/mL)样品和VC溶液加入3.9mL ABTS+·溶液中,室温放置10min,测量其在波长734nm处的吸光度(Ai)。测定3.9mL ABTS+·溶液与100μL 95%乙醇混合后在波长734nm处的吸光度(A0);测定3.9mL 95%乙醇溶液与100μL样品溶液在波长734nm处的吸光度(Aj)[8]。按式(1)计算其清除率,并计算其EC50。
1.2.2.3 超氧阴离子自由基清除实验 不同质量浓度(0.2~1.6mg/mL)的样品和VC溶液100μL,依次加入50μL 500μmol/L的NADH(溶解于0.2mol/L 磷酸盐缓冲液,pH7.4)、50μL 200μmol/L的NBT和50μL 20μmol/L的PMS。置于25℃条件下反应8min,测量其在波长560nm 处的吸光度(Ai)。测定50μL NADH、50μL NBT和50μL PMS与100μL 95%乙醇混合后在波长560nm处的吸光度(A0);测定50μL NADH、50μL NBT和50μL 水与100μL样品溶液在波长560nm处的吸光度(Aj)[9]。按式(1)计算其清除率,并计算其EC50。
1.2.2.4 羟自由基清除实验 不同质量浓度(0.0625~1.0mg/mL)样品和VC溶液500μL,依次加入28mmol/L脱氧核糖(溶于pH7.0的0.2mmol PBS 磷酸缓冲液)中50μL、1mmol/L的EDTA 50μL、1mmol/L的氯化亚铁50μL和1mmol/L的H2O250μL,最后加入1mmol/L的抗坏血酸50μL启动反应,37℃水浴孵育1h,加入10%三氯乙酸250μL终止反应,再加入0.5% TBA(溶于25mmol/L的NaOH溶液),105℃孵育0.5h,于532nm处测得吸光度(Ai),用500μL蒸馏水代替样品溶液,测得吸光度(A0),用PBS代替脱氧核糖测得吸光度(Aj)[10]。按式(1)计算其清除率,并计算其EC50。
1.2.2.5 金属离子螯合能力实验 不同质量浓度(0.03125~0.5mg/mL)的样品和EDTA溶液1mL,加入1mmol/L 的FeCl2·4H2O 50μL和5mmol/L Ferrozine 40μL,振荡混匀。37℃孵育10min后,测定波长562nm处吸光度(Ai)。用水代替Ferrozine时测得吸光度(Aj),用95%乙醇代替样品溶液时测得吸光度(A0)[11]。按式(1)计算其螯合率,并计算其EC50。
1.2.2.6 还原力测定实验 不同质量浓度(0.1~0.5mg/mL)的样品和VC溶液1.0mL,加入0.2moL/L的磷酸盐缓冲液(pH6.6)2.5mL和1%的铁氰化钾溶液2.5mL,50℃水浴孵育20min,快速冷却,然后加入2.5mL 10%(w/v)三氯乙酸溶液,混合溶液3000r/min离心10min,精密吸取上清液2.5mL,加入2.5mL蒸馏水和0.5mL 0.1%的三氯化铁溶液,在700nm处测吸光度A,吸光度值越大,还原力越强[12]。
1.2.3 含量测定
1.2.3.1 总黄酮含量测定 将0.5mL不同质量浓度的芦丁标准品溶液(0~140μg/mL)置于2mL离心管中,加入5% NaNO2溶液50μL,摇匀,静置 6min,加入10% Al(NO3)3溶液50μL,摇匀,静置 6min,最后加入的1mol/L NaOH溶液250μL,摇匀,静置15min,510nm波长处测吸光值,重复三次,取平均值。以芦丁的质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。根据芦丁标准曲线,按照相同方法求得各样品中总黄酮含量[13]。
1.2.3.2 总酚含量的测定 将0.1mL不同质量浓度的没食子酸标准品溶液(0~140μg/mL)置于4mL离心管中,加入1mL Folin-Ciocalteu试剂,振荡5min后加入1mL 7% Na2CO3溶液充分混匀,室温放置5h,760nm波长处测吸光值,重复三次,取平均值。以没食子酸的质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。根据没食子酸标准曲线按照相同方法求得各样品中总酚含量[14]。
1.3 数据处理
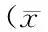
2 结果与分析
2.1 藏茜草不同极性部位对DPPH自由基的清除作用

图1 藏茜草不同极性部位对DPPH自由基的清除率Fig.1 DPPH radical scavenging activity of different extract from R tibetica Hook. F
由图1和表1可知,不同极性部位对DPPH自由基清除能力存在显著差异,且在0.0125~0.2mg/mL终浓度范围内呈明显的量效关系。其中,乙酸乙酯部位的EC50为(0.06±0.01)mg/mL,随显著高于VC的EC50(0.013±0.002)mg/mL,但仍然表现出较高的自由基清除能力。正丁醇部位和95%醇提部位清除DPPH自由基能力相当,且活性较小,而水提部位对DPPH自由基几乎没有清除作用。
2.2 藏茜草不同极性部位对ABTS自由基的清除作用
由图2和表1可知,除水提部位外,其它四个极性部位对ABTS+·均表现出一定的清除能力,且有明显的量效关系。其中乙酸乙酯部位对ABTS+·清除能力最强,在质量终浓度10μg/mL时,清除率可达97.89%。不同极性部位清除ABTS+·自由基的能力顺序为:乙酸乙酯部位>石油醚部位>95%醇提部位>正丁醇部位>水提部位。

图2 藏茜草不同极性部位对ABTS自由基的清除率Fig.2 ABTS radical scavenging activity of different extract from R tibetica Hook. F
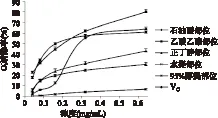
图3 藏茜草不同极性部位对·的清除率Fig.3 Superoxide radical scavenging activity of different extract from R tibetica Hook. F


表1 藏茜草不同极性部位对5种抗氧化评价方法的清除率EC50Table 1 The EC50of different extracts from R tibetica Hook. F by five antioxidant assays
2.4 藏茜草不同极性部位对羟自由基(OH·)清除作用
Fenton反应产生的羟自由基能将脱氧核糖降解为丙二醛,丙二醛与硫代巴比妥酸反应生成的红色物质在532nm处有最大吸收,通过检测吸光度值的变化可以反映羟自由基清除能力。从图4和表1可知,在测试浓度范围内,藏茜草不同极性部位清除羟基自由基的能力随样品浓度增大而逐渐增强,但均弱于VC。各极性部位对羟基自由基的清除能力的顺序为正丁醇部位>95%醇提部位>乙酸乙酯部位>石油醚部位>水提部位

图4 藏茜草不同极性部位对OH·的清除率Fig.4 Hydroxyl radical scavenging activity of different extract from R tibetica Hook. F
2.5 藏茜草不同极性部位对金属的螯合能力测定
测定亚铁离子螯合能力的大小是评价氧化剂抗氧化性能常用的方法之一,金属离子螯合后可降低其在自由基氧化过程中催化作用,减少自由基生成。螯合能力越强被评价的抗氧化剂潜在的抗氧化性就愈强。Ferrozine能够与Fe2+形成紫红色的螯合物,当其他有竞争力的螯合剂存在时,紫红色会变浅。通过螯合物颜色的变化,可以评价物质对Fe2+的螯合能力。图5和表1所示的结果表明,EDTA具有极强的金属螯合活性;除水提部位外,藏茜草不同极性部位均具有很强的螯合作用,在低浓度(0.125mg/mL)时,各极性部位对Fe2+的螯合率顺序为乙酸乙酯部位>正丁醇部位>石油醚部位>95%醇提部位,但是在高浓度(0.5mg/mL)时,各极性部位对Fe2+的螯合率差别不大,分别为95%醇提部位(89.36%)、正丁醇部位(86.12%)、乙酸乙酯部位(81.13%)、石油醚部位(75.58%)。

图5 藏茜草不同极性部位对金属离子的螯合率Fig.5 Chelating ability of different extract from R tibetica Hook. F
2.6 藏茜草不同极性部位的还原力测定
物质的还原能力与其抗氧化活性之间有一定的相关性,铁氰化钾被抗氧化物质还原成亚铁氰化钾,亚铁氰化钾与三价铁离子反应,生成的普鲁士蓝在700nm有最大吸收峰。吸光度越大,还原能力越强。从图6可以看出:乙酸乙酯部位还原能力最强,石油醚部位、正丁醇部位和95%醇提部位的还原能力相当,表现出弱的还原力,而水提部位几乎没有还原能力。

图6 藏茜草不同极性部位的还原力Fig.6 Reduce power of different extract from R tibetica Hook. F
2.7 藏茜草不同极性部位总黄酮含量测定
样品中的总黄酮含量由芦丁标准曲线:Y=6.9399X-0.0023(R2=0.9998)换算得来,各极性部位的总黄酮含量如表2所示:乙酸乙酯部位中总黄酮含量最高,为(232.03±1.74)mg芦丁当量/g提取物,水提部位的含量最低,仅(1.87±0.11)mg芦丁当量/g提取物;石油醚部位中总黄酮含量较多,为(84.59±1.26)mg芦丁当量/g提取物,然后依次是正丁醇部位和95%醇提部位,分别是(63.96±0.77)和(48.78±1.40)mg芦丁当量/g提取物。
2.8 藏茜草不同极性部位总多酚含量测定
样品中的多酚含量由没食子酸标准曲线:Y=5.8343X+0.0086(R2=0.9988)换算得来,各提取部位的多酚含量如表2所示:乙酸乙酯部位中总多酚含量最高,为(173.53±1.75)mg 没食子酸当量/g提取物,然后依次是石油醚部位、正丁醇部位和95%醇提部位,分别是42.29±0.89、39.89±1.03、(36.29±0.72)mg没食子酸当量/g提取物。水提部位多酚含量最低,仅为(3.25±1.04)mg没食子酸当量/g提取物。
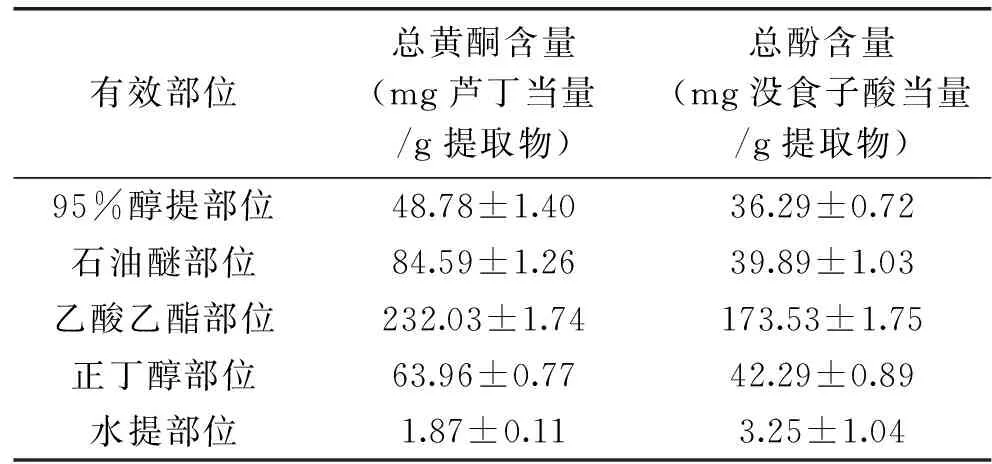
表2 藏茜草不同极性部位中总黄酮和总酚含量测定Table 2 Total flavonoid and phenolic content in different extracts from R tibetica Hook. F
2.9 抗氧化活性间相关性分析

表3 藏茜草抗氧化活性测定方法间相关系数(r)Table 3 Correlation coefficient(r) of five models of antioxidant activity
注:*表示在0.05水平上显著相关,**表示在0.01水平上显著相关;表4同。
2.10 多酚、黄酮含量与抗氧化活性相关性分析
研究表明:植物的抗氧化活性与其多酚和黄酮含量有密切相关[15],通过对藏茜草不同极性部位的总多酚和总黄酮含量进行测定和相关性分析,通过统计学分析藏茜草产生抗氧化活性的物质基础,为进一步提取分离有效成分提供依据。

表4 藏茜草抗氧化活性与其总黄酮含量 和多酚含量的相关系数(r)Table 4 Correlations between the antioxidant activity and total phenolics and flavonoids content of R tibetica Hook F
3 结论

[1]Circu M L,Aw T Y. Reactive oxygen species,cellular redox systems,and apoptosis[J]. Free Radic Biol Med,2010,48:749-762.
[2]Halliwell B,Gutteridge J M. Role of free radicals and catalytic metal ions In human disease:an overview[J]. Methods Enzymol,1990,186:1-85.
[3]Gordon M H. Significance of dietary antioxidants for health[J].Int J Mol Sci,2012,13:173-179.
[4]Grice H C. Safety evaluation of butylated hydroxyanisole from the perspective of effects on forestomach and oesophageal squamous epithelium[J]. Food Chem Toxicol,1988,26:717-723.
[5]才让草.十种中藏药的辨析[J].中国民族民间医药,2011,22:5.
[6]马合木提·买买提明,赛力慢·哈得尔,玛尔哈巴·吾斯满. 芜菁籽不同溶剂提取物体外抗氧化活性研究[J]. 化学研究与应用,2013,6:829-833.
[7]Blois M S. Antioxidant determinations by the use of a stable free radical[J]. Nature,1958,26:1199-1200.
[8]Re R,Pellegrini N,Proteggente A,etal. Rice-Evans C:Antioxidant activity applying an improved ABTS radical cation decolourisation assay[J]. Free Rad Biol Med,1999,26:1231-1237.
[9]Shukla S1,Mehta A,Mehta P,etal. Antioxidant ability and total phenolic content of aqueous leaf extract of Stevia rebaudiana Bert[J]. Exp Toxicol Pathol,2012,64(7-8):807-811.
[10]Halliwell B,Gutteridge J M C,Amoma O L. The deoxyribose method:a simple test tube assay for the determination of rate constant for reaction of hydroxyl radical[J]. Anal Bio chem,1987,165:215-9.
[11]Dinis T C P,Madeira V M C,Almeida L M. Action of phenolic derivates(acetoaminophen,salycilate and 5-aminosalycilate)as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers[J]. Archives of Biochemistry and Biophysics,1994,315:161-169.
[12]Gulcin I,Sat I G,Beydemir S,etal. Comparison of antioxidant activity of clove(Eugenia caryophylata Thunb)buds and lavender(LavandulastoechasL.)[J]. Food Chemistry,2004,87(3):393-400.
[13]Athukorala Y,Jeon Y,Kim K. Antiproliferative and antioxidant properties of an enzymatic hydrolysate from brown alga,Eckloniacava[J]. Food and Chemical Toxicology,2006,44:1065-1074.
[14]Silva J K,Cazarin C B B,Colomeu T C,etal. Antioxidant activity of aqueous extract of passion fruit(Passiflora edulis)leaves:Invitroandinvivostudy[J]. Food Research International. 2013,53(2):882-890.
[15]Riceevans C A,Miller N J,Paganga G. Structure-antioxidant activity relationships of flavonoids and phenolic acids[J]. Free Radical Biology and Medicine,1996,20(7):933-956.
Study on the antioxidant activity of different extracts fromRubiatibeticaHook. F.
JING Lin-lin1,MA Hui-ping1,FAN Xiao-fei1,2,YANG Bei-bei3,PENG Xiao-xia3,JIA Zheng-ping1,*
(1. Department of Pharmacy,Lanzhou General Hospital,Lanzhou Command of CPLA,Lanzhou 730050,China;2.Department of Medicinal Chemistry,Lanzhou University,Lanzhou 730000, China;3.Gansu college of Traditional Chinese Medicine,Lanzhou 730000,China)
The present study was carried out to evaluate the antioxidant capacity of the 95% ethanol crude extracts and their four solvent fractions(petroleum ether,ethyl acetate,normal butyl alcohol and aqueous)ofRubiatibeticaHook. F. The extracts of theRubiatibeticaHook. F. were evaluated for their total phenols,total flavonoids and antioxidant activity(DPPH radical,ABTS radical,hydroxyl radical,superoxide scavenging effect,reducing power and ferrous ions chelating activities). The relationship between the antioxidant activity and the content of total phenolics and total flavonoids was analysed. The results showed that all the fraction except water fraction had great antioxidant activity and the content of total phenolics and total flavonoids had a highly significant correlation with the activity. The ethyl acetate fraction was the most effective fraction with the highest content of total phenolics and total flavonoids and the content of them were(232.03±1.74)mg rutin equivalent/g extract and(173.53±1.75)gallic acid equivalent mg/g extract,respectively. The EC50values of ethyl acetate fraction based on DPPH,superoxide,hydroxyl radical and ABTS was 0.06±0.01,0.17±0.01,(0.24±0.02)mg/mL and(1.75±0.23)μg/mL. The EC50of ethyl acetate fraction on ferrous ions chelating activities was(0.11±0.01)mg/mL. Ethyl acetate fraction ofRubiatibeticaHook. F,a strong ability to act as antioxidant,may be considered as a natural source of active compounds.
RubiatibeticaHook. F;antioxidant activity;total flavonoids;total phenolics
2014-03-18
景临林(1982-),男,博士,研究方向:天然产物化学。
国家自然科学基金项目(81202458);全军医药科研“十二五”面上项目(CLZ12JA04);中国博士后科学基金(2012M521926)。
TS255.1
A
1002-0306(2015)01-0091-06
10.13386/j.issn1002-0306.2015.01.011

