离子交换法分离发酵液中ε-聚L-赖氨酸
刘延岭,邓 林
(四川工商职业技术学院,四川都江堰 611830)
离子交换法分离发酵液中ε-聚L-赖氨酸
刘延岭,邓 林
(四川工商职业技术学院,四川都江堰 611830)
研究了ε-聚L-赖氨酸发酵液前处理的工艺条件。以蛋白质和ε-聚L-赖氨酸浓度为指标,分别使用5mol/L氢氧化钠于pH8.5沉淀蛋白质和5ku的聚砜超滤膜进行超滤,达到了良好的去除杂蛋白的效果。同时探讨了离子交换法分离发酵液中ε-聚L-赖氨酸的工艺。以ε-聚L-赖氨酸吸附量为指标,采用静态吸附法选择合适的树脂:弱酸型HD-2阳离子交换树脂,其最大吸附量可达到28.8mg/g。
离子交换法,分离,ε-聚L-赖氨酸
离子交换法是根据发酵产物的酸碱度、极性和分子大小而进行的分离纯化技术。在发酵工业中,蛋白质、氨基酸、核酸、酶及抗生素等常用离子交换树脂法进行分离提纯[1]。离子交换法具有成本低、操作方便、提取率高、设备简单等优点。
ε-聚L-赖氨酸(ε-Poly-L-lysine)是由L-赖氨酸的ε-氨基和另一个赖氨酸的α-羧基之间形成的ε-酰胺键连接而形成的一种氨基酸同型化合物[2],可由微生物发酵产生的[3-6]。由于ε-聚L-赖氨酸具有广谱抗菌性,对革兰氏阳性菌、革兰氏阴性菌、酵母菌、霉菌均有很好的抑菌效果,目前已广泛应用到食品工业的各个领域,如用于面包点心、奶制品、肉制品、冷藏食品和袋装食品等[7]。
基于ε-聚L-赖氨酸优良的防腐性能及其广泛的应用前景,近年来其发酵生产和提取工艺成为了国内外研究的热点。在前期的实验中,已分离筛选出一株生产菌株[8]。本实验主要针对发酵液中ε-聚L-赖氨酸的提取进行研究。探索了发酵液预处理的工艺,并考察不同离子交换树脂对发酵液中ε-聚L-赖氨酸的吸附和解吸性能,确定适用于分离提纯ε-聚L-赖氨酸的树脂类型,以期为ε-聚L-赖氨酸的工业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
ε-聚L-赖氨酸生产菌株白色链霉菌(Streptomyces albus) 四川省食品发酵工业研究设计院筛选保藏;种子培养基 葡萄糖30g/L、酵母膏5g/L、硫酸铵1g/L、磷酸二氢钾1.2g/L、磷酸氢二钾1.2g/L、硫酸镁0.03g/L、硫酸亚铁0.01g/L、pH6.8;发酵培养基 葡萄糖40g/L、酵母膏8g/L、硫酸铵1.2g/L、磷酸二氢钾1.5g/L、磷酸氢二钾1.5g/L、硫酸镁0.05g/L、pH6.8;ε-聚L-赖氨酸标准品 Sigma公司;考马斯亮蓝G-250 北京西美杰科技有限公司;所用其他试剂均为国产分析纯;实验使用的三种树脂分别为强酸型阳离子交换树脂苯乙烯系列734#、弱酸型阳离子交换树脂丙烯酸系列HD-2和D152,其基本性状见表1。

表1 3种树脂的基本性状Table 1 Basic properties of three types of ion exchange resins
T6紫外可见分光光度计 北京普析通用仪器有限责任公司;KH30RF高速冷冻离心机 凯达科学仪器有限公司;卷式膜超滤小型实验机 济南博纳生物技术有限公司;3200P pH测量仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 发酵种子液的制备 用接种环挑取一环新鲜培养的孢子,接种到种子培养基中,30℃,180r/min摇床发酵培养36h。
1.2.2 发酵液的制备 将种子培养液按3%接种量接种于发酵培养基中,30℃,180r/min摇床发酵培养72h[9]。
1.2.3 发酵液预处理工艺的选择 根据刘洁萍[9-12]等人的实验,从发酵液中分离ε-聚L-赖氨酸时预处理去除杂蛋白有三种方法:滤纸过滤、调节pH和超滤膜过滤。综合三种方法,本实验采用先调节pH再超滤的方法对发酵液进行预处理。
将发酵液于5000r/min条件下离心15min,收集上清液,向上清液中加入5%三氯乙酸或5mol/L氢氧化钠后,调节pH为3、5、6、7、8、9、10。调节上清液pH后,溶液中立即产生大量白色絮状沉淀。静置30min,2000r/min进行离心,分别测定离心液中蛋白质浓度和ε-聚L-赖氨酸浓度,以确定发酵液预处理时最佳pH。
1.2.4 发酵液蛋白质含量的测定 按照考马斯亮蓝G-250染色法进行测定。
1.2.5 ε-聚L-赖氨酸含量的测定 使用改进的Itzhaki方法进行测定[13]。
1.2.5.1 标准曲线的制作 取0.2mL ε-聚L-赖氨酸浓度为0~0.12g/L的标准液与0.5mL 500μmol/L甲基橙溶液混合,30℃振荡反应30min,4000r/min离心15min,将上清液用0.05mmol/L磷酸钾缓冲液(pH7.0)稀释10倍,于464nm处测定吸光度,以磷酸钾缓冲液与甲基橙反应为空白对照。
1.2.5.2 ε-聚L-赖氨酸含量的测定 取发酵上清液2mL与0.5mL 500μmol/L甲基橙溶液混合,30℃下振荡30min,4000r/min离心15min,将上清液用0.05mmol/L磷酸钾缓冲液(pH7.0)稀释10倍后于464nm处测吸光度。
1.2.6 树脂静态吸附及解吸性能测定 称取按说明书预处理后的三种不同类型的湿树脂各5g,置于250mL磨口锥形瓶中,加入预处理后的发酵液200mL,25℃振荡12h后继续保温静置,于不同时段测定吸附后发酵液中ε-聚L-赖氨酸的浓度[14]。按公式(1)计算吸附量。

式(1)
式中:c0为初始浓度(mg/mL);c1为吸附后浓度(mg/mL);V为吸附体积(mL);m为树脂量(g)。
将上述吸附已饱和的各型树脂过滤,取一定量加入适量蒸馏水洗涤,再加入200mL 0.1mol/L的盐酸进行洗脱,25℃振荡12h后测定洗脱液中ε-聚L-赖氨酸的浓度。按公式(2)计算各树脂在室温下的解吸率。

式(2)
式中:c为洗脱液中ε-聚L-赖氨酸浓度(mg/mL);V为洗脱液体积(mL);m为树脂质量(g);Q为吸附量(mg/g)。
1.2.7 弱酸性HD-2树脂的静态吸附曲线 称取5g弱酸型HD-2树脂于250mL锥形瓶中,加入200mL经预处理后的发酵液,于25℃恒温振荡吸附,每隔1h取样测定吸附结果,绘制静态吸附动力学曲线。
1.2.8 HD-2树脂的最大吸附量测定 称取5g弱酸型HD-2型树脂于250mL锥形瓶中,每隔1h加入100mL经预处理后的发酵液,于25℃恒温振荡吸附,直至树脂吸附达到饱和为止。
2 结果与讨论
2.1 ε-聚L-赖氨酸标准曲线的绘制
由图1可知,ε-聚L-赖氨酸浓度在0~0.1g/L范围内与吸光度存在线性关系。根据标准曲线,可以快速的计算出ε-聚L-赖氨酸的浓度。
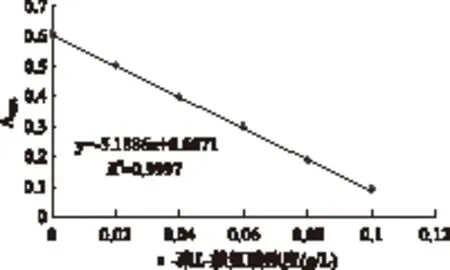
图1 ε-聚L-赖氨酸标准曲线Fig.1 The calibration curve of ε-poly-L-lysine

表2 3种离子交换树脂对ε-聚L-赖氨酸的静态吸附与解吸Table 2 The static adsorption capacity and desorption rates of 3 resins of ε-Ploly-L-lysine
2.2 发酵液的预处理
2.2.1 预处理pH的选择 通过测定可知发酵液pH为4.2。由图2可知,在pH8和pH9的条件下,所得离心液中蛋白质浓度较小,且ε-聚L-赖氨酸浓度较大。说明在此pH条件下杂蛋白去除效果好,ε-聚L-赖氨酸损失也少。综合考虑,发酵液预处理中选择使用5mol/L氢氧化钠调节发酵液pH8.5,去除杂蛋白。

图2 不同pH条件下预处理发酵液的结果Fig.2 The results of broth after pretreatment at different pH
2.2.2 超滤法预处理结果 ε-聚L-赖氨酸是L-赖氨酸的聚合物,由25~35个L-赖氨酸残基通过α-羧基与ε-氨基连接聚合而成。根据文献资料,其分子量一般为5ku左右[11]。因此,选择截留分子量为5ku的聚砜超滤膜对去除杂蛋白后的发酵液进行超滤,目的是除去部分大分子蛋白质。使用去除杂蛋白后的发酵液进行超滤,测定超滤后所得透过液和截留液中的蛋白质和ε-聚L-赖氨酸浓度,结果见图3。

图3 超滤处理发酵液的结果Fig.3 The results of broth after supernatant treatment
由图3可知,通过超滤法预处理后,透过液的蛋白质浓度明显降低,而截留液中蛋白质浓度相对较高,说明大部分大分子蛋白质被截留。同时,ε-聚L-赖氨酸在超滤前后浓度变化不大,说明超滤法具有可行性和有效性。
2.3 三种离子交换树脂对ε-聚L-赖氨酸的静态吸附-解吸实验
所选三种树脂对ε-聚L-赖氨酸的静态吸附和解吸结果见表2。
由表2所知,从吸附效果来看,3种树脂均对ε-聚L-赖氨酸具有一定的吸附能力,其中,弱酸型阳离子交换树脂HD-2型的吸附效果最好,强酸型阳离子交换树脂苯乙烯系列734#的吸附效果次之,弱酸型阳离子交换树脂D152型的吸附效果最差。解吸效果来看,弱酸型阳离子交换树脂HD-2型的解吸效果最好,能够较容易地解析下目的产物,而强酸型阳离子交换树脂苯乙烯系列734#的吸附效果较差,ε-聚L-赖氨酸损失也较多。
综合以上3种树脂的吸附和解吸结果,选择弱酸型的HD-2型树脂进一步研究。
2.4 弱酸性HD-2树脂的静态吸附曲线
由图4可以看出,HD-2树脂对发酵液中ε-聚L-赖氨酸的吸附为快速平衡型。在6h之前,吸附量随着时间的增加而增大,到达6h后,吸附量增加缓慢,达到平衡。

图4 弱酸性HD-2型树脂的静态吸附动力学曲线Fig.4 Static adsorption curve of ε-poly-L-lysine on HD-2 resin
2.5 HD-2树脂的最大吸附量测定
HD-2树脂的最大吸附量测定结果见图5。可以看出,5g弱酸型HD-2树脂最多可以吸附约800mL发酵液,最大吸附量达到28.8mg/g。
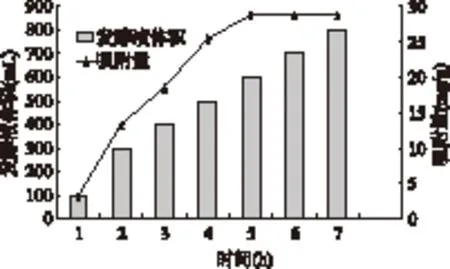
图5 HD-2树脂的最大吸附量测定结果Fig.5 The maximum adsorption capacity of ε-poly-L-lysine on HD-2 resin
3 结论
3.1 研究了ε-聚L-赖氨酸发酵液前处理的工艺条件。采用先调节pH再超滤的方法对发酵液进行预处理。分别使用5mol/L氢氧化钠于pH8.5沉淀蛋白质和5ku的聚砜超滤膜进行超滤,达到了良好的去除杂蛋白的效果。
3.2 研究了离子交换法分离提取发酵液中ε-聚L-赖氨酸的方法。筛选出了弱酸型HD-2阳离子交换树脂,其最大吸附量可达到28.8mg/g。
[1]牟丹,钱海峰,谭志刚,等.利用超滤技术及离子交换法制取高纯度植酸的研究[J].食品工业科技,2014,35(5):225-228.
[2]Yoshimitsu H. Occurrence,biosynthesis,biodegradation,and industrial and medical applications of a naturally occurringε-poly-L-lysine[J]. Biosci Biotechnol Biochem,2011,75(7):1226-1233.
[3]Shima S,Sakai H. Poly-L-lysine Produced By Streptomyces[J]. Agricultural and Biological Chemistry,1977,41(9):1907-1909.
[4]Shima S,Heiichi S. Poly-L-lysine Produced By Streptomyces
PartⅢ.Chemical Studies[J]. Agricultural and Biological Chemistry,1981,45(11):2503-2508.
[5]黄莉,唐仁勇,张佳敏,等.多聚赖氨酸产生菌的筛选及16SrDNA测序鉴定[J].食品工业科技,2013,34(17):163-167.
[6]黄静敏,吴清平,刘盛荣,等.ε-聚赖氨酸产生菌新菌株的筛选和产物结构鉴定[J].微生物学通报,2011,38(6):871-877.
[7]扬博,郭丽琼,郑冰昕,等.ε-聚赖氨酸产生菌的鉴定及产物特性研究[J].中国食品学报,2011,11(6):163-169.
[8]刘延岭,周昌豹,李峰,等.ε-聚L-赖氨酸生产菌株的选育[J].四川食品与发酵,2008,4(2):47-49.
[9]刘洁萍.从发酵液中提取生物防腐剂ε-聚赖氨酸的初步研究[D].天津:天津科技大学,2004.
[10]艾婷婷.发酵液中ε-聚赖氨酸提取工艺的初步研究[D].无锡:江南大学,2013.
[11]宗红,詹耀,吴翔,等.微生物发酵液中ε-聚赖氨酸的分离提纯[J].食品科学,2011,32(1):131-134.
[12]张海涛,李燕,欧杰,等.从发酵液中分离ε-聚赖氨酸的树脂筛选[J].化学研究与应用,2008,20(1):108-112.
[13]Itzhaki R F. Colorimetric Method for Estimating Polylysine and Polyarginine[J]. Analytical Biochemistry,1972,50:569-574.
[14]Toru Takagishi1,Toshihiko Ueno1,Nobuhiko Kuroki1,etal. Interaction of α-poly-L-lysine and ε-poly-L-lysine with methyl orange and its homologs in aqueous solution:Results from dialysis and spectroscopic measurements[J]. Journal of Polymer Science,Polymer Chemistry Edition,1984,22(6):1281-1289.
Study on the seperation of ε-poly-L-lysine from fermentation broth by ion exchange method
LIU Yan-ling,DENG Lin
(Sichuan Technology and Business College,Dujiangyan 611830,China)
The pretreatment ofStreptomycesalbusfermentation broth was studied in order to obtain ε-poly-L-lysine in it. 5mol/L NaOH was added into broth to adjust the pH8.5 in order to precipitate the protein,then 5ku polysulfone membrane was used in ultrafiltration,through which the most impurity protein was removed. The process conditions of ion exchange were also discussed in detail. The weakly acidic cation exchanger resin HD-2 was selected as the best through static adsorption method with the adsorption capacity as index. The maximum adsorption capacity of ε-poly-L-lysine on HD-2 resin was 28.8mg/g.
ion exchange method;separation;ε-poly-L-lysine
2014-04-03
刘延岭(1973-),男,本科,高级工程师,研究方向:食品生物技术。
TS202.3
A
1002-0306(2015)01-0073-04
10.13386/j.issn1002-0306.2015.01.007

