长方案促排卵过程中血清LH低于正常值时补充LH对助孕结局的影响
李巍巍, 许晓燕, 高瑞峰, 赵 华, 王兴玲, 孙丽君, 管一春, 娄 华
长方案促排卵过程中血清LH低于正常值时补充LH对助孕结局的影响
李巍巍1, 许晓燕1, 高瑞峰1, 赵 华2△, 王兴玲1, 孙丽君1, 管一春1, 娄 华1
1郑州大学第三附属医院生殖中心,郑州 450052
2华中科技大学同济医学院附属同济医院生殖中心,武汉 430030
目的 探讨在体外受精-胚胎移植(IVF-ET)周期长方案促排卵过程中晚卵泡期血清促黄体生成素(LH)低于
正常值时,补充基因重组人黄体生成素(r-hLH)或人绝经期尿促性腺激素(HMG)对IVF-ET助孕结局的影响。方法
采用回顾性分析,选择因女方输卵管因素行IVF-ET助孕的患者529例,所有患者均采用标准长方案,单用基因重组促卵泡激素(rFSH)促排卵。根据年龄、晚卵泡期血清LH、是否补充外源性LH将所有患者分成6组:<35岁的A组血清LH>1.2mU/mL,单用rFSH促排46例,B组血清LH<1.2mU/mL,补充r-hLH 52例,C组血清LH<1.2mU/mL,补充HMG 257例;≥35岁的D组血清LH>1.2mU/mL,单用rFSH促排34例,E组血清LH<1.2mU/mL,补充rhLH 41例,F组血清LH<1.2mU/mL,补充HMG 99例。结果 <35岁的3组患者之间和≥35岁的3组患者之间在年龄、不孕年限、BMI,基础FSH、LH、E2水平,Gn使用天数、Gn用量,HCG日LH、P水平,HCG日内膜厚度及获卵数等方面差异均无统计学意义(均P>0.05)。B组及E组rFSH总量分别高于C组及F组,差异有统计学意义(均P<0.05);B组及F组E2水平及2PN受精率分别明显高于A组及D组,差异有统计学意义(均P<0.05);A、B、C组之间优质胚胎率及妊娠率比较差异无统计学意义(均P>0.05);E组优质胚胎率及妊娠率明显高于D组,差异有统计学意义(均P<0.05)。结论 口服避孕药降调长方案晚卵泡期血LH值<1.2mU/mL时,适量添加r-hLH可以改善卵子质量,提高受精率,改善妊娠结局,尤其是明显提高≥35岁患者的临床妊娠率、受精率及优胚率。
体外受精-胚胎移植; 长方案; 黄体生成素; 妊娠率
卵泡的成熟及理想的雌二醇(estradiol 2,E2)水平的维持离不开促卵泡激素(follicle stimiulating hormone,FSH)和黄体生成素(luteinizing hormone,LH)的相互作用、相互调节。20世纪初期,Balasch[1]和Shoham等[2]就提出了“LH窗”的概念,他们认为血清中LH水平低于阈值时,将影响到卵泡的发育,内膜增生所需雌激素的浓度将会不足。然而,如果发育的卵泡暴露于过高的LH浓度中,则会导致卵泡发育提前闭锁和停滞。到目前为止,在体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)助孕技术中,标准长方案在各种控制性超促排卵中依然是最常用的,它是促性腺激素释放激素激动剂(gonadotrophin hormone releasing hormone,GnRHa)与促性腺激素(gonadotrophin,Gn)的联合应用。由于患者的个体差异,Gn-RHa对下丘脑-垂体轴(HPO轴)的抑制程度不完全相同,一些患者出现HPO轴过度抑制,导致LH水平过低,在临床促排卵过程中表现为卵泡发育缓慢,Gn剂量增加和时间延长,卵子质量下降,受精率下降,子宫内膜发育与胚胎着床不同步,进而导致妊娠率下降。目前国内外学者对促排卵中添加LH依然众说纷纭,本研究结合郑州大学第三附属医院生殖中心的用药特点,回顾性分析卵泡发育晚期血清LH<1.2mU/mL的患者449例,探讨补充重组人黄体生成素(recombination luteinizing hormone,rhLH,商品名乐芮,德国默克雪兰诺公司)或人绝经期尿促性腺激素(human menopausal gonadotropin,HMG,丽珠公司)对IVF-ET助孕结局的影响。
1 资料与方法
1.1 研究对象
选择2013年1月~12月在郑州大学第三附属医院生殖中心,因输卵管因素不孕行IVF-ET助孕的患者529例,根据年龄、晚卵泡期是否添加LH,将所有患者分为6组。A组:<35岁,血清LH>1.2mU/mL,单用rFSH促排,46例;B组:<35岁,血清LH<1.2mU/mL,补充r-hLH,52例;C组:<35岁,血清LH<1.2mU/mL,补充HMG,257例;D组:≥35岁,血清LH>1.2mU/mL,单用rFSH促排,34例;E组:≥35岁,血清LH<1.2 mU/mL,补充r-hLH,41例;F组:≥35岁,血清LH<1.2mU/mL,补充HMG,99例。患者纳入标准:①排卵正常;②阴道超声检查提示内膜无异常回声;③阴道超声检测提示输卵管无明显积液;④3个月内未使用过任何激素类药物;⑤排除染色体、传染病活动期、子宫内膜异位症、妇科相关肿瘤及生殖器官畸形等影响妊娠的疾病。
1.2 研究方法
1.2.1 促排方案 所有患者均采用口服避孕药降调标准长方案促排卵,在取卵周期的前1个月经周期的月经第3~5天口服妈富隆或达英-35,在月经第17~18天行阴道B超检查,未发现双侧卵巢有>10mm的卵泡时,每天开始肌肉注射曲谱瑞林0.05~0.10mg(达菲林,法国博福易普生)进行二次降调,降调共计14d,用药的第15天早上行阴道超声检查并抽静脉血测FSH、LH、E2及孕激素(progesterone,P)的水平。当达到降调标准时(血清FSH<5mU/mL、LH<5mU/mL、E2<50pg/mL),根据患者年龄、卵泡大小、个数及血清激素水平决定启动Gn的剂量(150~300U/d),所有入选患者均采用人基因重组卵泡刺激素针(recombination follicle stimiulating hormone,rFSH,商品名果纳芬,德国默克雪兰诺公司)。用药3d后根据卵泡大小、数量及激素水平进行药物剂量的调整,在促排卵第6天测血清LH水平,当血清LH>1.2mU/mL时患者继续用rFSH促排,若血清LH<1.2 mU/mL时开始补充r-hLH 75U/d或HMG 75~150U/d,增加HMG剂量的同时为了避免患者卵巢过激要减少rFSH的用量。当患者双侧卵巢至少有2~3个卵泡>18mm时,开始肌注绒毛膜促性腺激素(human chorionic gonadotropin,HCG,商品名艾泽,德国默克雪兰诺公司)250μg,37~38h后在B超下经阴道取卵,取卵后3d在B超引导下进行胚胎移植。若有患者卵泡数目过多为预防卵巢过度刺激综合征的发生,或HCG日血清P>2.0ng/mL或子宫内膜厚度<7mm,具备以上三种情况之一的患者,取消新鲜周期移植采用全胚冷冻,529例患者当中有145例患者行全胚冷冻。胚胎移植后14d抽取患者静脉血检测T-HCG水平,确定是否妊娠,于移植后30d行阴道超声检查,确定是否临床妊娠及着床孕囊数。
1.2.2 激素水平测定 采用化学发光法检测患者基础状态FSH、LH、E2、P、HCG等各种激素水平。采用德国西门子公司提供的分析仪及试剂盒,由专人严格按照操作步骤及质控要求进行检测。
1.2.3 观察指标 比较各组患者临床及实验室相关指标:患者年龄、不孕年限及体重指数,月经第2~4天血清LH、FSH及E2的水平,超促排卵过程中Gn使用天数、用量及FSH的用量,肌注HCG日的血清LH、E2、P的水平及内膜厚度,取卵日的获卵数,IVF助孕的双原核胚胎(2PN)受精率、优质胚胎率及新鲜周期妊娠率。主要观察指标计算方法如下:2PN受精率=2PN受精数/获卵总数×100%;优质胚胎率=Ⅰ级胚胎数/可利用胚胎数×100%;新鲜周期临床妊娠率=临床妊娠周期数/移植周期数×100%。
1.3 统计学方法
采用SPSS 19.0统计软件进行数据处理,计量资料以均数±标准差(¯x±s)表示,组间均数比较采用独立样本t检验,计数资料组间比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 <35岁3组患者临床及实验室相关指标的比较
在<35岁的3组患者中,A组有5例、B组有8例、C组有79例患者均因P值升高及预防过度刺激取消新鲜周期移植,行全胚冷冻,这些患者均不计入妊娠率的评估。3组患者相比较,在年龄、不孕年限、BMI,基础FSH、LH、E2水平,Gn使用天数、Gn用量,HCG日LH、P水平,HCG日内膜厚度、获卵数、优质胚胎率及临床妊娠率之间差异均无统计学意义(均P>0.05);B组rFSH总量明显高于C组,差异有统计学意义(P<0.01);B组HCG日E2水平及2PN受精率明显高于A组,差异有统计学意义(均P<0.05)。见表1。

表1 <35岁的3组患者临床及实验室相关指标的比较(¯x±s)Table1 Comparison of the clinical and laboratory related indicators of patients<35years old among group A,B and C(¯x±s)
2.2 ≥35岁3组患者临床及实验室相关指标的比较
在≥35岁3组患者中,D组有2例、F组有14例患者均因P值升高及预防过度刺激取消新鲜周期移植,行全胚冷冻,此类患者均不计入妊娠率的评估。3组患者相比较,在年龄、不孕年限、BMI,基础FSH、LH、E2水平,Gn使用天数、用量,HCG日LH、P水平,HCG日内膜厚度及获卵数之间差异均无统计学意义(均P>0.05);E组rFSH总量明显高于F组,差异有统计学意义(P<0.01);E组HCG日E2水平、2PN受精率、优质胚胎率及临床妊娠率均明显高于D组,差异均有统计学意义(均P<0.05);E组与F组之间雌激素水平、2PN受精率、优质胚胎率及临床妊娠率相比较差异无统计学意义(均P>0.05)。见表2。
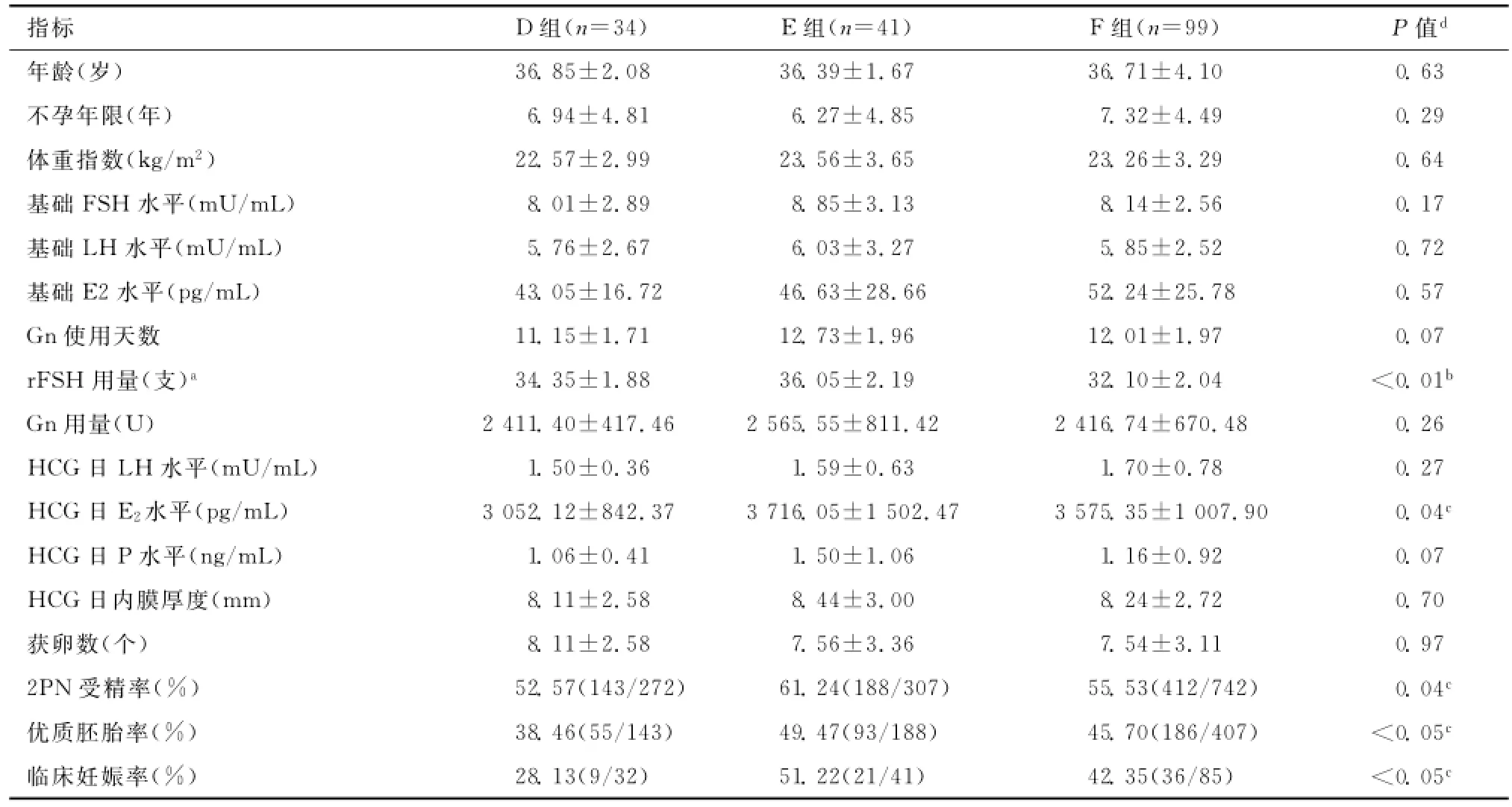
表2 ≥35岁的3组患者临床及实验室相关指标的比较(¯x±s)Table2 Comparison of the clinical and laboratory related indicators of patients≥35years old among group D,E and F(¯x±s)
3 讨论
卵泡的发育是卵泡颗粒细胞和卵泡膜细胞在FSH与LH共同调节下完成的,卵泡膜细胞上有LH受体,LH在卵泡发育早期刺激卵泡膜产生雄激素,为E2的合成提供底物,而这种作用发生的前提是LH浓度达到一个阈值水平。在不孕患者行IVF-ET助孕时,对不同的患者我们将采取不同的促排卵方案,长方案以“周期取消率低,卵子回收率高”等特点,在IVF-ET中被视为经典的促排方案而为生殖临床医生广泛接受。GnRHa犹如一把双刃剑,除了以上涉及到的优点外,GnRHa可抑制颗粒细胞合成分泌E2,溶解黄体而影响黄体功能。这些都不利于胚胎着床及妊娠的持续进行,因此GnRHa的剂量把握变得尤为的重要,而每位患者对GnRHa的反应性有着很大的差异,在垂体降调节的过程中,部分患者会出现垂体的过度抑制,从而导致卵巢低反应,增加了Gn的用量和促排时间,这些因素均会影响到卵子的质量及临床妊娠率。故在降调节中出现血LH水平明显降低的患者是否外源性添加LH值得探讨。
目前关于黄体期GnRHa降调节后,血清LH界值的标准还没有统一的参考值,是否添加外源性r-hLH说法不尽相同。有的学者认为黄体期Gn-RHa降调节后,血清LH的过度抑制将导致获卵率和受精率降低[3],在晚卵泡期适量添加外源性LH,能改善因LH缺乏而导致E2水平下降,从而改善胚胎质量,提高受精率、种植率及妊娠率[4]。Pezzuto等[5]认为在长方案促排卵的早卵泡期血清LH<0.5mU/mL时添加LH可促进卵细胞的成熟,进一步提高卵子受精率。骆丽华等[6]对启动日血LH<1mU/mL的患者早期添加外源性LH,其研究结果证实添加r-hLH对临床结局是有益处的。Franco等[7]报道的垂体降调节后添加r-hLH组与未添加组相比,成熟卵子数及受精率均明显增高。但也有学者认为,降调节后剩余的内源性LH完全可满足卵泡发育、刺激雄激素的分泌,没必要添加外源性LH。Kovacs等[4]通过临床应用发现卵泡期血清LH过度抑制后,在促排过程中添加r-hLH后,与未添加组相比成熟卵子数、受精率、冷冻胚胎数、累计妊娠率均没有明显差异。马兰等[8]通过对临床资料的分析认为,降调节的血清LH水平在0.5~1.5 mU/mL范围内无需添加外源性HMG或rLH,添加后反而会降低受精率,增加移植取消率及发生过激风险;而血清LH<0.5mU/mL添加外源性LH可以改善妊娠结局。Lahoud等[9]研究表明晚卵泡期添加r-hLH可提高获卵率及E2水平,而着床率和妊娠率无明显改变。
鉴于上述LH界值及低LH患者是否添加外源性LH存在争议,本研究回顾性分析了529例IVF助孕周期患者的临床资料。观察结果表明在促排第6天,血清LH<1.2mU/mL的B、C、E、F组患者分别补充外源性LH后,在HCG日LH水平均有不同程度的增高,与A、D两组比较差异无统计学意义,说明补充外源性LH还是起到一定作用。B组HCG日血E2水平、2PN受精率均明显高于A组,提示对于血清LH值过度抑制的患者补充适量LH有益于卵泡的成熟发育,从而提高卵泡分泌E2水平及优质胚胎的数量,避免了卵泡发育中晚期血清LH值过低而影响到胚胎的质量及临床妊娠率。B组HCG日血E2水平、优质胚胎率稍高于C组,但差异无统计学意义(均P>0.05)。鉴于r-hLH生物活性高且稳定,与LH受体结合能力强,而HMG活性不稳定,含有一定量的HCG,且HMG含有杂质蛋白质,易出现迟发性变态反应,故认为r-hLH的作用优于HMG[10]。我们的比较结果无统计学差异可能与B组样本量较少也有一定关系,没有体现出r-hLH生物活性的优势。B组rFSH用量明显多于C组(P<0.01),这与C组补充的是HMG有关,HMG是从绝经期妇女尿中提取的一种性激素,每支HMG分别含75U的FSH和75U的LH,半衰期24h,在增加HMG用量时为了避免患者卵巢过激需减少rFSH的用量,这也在一定程上降低了患者的治疗费用。
随着女性年龄的增长,尤其是≥35岁的女性,卵泡上LH受体数量下降,LH的生物活性明显下降。Konig等[11]对253对≥35岁的夫妇行IVF治疗降调后,在促排卵第6天补充r-hLH 150U/d,结果显示与未补充组相比临床妊娠率无差异。Maxrs等[12]对使用r-hFSH刺激卵巢拟行卵胞浆内单精子注射(Intracytoplasmic sperm injection,ICSI)的患者,从第6天开始补充r-hLH(150U/d)的效果进行评估,发现r-hFSH加r-hLH组的胚胎移植数量较多,≥35岁联合应用r-hFSH加r-hLH时着床率较高。本研究发现对于≥35岁,血清LH<1.2 mU/mL组患者添加外源性LH后,所得结论与以上观点相符,即E组E2水平、2PN受精率、优胚率及妊娠率均明显高于D组,差异有统计学意义(均P<0.05)。依据本研究结果,我们认为对于≥35岁的患者,在IVF超促排卵过程中,若发现血清LH水平低于1.2mU/mL时,及时补充r-hLH有望改善临床妊娠率,对于大龄患者血清LH水平在正常范围内,而血E2水平不高、卵泡生长缓慢者也应及时补充外源性LH。E组rFSH用量明显高于F组,差异有统计学意义,其原因与上述分析的<35岁B、C两组原因相同。
有证据显示,通过免疫分析检测血清中LH的浓度不一定反映血液循环中的生物活性,而局部的激素浓度也与受体状态、数量和旁分泌网络有关。基于以上原因,在超促排卵过程中添加外源性LH的指征,添加的时机及剂量都是需要临床医生认真考虑的问题,因为过早添加LH不仅增加患者的经济负担,还影响卵泡的发育及成熟。为了明确更有利于卵泡发育的LH添加时机和剂量,还需进一步扩大样本量,并结合分子生物学及药理学,探索在促排卵过程中LH的作用机制,从而提高IVF的助孕结局,尤其是≥35岁患者的妊娠结局。
[1] Balasch J,Fabrgues F.Is luteinizing hormone needed for optional ovulation induction?[J].Curr Opin Obstet Gynecol,2002,14(3):265-274.
[2] Shoham Z.The clinical therapeutic window for luteinizing hormone in controlled ovarian stimulation[J].Fertil Steril,2002,77(6):1170-1177.
[3] 徐士儒,李媛,刘红,等.重组人黄体生成素在体外受精-胚胎移植促排卵治疗中的应用[J].中华妇产科杂志,2010,45(6): 420-423.
[4] Kovacs P,Kovats T,Kaali S G.Results with early follicular phase recombination luteinizing hormone supplementation during stimulation for in vitro fertilization[J].Fertil Steril,2010,93(2):475-479.
[5] Pezzuto A,Ferrari B,Coppila F,et al.LH supplementation in down-regulated women undergoing assisted reproduction with baseline low serum LH levels[J].Gynecol Endocrinol,2009,24(1):1-7.
[6] 骆丽华,刘雨生,季静娟,等.长方案卵巢刺激启动日血黄体生成激素水平作为黄体生成激素添加指标的价值[J].中国实用妇科与产科杂志,2012,28(8):619-623.
[7] Franco J G Jr,Baruffi R L,Oliveira J B,et al.Effects of recombinant LH supplementation to recombinant FSH during induced ovarian stimulation in the GnRH-agonist protocol:a matched case-control study[J].Reprod Biol Endocrinol,2009,4(7):58.
[8] 马兰,陈潇,李红.长方案促排卵中期添加黄体生成素对助孕结局的影响[J].生殖与避孕杂志,2013,33(7):485-489.
[9] Lahoud R,Al-Jefout M,Tyler J,et al.A relative reduction in mid-follicular LH concentrations during GnRH agonist IVF/ICSI cycles leads to lower live birth rates[J].Hum Reprod,2006,21(10):2645-2649.
[10] Wong P C,Qiao J,Clement H,et al.Current opinion on use of luteinizing hormone supplementation in assisted reproduction therapy:a Asian perspective[J].Reprod Biol Med Online,2011,23(1):81-90.
[11] Konig T E,van der Houwen L E,Overbeek A,et al.Recombinant LH supplementation to a standard GnRH antagonist protocol in women of 35years or older undergoing IVF/ICSI: a randomized controlled multicentre study[J].Hum Reprod,2013,28(10):2804-2812.
[12] Maxrs R,Meldrum D,Miuasher S,et al.Randomized trial to compare the effect of recombinant human FSH(follitropin alfa)with or without recombinant human LH in women undergoing assisted reproduction treatment[J].Reprod Biolmed Online,2004,8(2):175-182.
(2014-10-20 收稿)
Effect of Exogenous LH Supplementation in GnRH-agonist Long Protocol on IVF Outcomes in the Patients with Subnormal Serum LH
Li Weiwei,Xu Xiaoyan,Gao Ruifeng et al
Reproductive Medicine Center,The Third Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
Objective To evaluate the effect of supplementation with recombinant human luteinizing hormone(r-hLH)or human menopausal gonadatropin(HMG)on in vitro fertilization-embryo transfer(IVF-ET)outcomes in patients with the serum LH concentration lower than 1.2mU/mL in gonadotropin-releasing hormone(GnRH)-agonist long protocol.Methods Clinical data of 529patients who underwent IVF-ET due to tube-peritoneal factors were retrospectively analyzed.All patients were given long luteal phase protocols with rFSH used for controlled ovarian hyperstimulation(COH).They were divided into 6groups according to age,serum LH concentration in late follicular phase and exogenous LH supplementation:group A,in which 46patients at age of<35years had serum LH>1.2mU/mL and had no LH supplementation;group B,in which 52patients with their age less than 35years old had serum LH<1.2mU/mL and were supplemented with r-hLH;group C,in which 257patients less than 35years old had serum LH<1.2mU/mL and were supplemented with HMG;group D,in which 34patients at age of≥35years did not receive any LH supplementation with their serum LH>1.2mU/mL;group E,in which 41patients at age of≥35years had serum LH<1.2mU/mL and were supplemented with r-hLH;group F,in which 99patients with their age≥35years old and serum LH<1.2mU/mL were administered with HMG.Results There were no statistical differences between<35years old groups(group A,B,C)and≥35years old groups(group D,E,F)in age,duration of infertility,BMI,levels of basic FSH,LH,and estradiol(E2),days of usage of Gn,total dose of Gn,levels of LH,progesterone(P)and endometrial thickness on the day of HCG,and the number of oocytes retrieved(P>0.05).The total doses of rFSH was statistically significantly higher in group B and group E than in group C and group F(P<0.05).The E2levels and 2PN fertilization rate was statistically significantly higher in group B and group F than in group A and group D(P<0.05).There were no statistical differences among group A,B,and C in high-quality embryo formation rate and pregnancy rate(P>0.05).The high-quality embryoformation rate and pregnancy rate in group E was significantly higher than in group D(P<0.05).Conclusion r-hLH supplementation can improve the quality of oocytes,increase the fertilization rate,and improve the pregnancy outcomes of patients with low serum LH level(LH<1.2mU/mL)in late follicular phase in GnRH-agonist long protocol.It significantly increases the clinical pregnancy rate,fertilization rate and high-quality embryo formation rate in patients equal to or greater than 35years old.
in vitro fertilization-embryo transfer; GnRH-agonist long protocol; luteinizing hormone; pregnancy rate
R169.49
10.3870/j.issn.1672-0741.2015.03.021
李巍巍,女,1975年生,医学硕士,副主任医师,E-mail:liweiweicandy@aliyun.com
△通讯作者,Corresponding author,E-mail:zhao-hua@outlook.com

