p53通过调控p55PIK抑制肝细胞癌SMMC-7721细胞的增殖*
傅寅佳, 杨 熹, 曹小年, 来森艳, 王桂华, 胡俊波, 李 襄△
论著
p53通过调控p55PIK抑制肝细胞癌SMMC-7721细胞的增殖*
傅寅佳1, 杨 熹1, 曹小年2, 来森艳1, 王桂华1, 胡俊波1, 李 襄1△
华中科技大学同济医学院附属同济医院1肿瘤研究所/胃肠外科2普胸外科,武汉 430030
目的 探讨p55PIK对肝癌SMMC-7721细胞增殖能力的影响,及p55PIK上游可能的调控机制。方法 以肝癌SMMC-7721细胞为研究对象,通过脂质体转染p55PIK特异性小干扰RNA(siRNA)si-p55构建p55PIK低表达的实验模型。通过CCK8检测p55PIK对肝癌SMMC-7721细胞增殖能力的影响。通过流式细胞术检测p55PIK对细胞周期进程的影响。转染针对p53的小干扰RNA(siRNA)si-p53低表达p53,采用Western blot检测p53对p55PIK表达的影响,并通过CCK8法检测p53对p55PIK在肝癌细胞增殖调控中的作用。结果 低表达p55PIK可导致肝癌SMMC-7721细胞的增殖能力降低[转染后96h,si-NC组、si-p55组的A值分别为(1.325±0.050)、(1.183±0.019)],细胞周期G0/G1期阻滞[si-NC组:(39.07±2.02)%;si-p55组:(49.66±1.05)%]。低表达p53可在肝癌SMMC-7721细胞中上调p55PIK的表达。p55PIK可部分拮抗p53对肝癌SMMC-7721细胞增殖的抑制作用。结论 p53可部分通过调控p55PIK抑制肝癌SMMC-7721细胞的增殖。
肝癌; p55PIK; p53; 细胞增殖
p55PIK是磷脂酰肌醇-3-激酶(phosphoinositide-3-kinases,PI3Ks)的一个调节亚基,有研究证实,其在乳腺癌、结肠癌中具有促进肿瘤增殖与侵袭转移的作用,并在白血病细胞中具有抑制分化的作用[1-4]。目前发现,p55PIK可通过Rb、PCNA、NF-κB、TGF-β等经典信号通路发挥下游效应[5-7]。p55PIK作为细胞内重要的信号通路节点,是潜在的肿瘤治疗靶点。然而,p55PIK在肝细胞癌中的生物学作用目前尚未见研究报道,且p55PIK上游的调控机制在国内外也还未见详细研究。
p53是最早被发现的抑癌基因之一,在各类肿瘤中存在失活突变,在生物学功能上与细胞周期进程、凋亡、DNA修复、侵袭转移等密切相关。近年来,有研究证实p53主要通过Rb、TGF-β、miR-34等下游通路发挥上述生物学功能[8-10],然而p53在肝癌中的调控机制尚未完全明晰,进一步完善p53信号通路理论将为新药物的开发提供重要线索和依据。
由于p53在肝癌中存在广泛的失活突变,且能通过调控一系列下游靶基因的表达而影响肝癌的发生发展。因此我们推测在肝癌中p55PIK的表达也可能受上游p53的调控。本研究以肝癌细胞为实验模型,通过经典的分子生物学方法揭示并论证了上述假设,进一步完善了p55PIK相关信号传导理论。
1 材料与方法
1.1 材料
人肝癌细胞株SMMC-7721购买于武汉博士德生物公司;CCK8购于武汉启动子生物公司;Lipofectamine 2000购于Invitrogen公司;Opti-MEN、胎牛血清购于美国Gibco公司;p55PIK抗体、GAPDH抗体购于Santa Cruz公司;si-p53、si-p55及阴性对照序列si-NC由广州瑞博公司合成与纯化;BrdU购于BD Biosciences公司。
1.2 方法
1.2.1 细胞培养 SMMC-7721细胞以含有10%胎牛血清的DMEM高糖培养液(HyClone),在恒温37℃、5%CO2下常规培养。
1.2.2 细胞转染 当SMMC-7721细胞生长至50%融合时,进行转染。以Opti-MEN分别稀释Lipofectamine 2000和siRNA,室温下静置5min,将稀释后的Lipofectamine 2000与siRNA轻柔混合,室温下静置20min。以上述混合物替换原有培养液。常规培养6h后,换回常规培养液继续培养。1.2.3 CKK8法检测细胞增殖 常规消化收集转染48h后的细胞,调整细胞密度,每孔种入约1× 104个细胞于96孔板中,每组设4个复孔,贴壁后进行转染,在转染后24、48、72、96h时,加入CCK8 10 μL/孔至待测组,继续常规培养2h,以酶标仪检测各组在450nm波长下的吸光度(A)值,绘制细胞生长曲线。
1.2.4 PI染色测定细胞周期 在转染48h后,常规消化收集细胞,75%冰乙醇固定过夜,PBS洗涤,加入碘化丙啶(PI)(终浓度50μg/mL)和RNA酶A(终浓度50μg/mL),室温下避光放置30min,以流式细胞仪检测细胞周期分布。
1.2.5 Western blot检测蛋白表达 转染48h后,常规消化收集细胞,以RIPA裂解细胞提取总蛋白并测蛋白浓度(BCA法),以SDS-PAGE电泳分离蛋白,通过湿转法转至PVDF膜,5%脱脂牛奶封闭1h,4℃孵育一抗过夜,以TBST缓冲液漂洗后,在室温下孵育二抗2h,再次洗膜后曝光。
1.3 统计学处理
使用SPSS 19.0软件进行统计学分析,计量资料组间均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 p55PIK对SMMC-7721细胞增殖的影响
首先在SMMC-7721细胞中分别转染针对p55PIK的特异性小干扰RNA(siRNA)si-p55或阴性对照序列si-NC,以验证si-p55的效果。在转染48h后,通过Western blot检测p55PIK的表达,发现相对于si-NC组,si-p55组中p55PIK的蛋白表达有明显降低(图1),提示所用的si-p55可有效低表达p55PIK。随后,在转染后以CCK8法及PI染色法分别检测细胞增殖能力与细胞周期进程。CCK8法检测显示(图2):在转染后72h及96h时,si-p55组平均A值分别为(0.663±0.025)、(1.183± 0.019),si-NC组分别为(0.731±0.215)、(1.325± 0.050)。自转染后72h开始,si-p55组的A值均明显小于对照si-NC组的A值(P<0.01)。该结果提示,低表达p55PIK可抑制SMMC-7721的增殖。通过PI染色法对细胞周期分布检测,结果显示(图3):si-p55组中G0/G1期细胞比例为(49.66± 1.05)%,S期为(40.85±1.08)%,G2-M期为(9.49 ±0.13)%,而在si-NC组中G0/G1期细胞比例为(39.07±2.02)%,S期为(51.78±1.71)%,G2-M期为(9.14±3.72)%,提示低表达p55PIK可致SMMC-7721细胞G0/G1阻滞。

图1 si-p55减少SMMC-7721细胞中p55PIK的表达Fig.1 si-p55decreased the expression of p55PIK in SMMC-7721cells

图2 p55PIK低表达抑制SMMC-7721细胞增殖Fig.2 Knockdown of p55PIK inhibited the proliferation of SMMC-7721cells
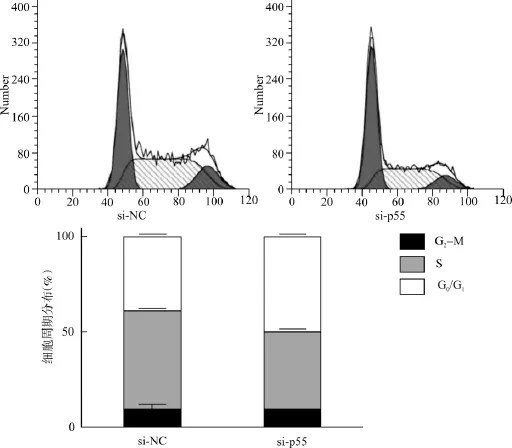
图3 p55PIK低表达可导致细胞G0/G1期阻滞Fig.3 Knockdown of p55PIK led to cell cycle arrest in G0/G1phase
2.2 p53可调控p55PIK的蛋白表达
在SMMC-7721细胞中转染针对p53的siRNA si-p53,并以si-NC作为对照,通过Western blot检测p53及p55PIK的蛋白表达,发现相对于si-NC组,si-p53组中p53蛋白表达明显降低,同时p55PIK的蛋白表达明显增高(图4)。此结果提示,si-p53可有效抑制p53在SMMC-7721细胞中的表达,且p53低表达可促进p55PIK的蛋白表达。由此证明了p53在肝癌细胞中对p55PIK的表达具有调控作用。

图4 p53低表达上调p55PIK表达Fig.4 Knockdown of p53up-regulated the expression of p55PIK
2.3 p53通过抑制p55PIK调控SMMC-7721细胞增殖
在SMMC-7721细胞中进行以下分组转染:si-NC组、si-p53组、si-p53联合si-p55组。在转染后通过CCK8法检测细胞增殖能力的变化。si-NC组 72h、96h的平均A值分别为(0.720±0.045)、(0.924±0.029);si-p53组分别为(0.843±0.037)、(1.150±0.056);si-p53联合si-p55组分别为(0.789±0.023)、(1.043±0.067)。结果提示从72 h开始,si-p53组A值均高于si-NC及si-p53联合si-p55组(P<0.05);si-p53联合si-p55组A值均高于si-NC组(P<0.05)(图5)。此结果提示,p53对肝癌细胞增殖的抑制作用部分通过调控p55PIK的表达而实现。
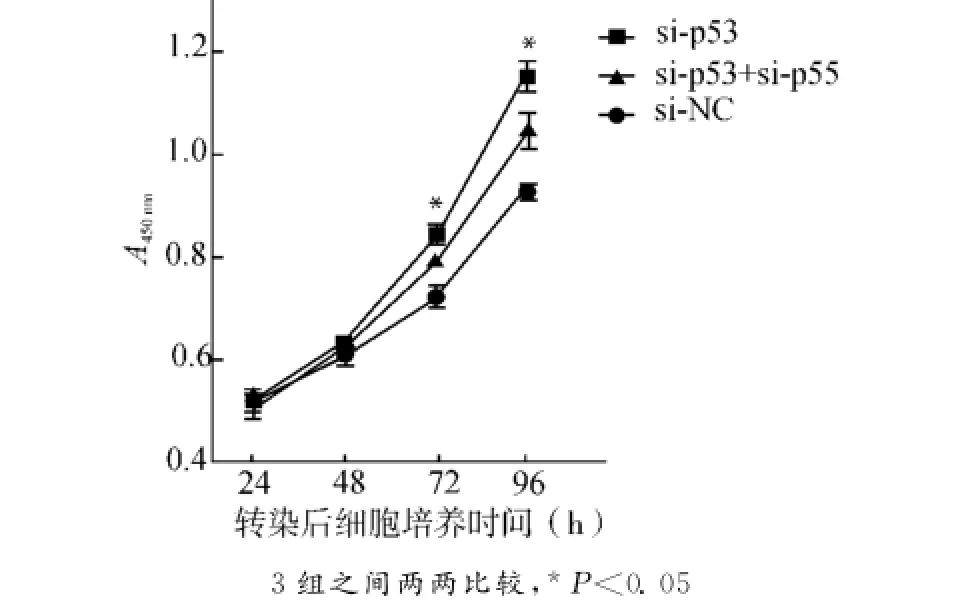
图5 p53对肝癌细胞的抑制作用部分依赖于p55PIKFig.5 p53inhibited live cancer cell proliferation,partially depending on p55PIK
3 讨论
肝癌是世界上发病率和病死率较高的恶性肿瘤,每年造成的死亡人数在所有癌症中排第3位,我国是世界上肝癌发病率和病死率最高的国家[11]。虽然随着手术技术不断提高,肝癌的手术成功切除率也不断提高,但由于其发病隐匿,对化疗不敏感,目前总体预后仍然不够理想。因此,对肝癌发生发展机制的进一步揭示是目前医学界亟待解决的重大问题。p55PIK是PI3K信号通路中的重要调节亚基,现已证实在多种肿瘤中可通过影响细胞增殖促进肿瘤的发生发展[3,5-6,12-13]。我们通过siRNA技术构建低表达p55PIK的细胞模型,通过CCK8实验首次在肝癌细胞模型中证明p55PIK低表达可抑制肝癌细胞生长;通过流式细胞学实验,进一步证实了p55PIK低表达可导致细胞周期G0/G1期阻滞。通过这一组经典分子生物学实验,本研究首次系统论证了p55PIK可促进肝癌细胞增殖。这一结论与此前所报道的p55PIK在结肠癌、胃癌、乳腺癌中的生物学作用是相一致的[3,12-13]。
此前已有较多对p55PIK下游的信号调控通路的具体研究,然而p55PIK上游的调控机制目前已有的报道甚少。同时p53在多种肿瘤的发生发展中起到十分重要的作用,是经典抑癌基因,而在肝癌中也存在广泛的失活突变[14-18]。由此我们设想在肝癌的发生发展中,p53与p55PIK存在潜在联系。为了验证这个假设,我们通过Western blot证实了p53可抑制p55PIK蛋白表达。通过CCK8实验在功能上进行验证,发现抑制p55PIK在一定程度上可逆转低表达p53对细胞增殖的促进作用,证明了p55PIK是p53信号传导通路的一个组成部分。至于p55PIK只能部分拮抗p53的功能,我们猜测这一现象可能是由于p55PIK是p53众多下游信号通路中的一个分支,即使p55PIK信号通路受阻,p53也可通过其他信号通路发挥部分作用。因此,这证实了p53对肝癌细胞的抑制作用部分依赖于p55PIK而实现。至此,我们基本对p55PIK与p53的关系与功能进行了系统论证,然而p53对p55PIK的具体调控机制还有待进一步探索,同时p55PIK在肝癌发生发展中可能存在的其他生物学作用尚有待进一步论证。
[1] Wang G,Deng Y,Cao X,et al.Blocking p55PIK signaling inhibits proliferation and induces differentiation of leukemia cells[J].Cell Death Differ,2012,11(19):1870-1879.
[2] Pons S,Asano T,Glasheen E,et al.The structure and function of p55PIK reveal a new regulatory subunit for phosphatidylinositol 3-kinase[J].Mol Cell Biol,1995,15(8):4453-4465.
[3] Hu J,Liu S,Wang J,et al.Overexpression of the N-terminal end of the p55gamma regulatory subunit of phosphatidylinositol 3-kinase blocks cell cycle progression in gastric carcinoma cells[J].Int J Oncol,2005,26(5):1321-1327.
[4] 邓豫,王桂华,左学良,等.TAT-N24穿膜融合多肽对前列腺癌细胞增殖的影响[J].医药导报,2011,30(7):843-845.
[5] Wang G,Chen C,Yang R,et al.p55PIK-PI3Kstimulates angiogenesis in colorectal cancer cell by activating NF-κB pathway[J].Angiogenesis,2013,16(3):561-573.
[6] Xia X,Cheng A,Akinmade D,et al.The N-terminal 24amino acids of the p55gamma regulatory subunit of phosphoinositide 3-kinase binds Rb and induces cell cycle arrest[J].Mol Cell Biol,2003,23(5):1717-1725.
[7] Wang G,Cao X,Lai S,et al.PI3Kstimulates DNA synthesis and cell-cycle progression via its p55PIK regulatory subunit interaction with PCNA[J].Mol Cancer Ther,2013,12(10): 2100-2109.
[8] Hermeking H.MicroRNAs in the p53network:micromanagement of tumour suppression[J].Nat Rev Cancer,2012,12(9):613-626.
[9] Termén S,Tan E,Heldin C,et al.p53regulates epithelialmesenchymal transition induced by transforming growth factorβ[J].J Cell Physiol,2013,228(4):801-813.
[10] He L,He X,Lim L P,et al.A microRNA component of the p53tumour suppressor network[J].Nature,2007,447(7148):1130-1134.
[11] Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[12] Hu J,Xia X,Cheng A,et al.A peptide inhibitor derived from p55PIK phosphatidylinositol 3-kinase regulatory subunit:a novel cancer therapy[J].Mol Cancer Ther,2008,7(12):3719-3728.
[13] 李襄,胡艺冰,孙黎,等.下调p55PIK基因表达对乳腺癌MDA-MB-231细胞体外增殖和迁移能力的影响[J].华中科技大学学报:医学版,2012,41(6):643-646.
[14] Muller P A,Vousden K H.p53mutations in cancer[J].Nat Cell Biol,2013,15(1):2-8.
[15] 田敏,吴穷.p53基因在原发性肝癌中的研究进展[J].中华全科医学,2013,11(9):1445-1460.
[16] Lim S,Kim H,Jung G.p53inhibits tumor cell invasion via the degradation of snail protein in hepatocellular carcinoma[J].FEBS Letters,2010,584(11):2231-2236.
[17] 孔德光,吴高松.p53与乳腺癌转移的关系及其机制[J].华中科技大学学报:医学版,2014,43(6):720-722.
[18] 郭成,段建峰,刘青光,等.野生型-p53与JunB融合基因对裸鼠肝细胞肝癌移植瘤的抑制作用[J].华中科技大学学报:医学版,2013,42(6):703-706.
(2015-01-22 收稿)
p53 Inhibits the Proliferation of Liver Cancer Cell Line SMMC-7721 by Targeting p55PIK
Fu Yinjia1,Yang Xi1,Cao Xiaonian2et al
1 Cancer Research Institute/Department of Gastrointestinal Surgery,2Department of Thoracic Surgery,Tongji Hosptial,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China
Objective To examine the effects of p55PIK on the proliferation of liver cancer cell line SMMC-7721and the possible regulative mechanism of the upstream molecules of p55PIK.Methods p55PIK downexpression models were established by transfecting p55PIK-specific siRNA si-p55into SMMC-7721cells with lipofectamine.CCK8assay was used to investigate the impact of p55PIK on the proliferation of SMMC-7721cells.The effect of p55PIK on cell cycle was determined by flow cytometry(FCM).si-p53,a siRNA targeting p53,was used to detect the impact of p53on the expression of p55PIK by Western blot and on the proliferation of SMMC-7721cells by using CCK8assay.Results Knockdown of p55PIK in liver cancer cell line SMMC-7721inhibited the cell proliferation[96hafter transfection,A-value in si-NC and si-p55were respectively(1.325± 0.050)and(1.183±0.019)]and induced cell cycle arrest in G0/G1-phase[(39.07±2.02)%in si-NC and(49.66±1.05)%in si-p55].Low-expressing of p53could up-regulate the expression of p55PIK in SMMC-7721cells.Knockdown of p55PIK attenuated the impact of p53-knockdown on promoting the proliferation of SMMC-7721cells.Conclusion p53can inhibit the proliferation of liver cancer SMMC-7721cells partially by down-regulating the expression of p55PIK.
hepatic carcinoma; p55PIK; p53; cell proliferation
R735.7
10.3870/j.issn.1672-0741.2015.03.001
*国家自然科学基金资助项目(No.30973496),国家青年科学基金资助项目(No.81301899)
傅寅佳,男,1986年生,博士研究生,E-mail:fuyinjia@hust.edu.cn
△通讯作者,Corresponding author,E-mail:54261592@qq.com

